一种可抑制肥大细胞脱颗粒的化合物及其制备方法和用途与流程
本发明涉及一种可抑制肥大细胞脱颗粒的化合物及其制备方法和用途,属于医药
技术领域:
。
背景技术:
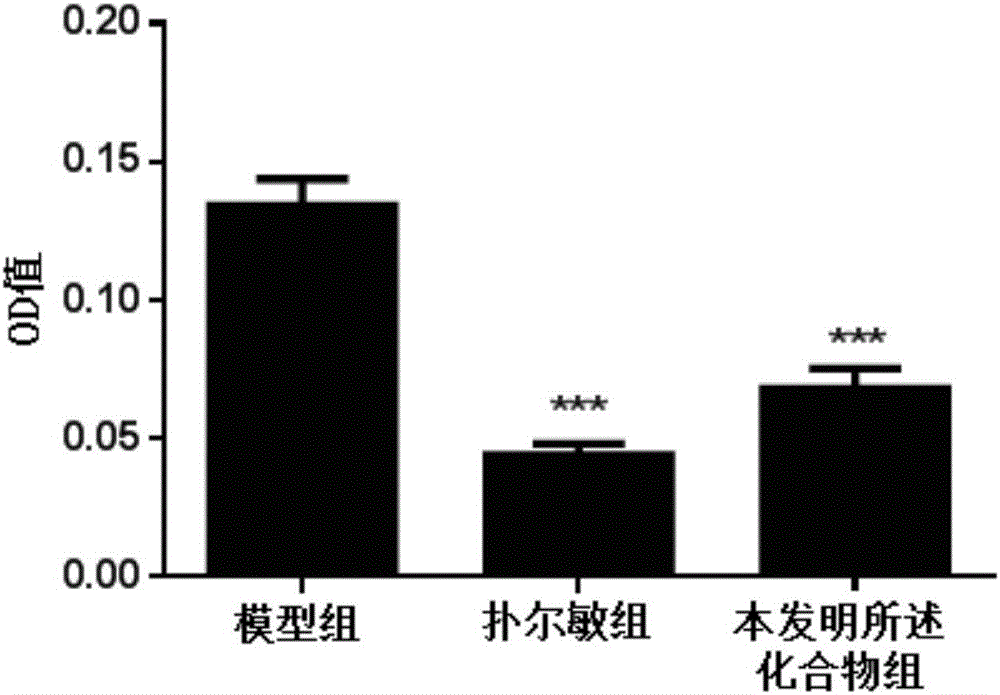
:肥大细胞广泛分布于皮肤、淋巴组织、子宫、膀胱以及呼吸道和消化道粘膜及粘膜下结缔组织中毛细血管及淋巴管周围。肥大细胞脱颗粒是很多机体病理反应的原因之一,它与肿瘤发生、血脂清除、血管发生、神经系统功能、生殖系统的性周期变化、过敏反应等都有不等程度的关系。肥大细胞不仅在过敏反应中起关键作用,而且在许多疾病的过程中表现出功能的多态性,如:炎症反应、细胞毒性作用、血管的生长与形成以及免疫调节作用等都有肥大细胞的参与。肥大细胞脱颗粒是一复杂的生物化学过程,且受多种刺激影响。经典理论认为变应原与肥大细胞表面的IgE分子桥联后,使IgE分子发生变构,后者改变了肥大细胞膜的能量代谢和通透性,并促进细胞膜磷脂甲基化过程和钙离子通道开放。IgE激活的肥大细胞脱颗粒过程主要释放三种类型的颗粒物质来发挥其生理功能,分别为:1)预存介质,如组胺,β-己糖胺酶(β-hex)、血清素、肿瘤坏死因子(TNF)-α等;2)脂质介质,主要为前列腺素D2及白三烯类物质;3)新合成的介质,包括细胞因子及趋化因子。预存介质中的组胺,作为最为人们所熟知的过敏介质,在肥大细胞被激活后的几分钟内即大量释放,可引起血管扩张,支气管收缩,血管通透性增加以及平滑肌收缩等一系列与过敏及炎症相关的反应([J].CellularandMolecularLifeSciences,2011,68(6):965-975);而以前列腺素及白三烯为代表的脂质介质的释放,则是由于细胞内钙流的增加以及MAPK磷酸化引起的,其释放速度较为迅速,仅次于预存介质的释放;脂质介质主要功能为增加机体血管通透性,将免疫效应细胞(如白细胞)募集至病灶部位,促进粘液的产生,以及进一步活化神经细胞;而新合成的介质的释放,则发生于肥大细胞被激活的数小时之后,其可募集免疫效应细胞,并进一步促进炎症的发生([J].JournalofHistochemistry&Cytochemistry,2014,62(10):698-738)。因此,筛选可抑制肥大细胞活化的化合物具有重要意义。另外,随着现代工业化进程的发展,过敏已成为世界第六大疾病,正给人们带来持续性的健康威胁。据媒体报道,全球约有22%的人群患有过敏性疾病,其中以儿童患者最多,且其患者以每10年23倍的速度持续增长。由此类推,中国正有两亿多人遭受过敏性疾病的困扰。过敏也可称作为过敏性疾病,是由环境中本对人类无害的物质引起的免疫系统的过度反应([M].LippincottWilliams&Wilkins,2007)。过敏性疾病常见的主要有花粉症、食物过敏、特应性皮炎以及过敏性哮喘等([J].NewEnglandJournalofMedicine,2001,344(1):30-37)。其症状主要表现为皮肤红肿、发痒,流涕及呼吸急促等。目前临床上主要使用抗组胺药和肥大细胞稳定剂这两类药物用于治疗过敏性疾病,而抗组胺药在用药后,易出现困倦、嗜睡、精神不集中等症状,因此肥大细胞稳定剂成为近来研究热点。肥大细胞稳定剂可防止过敏反应中肥大细胞脱颗粒或释放组胺和其它成分或“介质”,目前作为肥大细胞稳定剂销售的药物有色甘酸二钠,其作用机理是能与敏感的肥大细胞膜外侧的钙通道结合,阻止钙内流,抑制肥大细胞脱颗粒,减少组胺、慢反应物、白三烯等多种炎性介质的释放,但目前具有类似作用机理的化合物还很有限,本领域还需要继续筛选可作为肥大细胞稳定剂的新化合物。技术实现要素:本发明的目的是提供一种可抑制肥大细胞脱颗粒的化合物及其制备方法和用途。本发明所述的可抑制肥大细胞脱颗粒的化合物,分子式为C22H26O6,分子量为386.17,具有如下化学结构式:本发明上述化合物可来源于天然提取物,也可来源于化学合成或来源于以天然提取物为原料的半合成。一种制备本发明上述化合物的方法,包括如下步骤:a)用75~95vol%乙醇水溶液对辛夷药材进行回流提取,并过滤和收集滤液;b)用石油醚萃取滤液,并分液和弃去石油醚层,收集水层;c)用乙酸乙酯萃取水层,并分液和弃去水层,收集乙酸乙酯层;d)减压浓缩乙酸乙酯层,对乙酸乙酯粗提物用MCI柱进行层析分离,流动相依次为乙醇:水=1:9,2:8,4:6,5:5,6:4,7:3,9:1,根据薄层层析将流分划成八部分,记为Fr.E1~E8;e)对记为Fr.E7的流分用LH-20柱进行层析分离,流动相为甲醇,根据薄层层析将流分划成十部分,记为Fr.E7A~E7J;f)对记为Fr.E7D的流分用ODS柱进行层析分离,流动相依次为甲醇:水=40:60,45:55,50:50,55:45,60:4,65:35,70:30,80:20,90:10,100%甲醇,根据薄层层析将流分划成十四部分,记为Fr.E7D1~E7D14;g)对记为Fr.E7D10的流分用硅胶柱进行层析分离,流动相依次为二氯甲烷:甲醇=50:1,40:1,20:1,1:1,根据薄层层析将流分划成八部分,记为Fr.E7D10A~E7D10H;h)对记为Fr.E7D10F的流分用半制备液相色谱柱进行分离,流动相为乙腈:水=48:52,流速为3mL/min,即得到本发明所述化合物。组成上述流动相中的溶剂比均指体积比。本发明所述化合物的一种用途,是以所述化合物或该化合物的药学上可接受的盐、溶剂化物、互变异构体、立体异构体或前体化合物作为活性成分用于制备抑制肥大细胞脱颗粒的药物。本发明所述化合物的另一种用途,是以所述化合物或该化合物的药学上可接受的盐、溶剂化物、互变异构体、立体异构体或前体化合物作为活性成分用于制备肥大细胞稳定剂的药物。本发明所述化合物的又一种用途,是以所述化合物或该化合物的药学上可接受的盐、溶剂化物、互变异构体、立体异构体或前体化合物作为活性成分用于制备预防或/和治疗过敏性疾病的药物。所述过敏性疾病包括特应性皮炎、花粉症、食物过敏和哮喘中的至少一种疾病。本发明所述药物的剂型不限,只要是能够使活性成分有效地到达体内的剂型都可以,例如可选自:片剂、胶囊剂、粉末、颗粒剂、糖浆、溶液、悬浮液、注射剂、酊剂、口服液、气雾剂、口含剂、冲剂、丸剂、散剂等常见剂型或纳米制剂等缓释剂型。本发明所述药物中,除了含有主要活性成分之外,还可含有少量的且不影响有效成分的次要成分和/或药学上可接受的载体,例如:可以含有甜味剂以改善口味、抗氧化剂以防止氧化,以及各种制剂所必要的辅料等。本发明中所述术语的定义如下:术语“药学上可接受的盐”是指所述化合物与药学上可接受的无机酸或有机酸所形成的盐,所述的无机酸包括但不限于:盐酸、氢溴酸、磷酸、硝酸、硫酸;所述的有机酸包括但不限于:甲酸、乙酸、丙酸、丁二酸、1,5-萘二磺酸、亚细亚酸、草酸、酒石酸、乳酸、水杨酸、苯甲酸、戊酸、二乙基乙酸、丙二酸、琥珀酸、富马酸、庚二酸、己二酸、马来酸、苹果酸、氨基磺酸、苯丙酸、葡糖酸、抗坏血酸、烟酸、异烟酸、甲磺酸、对甲苯磺酸、柠檬酸,以及氨基酸;所述“药学上可接受的”是指适用于人而无过度不良副反应(如毒性、刺激和变态反应),即有合理的效益/风险比的物质。术语“互变异构体”是指因分子中某一原子在两个位置迅速移动而产生的官能团异构体,例如:烯醇与相应的酮。术语“立体异构体”是指由分子中原子在空间上排列方式不同所产生的异构体,例如:顺反异构体、对映异构体、构象异构体等。术语“前体化合物”是指在体外无活性,但能够在生物体内进行代谢或化学反应转化为本发明的活性成分,从而发挥其药理作用的化合物。与现有技术相比,本发明具有如下显著性有益效果:本发明的研究结果显示:本发明所述化合物可显著抑制肥大细胞(BMMC)中β-己糖胺酶(β-hex)的释放,抑制率可达85.57%,具有显著的抑制肥大细胞脱颗粒的作用,可望作为活性成分用于制备抑制肥大细胞脱颗粒的药物,进而可作为活性成分用于制备肥大细胞稳定剂的药物和用于制备预防或/和治疗过敏性疾病的药物,具有广泛的应用前景。附图说明图1显示了本发明所述化合物对PCA模型的过敏性炎症反应的影响;图2显示了本发明所述化合物对组胺诱发的小鼠毛细血管通透性的影响。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。实施例1:本发明所述化合物的制备a)用95vol%乙醇水溶液对17.5kg辛夷药材进行回流提取(提取三次,每次溶剂用量为60L,提取2h),并过滤和收集滤液;b)用石油醚萃取滤液,并分液和弃去石油醚层,收集水层;c)用乙酸乙酯萃取水层,并分液和弃去水层,收集乙酸乙酯层;d)减压浓缩乙酸乙酯层,对乙酸乙酯粗提物用MCI柱进行层析分离,流动相依次为乙醇:水=1:9,2:8,4:6,5:5,6:4,7:3,9:1,根据薄层层析将流分划成八部分,记为Fr.E1~E8;e)对记为Fr.E7的流分用LH-20柱进行层析分离,流动相为甲醇,根据薄层层析将流分划成十部分,记为Fr.E7A~E7J;f)对记为Fr.E7D的流分用ODS柱进行层析分离,流动相依次为甲醇:水=40:60,45:55,50:50,55:45,60:4,65:35,70:30,80:20,90:10,100%甲醇,根据薄层层析将流分划成十四部分,记为Fr.E7D1~E7D14;g)对记为Fr.E7D10的流分用硅胶柱进行层析分离,流动相依次为二氯甲烷:甲醇=50:1,40:1,20:1,1:1,根据薄层层析将流分划成八部分,记为Fr.E7D10A~E7D10H;h)对记为Fr.E7D10F的流分用半制备液相色谱柱(半制备色谱柱型号:AgilentEclipseXDB-C18,5μm,9.4×250mm)进行分离,流动相为乙腈:水=48:52,流速为3mL/min,即得到本发明所述化合物。所述化合物的波谱数据如下:分子式:C22H26O6,分子量:386.17,淡黄色蜡状;HR-EI-MSm/z:386.1725[M]+,(calcdforC22H26O6,386.1729).;UV(MeOH)λmaxnm:207,232,273;IR(KBr)νmaxcm-1:1590,1512,1462,1417,1373,1329,1246,1175,1128,1061,1035,1007,825;1H-NMR(CDCl3,600MHz)δH:3.07(1H,m,H-1),3.11(1H,m,H-5),3.81(3H,s,H-OMe),3.84(3H,s,H-OMe),3.87(6H,s,H-OMe),3.88-3.94(2H,m,H-4a,8a),4.25(1H,dd,J=9.2,6.6Hz,H-8e),4.29(1H,dd,J=9.1,6.8Hz,H-4e),4.73(1H,d,J=5.0Hz,H-2),4.78(1H,d,J=4.7Hz,H-6),6.57(2H,s,H-10',14'),6.89(2H,d,J=8.6Hz,H-11,13),7.28(2H,d,J=8.6Hz,H-10,14);13C-NMR(CDCl3,151MHz)δC:54.16(C-5),54.63(C-1),55.45(C-15),56.31(C-16,18),60.99(C-17),71.71(C-8),72.21(C-4),85.66(C-6),86.24(C-2),102.91(C-10',14'),114.1(C-11,13),127.47(C-10,14),133.11(C-9),136.99(C-9'),137.55(C-12'),153.56(C-11',13'),159.35(C-12)。实施例2:考察本发明所述化合物对肥大细胞脱颗粒的影响使用肥大细胞(BMMC细胞),加入anti-mouse-DNP-IgE过夜后,经药物干预30min,随后加入DNP-BSA30min,刺激BMMC细胞发生脱颗粒,检测其β-hex释放量。(1)BMMC细胞培养提取C57BL/6小鼠骨髓,用30ng/LIL-3及10%FBS的RPMI1640培养基于37℃、5%CO2培养箱中培养四周,检测肥大细胞纯度高于99%后,用10ng/L及10%FBS的RPMI1640培养,每5天传代一次。(2)细胞致敏将0.5*106/mLBMMC细胞加入0.1μg/mLanti-mouse-DNP-IgE,于37℃、5%CO2培养箱中培养过夜。(3)加药干预24h后,加入用HEPES缓冲液稀释的25μM的本发明化合物或用HEPES缓冲液稀释的5μM小白菊内酯(肥大细胞稳定剂)进行干预30min。(4)刺激肥大细胞脱颗粒30min后,加入5ng/mLDNP-HSA刺激30分钟,诱发脱颗粒。(5)检测与分析β-hex的释放取50μL上清液,加入显色液(p-NAG)50μL,于37℃孵育90min,加入50μL甘氨酸终止反应,于405nm处检测吸光值;然后在细胞中加入50μL1%的triton-100,使细胞中剩余β-hex的全部释放。同样取50μL显色测定剩余β-hex含量;根据各种所测OD值,按以下公式检测β-hex释放率(%):β-hex释放率(%)=上清液OD值/(0.5×上清液OD值+剩余酶孔OD值)×100%。(6)数据分析利用软件SPSS16.0进行数据分析,不同干预组的差异性比较采用t检验分析,p<0.05认为组间差异具有统计学意义。(7)实验结果本发明所述化合物对BMMC细胞脱颗粒的具体影响见表1所示。表1对BMMC细胞中β-hex释放的影响浓度(μM)β-hex的释放率(%)SEM抑制率(%)模型组32.780.11小白菊内酯2512.460.8862.00本发明所述化合物254.730.4585.57由表1结果可知:本发明所述化合物可显著抑制IgE介导的BMMC细胞中β-hex的释放,抑制率高达85.57%,可望作为活性成分用于制备抑制肥大细胞脱颗粒的药物。实施例3:本发明所述化合物对小鼠被动皮肤过敏的影响Balb/c小鼠经扑尔敏4mg/kg/d或样品组50mg/kg/d治疗4天。在每只小鼠两只耳廓分别注射小鼠抗天花粉血清0.2mL,注射血清后继续给药或溶剂2天,于末次给药1h后尾静脉注射0.5%依文思蓝抗原注射液(含1.25mg卵蛋白)0.25mL,30min后处死动物,剪下两耳廓,置于1mol/L的KOH溶液0.75mL中,于37℃过夜消化,加入3.5mL0.6mol/L的H3PO4溶液和丙酮混合液(5:13,体积比),离心,取上清液,用分光光度计(640nm)测吸光度。数据为mean±SE,n=10。***P<0.0001。(1)Balb/c小鼠的饲养Balb/c小鼠饲养于屏障系统小鼠实验饲养室(温度:22~23℃,湿度:50~70%,工作照度:150~300Lx,动物照度:15~20Lx,噪声标准<60dB);试验前,适应环境2周。(2)Balb/c小鼠的分组Balb/c小鼠50只,按体重随机分为模型对照组(10只)、本发明所述化合物组(10只)和扑尔敏阳性对照组(10只)进行药效学实验。(3)小鼠抗天花粉血清制备于小鼠两后足垫分别皮下注射以氢氧化铝凝胶配制的0.25%天花粉液50μL,致敏14d后将小鼠放血处死,制备小鼠抗天花粉血清,于-20℃低温冰箱保存备用。(4)药物处理扑尔敏阳性药对照组:将扑尔敏药物溶解于含有10%助溶剂的双蒸水中,给予4mg/kg/d扑尔敏;本发明所述化合物组:将本发明所述化合物溶解于含有10%助溶剂的双蒸水中,分别给予50mg/kg/d本发明所述化合物;模型对照组:给予含有10%助溶剂的双蒸水;治疗6天后,分别测定各组不同处理后的耳廓吸光度。详细测试结果如图1所示。由图1可见:与模型对照Balb/c小鼠组小鼠相比,本发明所述化合物组可以显著抑制PCA模型的过敏性炎症反应,***P<0.0001。实施例4:本发明所述化合物对组胺诱发的小鼠毛细血管外显率的影响Balb/c小鼠50只,雌雄各半,随机分成6组,包括模型组、扑尔敏组(4mg/kg)、样品组。灌胃给药,连续5d,于末次给药30min后,腹部皮内注射组胺10μg/mL,形成一小皮丘,立即尾静脉注射0.5%依文思蓝0.0lmL/g,30min后处死动物,用直径0.8cm的打孔器打下两片蓝染皮片,放入3mL生理盐水-丙酮(3:7,体积比)混合液中,在37℃恒温水浴锅中放置24h,浸出液离心,取上清液,用分光光度计(610nm)测吸光度。计算抑制百分率,抑制率(%)=(模型组吸光度-样品组吸光度)/模型组吸光度×100%。数据为mean±SE,n=10。***P<0.0001。(1)Balb/c小鼠的饲养Balb/c小鼠饲养于屏障系统小鼠实验饲养室(温度:22~23℃,湿度:50~70%,工作照度:150~300Lx,动物照度:15~20Lx,噪声标准<60dB);试验前,适应环境2周。(2)Balb/c小鼠的分组Balb/c小鼠50只,按体重随机分为模型对照组(10只)、本发明所述化合物组(10只)和扑尔敏阳性对照组(10只)进行药效学实验。(3)药物处理扑尔敏阳性药对照组:将扑尔敏药物溶解于含有10%助溶剂的双蒸水中,给予4mg/kg/d扑尔敏;本发明所述化合物组:将本发明所述化合物溶解于含有10%助溶剂的双蒸水中,分别给予50mg/kg/d本发明所述化合物;模型对照组:给予含有10%助溶剂的双蒸水;治疗5天后,于末次给药30min后,腹部皮内注射组胺10μg/mL,形成皮丘,并立即尾静脉注射0.5%依文思蓝0.0lmL/g,30min后处死动物,取两片蓝染皮片萃取,于37℃恒温水浴锅中放置24h,检测吸光度。详细测试结果如图2所示。由图2可见:在给药干预5天后,与模型对照组相比,本发明所述化合物组可显著抑制组胺致小鼠毛细血管通透性增高,其抑制率为52.40%,***P<0.0001。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1