一种新型磷脂酶A2及其制备2‑DHA‑PS的方法与流程
本发明属于酶制剂
技术领域:
,具体涉及一种新型磷脂酶A2及其制备sn-2位为二十二碳六烯酸的磷脂酰丝氨酸(2-DHA-PS)的方法。
背景技术:
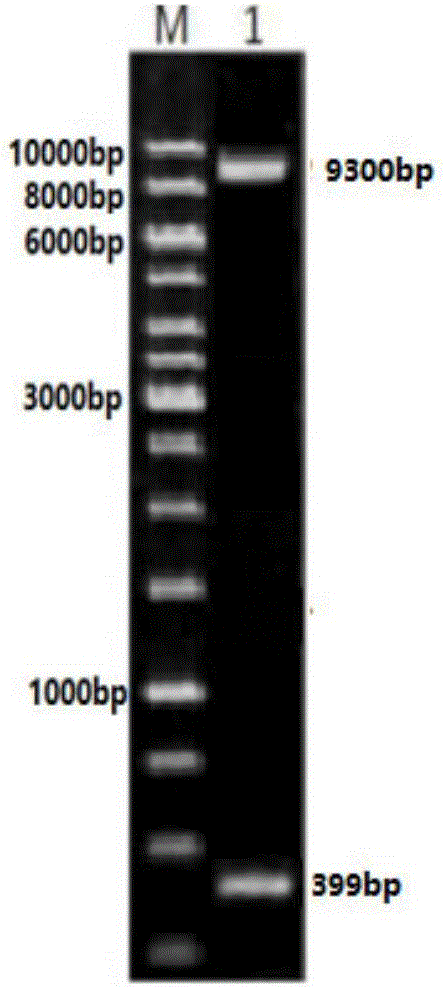
::二十二碳六烯酸(docosahexaenoicacid,DHA),俗称脑黄金,是一种对人体非常重要的不饱和脂肪酸,属于ω-3不饱和脂肪酸家族中的重要成员。DHA是神经系统细胞生长及维持的一种主要成分,是大脑和视网膜的重要构成成分,在人体大脑皮层中含量高达20%,在眼睛视网膜中所占比例最大,约占50%,因此,对胎婴儿智力和视力发育至关重要。磷脂酰丝氨酸(phosphatiAylserine,PS)是一种天然的磷脂,PS的结构决定了其具有双亲性的独特性质,带有负电荷的一端具有亲水性(或水溶性),由脂肪酸组成的另一端具有亲脂性(或脂溶性)。PS是磷脂中的一种,天然含量稀少,但它是大脑中主要的酸性磷脂,能控制和调节细胞膜关键蛋白的功能状态。PS占细胞膜双分子层磷脂的10%-20%,对中枢神经作用显著,能提高脑细胞的活力,改善大脑功能、修复大脑损伤,成为“脑专一性营养物质”,逐渐引起人们广泛关注。单纯地服用DHA会造成胃肠的负担,而且DHA不容易通过血脑屏障。研究表明,PS可以作为DHA的一种载体,当DHA结合到磷脂酰丝氨酸甘油骨架2位时,DHA的稳定性更高,而且更易通过血脑屏障。DHA和PS在体外以2-DHA-PS的形式被吸收后,在大脑中最终转化为DHA-PS而进行神经保护作用,2-DHA-PS可以兼具DHA和PS的生物学功能。磷脂酶A2(PhospholipaseA2,PLA2),是磷脂-2-酰基水解酶(EC3.1.1.4),它催化甘油磷脂sn-2位酯键的水解反应,生成溶血磷脂和脂肪酸,在磷脂分解代谢中有重要作用,此外某些来源的PLA2具有催化磷脂sn-2位磷酸二脂酯键碱基交换的功能。PLA2广泛存在于自然界,几乎所有的生物细胞及亚细胞中都有这种酶。存在于细胞内的PLA2,浓度、酶活较低,但参与许多重要的生理代谢过程;存在于细胞外的PLA2,含量高、活力强、易于富集纯化,是工业商品PLA2的主要来源。PLA2在多个领域具有应用价值:1、用于溶血磷脂的制备:溶血磷脂在食品加工中可作为乳化分散剂、乳化剂使用,溶血磷脂添加在护肤化妆品中,能起到舒展皮肤皱纹,改善粗糙结构的作用;2、用于油脂精炼:PLA2可以将油脂中的磷脂转化成易于溶解在水中的溶血磷脂,然后经过离心即可除去油脂中的磷脂,以达到脱胶的目的。3、用于功能性磷脂的制备:由于某些PLA2具有催化磷脂sn-2位磷酸二脂酯键碱基交换的功能,可以将不饱和脂肪酸(如二十二碳六烯酸、二十碳五烯酸)整合在磷脂骨架中,从而提高磷脂的生理功能。但是大部分PLA2只具有水解作用,而本研究中来自于猪胰腺的PLA2不仅具有水解作用,还具有转酯作用,可以用来制备功能性磷脂。虽然PLA2具有很多应用价值,但距工业生产的需要,特别是与其他酶生产和应用相比,存在很大的差距,主要原因是:1、酶源狭窄,目前PLA2主要从动物胰脏、蛇毒、蜂毒中提取,也有从动物内脏或微生物中提取PLA2,但是工艺复杂,不利于PLA2的大量生产和利用;2、该酶的作用机理尚未完全搞清,目前对其催化磷脂sn-2位磷酸二脂酯键水解的研究较多,而对催化磷脂sn-2位磷酸二脂酯键碱基交换的研究甚少。毕赤酵母是一种单细胞低等真核生物,培养条件普通,生长繁殖速度迅速。毕赤酵母表达系统用于表达基因工程产品时,可以大规模生产,有效降低了生产成本。毕赤酵母表达系统具有一定的翻译后加工能力,收获的外源蛋白质具有一定程度上的折叠加工和糖基化修饰,性质较原核表达系统表达的蛋白质更加稳定,毕赤酵母表达系统具有两种表达形式,包括毕赤酵母游离表达系统和毕赤酵母细胞表面展示系统。毕赤酵母游离表达系统表达的外源基因具有一定的翻译后加工能力,收获的外源蛋白质具有一定程度上的折叠加工和糖基化修饰,性质较原核表达系统表达的蛋白质更加稳定,某些酵母表达系统具有外分泌信号序列,能够将所表达的外源蛋白质分泌到细胞外,易于纯化,而毕赤酵母细胞表面展示系统除具有外源基因的翻译后加工能力和蛋白的折叠加工及适度糖基化的优点外,经该系统得到的全细胞催化剂还可以重复利用从而降低生产成本。毕赤酵母表达系统已成为现代分子生物学研究最重要的工具和模型,是表达外源基因比较理想的工具。在本发明中,对来源于猪胰腺的磷脂酶A2进行易错PCR得到新型磷脂酶A2基因,在毕赤酵母表达系统中进行了表达,得到新型的毕赤酵母磷脂酶A2重组菌株(包括毕赤酵母磷脂酶A2游离表达重组菌株和毕赤酵母细胞表面展示磷脂酶A2重组菌株)。重组菌株发酵后,经过相应的处理可得新型磷脂酶A2催化剂。在新型磷脂酶A2催化剂的催化下,PS与DHA可生成2-DHA-PS。技术实现要素::本发明的目的在于克服现有技术的不足之处,提供一种磷脂酶A2突变体及其基因,本发明使用易错PCR技术,对野生型猪胰腺磷脂酶A2进行随机突变,得到磷脂酶A2突变体(Leu10Ala)。PS与DHA在磷脂酶A2突变体的催化下生成2-DHA-PS,经分离纯化得到2-DHA-PS产品。本发明实现目的技术路线如下:取新鲜猪胰腺于液氮中研碎,按照Trizol试剂说明书进行总RNA的提取并进行RT-PCR。以合成的cDNA第一链为模板,设计引物,扩增野生型猪胰腺磷脂酶A2基因序列(如SEQIDNO:3所示)。将其与pET22b连接后通过易错PCR进行随机突变,获得磷脂酶A2突变体基因(如SEQIDNO:5所示),构建重组载体并在毕赤酵母GS115中成功表达,得到产新型磷脂酶A2的重组菌株,进一步通过发酵获得新型磷脂酶A2。PS与DHA在新型磷脂酶A2的催化下生成2-DHA-PS,经分离纯化得到2-DHA-PS产品。在本发明中采用如下定义:1、氨基酸和DNA核酸序列的命名法使用氨基酸残基的公认IUPAC命名法,用三字母代码形式。DNA核酸序列采用公认IUPAC命名法。2、磷脂酶A2突变体的标识采用“原始氨基酸位置替换的氨基酸”来表示磷脂酶A2突变体中突变的氨基酸。如Leu10Ala,表示位置10的氨基酸由亲本磷脂酶A2的Leu替换成Ala,位置的编号对应于SEQIDNO:4中野生型磷脂酶A2的氨基酸序列编号。在本发明中,PLA2表示原始磷脂酶A2(氨基酸序列如SEQIDNO:4所示),PLA2M表示突变后的磷脂酶A2(氨基酸序列如SEQIDNO:6所示);pla2表示原始磷脂酶A2的基因(如SEQIDNO:3所示),pla2m表示突变后磷脂酶A2的基因(如SEQIDNO:5所示)。磷脂酶A2碱基氨基酸PLA2第28位为T、第29位为T第10位为LeuPLA2M第28位为G、第29位为C第10位为Ala用于表达所述的磷脂酶A2突变体的宿主细胞为毕赤酵母GS115,表达载体为pPIC9K;用于表达所述的磷脂酶A2突变体的宿主细胞为毕赤酵母GS115,展示载体为pPIC9K-Flo;有益效果:1、本发明中磷脂酶A2突变体基因在毕赤酵母表达系统中进行了表达,得到毕赤酵母磷脂酶A2突变体重组菌株(包括毕赤酵母磷脂酶A2突变体游离表达重组菌株和毕赤酵母细胞表面展示磷脂酶A2突变体重组菌株),重组菌株发酵后,经过相应的处理可得新型磷脂酶A2催化剂。2、本发明使用易错PCR技术,对野生型磷脂酶A2进行随机突变,得到磷脂酶A2突变体PLA2M,酶活较野生型磷脂酶A2的酶活提高了27%。3、本发明采用酵母展示系统,将新型磷脂酶A2展示于酵母表面,酵母细胞既作为酶的生产者,又可以充当固定化酶中的载体,免去了酶的纯化和固定等操作,简化了生产环节,降低了生产成本。4、本发明提供了一种催化制备2-DHA-PS的方法,2-DHA-PS经过新型磷脂酶A2催化反应制备而得,改善了现有合成方法产量低、选择性不高、无法获取高纯度2-DHA-PS的问题,通过本发明的方法可制备2-DHA-PS,在医药、食品及保健品领域具有很大的应用潜力。附图说明:图1为野生型磷脂酶A2成熟肽基因的PCR扩增电泳图其中:M为DNAMarker,1为pla2成熟肽基因;图2为本发明重组质粒pPIC9K-pla2m酶切验证图其中:M为DNAMarker,1为pPIC9K-pla2m经EcoRI和NotI双酶切;图3为本发明重组质粒pPIC9K-Flo-pla2m酶切验证图其中:M为DNAMarker,1为pPIC9K-Flo-pla2m经SnaBI和EcoRI双酶切。具体实施方式:下面结合实施例对本发明的技术内容做进一步说明;下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。实施例1:野生型猪胰腺磷脂酶A2成熟肽基因pla2的获得1、取新鲜猪胰腺于液氮中研碎,按照Trizol试剂说明书进行总RNA的提取并进行RT-PCR。2、以合成的cDNA第一链为模板,根据Genbank序列号Y00146.1登录的pla2序列,在其ORF框上下游设计一对引物,分别引入限制性酶切位点BamHI、HindⅢ。设计本发明的pla2成熟肽基因的扩增引物如下:上游引物P1(SEQIDNO.1):5’-CGCGGATCCATGCAGGAAGGCATCAGC-3’下游引物P2(SEQIDNO.2):5’-CCCAAGCTTTTAACAGTACTTCTTGGTGTCCAG-3’其扩增的反应体系为:2×buffer25μLdNTPs(2.5mmol/Leach)2μL上游引物P1(20μmol/L)5μL下游引物P2(20μmol/L)5μLDNA模版2μLPyrobest酶0.5μLddH2O10.5μL总体积50μL扩增条件为:95℃预变性5min;95℃变性30s,60℃退火40s,72℃延伸1min30s反应30个循环;72℃延伸10min。PCR扩增产物经0.8%琼脂糖凝胶电泳,得到399bp的条带(图1),用小量DNA回收试剂盒回收PCR产物,得到本发明的野生型磷脂酶A2成熟肽基因(pla2),测序后见序列3。将扩增获得的pla2与pET22b载体连接,得到重组质粒pET22b-pla2,并化转入大肠杆菌DH5α中,经BamHI、HindⅢ双酶切验证,pla2已成功克隆到pET22b载体上。实施例2:磷脂酶A2突变体基因pla2m的获得1.基于易错PCR技术进行随机突变,构建磷脂酶A2突变体,设计引物如下:上游引物P1(SEQIDNO.1):5’-CGCGGATCCATGCAGGAAGGCATCAGC-3’下游引物P2(SEQIDNO.2):5’-CCCAAGCTTTTAACAGTACTTCTTGGTGTCCAG-3’在易错PCR反应体系中,以P1和P2作为上下游引物,以pla2成熟肽基因为模板,进行易错PCR。其扩增的反应条件为:10×PCR缓冲液(无Mg2+)10.0μLdATP0.2μLdGTP0.2μLdCTP1.0μLdTTP1.0μL上游引物P11.5μL下游引物P21.5μL野生型磷脂酶A21.0μLTaqDNA聚合酶1.0μLMg2+(7mM)28μLMn2+(0.15mM)2μLddH2O52.6uL扩增条件为:95℃预变性5min;95℃变性30s,60℃退火40s,72℃延伸1min30s反应30个循环;72℃延伸10min。2.将磷脂酶A2易错PCR产物克隆入表达载体pET22b中,转化大肠杆菌BL21(DE3),接种于每孔含200μLLB液体培养基(含30μg/mL的Kan)的96孔细胞培养板中,于37℃条件下200r/min摇床培养,当OD600达到0.6,向每个孔中加入IPTG(终浓度1mmol/L),在16℃下诱导16h,4℃下4000r/min离心15min后收集菌体,重悬于15mL预冷的pH为7.4的PBS缓冲液中,用低温超高压连续流动细胞破碎仪破碎细胞,破碎结束后,在4℃下12000r/min离心45min,收集上清获得粗酶液,随后进行酶活力检测。3.磷脂酶A2活力测定(1)磷脂酶A2酶活测定原理微孔比色法是国外最新发展的一种磷脂酶A2测定法。其原理是基于1976年Aarsman等建立的巯基显色法,即合成一种磷脂类似物2-硫代十六酰乙基磷酸胆碱(2-hexadecanoylthio-l-ethyl-phosphorylcholine,HEPC)作底物,该底物中sn-2位以硫酯键替代,仍可受磷脂酶A2水解,并释放出游离巯基,与5,5’-二硫代硝基苯甲酸(DTNB)或其它显色剂显色,在410nm波长附近有最大吸收,测定吸收值,换算出巯基的量就可以求出酶活力。反应在96孔板中进行,用酶标仪测定吸收值。酶活力定义为:37℃下每分钟产生1nmol游离巯基的酶量为1个酶活力单位。(2)磷脂酶A2酶活测定方法基础液:0.2mol/LpH8.0Tris-HCl缓冲液90ml,加入0.2mol/LCaCl2,5mmol/LDTNB,5mmol/L去氧胆酸钠各20ml,充分混匀。工作液:5mmol/LHEPC1ml加基础液15ml,混匀。对照液:蒸馏水1ml,加基础液15ml,混匀。磷脂酶A2的测定步骤混匀,37℃温育1h,测410nm波长A值,空白调零(3)酶活力计算磷脂酶A2活力(U/ml)=73.5×(A测定孔-A对照孔)(4)磷脂酶A2酶活测定经测定,PLA2M的酶活比PLA2提高了27%;4、序列测定测序(北京华大生物工程公司)结果表明,此时扩增得到突变位点为Leu10Ala的新型磷脂酶A2(pla2m),见序列5。实施例3:毕赤酵母野生型磷脂酶A2及磷脂酶A2突变体游离表达重组菌的构建1、PLA2和PLA2M表达载体pPIC9K-pla2、pPIC9K-pla2m的构建分别将扩增产物野生型猪胰腺磷脂酶A2基因(pla2)和易错PCR纯化产物(pla2m)EcoRI和NotI双酶切后与同样双酶切的毕赤酵母表达载体pPIC9K用连接酶进行连接,转化大肠杆菌DH5α,经Amp抗性筛选,菌落37℃过夜培养后抽提质粒,重组质粒进行酶切验证(见图2)。将验证正确的重组表达质粒分别命名为pPIC9K-pla2和pPIC9K-pla2m。将经过酶切后得到的阳性克隆送至北京华大基因科技股份有限公司测序,以保证目的片段序列的正确性。2、PLA2和PLA2M重组菌株的构建及其高表达菌株的筛选(1)线性化质粒DNA的制备在转化毕赤酵母之前,要先将构建好的重组表达质粒pPIC9K-pla2和pPIC9K-pla2m线性化,以提高质粒在毕赤酵母染色体上的整合效率。每次转化需要线性化质粒DNA10μg。用SalI限制性内切酶进行线性化酶切。(2)线性化质粒pPIC9K-pla2和pPIC9K-pla2m电转化毕赤酵母、阳性转化子的鉴定及新型磷脂酶A2菌株的筛选①将80μL毕赤酵母GS115感受态细胞和10μg经线性化的DNA加入到1.5mL预冷的离心管中,混匀,将反应液转移到预先冰浴的转化杯中;②将装有转化液的转化杯冰浴5min后,在电转电压1500V,电转时间5ms的条件下,进行毕赤酵母电转化;③脉冲后,立即向转化杯中加入1mL预冷的1mol/L的山梨醇溶液,把转化液转移到一个新的1.5mL离心管中;④30℃静置培养lh,吸取毕赤酵母GS115电转液200μL涂布在MD培养基上;⑤30℃培养直至转化子出现;⑥挑取转化子单菌落溶解在10μL去离子水中,取2μL菌液,加入Lyticase破壁酶,30℃反应l0min,反应液立即放入-80℃冰箱中冷冻l0min,使酵母细胞壁裂解,释放的基因组作为模板进行PCR。以转入空质粒pPIC9K的毕赤酵母GS115/pPIC9K作为对照,确定阳性转化子。⑦在确定阳性转化子的基础上,先用含不同浓度遗传霉素的抗性平板筛选高遗传霉素抗性的转化子,然后分别测定这些高遗传霉素抗性的转化子的磷脂酶A2的酶活,以得到PLA2的重组菌株GS115/pPIC9K-pla2和PLA2M的重组菌株GS115/pPIC9K-pla2m。实施例4:毕赤酵母细胞表面展示PLA2和PLA2M重组菌的构建1、重组质粒pPIC9K-Flo-pla2和pPIC9K-Flo-pla2m的构建野生型磷脂酶A2基因(pla2)、磷脂酶A2突变体基因(pla2m)和载体pPIC9K-Flo经SnaBI和EcoRI双酶切后,pla2、pla2m分别与pPIC9K-Flo连接,将连接产物转化到大肠杆菌DH5α感受态中,在含有Amp的LB固体培养基中筛选培养,挑取阳性转化子,培养后提质粒,双酶切鉴定并测序(见图3),命名为pPIC9K-Flo-pla2和pPIC9K-Flo-pla2m。2、毕赤酵母重组菌的构建将测序正确的重组质粒经SalI线性化后,用电转化法转化毕赤酵母GS115,MD平板筛选重组子,获得毕赤酵母细胞表面展示野生型磷脂酶A2重组菌GS115/pPIC9K-Flo-pla2和毕赤酵母细胞表面展示磷脂酶A2突变体重组菌GS115/pPIC9K-Flo-pla2m。实施例5:PLA2和PLA2M在毕赤酵母游离表达重组菌中的表达及制备将培养于YPD固体平板上实施例3所得到的毕赤酵母游离表达重组菌GS115/pPIC9K-pla2和GS115/pPIC9K-pla2m分别接种至YPD液体培养基中,30℃、250r/min培养24h。以1%的接种量转接到新鲜BMGY培养基中,30℃培养24h,然后6000r/min离心5min得到菌体,转入BMMY培养基中。30℃、250r/min,每隔24h补甲醇,使其终浓度保持在0.5%V/V,培养120h后可得到磷脂酶A2的粗酶液。测定其磷脂酶A2酶活,其中毕赤酵母游离表达野生型PLA2的酶活可达89U/ml,毕赤酵母游离表达PLA2M的酶活可达113U/ml,比野生型PLA2的酶活提高了27%。然后采用分级盐析法沉淀野生型PLA2和新型PLA2M,收集蛋白质沉淀,溶解后,透析除盐,再经离子交换层析、凝胶层析后,冷冻干燥制得野生型PLA2和新型PLA2M酶粉。实施例6:毕赤酵母细胞表面展示PLA2和PLA2M全细胞催化剂的制备将培养于YPD固体平板上实施例4得到的毕赤酵母细胞表面展示重组菌GS115/pPIC9K-Flo-pla2和GS115/pPIC9K-Flo-pla2m分别接种至YPD液体培养基中,30℃、250r/min培养24h,以1%的接种量转接到新鲜BMGY培养基中,30℃培养24h,然后6000r/min离心5min得到菌体,转入BMMY培养基中,30℃、250r/min培养120h,每隔24h补甲醇,使其终浓度保持在0.5%V/V,然后离心收集取菌体,用双蒸水洗2次,通过真空冷冻干燥制得毕赤酵母细胞表面展示PLA2全细胞催化剂和PLA2M全细胞催化剂。测定其磷脂酶A2酶活,其中野生型PLA2全细胞催化剂的酶活可达237U/g,PLA2M全细胞催化剂的酶活可达301U/g。实施例7:本发明采用的2-DHA-PS的分析方法样品中2-DHA-PS相对含量的分析方法为液质联用技术(HPLC/ESI/MSn),具体过程是取适量的样品,溶解于氯仿:甲醇=1:1(v/v)溶液中,并在样品溶液中加入1μM的磷酯酰丝氨酸(PS(14:0/14:0))内标物。利用HPLC/ESI/MSn法检测的色谱条件为:固定相:Si60色谱柱(125mm×4mm,5μm);柱温:25℃;样品溶液进样量:5μl;采用柱后分流技术:色谱柱内流速为1mL/min,分流后流入质谱离子源的流速为0.2mL/min;流动相体系:流动相A:氯仿:甲醇:氢氧化铵=89:10.5:0.5(v/v/v);流动相B:氯仿:甲醇:氢氧化铵:水=55:39.5:0.5:5(v/v/v/v);洗脱梯度程序:0-45min,95%A-50%A,5%B-50%B;45-60min,50A-95%A,50%B-5%B;利用HPLC/ESI/MSn法检测的质谱条件为:离子化方式:ESI(负离子方式);扫描范围在m/z550~1000;喷雾电压为4.5KV;离子传输管的温度为350℃;2-DHA-PS相对含量的表征方法为:2-DHA-PS转化率(%)=2-DHA-PS/PS*100%实施例8:PLA2和PLA2M的酶粉催化制备2-DHA-PS以PS和DHA为底物,实施例5所得PLA2和PLA2M的酶粉为催化剂制备2-DHA-PS。反应体系为:PS的质量160mg、DHA的质量280mg溶于5g甘油,磷脂酶A2酶粉3mg溶于0.5mL1mmoL/LpH=8.0的Tris-HCl缓冲溶液(含3mmoL/LCaCl2),混合,反应温度为50℃、反应转速为500rpm/min、反应时间为32h时。PS和DHA经PLA2酶粉催化得到2-DHA-PS的转化率为23%,PS和DHA经PLA2M酶粉催化得到2-DHA-PS的转化率为39%。实施例9:PLA2和PLA2M的全细胞催化剂催化制备2-DHA-PS以PS和DHA为底物,实施例6制备的PLA2和PLA2M的全细胞催化剂为催化剂制备2-DHA-PS。反应体系为:PS的质量为160mg、DHA的质量为280mg溶于5g甘油,磷脂酶A2全细胞催化剂4mg溶于0.5mL1mmoL/LpH=8.0的Tris-HCl缓冲溶液(含3mmoL/LCaCl2),混合,反应温度为50℃、反应转速为500rpm/min、反应时间为32h时。PS和DHA经PLA2全细胞催化剂催化得到2-DHA-PS的转化率为32%,PS和DHA经PLA2M全细胞催化剂催化得到2-DHA-PS的转化率为56%。SEQUENCELISTING<110>天津科技大学<120>一种新型磷脂酶A2及其制备2-DHA-PS的方法<130>1<160>6<170>PatentInversion3.5<210>1<211>27<212>DNA<213>人工序列<400>1cgcggatccatgcaggaaggcatcagc27<210>2<211>33<212>DNA<213>人工序列<400>2cccaagcttttaacagtacttcttggtgtccag33<210>3<211>399<212>DNA<213>猪胰腺<400>3atgcaggaaggcatcagctcaagggcattatggcagtttcgtagcatgattaagtgcgca60atccccggcagtcaccccttgatggatttcaacaactatggctgctactgtggcctaggt120ggatcagggacccctgtggatgaactggacaggtgctgcgagacacacgacaactgctac180agagatgccaagaacctggacagctgtaaattcctcgtggacaatccctacaccgaaagc240tactcctactcatgttctaacactgagatcacctgcaacagcaaaaacaatgcttgtgag300gccttcatctgtaactgtgaccgaaatgctgccatttgcttctcaaaggccccatacaac360aaggagcacaagaacctggacaccaagaagtactgttaa399<210>4<211>133<212>PRT<213>猪胰腺<400>4MetGlnGluGlyIleSerSerArgAlaLeuTrpGlnPheArgSerMet151015IleLysCysAlaIleProGlySerHisProLeuMetAspPheAsnAsn202530TyrGlyCysTyrCysGlyLeuGlyGlySerGlyThrProValAspGlu354045LeuAspArgCysCysGluThrHisAspAsnCysTyrArgAspAlaLys505560AsnLeuAspSerCysLysPheLeuValAspAsnProTyrThrGluSer65707580TyrSerTyrSerCysSerAsnThrGluIleThrCysAsnSerLysAsn859095AsnAlaCysGluAlaPheIleCysAsnCysAspArgAsnAlaAlaIle100105110CysPheSerLysAlaProTyrAsnLysGluHisLysAsnLeuAspThr115120125LysLysTyrCysIle130<210>5<211>399<212>DNA<213>人工序列<400>5atgcaggaaggcatcagctcaagggcagcatggcagtttcgtagcatgattaagtgcgca60atccccggcagtcaccccttgatggatttcaacaactatggctgctactgtggcctaggt120ggatcagggacccctgtggatgaactggacaggtgctgcgagacacacgacaactgctac180agagatgccaagaacctggacagctgtaaattcctcgtggacaatccctacaccgaaagc240tactcctactcatgttctaacactgagatcacctgcaacagcaaaaacaatgcttgtgag300gccttcatctgtaactgtgaccgaaatgctgccatttgcttctcaaaggccccatacaac360aaggagcacaagaacctggacaccaagaagtactgttaa399<210>6<211>133<212>PRT<213>人工序列<400>6MetGlnGluGlyIleSerSerArgAlaAlaTrpGlnPheArgSerMet151015IleLysCysAlaIleProGlySerHisProLeuMetAspPheAsnAsn202530TyrGlyCysTyrCysGlyLeuGlyGlySerGlyThrProValAspGlu354045LeuAspArgCysCysGluThrHisAspAsnCysTyrArgAspAlaLys505560AsnLeuAspSerCysLysPheLeuValAspAsnProTyrThrGluSer65707580TyrSerTyrSerCysSerAsnThrGluIleThrCysAsnSerLysAsn859095AsnAlaCysGluAlaPheIleCysAsnCysAspArgAsnAlaAlaIle100105110CysPheSerLysAlaProTyrAsnLysGluHisLysAsnLeuAspThr115120125LysLysTyrCysIle130当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1