一锅法合成2,4‑二烯基取代吲哚化合物的方法与流程
本发明属于有机合成领域,尤其涉及一种一锅法合成2,4-二烯基取代吲哚化合物的方法以及应用。
背景技术:
吲哚类化合物是自然界中分布最广的杂环化合物,作为医药、农药、染料和其它精细化工产品的中间体,其应用越来越广。近年来,有机荧光材料已经成为发光材料领域中最为活跃的研究课题之一。吲哚是一种由紫外光激发的荧光试剂,由于其显著的荧光位移变化,吲哚可应用于双波长比率法实验,从而可以避免染色不均、光致褪色等问题,得到广泛应用。本发明围绕该领域,选用具有电荷给予能力的吲哚发色基团为主要结构单元,通过改变吲哚环以及乙烯基上的取代基团来设计不同的结构,以得到最优的荧光化合物。以下是一些具有典型的吲哚类的荧光化合物:
Wattenberg报道(Cancer Res.1983,43,2448):人们大量食用的十字花科蔬菜所含的微量吲哚类化合物是抑制癌症发生的因素之一。大量研究表明,吲哚-3-甲醇有较好的抗致癌作用(Anticancer Res.1996,16,2709)。长春新碱和靛玉红等抗癌药都含有吲哚或类吲哚结构,所以吲哚类化合物在抗癌方面也有不可忽视的作用。
文献报道中合成二烯基取代吲哚的主要方法有:1)Ulf Pindur和Reinhard Adam利用吲哚-2-甲醛,吲哚-3-甲醛或者吲哚-2,3-二甲醛与磷叶立德进行Wittig反应得到2,3-二烯基取代吲哚(U.Pindur,R.Adam,Helv.Chim.Acta.1990,73,827);2)Peter Langer和Munawar Hussain利用2,3-二溴吲哚与端位烯基化合物以Pd(OAc)2为催化剂,SPhos为配体进行Heck反应,从而合成2,3-二烯基取代吲哚(M.Hussain,S.-M.Tengho Toguem,R.Ahmad,Thanh Tùng,I.Knepper,A.Villinger,P.Langer,Tetrahedron 2011,67,5304.)。鉴于上述合成方法具有一定的局限性,比如反应物的合成需要额外的步骤,而且条件也比较苛刻,对于合成2,4-二苯乙烯基取代吲哚的结构也有局限性。近年来,小分子有机荧光化合物逐渐引起人们的关注,而且对于2,4-二烯基取代吲哚的光学性质至今很少进行研究。因此,发展高效合成2,4-二烯基取代吲哚化合物的方法具有重要意义。
技术实现要素:
本发明提供了一种一锅法合成2,4-二烯基取代吲哚化合物的方法,该方法步骤简单,原料容易得到,而且能高效地合成2,4-二烯基取代吲哚化合物,对于2,4-二苯乙烯基取代吲哚也能以较好的收率制得。
一种一锅法合成2,4-二烯基取代吲哚化合物的方法,包括如下步骤:将吲哚甲酸、乙烯类化合物、[Cp*RhCl2]2(五甲基环戊二烯氯化铑二聚体)、碱式碳酸铜、醋酸钾以及六氟锑酸银加入到有机溶剂中,加热进行反应,反应完全后,后处理得到所述的2,4-二烯基取代吲哚化合物;
所述的芳香胺的结构如式(II)所示:
所述的乙烯类化合物的结构如式(III)所示:
所述的2,4-二烯基取代吲哚化合物的结构如式(I)所示:
式(I)~(III)中,R1为氢、C1~C5烷氧基、卤素;
R2为C1~C5烷氧羰基、取代或者为取代的苯基,所述的苯基上的取代基选自C1~C5酯基、三氟甲基或卤素中的一个或者多个。
本发明中,通过采用特定催化剂、碱和添加剂,使吲哚甲酸、乙烯类化合物得C-H键活化、烯基化和脱羧化反应同时发生,操作条件简单,反应收率高。
反应式如下:
作为优选,R1为氢、甲氧基、氟、氯或溴,此时,所述的吲哚甲酸容易得到,并且反应的产率较高。
作为优选,R2为甲氧羰基、取代或者为取代的苯基,所述的苯基上的取代基选自氟、氯、溴、三氟甲基、氰基或酯基,此时,所述的乙烯类化合物容易得到,并且反应的产率较高。
所述的吲哚甲酸和苯乙烯的价格较便宜,在自然界中广泛存在,所述的苯乙烯用量为过量,作为优选,以摩尔量计,吲哚甲酸:乙烯类化合物:[Cp*RhCl2]2:碱式碳酸铜:六氟锑酸银:醋酸钾:=1:3~4:0.05:2~2.1:0.2:1~1.2。
本发明中,所用的催化剂为五甲基环戊二烯氯化铑二聚体,该催化剂相对于其他铑金属催化剂活性较高,反应条件温和,而且反应效率较高。所用的碱式碳酸铜价格便宜,在此反应中很大地促进了反应的进行。所用的六氟锑酸银添加量较少,相对于其他添加剂来说,对反应起到决定性的作用,并且使反应非常高效。所用的醋酸钾具有中等碱性,能有效的使反应的产率提高。
作为优选,反应温度为110~120℃,反应的时间为20~24小时。反应时间过长增加反应成本,相反则难以保证反应的完全。
本发明中,能将原料充分溶解的有机溶剂都能使反应发生,但反应效率差别较大,优选为非质子性溶剂,非质子性溶剂能够有效地促进反应的进行;作为优选,所述的有机溶剂为DMF或者二氯甲烷;作为进一步的优选,所述的有机溶剂为二氯甲烷,此时,各种原料都能以较高的转化率转化成产物。
所述的有机溶剂的用量能将原料较好的溶解即可,一般情况下,0.1mmol的吲哚甲酸使用的有机溶剂的量约为1mL。
作为优选,所述的2,4-二烯基取代吲哚化合物为式(I-1)-式(I-10)所示化合物中的一种:
本发明中,可选用的后处理过程包括:萃取,洗涤,干燥,硅胶拌样,最后经过柱层析纯化得到相应的2,4-二烯基取代吲哚化合物,采用柱层析纯化为本领域常用的技术手段。
上述制备方法中,所述的吲哚甲酸、苯乙烯、[Cp*RhCl2]2、碱式碳酸铜、六氟锑酸银以及醋酸钾一般采用市售产品,都能从市场上方便地得到。
同现有技术相比,本发明的有益效果体现在:该制备方法比较简单,易于操作,后处理简便;反应原料容易得到,底物可设计性强,可根据实际需要设计合成出所需结构的化合物,并且可以通过改变吲哚甲酸或者苯乙烯上的取代基,从而改变产物2,4-二烯基吲哚的光学性质。
附图说明
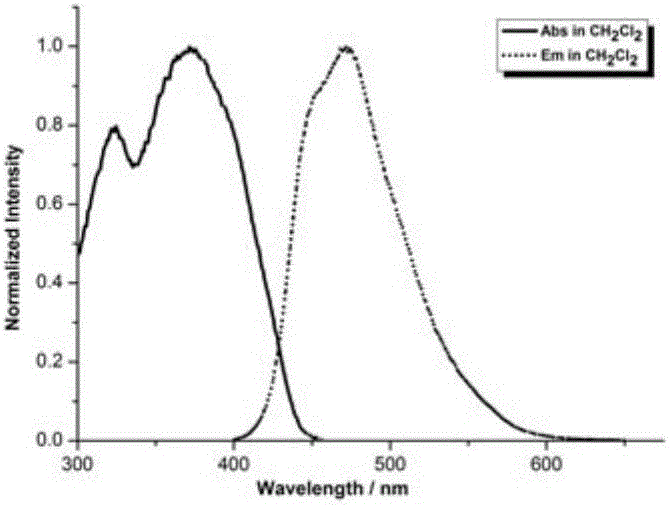
图1为实施例1得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图2为实施例2得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图3为实施例3得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图4为实施例4得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图5为实施例5得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图6为实施例6得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图7为实施例7得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图8为实施例8得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图9为实施例9得到的化合物的紫外-可见吸收光谱和荧光光谱图;
图10为实施例10得到的化合物的紫外-可见吸收光谱和荧光光谱图;其中,紫外-可见吸收光谱在Shimadzu UV-2450光谱仪上进行测试。荧光发射光谱在Shimadzu RF-5301PC荧光分光光度计上进行测定。测试条件均为室温下使用二氯甲烷作溶剂(氢化钙处理)。
具体实施方式
下面结合具体实施例对本发明做进一步的描述,以下具体实施例都是本发明的最优实施方式。
实施例1~10
按照表1的原料配比在35ml的Schlenk管中加入吲哚甲酸(0.1mmol)、乙烯类化合物(0.4mmol)、[Cp*RhCl2]2(0.005mmol)、碱式碳酸铜(0.21mmol)、六氟锑酸银(0.02mmol)以及醋酸钾(0.1mmol)和有机溶剂1ml,混合搅拌均匀,按照表2的反应条件反应完成后,萃取,洗涤,干燥,硅胶拌样,经过柱层析纯化得到相应的2,4-二烯基取代吲哚化合物(Ⅰ),反应过程如下式所示:
表1实施例1~10的原料配比
表2实施例1~10的反应条件和反应结果
表1和表2中,T为反应温度,t为反应时间,COOMe为甲氧基羰基,OMe为甲氧基,CF3为三氟甲基,Ph为苯基。
实施例1~10制备得到部分化合物的结构确认数据:
(2E,2'E)-dimethyl 3,3'-(1-methyl-1H-indole-2,4-diyl)diacrylate(I-1)
Rf 0.51(hexane/EtOAc=5/1).Yellow-green solid.Isolated yield:29.0mg,97%.1H NMR(400MHz,CDCl3):δ8.042(d,J=16Hz,1H),7.761-7.805(m,1H),7.323-7.359(m,2H),7.259(dd,J1=4.0Hz,J2=7.2Hz,1H),7.204(s,1H),6.531-6.619(m,2H),3.839(d,J=3.2Hz,6H),3.812(s,3H).13C NMR(100MHz,CDCl3):δ167.760,167.268,143.032,139.410,136.065,132.255,127.075,126.521,123.462,121.054,119.032,118.334,111.659,101.923,51.904,51.738,30.222.HRMS(ESI-TOF)calcd for C17H17NO4([M+H+]):300.1236,found:300.1238.
1-methyl-2,4-distyryl-1H-indole(I-2)
Rf 0.52(hexane/EtOAc=20/1).Red solid.Isolated yield:25.8mg,77%.1H NMR(400MHz,CDCl3):δ7.510(d,J=5.6Hz,2H),7.435-7.475(m,3H),7.253-7.3410(m,5H),7.218(d,J=10.0Hz,1H),7.180(d,J=7.2Hz,2H),7.085-7.130(m,3H),7.052(d,J=16.0Hz,1H),7.003(s,1H),3.671(s,3H).13C NMR(100MHz,CDCl3):δ138.814,138.750,138.073,137.162,131.226,129.349,129.204,128.741,127.985,127.429,127.241,126.608,126.564,126.542,122.050,117.612,116.922,108.587,97.767,30.070.HRMS(EI-TOF)calcd for C25H21N(M+):335.1674,found:335.1674.
2,4-bis(4-fluorostyryl)-1-methyl-1H-indole(I-3)
Rf 0.50(hexane/EtOAc=20/1).Brown solid.Isolated yield:26.3mg,71%.1H NMR(400MHz,CDCl3):δ7.535-7.570(m,2H),7.485-7.520(m,2H),7.440(d,J=16.0Hz,1H),7.331(dd,J1=3.2Hz,J2=5.6Hz,1H),7.183-7.245(m,4H),7.052-7.091(m,6H),3.806(s,3H).13C NMR(100MHz,CDCl3):δ163.764,163.484,161.300,161.026,138.702,138.664,134.211,134.171,133.309,133.289,130.034,129.175,128.064,127.979,127.895,126.970,126.950,126.466,122.057,117.570,116.647,116.637,115.931,115.711,115.504,108.580,97.591,30.077.HRMS(EI-TOF)calcd for C25H19F2N(M+):371.1486,found:371.1490.
2,4-bis(4-chlorostyryl)-1-methyl-1H-indole(I-4)
Rf 0.43(hexane/EtOAc=20/1).Orange solid.Isolated yield:33.4mg,83%.1H NMR(400MHz,CDCl3):δ7.525(d,J=2.0Hz,2H),7.506-7.516(m,1H),7.448-7.475(m,1H),7.331-7.358(m,5H),7.254(d,J=1.6Hz,1H),7.211-7.227(m,3H),7.167(d,J=6.8Hz,2H),7.084(s,1H),3.820(s,3H).13C NMR(100MHz,CDCl3):δ138.778,138.536,136.487,135.571,135.551,132.907,129.877,129.008,128.838,127.899,127.741,127.642,126.477,122.192,117.800,117.361,108.809,97.910,30.107.HRMS(EI-TOF)calcd for C25H19Cl2N(M+):403.0895,found:403.0890.
1-methyl-2,4-bis(4-(trifluoromethyl)styryl)-1H-indole(I-5)
Rf 0.46(hexane/EtOAc=20/1).Brown solid.Isolated yield:37.6mg,67%.1H NMR(400MHz,CDCl3):δ7.644-7.678(m,2H),7.622(s,6H),7.594(d,J=8.8Hz,1H),7.367-7.387(m,1H),7.272-7.320(m,1H),7.218-7.255(m,4H),7.139(s,1H),3.828(s,3H).13C NMR(100MHz,CDCl3):δ141.391,140.439,138.904,138.258,129.546,128.866,128.822,127.717,126.535,125.842,125.807,125.770,125.731,125.673,125.651,125.565,122.460,119.140,118.235,109.291,98.444,30.219,30.134,29.741,29.697.HRMS(EI-TOF)calcd for C27H19F6N(M+):471.1422,found:471.1426.
Dimethyl 4,4'-(1E,1'E)-2,2'-(1-methyl-1H-indole-2,4-diyl)bis(ethene-2,1-diyl)Dibenzoate(I-6)
Rf 0.33(hexane/EtOAc=5/1).Brown solid.Isolated yield:33.9mg,75%.1H NMR(400MHz,CDCl3):δ8.037(d,J=8.4Hz,4H),7.606-7.646(m,5H),7.384(d,J=7.2Hz,2H),7.283-7.330(m,4H),7.247-7.265(m,1H),3.925(s,6H),3.817(s,3H).13C NMR(100MHz,CDCl3):δ167.019,167.798,136.487,142.557,137.225,130.948,130.212,130.109,130.035,129.968,129.540,129.418,129.150,128.884,128.587,128.037,126.964,126.636,126.255,121.742,111.703,109.354,99.510,52.129,52.085,33.065.HRMS(ESI-TOF)calcd for C29H25NO4([M+H+]):452.1862,found:452.1872.
Dimethyl 4,4'-(1E,1'E)-2,2'-(5-fluoro-1-methyl-1H-indole-2,4-diyl)bis(ethene-2,1-diyl)dibenzoate(I-7)
Rf 0.28(hexane/EtOAc=5/1).Brown solid.Isolated yield:26.3mg,56%.1H NMR(400MHz,CDCl3):δ8.044(d,J=7.2Hz,4H),7.915(d,J=1.6Hz,1H),7.620-7.662(m,2H),7.578-7.599(m,2H),7.444-7.494(m,1H),7.301-7.334(m,1H),7.250-7.261(m,2H),7.119-7.148(m,2H),3.925(d,J=7.2Hz,6H),3.894(s,3H).13C NMR(100MHz,CDCl3):δ166.985,166.783,141.243,141.301(d,JC-F=120.08Hz),139.091,135.216,131.273(d,JC-F=33.2Hz),130.471,130.156,130.039,129.973,129.804,129.301,128.954,126.332(d,JC-F=11.2Hz),123.642,118.832,113.042(d,JC-F=105.2Hz),111.169,111.077,111.024,109.618(d,JC-F=46.4Hz),108.352,108.099,99.204,99.149,52.182,52.121,34.320.HRMS(ESI-TOF)calcd for C29H24FNO4([M+H+]):470.1768,found:470.1774.
Dimethyl 4,4'-(1E,1'E)-2,2'-(5-chloro-1-methyl-1H-indole-2,4-diyl)bis(ethene-2,1-diyl)dibenzoate(I-8)
Rf 0.28(hexane/EtOAc=5/1).Brown solid.Isolated yield:25.2mg,52%.1H NMR(400MHz,CDCl3):δ8.027-8.072(m,4H),7.741(d,J=16.4Hz,1H),7.665(d,J=8.4Hz,2H),7.578(d,J=8.4Hz,2H),7.361(d,J=8.4Hz,1H),7.217-7.260(m,3H),7.127-7.165(m,2H),7.117-7.125(m,1H),3.935(d,J=4.2Hz,6H),3.823(s,3H).13C NMR(100MHz,CDCl3):δ166.948,166.766,142.251,141.184,139.331,137.370,132.237,130.559,130.158,130.074,129.336,129.079,128.036,126.492,126.355,126.062,123.537,118.711,109.947,99.699,52.188 52.147,30.181.HRMS(ESI-TOF)calcd for C29H24ClNO4([M+H+]):486.1472,found:486.1480.
dimethyl 4,4'-(1E,1'E)-2,2'-(5-bromo-1-methyl-1H-indole-2,4-diyl)bis--(ethene-2,1-diyl)dibenzoate(I-9)
Rf 0.28(hexane/EtOAc=5/1).Brown solid.Isolated yield:27.5mg,52%.1H NMR(400MHz,CDCl3):δ8.056(dd,J1=8.4Hz,J2=11.6Hz,4H),7.661-7.702(m,3H),7.584(d,J=8.4Hz,2H),7.404(d,J=8.4Hz,1H),7.273-7.332(m,2H),7.255(d,J=4.4Hz,2H),7.095-7.125(m,1H),3.938(d,J=5.6Hz,6H),3.835(s,3H).13C NMR(100MHz,CDCl3):δ166.946,166.779,142.147,141.180,139.154,137.833,132.387,130.613,130.539,130.154,130.096,129.343,129.110,128.612,127.722,126.971,126.503,126.388,126.354,125.279,118.677,116.138,111.541,110.247,99.781,52.196,52.152,29.727.HRMS(ESI-TOF)calcd for C29H24BrNO4([M+H+]):530.0967,found:530.1968.
Dimethyl 4,4'-(1E,1'E)-2,2'-(5-methoxy-1-methyl-1H-indole-2,4-diyl)bis--(ethene-2,1-diyl)dibenzoate(I-10)
Rf 0.26(hexane/EtOAc=5/1).Red solid.Isolated yield:29.9mg,62%.1H NMR(400MHz,CDCl3):δ8.038(d,J=8.0Hz,4H),7.798(d,J=16.4Hz,1H),7.656(d,J=8.0Hz,2H),7.581(d,J=8.4Hz,2H),7.462-7.534(m,1H),7.252(d,J=5.2Hz,2H),7.187(d,J=8.8Hz,1H),7.137(s,1H),6.940(d,J=8.8Hz,1H),3.928-3.937(m,9H),3.798(s,3H).13C NMR(100MHz,CDCl3):δ167.113,166.819,152.670,143.464,141.459,139.203,134.581,130.124,129.976,129.847,129.108,128.308,126.864,126.308,126.276,126.183,119.145,116.492,109.604,108.856,99.075,57.221,52.160,52.065,29.723.HRMS(ESI-TOF)calcd for C30H27NO5([M+H+]):482.1967,found:482.1965。
- 还没有人留言评论。精彩留言会获得点赞!