去糖化的海参次级皂苷及其制备方法与流程
本发明涉及一种海参皂苷的酶解制备方法,具体涉及利用糖苷酶酶解海参皂苷的方法,最终得到脱除两个糖基的海参次级皂苷。
背景技术:
海参为棘皮动物门、海参纲、楯手目动物。海参皂苷是海参体内重要的次生代谢产物同时也是重要的活性物质,海参皂苷主要活性作用——抗肿瘤、抗真菌、抗病毒、抗衰老以及溶血作用,还有调节特定细胞的生长发育和免疫调节等作用。因此,海参皂苷是海参药用价值的重要指标。
皂苷具有溶血作用,皂苷可与红细胞膜结合形成甾醇复合物,从而导致通透性增加,造成血红蛋白的流失。这一性质增加了皂苷的毒性,阻碍其药用价值的发挥。Yibing Wang等人研究发现植物皂苷的溶血活性与其分子结构有很大关系——相同苷元,糖链上糖基个数越多溶血活性越强;相同糖基个数,但糖基之间连接方式不同溶血活性也不同,如双糖以(1-2)-,(1-4)-,(1-6)-方式连接的皂苷,其溶血性依次增强;糖基上的乙酰化降低皂苷溶血活性。Han M等人进行体内、体外实验表明,一些糖基化的大量皂苷,如人参皂苷 Rb1、Rb2、Rc,在小肠内吸收非常微弱,而一些脱糖基化的稀有皂苷,则更容易作为在体内发挥作用的活性成分被吸收到血液系统中。并且一些稀有人参皂苷,例如Rg3、Rh2、Rh1、化合物C-K及人参苷元等较未降解前的人参皂苷具有更好的肿瘤细胞毒活性。
海参皂苷的溶血活性比人参皂苷还要强,主要原因可能是海参皂苷的化学结构比人参皂苷复杂,尤其是C-3位置的糖链结构的差异。董平等人通过酸水解海参皂苷并研究其活性时发现天然状态下存在的皂苷成分,溶解生物膜的功效更强,当糖链部分少于2个单糖时,其溶血活性会急剧降低,当糖链部分含有1个单糖的皂苷或者无糖链的苷元,溶血作用很小,在浓度高达200 mg / L时,仍不能使红细胞完全溶解。学者Kalinin等的研究结果表明:海参皂苷末端为3-O-MeGlc时可促进K+的流失,而其C-4硫酸酯化后则可降低溶血作用,并降低K+流失的速率。
目前,对皂苷的降解方法主要包括化学降解法和酶及微生物降解法。酸水解是最常用,也是操作最为简便易行的皂苷降解方法。强酸水解可以将糖链部分或全部降解掉,得到苷元,但是反应过于激烈,容易发生侧链的脱水、环和、双键位移等不理想的产物。温和酸水解往往可以得到多种糖链长度不同的次级苷,部分次级苷相对于皂苷会发生构型的转变。皂苷类化合物分子结构中的糖苷键在碱水溶液中降解较难进行,因此通常需要提高反应温度等加以实验。酶水解具有一定的专属性,不同性质的酶作用于不同构型、不同组成糖的糖苷键,从而达到定向水解的目的,是最理想的制备次级皂苷的方法。
目前,有很多关于通过酶解作用将高含量的人参皂苷转化成高活性的稀有人参皂苷的报道,例如,高娟等人通过糖苷酶酶解Rb1制备次级苷Rg3、Rh2、Rh1、化合物CK等次级皂苷,并且有研究证明这些稀有人参皂苷具有更好的抗肿瘤细胞毒活性等生物活性。
然而,对海参皂苷酶解的相关研究很少,因此高娟论文中酶解方法对研究糖苷酶对海参皂苷的酶解作用有非常好的借鉴和指导意义。常用化学方法水解皂苷,但是具有副反应多,产物杂,专一性差等缺点。因此研究新的酶解海参皂苷方法,可以丰富海参皂苷的结构,尤其是非天然存在或在海参体内含量很少的结构类型,为海参皂苷结构、活性等方面的理论和应用研究奠定基础。
技术实现要素:
本发明的目的之一是提供去糖化的海参次级皂苷,目的之二是提供该海参次级糖苷的具体酶解制备方法,以弥补现有技术的不足。
为达到上述目的,本发明采取的具体技术方案为:
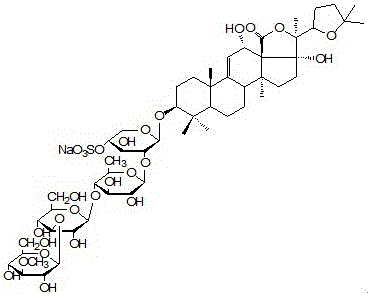
去糖化的海参次级皂苷是海参皂苷Holothurin A和海参皂Echinoside A的糖链上由于糖苷酶酶解脱去后两个糖基后得到的次级皂苷;海参皂苷Holothurin A(如图1所示),简称HA,和海参皂Echinoside A(如图2所示),简称EA。
上述的海参次级皂苷的制备方法包括以下步骤:
⑴、将干海参烘干并粉碎成粉末;
⑵、取上述干海参粉,乙醇浸提后,减压浓缩得到浸提膏,再冻干得到粗提物;
⑶、将上述粗提物水溶解,再用水饱和正丁醇进行多次萃取;然后取上清液减压蒸发得到浸提膏,再水浴蒸干成粉末,得到粗皂苷粉;
⑷、利用大孔树脂柱层析法对上述得到的粗皂苷进行除杂富集,使用乙醇液进行洗脱,检测洗脱液,将含有皂苷的洗脱液减压浓缩,并水浴蒸干成粉末,即为总皂苷;
⑸、正相硅胶柱层析纯化上述得到的总皂苷,检测洗脱液,将含有皂苷的洗脱液减压浓缩,并水浴蒸干,得到富含HA和EA的总皂苷;
⑹、反相硅胶柱层析分离上述富含HA和EA的总皂苷,检测洗脱液,根据洗脱时间,得到两种组分,再分别将对应洗脱液减压浓缩,并水浴蒸干,即得到HA和EA;
⑺、将上述得到的HA和EA分别进行酶解,选用糖苷酶,温度为40-60℃,pH4-6,添加糖苷酶量根据反应物的量来添加,反应时间为3-7d,将反应液进行水饱和正丁醇萃取,将上层萃取液进行减压浓缩,水浴蒸干分别得到:去糖化的海参HA次级皂苷和去糖化的海参EA次级皂苷。
进一步的,上述步骤⑶中水饱和正丁醇萃取皂苷5次,第一次使用粗皂苷水溶液:水饱和正丁醇1:3(v/v)萃取,再两次按1:2(v/v)萃取,最后两次按1:1(v/v)萃取。
进一步的,上述步骤⑷中乙醇洗脱具体为:大孔树脂用量与样品量的比例是30-80(ml):1(g),先用50%(v/v)的乙醇溶液洗脱,后用80%(v/v)乙醇溶液洗脱。
进一步的,上述步骤⑸中正相硅胶柱层析的洗脱条件为:正相硅胶用量与样品量的比例是30-70(g):1(g),分别用9:1:0.1,8:1:0,7:1:0.1,7:2:0.2(v/v/v)梯度比例的氯仿:甲醇:水进行洗脱,每个梯度洗脱至少5个柱体积,通过进行TLC(展开剂氯仿:甲醇:水,(v/v/v),10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色检测,每个梯度洗出的杂质在不同位置显色,再更换为7:2.5:0.2梯度洗脱至TLC能检测到皂苷,再更换为7:3:0.3梯度洗脱至TLC检测不再显色。
进一步的,上述步骤⑹中反相硅胶柱层析的洗脱条件为:反相硅胶用量与样品量的比例是30-70(g):1(g),先用40%(v/v)的甲醇洗脱,再用60%(v/v)的甲醇溶液洗脱,洗脱液进行减压浓缩,用TLC(展开剂70%(v/v)甲醇,10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)法检测洗脱液,洗脱液减压浓缩,并60℃水浴蒸干得到HA和EA两种主要皂苷。
进一步的,上述步骤⑺中,所述糖苷酶为果胶酶或复合纤维素酶。
本发明的有益效果:本发明所使用的糖苷酶在温和的条件下将海参皂苷酶解成次级皂苷,从而降低海参皂苷的毒性,提高其生物活性;同时,使用糖苷酶酶解海参皂苷,避免了使用微生物降解或从微生物中提取的粗酶进行降解而带来的副反应及副产物,提高了酶解产物的纯度和产量,可以得到单一产物,纯度可达100%。另外,本发明提供的制备方法也克服了化学方法反应条件剧烈,苷元部分的脱水、环化、双键转移等副反应等缺点。本发明具有反应条件温和,专一性强,产物纯度高,副反应少,产物单一,转化率高等特点。本发明制得去糖化的次级海参皂苷具有低毒性、高活性等的特点,从而促进海参皂苷在医药方面的应用。
附图说明
图1是海参皂苷Holothurin A分子式化学结构图。
图2是海参皂苷Echinoside A分子式化学结构图。
图3是实施例1中Pectinex Ultra SP--L酶解HA的薄层层析图。
图4是实施例1中Pectinex Ultra SP--L酶解EA的薄层层析图。
图5是实施例1中Pectinex Ultra SP--L酶酶解HA的TIC图。
图6是实施例1中Pectinex Ultra SP--L酶解HA的质谱图。
图7是实施例1中Pectinex Ultra SP--L酶酶解EA的TIC图。
图8是实施例1中Pectinex Ultra SP--L酶酶解EA的质谱图。
图9是实施例2中Celluclast 1.5 L酶酶解HA的薄层层析图。
图10是实施例2中Celluclast 1.5 L酶酶解EA的薄层层析图。
图11是实施例2中Celluclast 1.5 L酶酶解HA的TIC图。
图12是实施例2中Celluclast 1.5 L酶酶解HA的质谱图。
图13是实施例2中Celluclast 1.5 L酶酶解EA的TIC图。
图14是实施例2中Celluclast 1.5 L酶酶解EA的质谱图。
具体实施方式
以下通过具体实施例结合附图对本发明进一步解释和说明。
实施例1:
⑴、将购买的干海参放入50℃烘箱,2天后取出,粉碎成粉末;
⑵、取干海参粉(菲律宾刺参约1kg),经过60%乙醇浸提7天,期间不停搅拌,浸提3次,减压蒸发得到浸提膏,冻干得到粗提物;
⑶、将上述粗提物先用少量水充分溶解,而后用水饱和正丁醇进行五次萃取,第一次按样品与水饱和正丁醇1:3(v/v)萃取,后两次按1:2(v/v)萃取,最后两次按1:1(v/v)萃取。取上清液减压浓缩得到浸提膏,并用60℃水浴蒸干得到粗皂苷粉;
⑷、用大孔树脂柱层析法对⑶步中的粗皂苷进行富集,大孔树脂用量与样品量的比例是80(ml):1(g),先用50%(v/v)的乙醇溶液洗脱,后用80%(v/v)乙醇溶液洗脱,收集80%乙醇洗脱液,用TLC(展开剂氯仿:甲醇:水,7:3:0.3(v/v/v),10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)法检测,将显示紫红色斑点(TLC 检测呈阳性 )的洗脱液减压浓缩,并60℃水浴蒸干得到总皂苷;
⑸、正相硅胶柱层析纯化⑷的总皂苷,正相硅胶用量与样品量的比例是50(g):1(g),以9:1:0.1- 7:3:0.3(v/v/v)梯度比例的氯仿:甲醇:水依次进行洗脱,用TLC(展开剂氯仿:甲醇:水,7:3:0.3(v/v/v),10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)检测,将显示紫红色斑点(TLC 检测呈阳性 )的洗脱液减压浓缩,并60℃水浴蒸干,得到富含HA和EA的总皂苷;
⑹、ODS(50μm)反相硅胶柱层析分离上述富含HA和EA的总皂苷,ODS (50μm)反相硅胶用量与样品量的比例是40(g):1(g),先用40%(v/v)的甲醇洗脱,再用60%(v/v)的甲醇溶液洗脱,洗脱液进行减压浓缩,用TLC(展开剂70%(v/v)甲醇,10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)法检测洗脱液,洗脱液减压浓缩,并60℃水浴蒸干得到HA和EA两种主要皂苷。
⑺、将上述得到的HA和EA分别进行酶解:
①取上述两种皂苷单体各5mg;
②添加10μL酶液(Pectinex Ultra SP--L (果胶酶) 购自Novozymes公司,酶活力26000PGU/mL),用醋酸缓冲液(pH5.0)配置成5mL的反应体系;
③在50℃下保温反应。反应开始时记为0 h,总反应72h,每24h取1mL样品,用TLC(展开剂氯仿:甲醇:水,7:3:0.3(v/v/v),10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)检测;
④将每次取出的反应液,用水饱和正丁醇溶液按1:1(v/v)萃取,取上清液,由于产物量比较少,采用液氮吹干,得到去糖化的海参HA次级皂苷和去糖化的海参EA次级皂苷。
实施例2:
⑴、将购买的干海参放入50℃烘箱,2天后取出,粉碎成粉末;
⑵、取干海参粉(菲律宾刺参约1kg),经过60%乙醇浸提7天,期间不停搅拌,浸提3次,减压蒸发得到浸提膏,冻干机冻干得到粗提物;
⑶、将上述粗提物先用少量水充分溶解,而后用水饱和正丁醇进行五次萃取,第一次按样品与水饱和正丁醇1:3(v/v)萃取,后两次按1:2(v/v)萃取,最后两次按1:1(v/v)萃取。取上清液减压浓缩得到浸提膏,并用60℃水浴蒸干得到粗皂苷粉;
⑷、用大孔树脂柱层析法对⑶步中的粗皂苷进行富集,大孔树脂用量
与样品量的比例是80(ml):1(g),先用50%(v/v)的乙醇溶液洗脱,后用80%(v/v)乙醇溶液洗脱,收集80%乙醇洗脱液,用TLC(展开剂氯仿:甲醇:水,7:3:0.3(v/v/v),10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)法检测,将显示紫红色斑点(TLC 检测呈阳性 )的洗脱液减压浓缩,并60℃水浴蒸干得到总皂苷;
⑸、正相硅胶柱层析纯化⑷的总皂苷,正相硅胶用量与样品量的比例是50(g):1(g),以9:1:0.1- 7:3:0.3(v/v/v)梯度比例的氯仿:甲醇:水依次进行洗脱,用TLC(展开剂氯仿:甲醇:水,7:3:0.3(v/v/v),10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)检测,将显示紫红色斑点(TLC 检测呈阳性 )的洗脱液减压浓缩,并60℃水浴蒸干,得到富含HA和EA的总皂苷;
⑹、ODS(50μm)反相硅胶柱层析分离上述富含HA和EA的总皂苷,ODS (50μm)反相硅胶用量与样品量的比例是40(g):1(g),先用40%(v/v)的甲醇洗脱,再用60%(v/v)的甲醇溶液洗脱,洗脱液进行减压浓缩,用TLC(展开剂70%(v/v)甲醇,10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)法检测洗脱液,洗脱液减压浓缩,并60℃水浴蒸干得到HA和EA两种主要皂苷。
⑺、将上述得到的HA和EA分别进行酶解:
①取上述两种皂苷单体各5mg;
②添加200μL酶液(Celluclast 1.5 L(复合纤维素酶)购自Novozymes公司,酶活力700EGU/g,密度1.2g/mL),用醋酸缓冲液(pH5.0)配置成5mL的反应体系;
③在50℃下保温反应。反应开始时记为0 h,总反应72h,每24h取1mL样品,用TLC(展开剂氯仿:甲醇:水,7:3:0.3(v/v/v),10%-15%(v/v)硫酸乙醇溶液为显色剂,在110℃烘箱显色)检测;
④将每次取出的反应液,用水饱和正丁醇溶液按1:1(v/v)萃取,取上清液,由于产物量比较少,采用液氮吹干,得到去糖化的海参HA次级皂苷和去糖化的海参EA次级皂苷。
次级皂苷产物分析:选用HPLC-ESI-MS检测
用30%乙腈(色谱级)溶液复溶去糖化的海参HA次级皂苷和去糖化的海参EA次级皂苷,得到去糖化的海参HA次级皂苷和去糖化的海参EA次级皂苷溶液。
色谱条件:
流动相:A:乙腈
B;0.1% NH4HCO3
洗脱梯度:0-5-20-30-35-36 (min)
30%-30%-50%-60%-30%-30% (A相)
流速:1mL/min 进样量:20μL
色谱柱:XDB-C18(4.6×150mm,5μm) 柱温:30℃
结果分析
①由TLC薄层层析图可以看出,随酶解时间的延长,Pectinex Ultra SP--L (果胶酶)对皂苷的酶解程度加深(如图3、4),到72h时,HA完全转化为去糖化的次级皂苷,EA部分转化,可以得出,HA相较于EA酶解转化效率更高,EA则需要更长时间才能进行全部转化。
在负离子模式ESI-MS模式下,显示准分子离子峰m / z 859 [M-Na]-(质谱图6),所对应的TIC总离子流如图5所示,可知在13min左右出现离子峰是去糖化的海参HA次级皂苷,并且HA的转化率达到100%;在负离子模式ESI-MS模式下,显示准分子离子峰m / z 845 [M-Na]-(质谱图8),所对应的TIC总离子流如图7所示,可知在16min左右出现离子峰是EA,在21min左右出现离子峰是去糖化的海参EA次级皂苷,并且EA的转化率超过了50%。
②由TLC薄层层析图可以看出,随着时间的延长,Celluclast 1.5 L(复合纤维素酶)对皂苷的酶解作用加深(如图9、10),到72h时HA、EA都部分转化为产物,但是HA较于EA酶解效果要好些。
在负离子模式ESI-MS模式下,显示准分子离子峰m / z 859 [M-Na]-(质谱图12),所对应的TIC总离子流如图11,可知在13min左右出现离子峰是去糖化的海参HA次级皂苷,并且HA的转化率超过了50%;在负离子模式ESI-MS模式下,显示准分子离子峰m / z 845 [M-Na]-(质谱图14),所对应的TIC总离子流如图13,可知在16min左右出现离子峰是EA,在21min左右出现离子峰是去糖化的海参EA次级皂苷,并且EA的转化率小于50%。
在酶解过程中,出现了随着时间的延长,水溶液越来越浑浊,最后生成沉淀的现象。经HPLC-ESI-MS检测沉淀物为酶解产物,这说明HA和EA酶解产物不易溶于水。
上述实例不作为对本发明的限定,凡是在本发明的范围内所做的任何修改、等同替换、改进等,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!