抗菌肽融合蛋白及其制备方法和应用与流程
本发明涉及基因工程、生物技术制药工程技术领域,具体涉及一种抗菌肽融合蛋白及其制备方法,以及该融合蛋白在制备抗菌药物中的应用。
背景技术:
抗菌肽(Antimicrobial peptides.AMPs)是生物体在受到病原微生物侵袭时自身诱导产生的一类具有抗菌活性的小分子多肽,是天然免疫的主要成分,一般由20-60个氨基酸残基组成,耐高温、耐酸、水溶性好、抗菌谱广、抗菌机制特殊、杀菌快速且不产生耐药性。很多抗菌肽不仅能在较低浓度下有效抑制细菌、病毒、真菌和原虫等多种病原微生物的生长,甚至还可以杀死肿瘤细胞,而对正常的没有发生病变的真核细胞几乎没有作用。在医药行业上,抗菌肽的应用最为广泛,发展前景最好,目前科研人员在这一领域取得了丰硕的成果,如:美国马盖宁公司经过设计改造过的抗菌肽magainin对病毒和肿瘤细胞均有较好的杀伤作用;邓小娟从柞蚕中提取的抗菌肽对耐药性很强的金黄色葡萄球菌有杀菌作用。在临床应用上,抗菌肽可用于抗感染、抗病毒和抗肿瘤和提高免疫力等。已经在俄罗斯上市的抗菌肽Glutoxim可用于结核病的辅助治疗,可以提高结核双歧杆菌的清除率,缩短治疗时间,减少不良反应。已进入III期临床试验阶段的抗菌肽DiaPep277可用于糖尿病的治疗。DiaPep277通过对免疫系统进行调节,使胰岛B细胞免受自身免疫系统的破坏,从而有效控制病情。在食品工业上,抗菌肽可以作为食品保藏剂添加到食品中,减少有害防腐剂的使用。乳酸链球菌素(Nisin)是抗菌肽在食品中应用的最典型代表。抗菌肽还可以作为食品适量增效剂,如:LL-37可以作为趋化因子或细胞因子诱导剂而发挥免疫调节作用。在禽畜养殖业上,抗菌肽成为新型饲料添加剂进入人们的视野。在动物饲料中添加抗菌肽可以抑制病菌繁殖,改善动物肠道菌群结构,提高动物生产性能,如:在仔猪饲料添加抗菌肽能够增加肠道益生菌数量,控制腹泻率,提高仔猪生长性能,从而提高成活率。在水产养殖业上,水生生物抗菌肽的高效抗病毒、抗菌作用等为水产养殖的抗病害问题提供了新的解决方案。国内在水产养殖方面的研究已有很多报道,如:利用毕车酵母表达系统表达贻贝抗菌肽等。
天蚕素抗菌肽(cecropins)属于阳离子抗菌肽家族中重要一族,最早于瑞典科学家Boman等用阴沟通杆菌及大肠杆菌诱导惜古比天蚕(Hyalophora cecropia)蛹后发现。Boman等又进一步测定了天蚕素抗菌肽A和B的一级结构,随后天蚕素抗菌肽相继被分离、纯化,并且其氨基酸的结构特征和基因序列得到确定。到目前为止,天蚕素抗菌肽共有A、B、C、D、E5种结构,另外还发现多种类似物。天蚕素抗菌肽是世界上发现最早、研究最彻底、效果最明显的一类抗菌肽,是昆虫非特异性免疫系统的重要组成部分,一般由31~39个氨基酸组成,分子量约为3.5~4KD左右,其分子结构相对保守,主要由α螺旋构成,属于α螺旋类抗菌肽。这类抗菌肽热稳定性好、无免疫原性、抗菌能力强,能有效抑制格兰氏阳性菌和革兰氏阴性菌的生长。
研究发现,天蚕素抗菌肽对一些真核细胞不具毒性作用,如家蚕cecropin A和cecropin B能够抑制并杀死白色念珠菌,但对人体细胞株Jurkat没有毒性,即使在高浓度下,也不会使真核生物的红血球发生溶解破裂。除此之外,天蚕素抗菌肽具有抗病毒活性,抗寄生虫和原虫作用,抗肿瘤活性,具有免疫调节,促中性粒细胞、T细胞的化学趋势,促进伤口愈合等作用。目前,天蚕素抗菌肽已应用在动植物的生产和培育方面等,如:将天蚕素抗菌肽转入粮食作物、经济作物、果树、蔬菜等植物中,可以培育出抗病能力强的植物新品种;在动物日粮中添加天蚕素抗菌肽能够提高动物的生长性能,增强免疫力,改善动物肠道结构,促进免疫器官发育,提高免疫器官指数,提高免疫力,控制炎性反应,改善动物肠道菌群,减少应激,改善饲料转化率。
但是目前抗菌肽大多都是单独存在而发挥其抗菌功能,对不同菌株的杀菌能力还是存在一定的局限性,且抗菌活性也有待提高。现代研究认为:目前最具潜力成为抗生素替代品的是抗菌肽。天蚕素是目前研究比较清楚的抗菌肽。由于人工合成抗菌肽的技术瓶颈多、工艺复杂,而且合成成本昂贵,不适宜大规模生产。单一提纯物在使用时还可能具有溶血性问题,所以现在应用在人上的天蚕素抗菌肽基本上都是通过诱导家蚕或柞蚕产生的天蚕素与这些物质的初级混合物,作为保健食品使用,其中含有的天蚕素抗菌肽是极微的。
技术实现要素:
本发明所要解决的技术问题是针对以上现有技术,提供一种表达量高、活性强、稳定性高、对宿主毒害作用小的新型抗菌肽融合蛋白,该融合蛋白的表达体系蛋白表达量大,利于纯化复性和保持活性,且更为重要的是,该融合蛋白抗菌活性高,其本身和编码基因可应用于抗菌药物制备中,能为抗菌药物制备提供新的良好的材料来源。
肝脏细胞刺激因子(Hepatic Stimulator Substance,HSS)是一类肝特异性刺激因子,最初发现于胎肝或再生肝中,它具有促进肝细胞再生,刺激肝细胞合成DNA并进行有丝分裂的功能,能启动肝细胞增殖和修复肝损伤。鲨肝活性肽APSL(鲨肝肽)是一种近似HSS活性物质,具备调节免疫、增加肝细胞增殖、修复及改善胰岛β细胞损害的功能,对肝损害及糖尿病有潜在医治作用,此外在肝损害治疗时能够调节免疫起到辅助作用。鲨鱼是丰富的海洋资源,其肝脏占自身内脏的75%,具有强烈的增强免疫的作用。我们从鲨鱼肝脏cDNA文库中筛选的长度为105bp、等电点为11的鲨肝活性肽orf-86基因具有潜在的抗菌活性(orf-86一共34个氨基酸,含有18个疏水性氨基酸和9个正电荷氨基酸,而这些正是融合蛋白抗菌的机理:通过疏水作用和正电荷的促进作用与细菌细胞膜结合,从而通过膜穿孔和非膜穿孔形式导致细菌死亡),因此我们构建了petdute-his-sumo-APSL-cecropin重组表达载体来进行融合蛋白的表达。
本发明所采用的技术方案为:
一种抗菌肽融合蛋白,该蛋白包括抗菌肽天蚕素cecropin蛋白、orf-86鲨肝肽蛋白,所述抗菌肽天蚕素cecropin蛋白与orf-86鲨肝肽蛋白之间通过3GSA柔性肽片段连接,所述orf-86鲨肝肽蛋白氨基酸序列如SEQ ID NO.1所示,所述3GSA柔性肽片段如SEQ ID NO.2所示,所述抗菌肽天蚕素cecropin蛋白氨基酸序列如SEQ ID NO.3所示。即该蛋白从N端-C端依次包含了orf-86鲨肝肽蛋白、3GSA柔性肽、抗菌肽天蚕素cecropin蛋白。
该蛋白是抗菌肽天蚕素cecropin蛋白编码基因、orf-86鲨肝肽编码基因、以及位于抗菌肽天蚕素cecropin蛋白编码基因与orf-86鲨肝肽编码基因之间的3GSA柔性肽编码基因在基因水平融合后在原核表达的可溶性重组蛋白。所述抗菌肽融合蛋白的编码基因序列如SEQ ID NO.4所示。
本发明的另一目的是提供一种抗菌肽融合蛋白的制备方法,采取基因工程的方法设计融合基因表达融合蛋白,所述抗菌肽融合蛋白的制备方法,包括以下步骤:
(1)采用人工合成的方法获得包含抗菌肽天蚕素cecropin蛋白编码基因序列、3GSA柔性肽编码基因序列、orf-86鲨肝肽编码基因的orf-86融合基因序列,如SEQ ID NO.4所示;
(2)以pET-Duet-His-Sumo质粒为载体,构建重组质粒,并转化至大肠杆菌E.coli TG1中,通过鉴定、筛选,得到阳性克隆;
(3)将阳性克隆转化至大肠杆菌宿主菌BL21中,通过氨苄青霉素抗生素的筛选获得表达菌株;
(4)挑取阳性单克隆至LB培养基,LB培养基中含50ug/ml氨苄青霉素,37℃培养至OD600为0.6左右,加入终浓度1mM的IPTG进行蛋白诱导,诱导条件为16℃培养20h,得到在上清表达的带Sumo标签的融合蛋白;
(5)对得到的带Sumo标签的融合蛋白进行超滤浓缩,然后切除Sumo标签,得到抗菌肽融合蛋白。
作为优选,所述步骤(4)中阳性单克隆培养至OD600为0.6,此时大肠杆菌处于生长的对数期,有利于融合蛋白的大量表达,加入IPTG16℃培养20h进行蛋白诱导,有利于融合蛋白表达在上清中。
生物领域内对天蚕素和其他基因融合表达的研究并不多,本发明是生物领域内首次进行鲨肝活性肽和天蚕素基因融合蛋白的表达及其活性研究。与现有技术相比,本发明具有以下显著优点和有益效果:
(1)通过对抗菌肽基因和orf-86鲨肝肽基因的选择,以及柔性肽和标签蛋白的选择和合适排布,通过在基因工程上把抗菌肽天蚕素cecropin和orf-86鲨肝肽基因密码子串联并在二者间插入3GSA柔性肽的方法,以sumo为融合蛋白,pETDuet为载体,在工程菌E.coli BL21(DE3)内成功表达在上清的抗菌肽融合蛋白,表达量大,活性高,有利于保证后期纯化复性及融合蛋白活性;
(2)以往在研究目的蛋白的抗菌活性时,目的蛋白需要进行镍柱纯化、透析、超滤浓缩才能取得抑菌试验的成功,证明目的蛋白具有抑菌活性。本研究的天蚕素基因和orf86鲨肝肽基因融合的orf86重组蛋白在超声破碎取得上清后只进行了超滤浓缩就取得了抑菌试验的成功,证明了orf86融合蛋白具有抑菌活性,而且抑菌圈明显。本实验结果说明了orf86融合蛋白具有较高的表达量和抗菌活性。本研究解决了天然抗菌肽表达量低,对宿主伤害大的问题。orf86或其编码基因可应用于抗菌药物制备中,这为研制新一代的抗菌药物打下了基础,对研发新型高效的抗菌肽具有重要意义。在动物饲养、植物培育、水产养殖等方面具有广泛的应用;
(3)鲨肝肽orf-86基因和天蚕素cecropin基因融合蛋白具有一定的稳定性,超声破碎后的上清放在-20℃冰箱后再次进行抑菌活性实验,融合蛋白依然具有抑菌活性,说明该融合蛋白具有一定的稳定性,有利于融合蛋白的长时间保存和大量生产,本发明抗菌肽融合蛋白的制备方法更适用于工业化大生产;
(4)从氨基酸序列来看,天蚕素氨基酸和orf86鲨肝肽氨基酸的融合基因表达出氨基端具有支链氨基酸(亮氨酸、异亮氨酸、缬氨酸),同时orf86鲨肝肽氨基酸基因和天蚕素氨基酸基因融合蛋白也较一般的融合蛋白体内体外的稳定性更强。氨基酸序列来看,融合后的蛋白具有增加了天蚕素cecropin和鲨肝肽APSL的抗菌活性的潜力,具有一般基因融合预料不到的协同增效作用和预料不到的稳定性作用。
本发明进一步提供上述抗菌肽融合蛋白在制备抗菌药物中的应用。
本发明还进一步提供上述抗菌肽融合蛋白的编码基因在制备抗菌药物中的应用。
附图说明
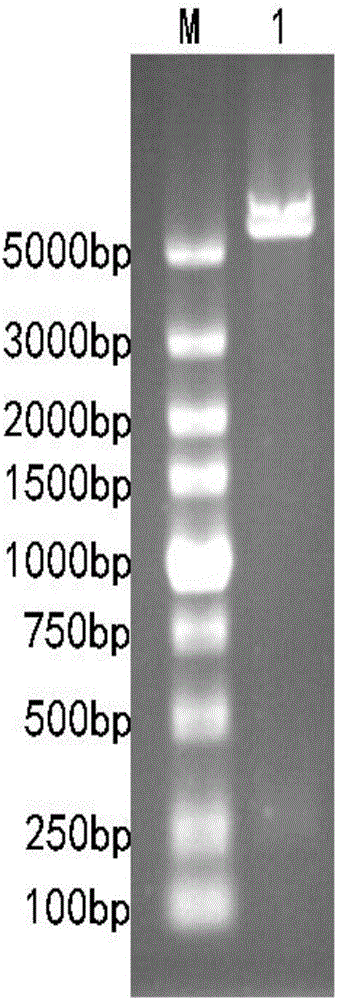
图1所示的是本发明实施例1中重组表达载体的双酶切鉴定电泳图,其中M:marker,1:orf-86双酶切结果;
图2所示的是本发明实施例2中重组质粒诱导表达的SDS-PAGE鉴定图,其中5:orf-86基因工程菌未诱导的菌液,6:orf-86基因工程菌诱导后的菌液;
图3所示的是本发明实施例2中重组质粒诱导表达的SDS-PAGE检测融合蛋白的表达存在形式图,其中1:orf-86基因工程菌的诱导蛋白超声波破碎上清,2:orf-86基因工程菌的诱导蛋白超声波破碎沉淀;
图4所示的是本发明实施例3中重组蛋白的抑菌活性检测图,其中水是阴性对照,AMP是阳性对照,86是重组蛋白orf-86对革兰氏阳性菌(枯草芽孢杆菌)抑菌活性检测图;
图5所示的是本发明实施例3中重组蛋白的抑菌活性检测图,其中水是阴性对照,AMP是阳性对照,86是重组蛋白orf-86对革兰氏阴性菌(大肠杆菌TG1)抑菌活性检测图;
图6:重组蛋白orf86的蛋白三级结构模拟图(白色:β转角,深灰色:氢键,浅灰色:α螺旋)。
具体实施方式
以下结合实施例对本发明作进一步具体描述。应该指出,以下具体说明都是例示性的,旨在对本发明提供进一步的说明。除非另有说明,本发明使用的所有科学和技术术语具有与本发明所属技术领域人员通常理解的相同含义。
材料和试剂:
1.菌种、质粒:
E.coli TG1菌株、E.coli BL21菌株、枯草芽孢杆菌菌株及质粒pET-duet-His-SUMO由中国科学院上海药物研究所赠予;菌株pET-duet-His-SUMO-cecropin由浙江理工大学生物实验室在质粒pET-duet-His-SUMO的基础上自行构建,其中的天蚕素cecropin基因序列同SEQ ID NO.5。
2.主要酶类及其生化试剂:
琼脂糖购自Boehringer Mannheim公司;蛋白胨(Tryptone)、酵母提取物(Yeast Extract)购自英国Oxoid公司;限制性内切酶、T4DNA Ligase及其相关试剂是TAKARA的产品;Amp、IPTG为Promega公司产品;其余试剂为国产分析纯。所需重组基因由苏州金唯智生物科技有限公司合成。常规试剂配制如无特别说明,均参照《分子克隆实验指南》第三版。
实施例1:重组表达载体的构建
1.目的片段的设计与合成
通过NCBI数据库获得天蚕素cecropin核酸序列(如SEQ ID NO.5所示),在本实验室的鲨肝小肽cDNA数据库中找到鲨肝肽orf-86基因(如SEQ ID NO.6所示),orf-86鲨肝肽是从条纹斑竹鲨再生肝脏cDNA文库中筛选出的等电点为11的可能具有潜在生物学活性的鲨肝肽orf-86基因翻译的小肽,在两个核苷酸序列中间加入3个串联片段(Gly+Ser+Ala)编码基因(如SEQ ID NO.7所示),形成鲨肝肽orf-86+3GSA编码片段+天蚕素cecropin融合基因(下简称orf-86融合基因,如SEQ ID NO.4所示),并在其5’端加上BamH I酶切位点,3’端加上Xho I酶切位点,委托苏州金唯智生物科技有限公司合成。
序列SEQ ID NO.4翻译成的氨基酸序列如SEQ ID NO.8所示。
本发明为了确保预表达的两个融合蛋白的空间构象不受干扰,利用3个串联片段(Gly+Ser+Ala)将天蚕素cecropin和orf-86鲨肝肽铰链起来,这样有利于两个蛋白的天然构象不发生改变。
2.重组表达载体的构建和筛选
Orf-86融合基因用BamH I酶和Xho I酶双酶切获得目的片段,得到的目的片段分别克隆至载体pETduet-His-SUMO上,构建两个重组质粒pETduet-His-SUMO-orf-86(下简称orf-86重组质粒)。
将构建的重组质粒进行双酶切鉴定,双酶切后在250bp-500bp之间有清晰条带,融合目的基因大小为255bp,与琼脂糖凝胶电泳显示条带大小相符,pETduet-His-SUMO载体大小为5684bp,与电泳结果相符,如图1。
将重组质粒分别转化到E.coli TG1大肠杆菌,将含有重组质粒的TG1大肠杆菌送到生工生物公司进行测序,结果显示重组载体构建成功,并未发生基因突变。
实施例2:融合蛋白的诱导表达和浓缩
1.重组融合蛋白的诱导表达
测序正确后,提取质粒,将重组质粒转化到BL21(DE3)大肠杆菌,进行诱导表达。
成功构建的两种工程菌接种于100mL LB培养液,分别于37℃恒温摇床培养至A600值为0.6左右,再加入IPTG至终浓度为1mmol/L,16℃诱导20h,12000rpm离心收集菌体,PBS洗涤两次后,将诱导后的重组菌超声破碎30min,超声3s,停3s,然后12000rpm离心25min,分别取上清和沉淀,SDS-PAGE电泳检测表达产物的存在形式,结果如图2所示。
重组菌经IPTG诱导和超声裂解后的电泳结果显示:与阴性对照组相比,在30kDa左右有明显特异性条带,与重组融合蛋白orf-86预测大小相符,并且表达的重组融合蛋白存在于超声上清液中(图3)。
2.重组融合蛋白的浓缩及SUMO肽的切除
重组融合蛋白浓缩:将经过SDS-PAGE电泳检测验证后表达在上清的重组融合蛋白溶液进行超滤浓缩。
切除SUMO肽:在浓缩的重组融合蛋白溶液中加入SUMO蛋白酶(按照1:100的比例混匀),4℃酶切过夜,切除SUMO肽。
体外保存试验表明,在大肠杆菌中表达的融合蛋白比较稳定,在-20℃存放一段时间后,活性未发生明显改变,这就避免了体外表达蛋白容易降解的矛盾。
实施例3:牛津杯法检测抑菌活性
重组蛋白orf-86抑菌活性检测
将121℃、20min灭过菌的琼脂粉和固体培养基拿到超净台中,先将琼脂粉倒薄薄的一层于玻璃培养皿上,再将活化好的TG1大肠杆菌和枯草芽孢杆菌分别加到温度降至为大约50℃左右的固体培养基中,待琼脂粉凝固后将含有菌液的固体培养基进行倒板。待平板凝固后,将灭过菌、经酒精灯火焰灼烧后的牛津杯放到平板上产生加样孔,向牛津杯中分别加入200μL的Amp(1mg/mL)、ddH2O、orf86,Amp为阳性对照,ddH2O为阴性对照。37℃培养过夜后观察抑菌圈的大小,判断样品的抗菌活性。
结果显示:重组蛋白orf-86在革兰氏阳性菌与革兰氏阴性菌检测平板上均产生了抑菌圈,但在革兰氏阳性菌上形成的抑菌圈比在革兰氏阴性菌上形成的抑菌圈大。因此,可以初步判断重组蛋白orf-86对革兰氏阳性菌有抑菌活性且活性较强,对革兰氏阴性菌有抑菌效果但活性较弱,如图4,图5。
综合上述实验结果可以得出结论:重组蛋白orf-86对革兰氏阳性菌有抑菌活性且活性较强,对革兰氏阴性菌有抑菌效果但活性较弱。抑菌活性实验表明产物具有较高的抗菌活性,表明本发明orf-86鲨肝肽和天蚕素cecropin融合蛋白或者融合基因可应用于抗菌药物制备中,这为研制新一代的抗菌药物打下了基础,对研发新型高效的抗菌肽具有重要意义。在动物饲养、植物培育、水产养殖等方面具有广泛的应用。
从orf-86鲨肝肽和天蚕素cecropin融合蛋白的序列特征可以推测,比较天蚕素cecropin和与orf-86鲨肝肽融合后的序列,发现融合后的蛋白比天蚕素多了很多疏水性氨基酸和正电荷(orf-86一共34个氨基酸,含有18个疏水性氨基酸和9个正电荷氨基酸),而这些正是融合蛋白抗菌的机理:通过疏水作用和正电荷的促进作用与细菌细胞膜结合,从而通过膜穿孔和和非膜穿孔形式导致细菌死亡。除此之外,天蚕素氨基酸和orf86鲨肝肽氨基酸的氨基端具有支链氨基酸(亮氨酸、异亮氨酸、缬氨酸),这也是融合蛋白orf86具有活性的一个原因。因此从氨基酸序列来看,融合后的蛋白具有增加了天蚕素cecropin和鲨肝肽APSL的抗菌活性的潜力。
鲨肝肽orf-86基因和天蚕素cecropin基因融合蛋白具有一定的稳定性,超声破碎后的上清放在-20℃冰箱后再次进行抑菌活性实验,融合蛋白依然具有抑菌活性,说明该融合蛋白具有一定的稳定性,我们后续会进行具体实验分析融合蛋白的体内稳定性和体外稳定性。利用高效液相色谱对融合蛋白进行体外稳定性分析;通过制备多克隆抗体测其半衰期对融合蛋白进行体内稳定性分析。
图6:重组蛋白orf86的蛋白三级结构模拟图(白色:β转角,深灰色:氢键,浅灰色:α螺旋)。
从融合蛋白orf86的三级结构模拟图中可以发现,在2个融合蛋白中分别有2个α螺旋、2个β转角以及较多的氢键,比单一的天蚕素蛋白、鲨肝肽蛋白多了一些二级结构。α-螺旋(α-helix)是蛋白质二级结构的主要形式之一,多肽链主链围绕中心轴呈有规律的螺旋式上升,每3.6个氨基酸残基螺旋上升一圈,向上平移0.54nm,两个氨基酸残基之间的距离为0.15nm,螺旋的方向为右手螺旋,氨基酸侧链R基团伸向螺旋外侧,每个肽键的N-H和第四个肽键的羰基氧形成氢键,氢键的方向与螺旋长轴基本平行,肽链中的全部肽键都可形成氢键,α-螺旋十分稳定。β-转角(β-turn)是一种简单的非重复性结构,是一种常见的蛋白质二级结构,含有极性和带电荷的氨基酸残基。β-转角中第一个残基的C=O与第四个残基的N-H氢键键合形成一个紧密的环,使β-转角成为比较稳定的结构。分子内、分子间的氢键能使蛋白质更为稳定。这些正是融合蛋白更为稳定的原因。
本发明实施例涉及到的材料、试剂和实验设备,如无特别说明,均为符合生物工程技术领域的市售产品。
以上所述,仅为本发明的优选实施例,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明的核心技术的前提下,还可以做出改进和润饰,这些改进和润饰也应属于本发明的专利保护范围。与本发明的权利要求书相当的含义和范围内的任何改变,都应认为是包括在权利要求书的范围内。
序列表:
SEQ ID NO.1:
KWKLFKKIEKVGQRVRDAVISAGPAVATVAQATALAK
SEQ ID NO.2:
MILILSIPTVQTQFTQFLLKIQSLVRQSLGFNFW
SEQ ID NO.3:
GSAGSAGSA
SEQ ID NO.4:
ATGATTCTGATTCTGAGCATTCCGACCGTGCAGACCCAGTTCACCCAGTTCCTGCTGAAAATCCAGAGCCTGGTGCGCCAGAGCCTGGGCTTTAATTTTTGGGGTAGCGCCGGTAGCGCCGGCAGCGCAAAATGGAAACTGTTTAAGAAAATTGAAAAAGTTGGCCAGCGCGTGCGCGATGCAGTGATTAGCGCCGGTCCGGCAGTTGCAACCGTTGCACAGGCCACCGCACTGGCCAAA
SEQ ID NO.5:
AAATGGAAACTGTTTAAGAAAATTGAAAAAGTTGGCCAGCGCGTGCGCGATGCAGTGATTAGCGCCGGTCCGGCAGTTGCAACCGTTGCACAGGCCACCGCACTGGCCAAA
SEQ ID NO.6:
ATGATTCTCATTCTTTCAATTCCAACTGTACAGACTCAATTTACACAATTTCTCCTCAAAATACAATCTCTCGTTAGACAGTCACTCGGGTTCAACTTTTGGTAG
SEQ ID NO.7:
GGTAGCGCAGGTAGCGCCGGTAGCGCA
SEQ ID NO.8:
MILILSIPTVQTQFTQFLLKIQSLVRQSLGFNFWGSAGSAGSAKWKLFKKIEKVGQRVRDAVISAGPAVATVAQATALAK
序列表:
SEQ ID NO.1:
KWKLFKKIEKVGQRVRDAVISAGPAVATVAQATALAK
SEQ ID NO.2:
MILILSIPTVQTQFTQFLLKIQSLVRQSLGFNFW
SEQ ID NO.3:
GSAGSAGSA
SEQ ID NO.4:
ATGATTCTGATTCTGAGCATTCCGACCGTGCAGACCCAGTTCACCCAGTTCCTGCTGAAAATCCAGAGCCTGGTGCGCCAGAGCCTGGGCTTTAATTTTTGGGGTAGCGCCGGTAGCGCCGGCAGCGCAAAATGGAAACTGTTTAAGAAAATTGAAAAAGTTGGCCAGCGCGTGCGCGATGCAGTGATTAGCGCCGGTCCGGCAGTTGCAACCGTTGCACAGGCCACCGCACTGGCCAAA
SEQ ID NO.5:
AAATGGAAACTGTTTAAGAAAATTGAAAAAGTTGGCCAGCGCGTGCGCGATGCAGTGATTAGCGCCGGTCCGGCAGTTGCAACCGTTGCACAGGCCACCGCACTGGCCAAA
SEQ ID NO.6:
ATGATTCTCATTCTTTCAATTCCAACTGTACAGACTCAATTTACACAATTTCTCCTCAAAATACAATCTCTCGTTAGACAGTCACTCGGGTTCAACTTTTGGTAG
SEQ ID NO.7:
GGTAGCGCAGGTAGCGCCGGTAGCGCA
SEQ ID NO.8:MILILSIPTVQTQFTQFLLKIQSLVRQSLGFNFWGSAGSAGSAKWKLFKKIEKVGQRVRDAVISAGPAVATVAQATALAK
- 还没有人留言评论。精彩留言会获得点赞!
- 一种抗CD24人源化抗体融合蛋白的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 一种融合蛋白表达纯化方法与制造工艺
- 抗USP2a蛋白单克隆抗体杂交瘤细胞及其产生的抗USP2a单克隆抗体和应用的制造方法与工艺
- 与癌症相关的基因融合体和基因变异体的制造方法与工艺
- 包含邻近氨基酸端的志贺毒素A亚基效应子区和细胞靶向性免疫球蛋白型结合区的蛋白的制造方法与工艺
- 杀虫融合蛋白改进的制造方法与工艺
- vin‑cdtb在大肠杆菌中的表达和制备的制造方法与工艺
- 一种抗肿瘤侵袭转移的多靶点融合蛋白的制备及用途的制造方法与工艺
- 重组人成纤维细胞生长因子21融合蛋白及其在制备治疗代谢疾病药物中的应用的制造方法与工艺