具有低培养基体积的血液培养系统的制作方法
本申请要求2015年5月14日提交的美国临时申请号62/161,380的申请日的权益,其公开内容在此通过引用并入本文。
技术领域
本实用新型涉及血液培养系统,具体地涉及具有低培养基体积的血液培养系统。
背景技术:
由于其高发生频率和高住院死亡率,脓毒症是重大的卫生保健问题。脓毒症的主要原因之一是血流感染(BSI)。BSI最通常通过血液培养诊断,其中在气氛受控的封闭系统中使用微生物生长培养基培育血液的样品以促进细菌生长。当前的自动化血液培养系统可能耗费12-48小时检测血液中感染性微生物的存在,并且可能耗费多至5天以排除任何感染性微生物的存在。
通常,额外的物质必须与血液培养结合以确保尽可能迅速和准确地测定BSI的存在或不存在。例如,采样时患者的血液可能已经包含抗生素。抗生素的存在可能进一步增加检测感染性微生物的存在所需的时间。此外,可耗费多至额外的12-48小时通过传代培养阳性血液培养物并进行鉴定和抗菌敏感性测试来鉴定引起感染的微生物。这些结果对于更改治疗过程太迟,并且导致更严重的疾病,并且甚至导致患者的死亡。因此,吸附抗生素并中和其对微生物生长的抑制效应的添加物也添加至血液培养基。
当前的血液培养系统具有促进微生物生长和更快的检测时间的多种试剂的肉汤混合物。促进微生物生长的一个重要因素是使用生长培养基稀释血液样品。使用生长培养基稀释患者的血液被认为减少抗生素的抑制效应和可能存在于血液样品中的患者的免疫应答组分。
为了能够恢复(recover)微生物、改进微生物的恢复和/或减少检测在抑制微生物生长的高抗生素浓度下的微生物生长所需的时间,多个种类的吸附树脂可以用于吸附患者的血液样品中的抗生素。然而,吸附树脂还可以吸附对微生物生长的早期检测必不可少的培养基的其它成分。当培养基是溶解性培养基(lytic media)时,吸附树脂可以吸附溶解性试剂(例如,皂苷)的组分。这样的吸附引起对微生物生长必不可少的溶解性功能和营养物二者的减少,导致更长的检测时间。
为了减少或最小化或控制物质如抗体和抗生素的抑制效应,推荐的血液对肉汤比率在大约1∶5至大约1∶10的范围内。参见Wilson,Michael L.等,Principles and Procedures for Blood Cultures;Approved Guidelines,Clinical and Laboratory Standards Institute,M47-A,Vol.27,No.17,p.8(2007年5月)和Versalovic,J.等,Manual of Clinical Microbiology,Vol.1,Diagnostic Strategies and General Topics,p.16,10th ed.,ASM Press,(2003)(Murray,P.R.等-编辑)。公认的偏好是使用较大体积的血液样品(每次抽取10ml至20ml)用于培养。参见Forbes,B.等Diagnostics Microbiology,Part 3:Diagnosis by Organ System(10th ed.1998).P 292。
用于接种血液培养瓶的推荐的血液体积是大约8ml至大约10ml,使得推荐的肉汤体积在至少50和150ml之间。因而,用于此血液培养种类的容器是大体积的,使得其难以精确地控制抽取的血液的体积以精确地抽取规定的8-10ml的血液体积的8-10ml血液(Weinstein,Melvin P.Current Blood Culture Methods and Systems:Clinical Concepts,Technology,and Interpretation of Results.The University of Chicago,Clinical Infectious Diseases,1996)。此外,还存在缩减血液培养消耗品的经济、工效学和环境需求。
随着培养基组分的改进,尤其是将树脂并入生长培养基,可以减少微生物生长需要的肉汤体积,因为树脂将吸附抗生素(如果存在)中的一些,其减轻抗生素对微生物生长的不利影响。因而,当前的血液培养系统已经在1∶3和1∶4的血液对肉汤体积比的情况下成功。一个实例是Becton BACTECTM(Becton Dickinson and Company的商标)Plus Aerobic产品,其使用至少1∶3的血液对肉汤比率,以及8-10ml血液体积的样品。当前仍然认为高浓度的血液对肉汤比率(例如1∶2和更大)对产生检测需要的必需量的全部阳性培养物不是有效的,并且应当被避免。(Weinstein,Current Blood Culture Methods and Systems)。然而,尽管通过使用树脂实现了功效的改进,但是依旧寻求提供改进的检测时间同时减少所需的血液样品和/或肉汤的量的血液培养环境。
技术实现要素:
根据本实用新型的一个实施方式,将血液样品递送入培养基,以使血液体积在大约4ml至大约10ml的范围内,并且血液体积对将血液样品递送入其的培养基的体积的比率是大约2∶1至大约1∶2。在某些实施方式中,比率是大约1∶1。因此,在其中血液对培养基比率是大约2∶1至大约1∶2的实施方式中,培养基体积的范围是大约2ml至大约20ml。在其中血液对培养基比率是大约1∶1的实施方式中,培养基的体积是大约4ml至大约10ml。
根据本实用新型的另一个实施方式,血液体积是大约1ml至大约3ml,在该实施方式中,培养基的体积在大约0.5ml至大约6ml的范围内。
在本实用新型的另一个实施方式中,培养基的体积小于40ml,并且血液体积对培养基的比率在大约2∶1至大约1∶2的范围内,其中血液体积不超过大约20ml。
根据本实用新型的另一个实施方式,血液体积是大约3ml至大约4ml,并且血液体积对培养基的体积的比率是大约2∶1至大约1∶2。
附图说明
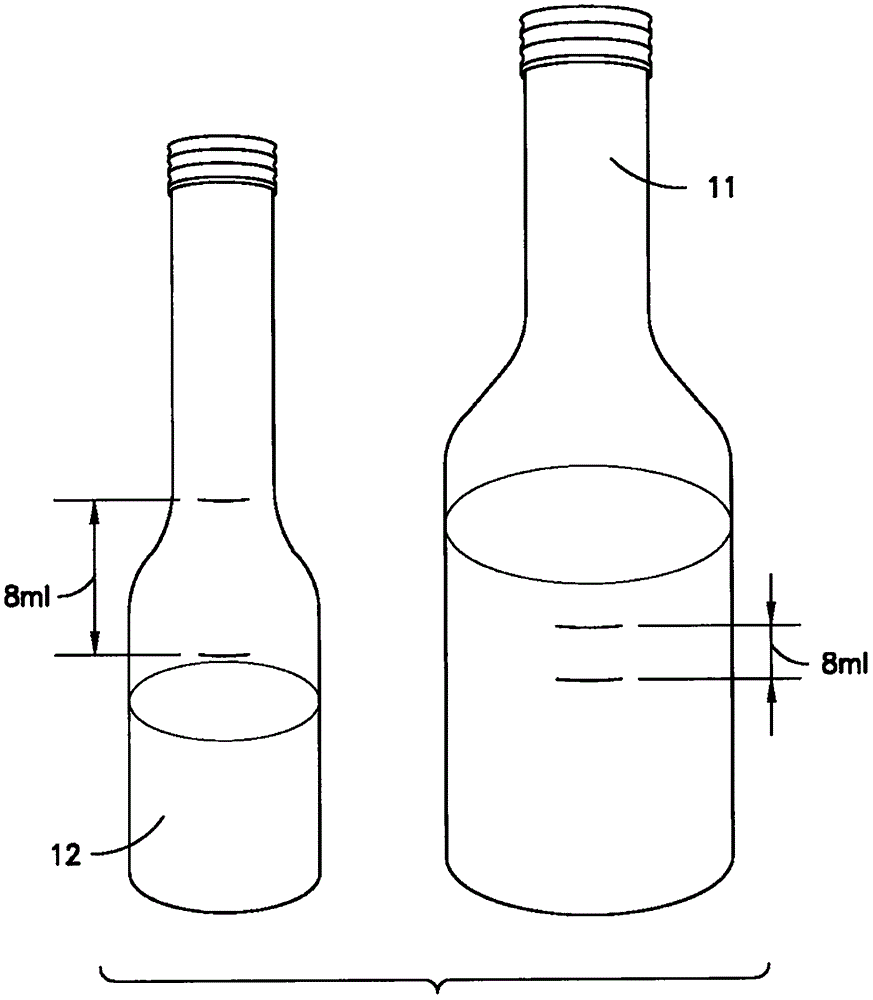
图1图解了用于本实用新型的实施方式的血液培养瓶的两种不同的配置。
图2A-C图解了使用肉汤中较高浓度的血液测定不存在抗生素抑制剂的血液中的微生物生长的本实用新型的一个实施方式。
图3A-C图解了使用肉汤中较高浓度的血液(提供1∶1的较低的血液对肉汤比率)测定包含抗生素抑制剂的血液样品中的微生物生长的方法。
图4A-C图解了在抗生素存在的情况下PlusAer、PlusLytic和MicroVolume样品制剂之间的恢复速率比较。
具体实施方式
本文描述了以肉汤中较高浓度的血液(提供较低的血液对肉汤比率)制备和测试血液培养样品的方法。优选地,“肉汤中较高浓度的血液”指的是肉汤(或培养基)体积等于或小于培养样品的血液体积(例如1∶1、2∶1)。培养基和肉汤在本文是可交换地使用的。与使用更稀释的血液对肉汤比率(例如1∶3、1∶4)的当前的工业血液培养样品瓶相比,本文描述的具有肉汤中较高浓度的血液(即提供较低的血液对肉汤比率)的样品显示了类似的或甚至改进的检测时间(“TTD”)结果。如本文使用的,检测时间或“TTD”定义为在血液微生物接种入容器的时间点和系统能够检测容器中的微生物生长的时间点之间经过的时间。
在一个实施方式中,血液培养物不包含抗生素抑制剂。在另一个实施方式中,血液培养物包含预定量的抗生素抑制剂。
本文描述的方法使用具有1∶1多至大约2∶1的较低的血液对肉汤比率的血液培养物。在其中布置血液培养物的血液培养瓶的体积和配置可以变化。例如,图1图解了血液培养瓶的两种不同的配置。瓶11是销售为BACTECTM Plus Aerobic瓶的80ml的瓶,其是包含30ml液体培养基和在大约2克至大约6克的范围内的树脂的80ml的瓶。BACTECTM是Becton Dickinson and Company的商标。瓶12是30ml的瓶,其提供有大约8ml的培养基和也在大约2克至大约6克的范围内的树脂。培养基体积可以在大约5ml至大约20ml的范围内变化。瓶的实际体积主要地是设计选择的问题,取决于因素,比如,瓶体积、液面上空间的配置,瓶将接收的血液和肉汤的总体积、传感器类型、传感器配置等。可选的瓶或管配置包括试管、钢瓶、烧瓶等。
使用较低的血液对肉汤比率允许较小量的生长培养基和试剂,允许使用较小体积的血液培养瓶。较小体积的血液培养瓶可以具有减小的直径、较低的高度或二者。减小的直径的瓶还允许通过与较大的80ml的瓶相比更准确地指示的体积抽取的更精确量的血液。体积的减小还减少消耗品的成本,并且与当前的标准的80ml的瓶相比通过立刻允许更多待测试的小瓶而允许仪器足迹(footprint)的减少。
实施例1:使用标准比率/标准体积和低比率/低体积的多种微生物的检测时间(TTD)的比较
比较大约1∶5的血液对培养基体积(即8ml的血液和40ml的培养基)的标准比率与1∶1的血液对培养基体积的检测时间。使用不具有溶解性试剂的培养基(非溶解性培养基)和具有溶解性试剂的培养基(溶解性培养基)二者。非溶解性培养基是BACTECTM Aerobic培养基。对于1∶4比率的样品,使用40ml的培养基。标准BACTEC Aerobic瓶包含40ml的培养基。因此对于1∶1比率的实施例,在样品被引入瓶之前,从瓶中移除32ml的培养基。为了使培养基是溶解性的,将大约0.25%的皂苷添加至培养基。
如上所述,制备了四组样品。两组具有1∶4的标准血液对肉汤比率,并且两组具有1∶1的比率。每种比率的两组中的一个具有非溶解性培养基,并且另一组具有溶解性培养基。为了产生具有1∶1的血液对肉汤比率的样品,取出了标准BACTEC Aerobic瓶中40ml的培养基中的32ml,仅留下剩余的8ml肉汤。为了使肉汤是溶解性的,溶解性试剂——皂苷——以在各自的标准比率和低比率样品中产生0.25%的浓度的量被添加至剩余的肉汤(1∶4的比率为40ml且1∶1的比率为8ml)。将大约8ml的血液和10-100cfu的在下面的表1中列出的每种微生物接种入每个瓶。具有原始的40ml培养基的BACTEC Standard Aerobic瓶用于具有1∶4的血液对肉汤比率的那些样品。将全部接种的瓶放置入BD BACTECTM FX仪器,并且在35℃下培养5天。结果显示在下面的表1中鉴定的八种微生物的检测时间是彼此相当的。因此,1∶1的血液对培养基比率支持血液培养中的微生物生长,即使低的1∶1比率的血液稀释系数显著地小于常规的1∶4。
表1:使用标准比率和体积以及低比率和体积的多种生物体的TTD
惊人地,具有1∶1比率(低比率/低体积)的样品表现类似于具有1∶4比率(标准比率/标准体积)的样品。而且,上面的表显示,对于一些微生物,具有溶解性培养基的瓶的TTD低于具有非溶解性培养基的瓶的TTD。然而,对于测试的微生物中的一些,与具有非溶解性培养基的瓶相比,观察到具有溶解性培养基的瓶的TTD的增加。由于样品尺寸是小的,这些观察结果未必指示具有非溶解性培养基的瓶与具有溶解性培养基的瓶相比TTD的实质性差异。
图2图解了使用较低的血液对肉汤比率测定不存在抗生素抑制剂的血液样品中的微生物生长的方法。图2A图解了将8ml的血液201引入4ml的液体培养基202。血液201和液体培养基202在16ml无菌和加盖的管203中结合,其产生了2∶1的血液对肉汤比率204。图2B图解了将8ml的血液201引入8ml的液体培养基206。血液201和液体培养基206在19ml无菌和加盖的管205中结合,其产生了1∶1的血液对肉汤比率207。在图2A和图2B中,容器中的传感器是固态荧光O2传感器。荧光信号改变解释为指示微生物生长。图2C图解了将8ml的血液201引入30ml的液体培养基209。血液201和液体培养基209在商业上可获得的BACTECTMStandard Aerobic产品(“StdAer”)中结合,其产生了至少1∶3的血液对肉汤比率210。
液体培养基是基于BACTEC Myco/F溶解性培养基使用额外的皂苷改进的培养基。样品分别装载(即加入(spike))10-100CFU的微生物211。测试的微生物是粪产碱杆菌、白色念珠菌、光滑念珠菌、粪肠球菌(Enterococcus faecalis)、大肠杆菌、脑膜炎双球菌、铜绿假单胞菌、金黄色葡萄球菌(2种不同的菌株)、表皮链球菌(Streptococcus epdidermidis)、肺炎链球菌和酿脓链球菌。在管的底部上使用的传感器212使用与如在BACTEC Myco/F溶解瓶中类似的配方制造。
对于每种微生物,血液培养瓶203、205、208在添加微生物211后立刻颠倒5次,并且然后装载入BACTEC FX仪器。接头(adaptor)用于支撑管,使得管稳固地停留在位置中,并且位于用于检测的适当位置。管和瓶培育5天,并且检测来自培养瓶传感器212的信号用于TTD分析。对每种微生物进行一式三份的培养。
步骤的结果描绘在下面的表2中。如表2中显示的,与具有至少1∶3的血液对肉汤比率的商业上可获得的BACTECTM Standard Aerobic瓶相比,具有1∶1的血液对肉汤比率207和2∶1的血液对肉汤比率204的血液培养瓶203、205(图2)显示了类似或甚至更短的TTD。
表2:低体积/低比率TTD与标准的1∶4比率的TTD的比较
具有1∶1的血液对肉汤比率207的制剂中的11种测试的微生物的平均TTD是11.7小时。具有更稀释的至少1∶3的血液对肉汤比率210的BACTEC Standard Aerobic瓶208具有15.0小时的平均TTD,其比1∶1的样品207长。类似地,具有2∶1的血液对肉汤比率204的16ml的瓶210的平均TTD是13.0小时。1∶1和2∶1的血液对肉汤比率207、204的较短的TTD相对于当前的更稀释的血液对肉汤比率——如具有至少1∶3的血液对肉汤比率210的BACTEC Standard Aerobic瓶——是预料不到的结果和改进。
实施例2:在有抗生素的培养基抑制剂中的生长
图3图解了使用肉汤中较高浓度的血液(从而提供1∶1的较低的血液对肉汤比率)测定包含抗生素的血液样品中的微生物生长的方法,所述抗生素将抑制至少一些微生物的生长。在抗生素存在的情况下,微生物生长的TTD可以在使用除生长培养基之外的树脂以增强微生物的生长的样品中缩短。树脂的主要功能是中和或吸附患者血液中的抗生素。树脂可以另外显著地减小抗生素的抑制效应,并且使培养基体积减少变得可能。也已经认为血液培养基中的溶解性试剂有益于微生物恢复和缩短TTD。这潜在地是由于血细胞溶解,其转而释放吞噬的微生物并产生更好的恢复。显示有效地溶解血细胞而不影响微生物的生存力和生长的通常使用的溶解性试剂的一个实例是皂苷——一种植物提取物。为了最小化微生物生长的TTD,在接种时,额外的皂苷可以添加至具有肉汤中较高浓度的血液的混合物。本领域技术人员知道其它溶解性试剂,并且本实用新型不限制使用任何一种溶解性试剂。
与至少1∶3的标准的稀释的血液对肉汤比率相比,测试了在存在抑制性抗生素的情况下1∶1的血液对肉汤比率的表现。在下面描述了1∶1的血液对肉汤比率的两种不同的样品制剂。
图3A图解了低体积/低比率制剂,其在30ml的小瓶中用布置在单独的室中的树脂和溶解性培养基制备。制剂包含树脂和8ml的总的溶解性培养基。容器中的传感器是固态荧光O2传感器。荧光信号改变用于测定微生物生长。调整低体积/低比率制剂的尺寸以与大约8ml的血液样品结合,其中血液对肉汤比率是大约1∶1。低体积/低比率制剂提供了1∶1的血液对肉汤比率。将总的8ml溶解性培养基分为两部分。一部分的溶解性培养基与树脂在30ml的瓶中,并且另一部分的溶解性培养基在单独的装置中,并且在瓶接种有血液样品和微生物二者时,其中的培养基在无菌条件下添加入30ml的瓶。
图3B图解了确认为“PlusLytic”的第二样品制剂。PlusLytic制剂使用商业上可获得的BACTEC Plus Aerobic产品,其是80ml的瓶中的30ml的培养基。在测试时,8ml的血液、预定量的抗生素、10-100CFU的微生物、和额外的20mg的皂苷与瓶中的30ml的培养基结合。血液对培养基的比率是8∶30,其是大约一份血液对3.7份培养基。此比率通常称为1∶4,即使培养基的体积不完全是样品的量的4倍。
对照测试样品制剂描绘在图3C中,并且确认为“PlusAer”。PlusAer制剂使用商业上可获得的BACTEC Plus Aerobic产品,而没有任何额外的培养基组分。在测试时,8ml的血液、预定量的抗生素、和10-100CFU的微生物与BACTEC Plus Aerobic产品的内容物结合。因此,血液对肉汤比率略小于1∶4[即8ml血液∶30ml培养基]。
使用64种抗生素/微生物组合测试每种样品制剂。测试的抗生素是庆大霉素、阿莫西林-克拉维酸、氨曲南、头孢曲松、头孢吡、亚胺培南、美洛培南、哌拉西林-三唑巴坦、万古霉素、替加环素(Tigecycline)、环丙沙星、四环素、氟康唑。接种入每个测试瓶的药物数量等于其在7ml的血液中的峰值血清水平下的药物量。这些抗生素与它们通常治疗的某些微生物组合。例如,阿莫西林-克拉维酸与金黄色葡萄球菌、大肠杆菌和粪肠球菌组合。在存在药物的情况下,测试每种样品的TTD和微生物的恢复二者。
彼此间隔几分钟,向培养基接种血液样品、抗生素和皂苷。
在TTD测试中,对于环丙沙星(Ciprofloxicin)、哌拉西林/三唑巴坦、和替加环素,低体积/低比率样品制剂具有与对照样品制剂(1∶4的PlusAer)相似的表现。当使用万古霉素、头孢吡、阿莫西林-克拉维酸、头孢曲松和美洛培南测试时,与PlusAer制剂相比,低体积/低比率制剂具有更快的TTD。参见下面的表3。对于仅一种抗生素——庆大霉素,与PlusAer制剂相比,低体积/低比率制剂具有更短的TTD。表现惊人地给出了本领域中的常规的观点:在低体积(即总的20ml或更少)下使用相对于肉汤较高量的血液(即较低的比率)(例如1∶1和2∶1的体积血液对体积培养基)不能实现可以接受的TTD。
表3:抗生素和微生物的不同组合的TTD/阳性的比较
关于药物吸附效率,低体积低比率制剂证明具有更快的吸附速率。较低体积制剂中的总抗生素吸附效率类似于PlusAer制剂中的总抗生素吸附效率。
图4在存在抗生素的情况下比较了PlusAer、PlusLytic和低体积/低比率样品制剂中的微生物的恢复速率。在每次比较中,测试的64种抗生素/微生物组合对各个制剂中的微生物生长是阳性的或阴性的。
图4A比较了包含1∶1的血液对肉汤制剂的低体积/低比率制剂与对照——其是PlusAer制剂(其具有1∶4比率的血液对肉汤)——的恢复速率。低体积/低比率制剂在47种情况中测试为阳性,而PlusAer对照制剂在43种情况中测试为阳性。PlusAer对照制剂在21种情况中测试为阴性,而低体积/低比率制剂在17种情况中测试为阴性。有差异的结果可显示在2种情况中,其中对于相同的抗生素/微生物组合,低体积/低比率制剂测试为阴性,而PlusAer测试为阳性。有差异的结果在6种情况中获得,其中对于相同的抗生素/微生物组合,PlusAer对照制剂测试为阴性,并且低体积/低比率制剂测试为阳性。低体积/低比率的总的恢复表现在统计学上等于PlusAer对照。
图4B比较了包含1∶4的血液对肉汤比率的PlusLytic制剂与对照——PlusAer制剂(也是1∶4)——的恢复速率。PlusLytic制剂在47种情况中测试为阳性,而PlusAer对照制剂在43种情况中测试为阳性。PlusAer对照制剂在21种情况中测试为阴性,而PlusLytic制剂在17种情况中测试为阴性。有差异的结果可显示在一种情况中,其中对于相同的抗生素/微生物组合,PlusLytic制剂测试为阴性,而PlusAer测试为阳性。有差异的结果还显示在五种情况中,其中对于相同的抗生素/微生物组合,PlusAer对照制剂测试为阴性,并且PlusLytic制剂测试为阳性。因而,当与对照比较时,PlusAer(1∶4)和Pluslytic(1∶4)实质上表现相同。
图4C比较了包含1∶1比率的血液对肉汤制剂的低体积/低比率制剂与PlusLytic制剂的恢复速率。低体积/低比率(1∶1)制剂和Plus Lytic制剂均在47种情况中测试为阳性。低体积/低比率(1∶1)制剂和Plus Lytic制剂均在17种情况中测试为阴性。有差异的结果可显示在两种情况中,其中对于相同的抗生素/微生物组合,低体积/低比率(1∶1)制剂测试为阴性,而PlusAer测试为阳性。有差异的结果还显示在两种情况中,其中对于相同的抗生素/微生物组合,PlusAer对照制剂测试为阴性,并且低体积/低比率(1∶1)制剂测试为阳性。
图4A和4C的恢复速率比较指示了与具有1∶4的血液对肉汤比率的制剂相比,包含1∶1的血液对肉汤比率的制剂显示了与对照大约相同的恢复速率,也就是图4A的低体积/低比率制剂和图4C的低体积/低比率(1∶1)制剂的比较。
虽然已经参照具体的实施方式描述了本文的实用新型,但是应当理解这些实施方式仅说明本实用新型的原理和应用。因此,应当理解可以对说明性实施方式做出众多改进,并且可以设计其它布置,而不背离如所附的权利要求限定的本实用新型的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!