溶血素方法和组合物与流程
本发明涉及增加通过化脓隐秘杆菌(trueperellapyogenes),一种牛子宫炎的病原体产生的溶血素的量的方法。本发明另外涉及包含溶血素的组合物,其使用本文所描述的方法分离与纯化,且适用于减轻或预防牛子宫炎。
背景技术:
子宫炎为奶牛通过各种微生物病原体的子宫感染的结果。其通常在产后期期间在黄体功能起始之后产生。通常在家畜滞留的环境中发现的细菌大概在产犊期间或之后引入至子宫中。在产生细菌感染的产后母牛中,细菌设法达到子宫,但不立即开始增殖。急性子宫炎在分娩后第0天与第21天之间出现。临床子宫内膜炎(子宫内衬或子宫内膜的发炎或刺激)在分娩后大致第21天与第35天之间出现。超出第35天,子宫内膜炎通常变为亚临床的。
存在多个与天然感染相关的因素,如来自产犊的压力、产奶/泌乳、负能量平衡、免疫抑制和此类动物更易罹患天然感染的事实。造成子宫炎和临床子宫内膜炎的起始的细菌病原体中的一个为化脓隐秘杆菌。此有机体具有多种促进其致病潜力的毒性因子,其中的一个为溶血素,一种胆固醇依赖溶细胞素。此蛋白质为溶血素,且对于免疫细胞,包括巨噬细胞为溶细胞性的。溶血素的表达对于此细菌的毒性是必需的。此蛋白质似乎是到目前为止鉴别的最有前景的候选化脓隐秘杆菌次单位疫苗。至关重要的是经分离溶血素在构象和免疫上与其天然状态的蛋白质类似/相同。因此,从化脓隐秘杆菌产生(且必要时)分离天然溶血素,以及基于其的有效疫苗的方法为高度所需的。
技术实现要素:
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其中所述方法包含使用含有葡萄糖以及选自由以下组成的群组的额外浓缩碳源的基础培养基:葡萄糖、半乳糖、蔗糖、麦芽糖、寡糖、甘油、乳糖、聚葡萄糖、糊精、丁二酸单甲酯和n-乙酰基葡糖胺;在培养基中的葡萄糖耗尽之前添加螯合剂至培养基;收获化脓隐秘杆菌和分离溶血素。
公开一种方法,其中螯合剂为乙二醇四乙酸(egta)、乙二胺四乙酸(edta)或两个的组合。
公开一种用于增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其中化脓隐秘杆菌复制为高于600nm处的5的光学密度(o.d.)的细菌细胞密度。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其中培养基维持在28℃与32℃之间的温度。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其进一步包含使用浓度在10mm与200mm之间的经磷酸盐缓冲的基础培养基。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其进一步包含使用基础培养基,其中培养基的ph在6.0与8.0之间。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其进一步包含使用基础培养基,其中培养基包含血晶素作为铁源。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其进一步包含使用包含聚山梨醇酯80的基础培养基。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其进一步包含使用包含维生素溶液的基础培养基。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其中所述维生素溶液包含以下中的一种或多种:维生素b12;肌醇;尿嘧啶核碱基;烟碱酸;泛酸钙;吡哆醛-hcl;吡哆胺-2hcl;核黄素;硫胺素-hcl;对氨基苯甲酸;生物素;叶酸;烟碱酰胺;和β-nad。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其中所述维生素溶液仅包含吡哆醛-hcl。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其包含连续、半连续或一次性补充浓缩碳源。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其包含使培养物ph从初始基础培养基起始ph减少到5.50与6.50之间的水准且接着通过自动添加碱性滴定剂而将ph控制于5.50与6.50之间。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其包含分离化脓隐秘杆菌蛋白酶与溶血素。
公开一种增加通过化脓隐秘杆菌产生的溶血素的产率的方法,其中分离化脓隐秘杆菌蛋白酶与溶血素是通过色谱步骤实现。
公开一种使溶血素不活化的方法,所述方法包含添加福尔马林至0.1%与0.5%之间的最终浓度。
公开尤其在干乳期期间适用于牛的疫苗接种以减轻或预防子宫炎的免疫原性组合物。
公开包含从本文所述的培养基中生长的化脓隐秘杆菌分离的溶血素的免疫原性组合物。
公开包含通过本文所描述的方法中的任一种获得的溶血素的免疫原性组合物。
公开包含通过本文所描述的方法中的任一种获得的溶血素和载剂的免疫原性组合物。
公开包含通过本文所描述的方法中的任一种获得的溶血素和佐剂的免疫原性组合物。
附图说明
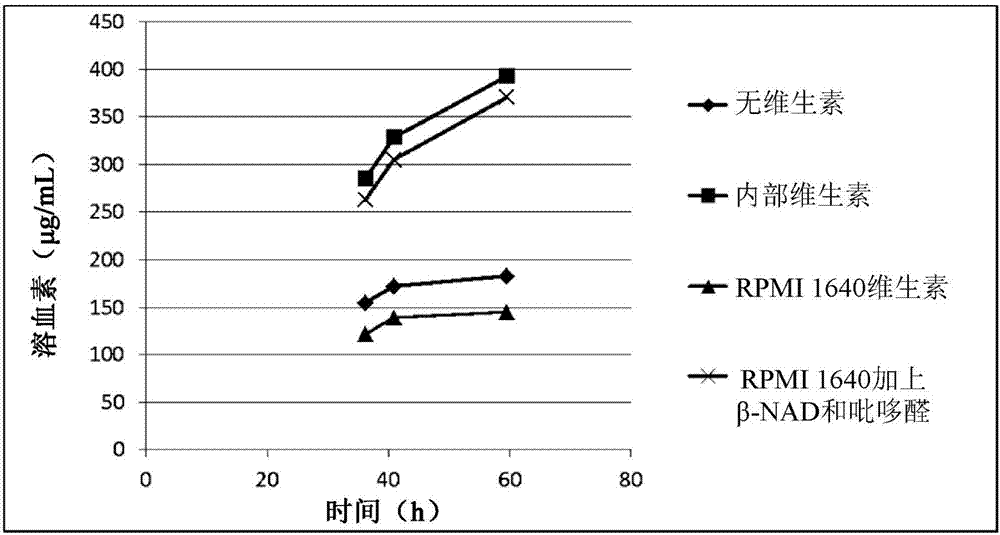
图1为通过不含维生素的培养基、内部维生素溶液或商业维生素溶液中的化脓隐秘杆菌的溶血素生产水准的比较。
图2为不含维生素的培养基、内部维生素溶液或补充有β-nad和吡哆醛的商业维生素溶液中的化脓隐秘杆菌的溶血素生产水准的比较。
图3为含有β-nad、吡哆醛或两者的培养基中的化脓隐秘杆菌的溶血素生产水准的比较。
图4为含有与右旋糖(dex)组合的高压灭菌(ac)或无菌添加(sa)的吡哆醛(pyr)的培养基中的化脓隐秘杆菌的o.d.(600nm)的比较。
图5为含有与右旋糖(dex)组合的高压灭菌(ac)或无菌添加(sa)的吡哆醛(pyr)的培养基中的化脓隐秘杆菌的溶血素生产水准的比较。
图6为含有已持续各种时间长度经照射,或完全未经照射的血晶素的培养基中的化脓隐秘杆菌的o.d.(600nm)的比较。
图7为含有已持续各种时间长度经照射,或完全未经照射的血晶素的培养基中的化脓隐秘杆菌的溶血素生产水准的比较。
图8为含有在添加至培养基之前已保存各种时间长度的血晶素的培养基中的化脓隐秘杆菌的溶血素生产水准的比较。
图9和图11为已维持于各种温度下的培养基中的化脓隐秘杆菌的o.d.(600nm)的比较。
图10和图12为已维持于各种温度下的培养基中的化脓隐秘杆菌的溶血素生产水准的比较。
图13为化脓隐秘杆菌的溶血素生产水准的比较,其中在发酵过程期间,培养基的温度维持于32℃,或从37℃移动至32℃。
具体实施方式
本文提及的所有公开案、专利申请、专利和其它参考文献都以全文引用的方式并入。
以下定义可应用于实施例的描述中采用的术语。以下定义替代以引用的方式并入本文中的每一个别参考文献中包含的矛盾定义。
除非本文中另外定义,否则结合本发明的实施例使用的科学与技术术语将具有所属领域的技术人员通常了解的含义。此外,除非上下文另外需要,否则单数术语应包括复数并且复数术语应包括单数。
如本文所用的术语“大约”、“大致”等当与可测量的数值变量结合使用时,意指所述变量的指定值,和在指定值的实验误差内(例如关于平均值,在95%信赖区间内),或在指定值的10%内(无论哪个更大)的变量的所有值。
就天数来说,“大约”理解为意指加上或减去1天;例如“大约3天”可意指2、3或4天。
如本文所用的术语“动物”意指易罹患子宫内膜炎的任何动物,包括哺乳动物(家养以及野生型)。优选地,如本文所用的“动物”是指牛。
如本文所用的术语“细菌(bacteria)”、“细菌物种”、“细菌(bacterium)”等意指原核微生物的大结构域。优选地,如本文所用的“细菌”是指包括化脓隐秘杆菌和相关细菌的微生物。
如本文所用的术语“细菌细胞密度”意指存在于培养物中的细菌的数目。一种定量细菌的数目的方法是通过在分光光度计中,通常在600nm下测量培养物的光学密度。
如本文所用的术语“基础培养基”意指起初接种微生物的培养基。尚未发生微生物的复制,其可对各种培养基组分的ph和/或浓度有影响。
如本文所用的术语“牛”意指一群不同的中等尺寸到大尺寸有蹄动物,其一般具有偶蹄,且至少一个性别具有真正的角。牛包括(但不限于)家牛、野牛、非洲水牛、水牛、牦牛和四角羚或螺旋犄角羚羊。
如本文所用的术语“培养物”或“培养基”意指含有微生物的培养基。
如本文所用的术语“干乳期”意指母牛未进行挤奶的时段;此时段是为了使母牛和它的乳房为随后的泌乳做准备。
如本文所用的术语“子宫内膜炎”意指子宫内衬,也称为“子宫内膜”的发炎或刺激。
如本文所用的术语“葡萄糖耗尽”意指培养物中的大部分或所有可用的葡萄糖的消耗、代谢或分解。举例来说,“耗尽”可为碳源的浓度处于或低于10mm时。
如本文所用的术语“促性腺激素释放激素”、“gnrh”、“促黄体激素释放激素”、“lhrh”等意指造成从促性腺激素、促卵泡激素(fsh)和促黄体激素(lh)的垂体前叶的合成和分泌的肽激素。gnrh分泌在所有脊椎动物中为脉动的,且为适当的生殖功能所需。
如本文所用的术语“接种物”意指一定量或培养的微生物。优选地,“接种物”是指一定量的细菌培养物。
如本文所用的术语“肌肉内(intramuscular/intramuscularly)”等意指将物质注射至肌肉中。
如本文所用的术语“刺激”意指对组织表面上的细胞造成损害的刺激物或药剂的条件或反应。
如本文所用的术语“泌乳(lactate/lactating/lactation)”意指从乳腺分泌乳汁,和雌性产生乳汁以喂养其幼儿的时段。
如本文所用的术语“分娩”意指牛生出小牛的时间。
如本文所用的术语“病原微生物”或“病原体”意指能够在动物中引起疾病或病理性病况的微生物。此类可包括(但不限于)细菌、病毒、真菌或酵母菌。
如本文所用的术语“怀孕(pregnant/pregnancy)”意指雌性子宫中的受精和一个或多个称为胚胎或胎儿的后代的发育。
如本文所用的术语“孕酮”意指参与动物的发情周期、怀孕和胚胎发生的类固醇激素。孕酮属于称作孕激素的一类激素。
如本文所用的术语“子宫(uterus/uterine)”等意指在怀孕期间滋养胚胎和胎儿的大部分哺乳动物的对雌性激素有反应的生殖器官。
如本文所用的术语“兽医学上可接受的载剂”或“载剂”是指如下物质:在合理医学判断的范围内适用于与动物组织接触而无不当毒性、刺激、过敏反应等,与合理的效益-风险比相称,并且对其预定用途有效。
提供以下描述来帮助所属领域的技术人员实践本发明。即使如此,本说明书不应理解为不恰当地限制本发明,因为本文中论述的实施例的修改和变化可由所属领域的技术人员在不脱离本发明发现的精神或范围的情况下作出。
培养技术
包括化脓隐秘杆菌的细菌可在含有生长培养基的容器中生长,所述生长培养基将允许细菌复制为高数目,从而促进所需蛋白质的分离。生长培养基可呈营养培养液形式,且可含有任何数目的充当生长所需或适用于生长的各种化合物和组分的来源的各种成分。这包括养分来源。小心地选择培养基的营养组分,且可包括蛋白质、肽和氨基酸。这些组分可充当细菌的碳源和氮源。要求更高的有机体可能需要添加补充营养来源。
能量来源也在生长培养基中至关重要。其通常以碳水化合物形式供应。以能量来源形式添加至培养基以增加有机体的生长速率的最常见物质为葡萄糖。也可以使用或需要其它碳水化合物。替代碳源可包括(但不限于)半乳糖、各种双糖,如蔗糖、乳糖或麦芽糖,和寡糖。其它碳源也可包括甘油、聚葡萄糖、糊精、丁二酸单甲酯和n-乙酰基葡糖胺。
也可在培养基中添加必需的金属和矿物质。培养基的这些无机组分可包括常量组分,如na、k、cl、p、s、ca、mg,和fe。也可能需要各种微量组分,如zn、mn、br、b、cu、co、mo、v和sr。培养基中也可能需要po4。其可以10mm与200mm之间,包括10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120125、130、135、140、145、150、155、160、165、170、175、180、185、190、195和200mm的浓度存在。
同样重要的是培养基的ph维持于所要细菌的生长所需的范围周围。培养基的ph可在6.0与8.0之间,包括6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9和8.0。使用特定pk值下的缓冲液化合物在添加可发酵碳水化合物作为能源来源时尤其重要。磷酸盐、乙酸盐、柠檬酸盐、两性离子化合物和特定氨基酸为可添加至培养基的缓冲剂的实例。此类化合物的一种潜在副作用为其螯合(或结合)二价阳离子(例如ca++和mg++)的能力。这些结合或螯合剂的作用可见于减少的生长或完全无法生长中,除非注意在调配物中补充必需的阳离子。ph也可通过添加各种酸性或碱性溶液,如碳酸氢钠和氢氧化钠来调节。溶解的co2也可用于调节培养物的ph。
生长培养基也可含有着色指示剂物质,其可充当检测培养基中的特定碳水化合物的发酵的有效方式。此类化合物应在临界ph值处明显且快速地改变颜色。使用的这些化合物中的大部分,如酚红、溴甲酚紫和品红可能有毒性;因此,必需使用低浓度的所述化合物。
生长培养基中也可能需要选择剂。化学制剂或抗微生物剂添加至培养基以使其对某些微生物具选择性。在特定浓度下选择和添加选择剂以抑制多微生物样品中的不希望的有机体的生长,或增强所需有机体的生长。必需确定选择剂将不仅抑制不希望的有机体,而且也将允许所需有机体的不受抑制的生长。
胶凝剂也可适用于生长培养基。用于培养基的最常见凝胶形成物质为琼脂。琼脂获自洋菜植物海藻,主要为石花菜属(gelidium)、江蓠属(gracilaria)和鸡毛菜属(pterocladia)物种。其在大于100℃下以水溶液形式提取,经脱色,过滤,干燥且碾磨为粉末。琼脂并非惰性胶凝剂,且可向培养基贡献养分和/或毒性剂,这取决于用于其生产的化学方法。
其它组分也可添加至生长培养基,用于特定目的。这些可包括各种生长因子、全血或血液组分,和激素。
培养基所维持的温度是关于产生的毒素的量的重要因素。为了使产生的毒素的量最大化,培养基的温度可维持于37℃或更低。优选地,温度可维持在21℃与36℃之间。更优选地,温度可维持在25℃与34℃之间。最优选地,温度可维持在28℃与32℃之间。
蛋白质纯化技术
本文涵盖各种制备型蛋白质纯化方法。此类方法旨在回收相对大量的纯化蛋白质以供后续使用,包括用于制备免疫原性组合物。(分析型纯化方法更多用于出于多种研究或分析目的而生产少量蛋白质)。制备型蛋白质纯化的主要步骤包括提取、纯化和必要时的浓缩。
为了提取蛋白质,可能需要引入至溶液中。这可通过使含有其的组织或细胞破裂或破坏而实现。存在若干达成此目的的方法:重复冷冻和解冻、超声处理、通过高压进行均质化、过滤或通过有机溶剂的渗透作用。所选方法取决于蛋白质的脆弱程度,和细胞的坚固程度。通常,对于大部分常规目的,柱色谱用于实现纯化。在此萃取过程之后,可溶蛋白质将在溶剂中,且可通过离心与细胞膜、dna等分离。
可能需要在蛋白质萃取之前或与蛋白质萃取结合来抑制可能存在且能够降解纯化的蛋白质的蛋白酶。存在多类可能存在的蛋白酶,包括丝氨酸蛋白酶、半胱氨酸蛋白酶、金属蛋白酶和天冬氨酸蛋白酶。各种方法可用于抑制各类蛋白酶,且可包括(但不限于)添加用以抑制蛋白酶的其它蛋白质,或可抑制蛋白酶的活性的各种化合物。
纯化策略一般涉及一些类型的色谱步骤和设备。纯化过程一般利用三种特性来分离蛋白质。第一,蛋白质可根据其等电点纯化,如通过将其运行通过ph梯度凝胶或离子交换柱。第二,蛋白质可根据其尺寸或分子量分离,如经由尺寸排外色谱法或通过sds-page(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)。第三,蛋白质可通过极性/疏水性分离,如通过高效液相色谱或反相色谱。蛋白质纯化方案可含有一个或多个色谱步骤。也存在其它色谱方法,包括疏水相互作用色谱(基于表面疏水性分离化合物)和亲合性色谱(使用对于连接至化合物的配体具有特异性的各种树脂分离化合物)。
如果需要蛋白质的浓缩,那么这可使用各种技术实现,所述技术可包括冻干(蛋白质的干燥)和超过滤(使用选择性渗透膜的浓缩)。
免疫原性组合物
本发明的免疫原性组合物可向动物投与以诱发针对化脓隐秘杆菌的有效免疫反应。因此,本发明提供刺激有效免疫反应的方法,其通过向动物投与治疗有效量的本文所述的本发明的免疫原性组合物来进行。
溶血素可在其用于免疫原性组合物中之前不活化。不活化的方法可包括(但不限于)热处理、uv光处理、调节ph(上调或下调)或用各种化学药剂处理。此类化学药剂可包括(但不限于):还原剂,如二硫苏糖醇(dtt)或β-巯基乙醇(bme);洗涤剂,如十二烷基硫酸钠(sds)、tritonx-100或chaps;离散剂,如酚或尿素;和反应性消毒剂,如甲醛或戊二醛。使用此类方法和药剂的方法易于使用所属领域的技术人员熟知的标准技术实现。
本发明的免疫原性组合物可包括一种或多种佐剂。佐剂包括(但不限于)ribi佐剂系统(ribiinc.;hamilton,mt);矾;氢氧化铝凝胶;水包油乳液;油包水乳液,如弗氏(freund's)完全和不完全佐剂;嵌段共聚物(cytrx;atlanta,ga);saf-m(chiron;emeryville,ca);
合成聚核苷酸,如含有cpg基元的寡核苷酸(us6,207,646,特此以引用的方式并入)也可用作佐剂。cpg寡核苷酸,如p-类免疫刺激寡核苷酸为适用的,包括e-修饰p-类免疫刺激寡核苷酸。固醇也可适用作佐剂。适用的那些可包括β-谷固醇、豆固醇、麦角固醇、麦角钙化醇和胆固醇。佐剂组合物可进一步包括一种或多种聚合物,如deae聚葡萄糖、聚乙二醇、聚丙烯酸和聚甲基丙烯酸(例如
多种细胞因子或淋巴因子已显示具有免疫调节活性,且因此可用作佐剂。这些可包括(但不限于)白介素1-α、1-β、2、4、5、6、7、8、10、12(参见例如us5,723,127)、13、14、15、16、17和18(和其突变形式)、干扰素-α、β和γ、粒细胞-巨噬细胞集落刺激因子(参见例如us5,078,996和atcc寄存编号39900)、巨噬细胞集落刺激因子、粒细胞集落刺激因子、gsf和肿瘤坏死因子α和β。适用于本发明的其它佐剂包括趋化因子,包括(但不限于)mcp-1、mip-1α、mip-1β和rantes。粘附分子,如选择素,例如l-选择素、p-选择素和e-选择素也可适用作佐剂。其它适用佐剂包括(但不限于)粘蛋白样分子,例如cd34、glycam-1和madcam-1;整合素家族的成员,如lfa-1、vla-1、mac-1和p150.95;免疫球蛋白超家族的成员,如pecam、icam(例如icam-1、icam-2和icam-3)、cd2和lfa-3;共刺激分子,如cd40和cd40l;生长因子,包括血管生长因子、神经生长因子、纤维母细胞生长因子、表皮生长因子、b7.2、pdgf、bl-1和血管内皮生长因子;受体分子,包括fas、tnf受体、fit、apo-1、p55、wsl-1、dr3、tramp、apo-3、air、lard、ngrf、dr4、dr5、killer、trail-r2、trick2和dr6。另一佐剂分子包括卡斯蛋白酶(ice)。
阳离子载剂也可适用于佐剂组合物。适合的阳离子载剂包括(但不限于)聚葡萄糖、聚葡萄糖-deae(和其衍生物)、peg、瓜尔胶、壳聚糖衍生物、如羟乙基纤维素(hec)的聚纤维素衍生物、聚乙烯亚胺、聚氨基,如聚赖氨酸等。
取决于投与途径,本发明的免疫原性组合物可以各种形式制得。举例来说,免疫原性组合物可以适合于可注射使用的无菌水溶液或分散液形式制得,或使用冷冻干燥技术以冻干形式制得。冻干免疫原性组合物通常维持在约4℃下,并且可在稳定化溶液(例如盐水或hepes)中在存在或不存在佐剂的情况下复原。免疫原性组合物也可以悬浮液或乳液形式制得。
这些免疫原性组合物可含有适合于经由任何常规投与途径投与的添加剂。本发明的免疫原性组合物可制备用于以例如液体、粉末、气溶胶、片剂、胶囊、肠包衣片剂或胶囊或栓剂形式向个体投与。因此,免疫原性组合物也可呈(但不限于)悬浮液、溶液、油性或水性媒剂中的乳液、浆料和可植入持续释放或生物可降解调配物形式。在用于肠胃外投与的调配物的一个实施例中,活性成分以干燥(即粉末或颗粒)形式提供以在肠胃外投与复原组合物之前用适合媒剂(例如无菌无热原质水)复原。其它适用的非经肠投与调配物包括包含呈微晶形式、在脂质体制剂中或作为生物可降解聚合物系统的组分的活性成分的那些。持续释放或植入的组合物可包含药学上可接受的聚合或疏水性材料,如乳液、离子交换树脂、微溶性聚合物或微溶性盐。
免疫原性组合物一般包括兽医学上可接受的载剂。此类载剂包括(不限于)水、生理盐水、缓冲生理盐水、磷酸盐缓冲液、醇/水溶液、乳液或悬浮液。其它常用的稀释剂、佐剂和赋形剂可根据常规技术添加。此类载剂可包括乙醇、多元醇和其适合混合物、植物油和可注射的有机酯。也可采用缓冲剂和ph调节剂,且包括(但不限于)由有机酸或碱制备的盐。代表性缓冲剂包括(但不限于)有机酸盐,如柠檬酸(例如柠檬酸盐)、抗坏血酸、葡萄糖酸、碳酸、酒石酸、丁二酸、乙酸或邻苯二甲酸的盐;tris、三甲胺盐酸盐或磷酸盐缓冲剂。非经肠载剂可包括氯化钠溶液、林格氏(ringer's)右旋糖、右旋糖、海藻糖、蔗糖、乳酸林格氏溶液或不挥发性油。
静脉内载剂可包括流体和营养补充剂、电解质补充剂(例如基于林格氏右旋糖的补充剂)等。如抗微生物剂、抗氧化剂、螯合剂(例如egta;edta)、惰性气体等的防腐剂和其它添加剂也可提供在药物载剂中。本发明不受载剂选择的限制。所属领域的技术人员能够从上述组分制备具有适当ph、等张性、稳定性和其它常规特征的这些药学上可接受的组合物。参见例如如下文本:《雷明顿:医药科学和实践(remington:thescienceandpracticeofpharmacy)》,第20版,lippincottwilliams&wilkins出版,2000;以及《医药赋形剂手册(thehandbookofpharmaceuticalexcipients)》,第4版,r.c.rowe等人编,aphapublications,2003。
重组技术
在本发明的其它实施例中,免疫原性组合物可包含重组疫苗。此类重组疫苗可包括重组蛋白,或者编码所述重组蛋白的载体和异源插入物。在一些实施例中,异源插入物包括一个或多个编码本发明的蛋白质的核酸序列。插入物可任选地包含异源启动子,如所属领域中已知的合成启动子。或者,宿主载体的启动子可对插入物的表达施加转录控制。适合的启动子(取决于载体的选择,其可为天然或异源的)的非限制性实例为h6牛痘启动子、i3l牛痘启动子、42k痘病毒启动子、7.5k牛痘启动子和pi牛痘启动子。
在一些实施例中,载体可为病毒载体,包括(但不限于)牛痘和痘病毒载体,如羊痘、浣熊痘、猪痘和不同禽痘载体(例如金丝雀痘和禽痘病毒株)。一般来说,病毒宿主非必需的序列为用于本发明的插入物的适合插入位点。上述病毒株在所属领域中充分表征,且这些载体中的一些插入位点为熟知的。
存在若干可用于克隆和表达本发明的核苷酸序列的已知方法或技术。举例来说,序列可分离为限制片段,且克隆至克隆和/或表达载体中。序列也可经pcr扩增,且克隆至克隆和/或表达载体中。或者,其可通过这两种方法的组合克隆。所属领域中已知且未确切描述的标准分子生物学技术可一般如以下各者中所述地遵循:sambrook等人,《分子克隆实验指南(molecularcloning:alaboratorymanual)》,coldspringharborlaboratorypress,newyork(1989);ausubel等人,《最新分子生物学实验方法汇编(currentprotocolsinmolecularbiology)》,johnwileyandsons,baltimore,maryland(1989);perbal,《分子克隆实践指南(apracticalguidetomolecularcloning)》,johnwiley&sons,newyork(1988);watson等人,《重组dna(recombinantdna)》,scientificamericanbooks,newyork;birren等人编《基因组分析:实验室手册系列(genomeanalysis:alaboratorymanualseries)》,第1-4卷coldspringharborlaboratorypress,newyork(1998);以及us4,666,828;us4,683,202;us4,801,531;us5,192,659和us5,272,057中所述的方法。聚合酶链反应(pcr)一般如《pcr方案:方法和应用指南(pcrprotocols:aguidetomethodsandapplications)》,academicpress,sandiego,ca(1990)中所述地进行。
本发明涵盖使用原核和真核表达系统,包括载体和宿主细胞,其可用于表达通过本发明的核苷酸序列表达的截短和全长形式的重组多肽。多种宿主表达载体系统可用于表达本发明的多肽。此类宿主表达系统也表示可克隆所关注的编码序列的媒剂,和随后纯化的经表达蛋白质。本发明进一步提供宿主细胞,其可在经适当载体或核苷酸序列转化或转染时表达本发明的经编码多肽基因产物。此类宿主细胞包括(但不限于)微生物,如经含有编码序列的重组噬菌体dna、质体dna或粘质体dna表达载体转化的细菌(例如大肠杆菌(escherichiacoli)、枯草杆菌(bacillussubtilis));经含有编码序列的重组酵母菌表达载体转化的酵母菌(例如酵母菌属(saccharomyces)、毕赤酵母(pichia));经含有编码序列的重组病毒表达载体(例如杆状病毒)感染的昆虫细胞系统;经重组病毒表达载体(例如花椰菜嵌纹病毒,camv;烟草花叶病毒,tmv)感染或经含有编码序列的重组质体表达载体(例如ti质体)转化的植物细胞系统;或具有重组表达构筑体的哺乳动物细胞系统(例如cos、cho、bhk、293、3t3),所述构筑体含有衍生自哺乳动物细胞的基因组的启动子(例如金属硫蛋白启动子)或衍生自哺乳动物病毒的启动子(例如腺病毒晚期启动子;牛痘病毒7.5k启动子),和编码序列。
本发明的载体可衍生自(但不限于)细菌质体、噬菌体、酵母菌游离基因、酵母菌染色体元件、哺乳动物病毒、哺乳动物染色体和其组合,如衍生自质体和噬菌体基因元件的那些,包括(但不限于)粘质体和噬菌粒。
本发明的载体可用于表达多肽。一般来说,本发明的载体包括可操作地连接于编码待表达的多肽的聚核苷酸的顺式作用调节区。调节区可为组成型或诱导型的。由宿主如下供应适当反式作用因子:通过体外翻译系统、通过补充载体或通过载体自身在引入至宿主中时。
为了促进溶血素的分离,可制得融合多肽,其中溶血素连接到异源多肽,其使得能够通过亲合性色谱分离。优选地,融合多肽是使用所属领域的技术人员已知的表达系统中的一个制得。举例来说,编码溶血素的聚核苷酸在其5'或3'端连接至编码异源多肽的核酸。核酸在恰当密码子阅读框架中连接,以使得能够产生融合多肽,其中溶血素的氨基和/或羧基末端融合至异源多肽,其允许抗原以融合多肽形式的简化回收。融合多肽也可预防抗原在纯化期间降解。在一些情况下,可能需要在纯化之后去除异源多肽。因此,也预期融合多肽在溶血素与异源多肽之间的接合点处包含裂解位点。裂解位点由通过对所述位点处的氨基酸序列具有特异性的酶裂解的氨基酸序列组成。涵盖的此类裂解位点的实例包括肠激酶裂解位点(通过肠激酶裂解)、因子xa裂解位点(通过因子xa裂解)和genenase裂解位点(通过genenase裂解;newenglandbiolabs;beverly,mass.)。
生产用于免疫原性组合物的重组多肽的原核表达系统的实例为谷胱甘肽s-转移酶(gst)基因融合系统(amershampharmaciabiotech;piscataway,n.j.)。生产融合蛋白的另一方法为连接框内编码多组氨酸标签的dna序列与编码抗原的dna的方法。标签允许通过金属亲合性色谱,优选地镍亲合性色谱来纯化融合多肽。xpress系统(invitrogen;carlsbad,ca)为可用于制造且接着分离多组氨酸-多肽融合蛋白的商业试剂盒的实例。另外,pmal融合和纯化系统(newenglandbiolabs;beverly,ma)为用于制造融合多肽的方法的另一实例,其中麦芽糖结合蛋白(mbp)融合至抗原。mbp通过直链淀粉亲合性色谱促进融合多肽的分离。其它融合搭配物和产生此类融合物的方法为易于获得的,且为所属领域的技术人员已知。这些融合物可全部地用作免疫原性组合物,或其可在重组抗原与异源多肽之间的连接点处裂解。
本发明的载体可包括任何通常包含于表达或呈现载体中的元件,包括(但不限于)复制起点序列、一种或多种启动子、抗生素抗性基因、前导或信号肽序列、各种标签序列、限制位点、核糖体结合位点、翻译增强子(能够形成用于mrna稳定性后转录的茎环结构的序列)、编码缺乏终止密码子的氨基酸的序列和编码细菌鞘蛋白的序列。
本发明通过以下实例进一步说明,但决不限于以下实例。
实例
实例1.溶血素的表达、分离和纯化的改进的方法。
用于所有发酵阶段的培养基为热灭菌的胰蛋白胨/酵母提取物/tween80/葡萄糖/磷酸盐/血晶素溶液。无菌过滤维生素溶液和进一步过滤器灭菌葡萄糖溶液在热灭菌后添加至培养基。冷冻野生型化脓隐秘杆菌安瓿经解冻,且用于接种含有培养基(0.5%v/v)的烧瓶(在约30%填充体积下);这在37℃、100rpm下在设定于5%的co2恒温箱中培育16-28小时。含有培养基的第二烧瓶接着用来自第一烧瓶的10%v/v培养物接种;这接着再次在37℃、100rpm下在设定于5%的co2恒温箱中培育4至8小时。发酵槽接着用来自第二烧瓶的0.5%v/v培养物接种。温度保持在37℃,且起始ph为7.2至7.4。使ph降至ph6.15,且接着仅用30%naoh在一个方向上控制。溶解氧使用最大流动速率为0.05vvm的纯氧维持于5%,且在缓慢速率(在2升规模下,20rpm)下搅拌容器。发酵槽外加调节至ph6.15的egta溶液,刚好在葡萄糖耗尽之前达到2g/l的最终浓度。在此同时,添加无菌过滤乳糖溶液至4至8g/l的最终浓度。接着通过过程内超性能液相色谱(uplc)分析测定收获时间,标称约48至80小时。收获培养物接着冷却到<20℃,且接着通过离心和过滤去除细胞。上清液通过使用10kda(截止)改性乙酸纤维素uf膜的切向流动过滤浓缩10至30倍。上清液接着通过使用含有50mmmes、500mmna2so4,ph5.8的缓冲液的4至5次洗涤透滤。透滤保留物接着经无菌过滤,且准备进行纯化。
关于上游方法改进,历史上,培养物在4h至稳定期(这是出现葡萄糖耗尽时)产生最大量的溶血素。有机体接着开始产生蛋白酶,但是,其超时地完全降解毒素。因此,收获细胞通常在葡萄糖耗尽后3至4h,在600nm处的o.d.通常为约3.7时进行。ph接着调节至5.7至5.9以进一步抑制蛋白酶。此方法的一个改进为蛋白酶随着添加egta而失能的发现。因此,在葡萄糖耗尽之前或葡萄糖耗尽时添加egta允许收获细胞以符合最大产率,因为蛋白酶的不活化,和向培养物后续馈入新鲜碳源使得能够实现较高产率。另外,先前使用10kdapes超滤盒进行上清液的浓缩;plo的回收率仅为约65%。但是,改变为10kda改性乙酸纤维素(例如hydrosart)超滤盒使得plo的回收率能够改进为约100%。
此方法的另外的改进包括对培养物的磷酸盐缓冲、添加维生素溶液以及添加镁。关于磷酸盐缓冲,ph6.8下的25mm磷酸钠确定为最优。对于维生素溶液,添加以下组合物:维生素b12(2.5mg/l);肌醇(50mg/l);尿嘧啶(50mg/l);烟碱酸(10mg/l);泛酸钙(50mg/l);吡哆醛-hcl(25mg/l);吡哆胺-2hcl(25mg/l);核黄素(50mg/l);硫胺素-hcl(25mg/l);对氨基苯甲酸(5mg/l);生物素(5mg/l);叶酸(20mg/l);烟碱酰胺(25mg/l);和β-nad(62.5mg/l)。关于添加镁,这可以柠檬酸镁、葡糖酸镁或硫酸镁形式供应。
此方法的另外的改进包括使用单一或多个碳源补充的分批和/或分批进料发酵策略。碳源也可含有额外营养因子和/或盐,如血晶素和磷酸盐。使溶血素的生长和生产最大化的规划发酵优化策略包括控制溶解氧、氧化还原、ph和二氧化碳含量。也可提高培育温度,因为一些实验操作已指示较低操作温度可能是有益的。
就溶血素的下游加工和纯化而言,蛋白质经由使用经50mmmes,500mmna2so4,ph5.8平衡的苯基琼脂糖树脂的疏水相互作用色谱(hic)纯化;其在50mmmes,ph5.8中洗脱。纯化的蛋白质接着经浓缩,随后缓冲液交换至磷酸缓冲液(钠或钾)中。接着测定溶血性活性以确保活性蛋白质已经纯化。这是通过用分析缓冲液连续稀释溶血素,接着用马红细胞在37℃下培育溶血素而进行。这接着经离心以使完整红细胞成团,将可溶(溶解)材料转移至新板,测量405nm处的o.d.,且标绘结果。在曲线的中点处测定溶血单位(hu),且溶血素在溶血单位小于1000hu时视为解毒的。uplc和sds-page接着用于确认经分离蛋白质的标识。最后,溶血素通过用0.25-0.5%(v/v)福尔马林在20℃下处理24-48h而不活化,且接着经无菌过滤。
实例2.用于增加溶血素的表达量的额外改进。
制备子宫炎种子培养基所需的原料显示于表1和表2中(包括目标浓度)。
表1氯化血晶素溶液
表2子宫炎种子培养基
氯化血晶素溶液始终在需要的当天新制。氯化血晶素粉末首先溶解于1mnaoh的适当体积中且当完全溶解时,用蒸馏水补足体积。
由于聚山梨醇酯80的高粘度,更容易将此组分直接称重至玻璃烧杯中作为制备子宫炎种子培养基的第一步。将蒸馏水的最终体积的约60%添加至具有电磁搅拌器的烧杯且继续混合且将溶液加热至约50至60℃。应注意,此溶液将在加热时变得混浊。以表2中示出的顺序缓慢添加所有其它组分。完全溶解所有成分且用蒸馏水补足体积。在121℃下对培养基热灭菌15至20分钟。培养基在室温下具有7天的存放期。此短存放期是由于血晶素含量。如果基础培养基在无血晶素的情况下制备,那么这将使室温下的存放期延长至约3个月。过滤灭菌的氯化血晶素溶液可视需要添加至大量基础培养基的一部分。但是,对于某些市场,这将需要使用之前的材料的附加药剂测试。
对于所有进行至多且包括35l中试规模的发酵研究,仅需要两个种子阶段以提供足够接种物体积。第一阶段可生长至稳定期且在其培育期中具有大量灵活性。第二阶段用于“更新”细胞且欲转移至呈指数生长的发酵阶段。
具有光滑壁和通风盖的一次性corningerlenmeyer烧瓶已用于到目前为止的所有发酵研究。但是,其它一次性或非一次性培养烧瓶应同样良好。对于所有种子阶段,烧瓶已填充至总体积的32%且接种后,在设定至5%和100转/分的co2振荡恒温箱中培育。co2恒温箱由于极大地改善生长而首先使用。但是,已开发好得多的生长培养基,因此标准恒温箱现在可能令人满意(这些研究尚未进行)。
测试来自化脓隐秘杆菌种源的种子通道的最大数量的实验显示对溶血素产率不存在有害的影响。实验设计是基于10,000l的理论最终发酵培养体积,借此来自种源的7个通道将对于此按比例扩大方法足够。这是基于用来自种源的3个充裕通道制备工作种子库。
实验测试用来自种源的第6通道接种的35l中试发酵槽中的溶血素产率。前5个通道为125ml烧瓶中的40ml体积且第6种子阶段为1000ml烧瓶中的320ml。
种子阶段1(125毫升规模实例)
解冻且无菌地打开化脓隐秘杆菌工作种子安瓿。在125ml光滑壁烧瓶中以安瓿的0.5%v/v接种40ml子宫炎种子培养基。在37℃下在100rpm的振荡平台上在设定于5%的co2恒温箱中有氧地培育16-28小时。od600应在3与7之间且不应剩余残余葡萄糖(参考章节3.6.2)。应通过划线到绵羊或马血琼脂板测试培养物的纯度(参考章节3.6.5)。
种子阶段2(125ml规模实例)
在125ml光滑壁烧瓶中以种子阶段1(ss1)的10%v/v接种40ml子宫炎种子培养基。在37℃下在100rpm的振荡平台上在设定于5%的co2恒温箱中有氧地培育4-8小时。od600应在1与3之间且确保在接种一个或多个发酵槽之前,种子阶段2(ss2)中剩余一些残余葡萄糖(参考章节3.6.2)。应通过划线到绵羊或马血琼脂板测试培养物的纯度(参考章节3.6.5)。
制备子宫炎生产基础培养基所需的原料显示于表3中。
表3子宫炎生产基础培养基(包括目标浓度)
子宫炎生产基础培养基的一般制备与关于子宫炎种子培养基在上文所描述相同。培养基类似,但不添加氯化血晶素且葡萄糖浓度较低。在121℃下在发酵槽中对所需体积的基础培养基热灭菌30至60分钟。
此培养基取代对高热灭菌负载敏感的基于胰蛋白胨大豆培养液(tsb)的培养基,借此极大地减少毒素产率。此改进的培养基耐热得多,但有意地从这个发展研究排除血晶素以仅比较具有高(等效于约2.5g/l的tsb)和低(0.5g/l)葡萄糖浓度的胰蛋白胨与tsb。意图为随后比较经血晶素热灭菌和不经血晶素热灭菌的改进的培养基。尚未进行此操作。
在子宫炎生产基础培养基已在一个或多个发酵槽中灭菌且冷却之后,通过以表4中示出的速率添加过滤灭菌组分1和2而制备子宫炎完全生产培养基。此培养基的残余葡萄糖浓度应为14±2mm。在接种后大致10至12小时,当残余葡萄糖小于8mm且od600大于2.5(分别参考章节3.5.4和3.5.6)时添加egta和乳糖溶液。取决于采用批式或连续灌食策略,乳糖溶液以组分编号4a或4b形式添加。
表4子宫炎完全生产培养基
维生素储备溶液
制备维生素储备溶液所需的原料显示于表5中。组合的维生素k1和k2添加在烧瓶和发酵研究中均显示产率提高。这些尚未包含于当前维生素储备溶液中,因为需要另外的工作以调查此额外复杂度是否合理化。尚未知道维生素k1和k2中的一个或两个是有益的。维生素k1和k2为非水溶性的且溶解于dmso中以用于进行的实验。
表5维生素储备溶液(包括目标浓度)
更容易制备可在-20℃下冷冻且储存至多12个月的维生素的非无菌储备溶液。将冷蒸馏水的最终体积的约20%至30%添加至具有电磁搅拌器的玻璃烧杯、肖特瓶(schottbottle)或玻璃锥形瓶(或任何其它适合的容器)中。一次一个地称重每种组分且在剧烈搅拌下用冷蒸馏水冲洗至容器中。补足体积且确保所有成分完全溶解且接着分配为40ml非无菌等分试样且在-20℃(或必要时更冷)下冷冻。
维生素/血晶素溶液
有可能在不显著影响毒素产率的情况下对子宫炎生产基础培养基的氯化血晶素组分热灭菌20至30分钟。需要另外的工作以测定含有氯化血晶素的培养基是否可在不显著影响溶血素产率的情况下使用较高热负载热灭菌。这将是抗原制造设计以实现稳固性和建立全球疫苗平台的重要部分。举例来说,澳大利亚将仅接受热灭菌或γ-照射的氯化血晶素添加物(即在无附加药剂测试的情况下,澳大利亚监管当局将不接受过滤灭菌的氯化血晶素添加物)。但是,直到这已经以实验方式展示,过滤灭菌的维生素/血晶素溶液用作热杀菌之后的培养基添加剂。由于此溶液的短存放期,重要的是在接种一个或多个发酵槽当天制备此溶液。组合的血晶素和维生素溶液用于使发酵槽中的体积增加最小化(否则将需要40ml/l的氯化血晶素以及维生素溶液)。制备维生素/血晶素溶液所需的原料显示于表6中。
表6维生素/血晶素溶液(包括目标浓度)
维生素/血晶素溶液始终在需要的当天新制。解冻所需量的维生素储备溶液且通过振荡混合。氯化血晶素首先溶解于适当体积的1mnaoh中且当完全溶解时,添加至所需体积的非无菌维生素溶液中。这产生比通过添加的naoh的量总共需要略微较大的体积,但这1%增加为可忽略的。直到对基础培养基中的血晶素的热灭菌效应消退,此制备方法为令人满意的。如果决定保留过滤灭菌的血晶素/维生素溶液,那么这可通过以体积的95%制备维生素储备溶液且接着在血晶素添加之后补足体积而更精确地进行。对溶液过滤灭菌且在2至8℃下储存直到在制备当天准备好使用。
表750%葡萄糖溶液(包括目标浓度)
使具有电磁搅拌器的铝箔(或类似物)覆盖的玻璃烧杯中的蒸馏水的最终体积的约50%达到接近沸点。缓慢添加葡萄糖粉末且继续搅拌,同时在加热的情况下覆盖(避免溶液沸溢),直到完全溶解。补足体积,使其冷却且过滤灭菌。
表810%egta溶液,ph5.8(包括目标浓度)
添加egta至具有电磁搅拌器的玻璃烧杯中的冷蒸馏水的最终体积的约60%。在不断搅拌的情况下测量溶液的初始ph,所述溶液将在此阶段呈现为浆料。快速添加总30%w/vnaoh溶液的80%,所述溶液在完全溶解时需要具有5.8的目标ph。当几乎溶解时,缓慢添加达到目标ph以及实现完全溶解所需的30%w/vnaoh的其余部分。目标ph容易在制备的最后超限,因此在此时,使用1mnaoh用于最终调节可能更好。如果ph目标略微地超限,那么可用2mhci溶液(或类似物)将其调整回来。在精确调节至ph5.8之后,补足体积且过滤灭菌。
表950%乳糖溶液(包括目标浓度)
使具有电磁搅拌器的铝箔(或类似物)覆盖的玻璃烧杯中的蒸馏水的最终体积的约50%达到接近沸点。缓慢添加乳糖粉末且继续搅拌,同时在加热的情况下覆盖(避免溶液沸溢)直到完全溶解。补足体积,使其冷却且过滤灭菌。
表106%乳糖溶液(包括目标浓度)
添加乳糖粉末至具有电磁搅拌器的烧杯中的蒸馏水的最终体积的大致80%且混合直到完全溶解。补足体积且过滤灭菌。
发酵可扩展性
化脓隐秘杆菌发酵方法已在0.5、2、5和35l规模下成功地生长。通常,在发酵方法从实验室规模按比例扩大到中试规模时观测到最具挑战性的物理化学特性变化。然而,在通过所述方法按比例扩大至35l中试规模期间未观测到问题,表明从小实验室规模发酵槽自始至终的良好可扩展性。基于迄今为止观测的良好方法可扩展性,未预期按比例扩大至生产容器时的问题。
表11概括了测试的发酵槽的关键物理参数。
表11发酵槽物理参数
发酵策略
在接种之前,到目前为止测试的发酵槽的起始操作条件显示于表12中。
表12发酵槽初始操作参数
溶解氧控制和co2环境
从化脓隐秘杆菌产生最高产率的溶血素的当前策略是用0.5%活跃生长的ss2细胞在每个发酵槽中接种子宫炎完全生产培养基。初始生长以缓慢搅拌速率开始且按需求使用纯氧以在0.05vvm的最大流动速率下维持5%的溶解氧设定点。此策略背后的概念是允许细胞快速生长,但也使通过气泡从液相剥离的co2最小化。这是使用氧气而不是空气的原因。使用此策略的do探针故障发生的问题偶尔引起问题,因此实现0.05vvm的连续氧气流动速率直到氧化还原控制阶段可能同样良好。
氧化还原控制
氧化还原控制用作化脓隐秘杆菌的发酵策略的一部分的原因是精确维持最佳微需氧环境条件以使溶血素产率最大化。尽管并非技术上正确的,控制无法通过标准光学或极谱溶解氧探头测量的极低水准的溶解氧是一种方法。氧化还原控制也帮助驱动在微需氧和好氧培养两者中重要的分解代谢反应。氧化还原控制的优势为极大改进的方法稳固性,借此复合培养基组分(例如胰蛋白胨和酵母提取物)的批次间变化性通过系统自调谐至最佳氧化还原水准而最小化。在无氧化还原控制的系统中,在不佳批次的胰蛋白胨的情况下观测的较低细胞产率将导致引起降低的溶血素产率的次佳微需氧条件。氧化还原控制具有不管原料质量的较小变化而将发酵微需氧环境自动调节至最佳水准的能力。氧化还原控制的缺点为氧化还原探头无法校准,而是仅相对于标准溶液的理论值检验其输出。这些值也具有约±20mv的相当大的误差。
氧化还原控制无法在接种后立即使用,因为系统需要足够活跃生长的细胞来产生足够大的溶解气体环境以提供驱动低于控制设定点的氧化还原所需的“动量”。这是po2控制用于发酵的初始生长期的原因。
当前氧化还原控制策略设计为使用固定空气喷射速率下的搅拌器速度的变化来增加氧化还原,且降低空气喷射速率来减少氧化还原。致力于完全去除在最终gms发酵方法使用任何纯氧的需要而使用空气替代氧气。使用空气的缺点为使溶血素产率最大化的最佳溶解co2浓度可能在升高的气体起泡速率下不可能。
当前,算法用于控制氧化还原(参考附录2)。此类型的算法可在其复杂度水平和自调谐能力中改进,但是,如果作出氧化还原控制进展为最终制造方法的判断,那么更稳固替代方案为可用的。一种解决方案可为使适当发酵槽供应商定做与已安装用于po2控制类似的级联pid控制系统,借此控制也可通过搅拌器、空气和氧气喷射级联。或者,存在通过使电流穿过培养物而控制氧化还原的可用的定制氧化还原控制发酵槽。
co2控制
尚未测试用于控制co2的策略。但是,相信控制溶解co2浓度可帮助优化以及维持溶血素产率的一致性。在用mettlertoledoinpro5000i溶解co2探头原位测试氧化还原控制策略时,明显地观测到较高气体喷射流动速率对溶解co2浓度具有显著影响。搅拌器速度似乎对co2水准具有极小影响。
氧化还原控制算法也可用于控制溶解co2。互补算法编写可视需要增加或减少气体喷射流动速率以控制从溶解co2探头或其它co2测量装置(例如废气测量)的输出。这也可从独立质量流量控制器进行以使得氧化还原和co2控制彼此独立。已手动测试此概念且确实起作用,尽管需要一些努力以首先确定溶解co2浓度对于优化溶血素产率是否重要,且如果发现其重要,那么最佳控制水准是多少。
如果发现溶解co2在优化溶血素产率中重要,那么将可能使用纯氧喷射替代空气而更容易地控制最佳水准,因为通过所需的较低气体流动速率实现更精细控制。
蛋白酶抑制
当残余葡萄糖浓度低于8mm且od600大于2.5时,每升培养物应添加二十毫升10%egta溶液(ph5.8)。如果初始葡萄糖浓度在14±2mm的适当起始范围内,那么egta添加的时序为接种后约10至12小时。这是发酵策略的重要部分,且必须密切监视并且小心地进行。尽管egta螯合许多二价金属离子,其对于ca2+离子具有极高亲和力。egta添加至培养物的原因是抑制蛋白酶的活性(和可能地,蛋白酶的形成)。我们已展示钙为化脓隐秘杆菌培养物中的蛋白酶活性所牵连的主要金属。当额外钙添加至具有正常量的egta的烧瓶中时,溶血素浓度快速减少,但镁添加提高产率。
乳糖
在葡萄糖耗尽之前添加乳糖溶液以使得生长不停止是重要的,但采用的策略为在egta添加后将乳糖添加至培养物。其可在接种后添加至培养物,但其在egta添加后添加的唯一原因是实现精确残余葡萄糖监测以用于重要得多的egta添加步骤。如果有可能监测乳糖存在下的葡萄糖浓度,那么此方法可在对产率无任何有害影响的情况下容易地改变。
已使用分批和分批进料乳糖馈入进行若干研究。此时,不知道分批进料策略是否提供优于单一或多次批式添加乳糖的任何益处。批式添加已使用50%乳糖溶液添加进行。由于所需的极低进料速率,6%乳糖溶液已经用于分批进料发酵以使得能够在2l工作体积下使用蠕动泵。此方法的缺点为较高稀释效应。更浓缩溶液可使用精确性更高的泵送方法(例如注射泵)添加。或者,如果观测到使用分批进料策略的益处,那么其它养分和/或成分可添加至进料(例如胰蛋白胨、镁、氯化血晶素等)。
镁
使用各种镁源进行小烧瓶研究。比较无机硫酸镁与三种有机镁源(葡糖酸镁、柠檬酸镁和叶绿素)的等摩尔镁浓度。葡糖酸镁提供最高溶血素产率,然而,如果此原料难以找到来源,那么可容易地使用已可用的其它镁源进行优化研究。测试有机镁源背后的概念为egta应较不能够螯合相比于无机来源的弱离子键更紧密结合的镁。存在仅添加较高水准的无机镁可允许较大蛋白酶产量的担忧(尽管这可能无根据)由于镁为生长所需,随着镁添加观测的增加的细胞块应导致较高溶血素产率(如在此烧瓶研究中所观测)。
过程内分析方法
光学密度
通过在分光光度计中的600nm处测量的光学密度的变化测定细胞生长。当值超过0.5时,水一般用作稀释剂以确保样品维持在吸收率测量精确性的线性范围内。使用生产生长培养基提供精确性的略微提高,使得扣除背景吸收率。这一般被认为非必需的,因为其仅实际上影响培养生长期的早期阶段的结果。
残余葡萄糖
使用可商购的手持式血糖分析仪测量残余葡萄糖。在将测试条带插入至装置中且等待指示之后,约10至20μl的未过滤发酵培养物样品准备好置于测试条的尖端上且结果以毫摩尔/升提供。
残余乳糖
用于残余葡萄糖的相同分析仪也对于残余乳糖给出结果。提供的实际值不精确,但其仍使得能够监测相对残余乳糖水准,这对于发酵监测是令人满意的。但是,已观测到当使用此仪器的残余乳糖水准降至低于3mm时,生长显著减缓。对于批式以及分批进料乳糖馈入,有必要将残余乳糖浓度维持在大于3mm。
溶血素浓度
用于测量溶血素浓度的主要过程内分析技术为使用uplc的反相液相色谱。另一高度敏感技术为通过将任意溶血单位分配至粗标准物且接着通过参考此标准物测量其它样品而测量溶血素浓度的溶血分析。此分析极适用于测量溶血素类毒素样品种的不活化水准。由于其高敏感性,具有高浓度(高于约50μg/ml)的溶血素样品的稀释误差被放大,使得分析相当可变,除非极度小心。
纯度测试
培养物纯度可通过划线到绵羊或马血琼脂板(sba或hba)上而测试。在37℃下好氧地培育板48至96小时。在co2环境中培育增加生长速率。纯培养物将呈现为小的白色/乳白色、凸状、光亮菌落。板也可经培育,然而,化脓隐秘杆菌菌落也将在这些条件下生长(尽管更缓慢)。通过观测板上的其它菌落类型而鉴别污染。
收获和细胞去除
收获时间当前未明确界定,但在接种后约60至70小时,当溶血素浓度在稳定期晚期停止增加时开始。
已通过将培养物冷却至小于20℃,无菌收获且在4℃下在6,000×g的预灭菌离心机锅中离心15至30分钟而进行研究和开发规模的培养物收获和细胞去除。上清液接着无菌倾析至适合的无菌容器中且通过低蛋白质结合灭菌级过滤器过滤灭菌。乙酸纤维素膜由于其极低蛋白质结合特性而成为第一选择。sartoriussartobran过滤器一般与经选择以适合过滤的体积的适当过滤器膜区域一起使用。举例来说,500cm2sartoriussartobranp具有过滤至少5l培养物上清液的足够容量。这些过滤器具有0.45μm预过滤器和0.2μm灭菌过滤器,但上清液并非难以过滤,在此情况下其它供应商等效物应同样适合。
浓缩和透滤
已使用sartoriusalpha切向流过滤装置以非无菌方法形式进行产物浓缩,所述装置具有sartorius10kdahydrosart(改性乙酸纤维素)和10kdapes(聚醚砜)sartoconslice盒。hydrosart盒展示优于pes盒的性能,相比于pes的仅约70%回收率,hydrosart盒具有100%回收率。此结果是基于有限数目的加工运行,其中需要更严格实验测试以小心地比较膜性能。
在开始浓缩之前,在玻璃量筒中小心地测量初始上清液体积,分配至切向流过滤装置中且接着在渗透管线密闭的情况下通过循环10分钟而跨越一个或多个膜调节。在此初始安设之后,所有超过滤加工在进料、保留物和渗透物压力分别维持在1.5、0.5和0巴且产物温度维持在15±2℃的情况下进行。溶血素粗上清液一般浓缩约10倍且接着用50mmmes/500mmna2so4,ph5.8(纯化起始缓冲液)透滤4至5次。在浓缩和透滤步骤结束时,系统小心地排水以使产物发泡最小化,产物发泡可降低回收率。接着在玻璃量筒中测量产物体积以精确计算最终浓度。产物接着通过乙酸纤维素灭菌过滤器(一般为sartoriussartobran过滤器)过滤灭菌,且如果不立即纯化,那么等分试样为适合体积(通常100至250ml)且在-70℃下冷冻直到准备用于纯化。
实例3.用于增加溶血素的表达量的进一步改进。
在评估培养基中的各种原料之前,进行发酵参数的进一步改进。关于控制参数,确定对于实验室规模开发操作,使用o2喷射、在搅拌下限于0.1vvm,但在必要时增加以保持氧化还原设定点的氧化还原控制策略最佳。用于开发操作的氧化还原设定点为-447mv。将进行确立氧化还原(mv)范围的另外的操作,以及氧气和搅拌控制的潜在的其它方法。
就发酵控制参数而言,培养物的起始ph为7.2,且允许在发酵过程期间降至6.15的ph,其接着维持于所述ph。将进行确立ph控制范围和恒定ph控制的另外的操作。在初始发酵生长期期间,溶解氧(d.o.)维持于5%,其中氧气喷射限于0.1vvm;也限制搅拌。当培养物的目标光学密度(600nm)达到至少2.5时,向培养物馈入乳糖至30g/l的最终浓度,且馈入egta至2g/l的最终浓度。此时,控制从d.o.设定点转变为氧化还原控制程序,以用于继续生长和发酵的毒素生产阶段。毒素生产阶段再继续30-70小时,以在溶血素生产的峰值时间收获。
在这些改进的参数在适当位置的情况下,进行培养基中的各种原料的评估,以便确定现有的制造批准的来源是否将适合。在多个发酵运行之后,可得出将使用基于植物的聚山梨醇酯80而不是基于动物的聚山梨醇酯80的结论。也确定来源于bectondickinson的酵母提取物是优选的,其以5克/升的浓度滴定。也确定将使用oxoidtm胰蛋白胨。
维生素溶液预先添加至发酵培养物以增加内部制备的溶血素的产率。致力于简化发酵过程,认为购买可商购的维生素溶液将适用。选择来自sigma的预混合维生素溶液“rpmi1640”,因为其与内部维生素制剂最接近匹配。实验经设计以测试在2l发酵槽中使用rpmi1640维生素相对于内部维生素的溶血素产率。图1中示出的实验结果展示相比于内部维生素溶液,rpmi1640维生素溶液表现不佳。存在于内部维生素溶液中的四种组分未包含在rpmi1640维生素溶液中(β-nad、吡哆醛、尿嘧啶和烟碱酸)。由于尿嘧啶和烟碱酸显示为未在发酵期间耗尽(数据未示出),认为缺乏β-nad和/或吡哆醛最可能引起降低的性能。实验经设计以测试添加rpmi1640维生素的β-nad和/或吡哆醛补充可提高此维生素溶液的性能的假定。如图2中所示,溶血素产率在内部维生素溶液与补充的rpmi1640维生素溶液之间类似。另一实验经设计以测试β-nad和/或吡哆醛是否可能是补充培养基所需的仅有维生素组分。此实验的结果(图3)确认吡哆醛是补充至培养基中以增加溶血素的产率所需的唯一维生素。对于当吡哆醛添加至培养基时,其必须在热灭菌后以无菌溶液形式进行,但是,当对其高压灭菌时,尽管不影响培养物的o.d.(图4),但确实导致溶血素生产水准的降低(图5)。
就用于培养基中的血晶素而言,确定粉末状原料的照射似乎对培养物的o.d.或溶血素生产水准不具有直接影响,如图6和图7中所示。图8表明溶血素生产随着血晶素溶液的存放期增加而减小;因此,血晶素在热灭菌之前即刻添加。
除各种培养基组分以外,进行关于发生发酵的温度的另外的研究。先前,发酵在37℃下进行。但是,后续实验指示36℃的较低设定点(相对于较高温度)尽管对培养物的o.d.不具有显著影响(图9),但确实导致产生的溶血素的量的增加(图10)。接着提出关于甚至更低温度可能对溶血素生产水准具有什么影响的问题。这些实验的结果引出如下结论:尽管较低温度导致培养物的o.d.的减小(图11),它也导致产生的溶血素的水准的增加,其中当前最佳温度为32℃(图12)。关于在发酵方法期间将培养物的温度维持于32℃,或将其自37℃移动至32℃导致溶血素的较好产率,确定恒定温度比移动更好(图13)。
实例4.溶血素纯化过程的进一步改进。
通过使用10kda聚砜中空纤维筒,在溶血素的>95%回收率下进行澄清发酵收获物的浓缩。在浓缩后,将50mmmes、1.2mna2so4,ph5.8的溶液添加至浓缩物以达成0.425m硫酸钠的最终浓度。na2so4处理的材料在施用至色谱柱之前过滤。
溶血素经由使用苯基琼脂糖树脂的疏水相互作用色谱(hic)纯化,所述树脂用50mmmes、425mmna2so4,ph5.8平衡。溶血素以每升树脂1g溶血素至每升树脂12g溶血素的浓度负载至所述柱。其接着在50mmmes,ph5.8中洗脱,其中溶血素产率>80%。纯化的蛋白质接着经浓缩,随后缓冲液交换至磷酸缓冲液(钠或钾)中。接着测定溶血性活性以确保活性蛋白质已经纯化。这是通过用分析缓冲液连续稀释溶血素,接着用马红细胞在37℃下培育溶血素而进行。这接着经离心以使完整红细胞成团,将可溶(溶解)材料转移至新板,测量405nm处的o.d.,且标绘结果。在曲线的中点处测定溶血单位,且溶血素在溶血单位小于1000时视为解毒的。uplc和sds-page接着用于确认经分离蛋白质的标识。最后,溶血素通过用0.10%至0.5%(v/v)福尔马林在20℃下处理20-48h而不活化,且接着经无菌过滤。
通过考虑本文中公开的本发明的说明书和实践,本发明的其它实施例和用途将对所属领域的技术人员显而易见。本文中所引用的所有参考文献,包括所有公开案、美国和外国专利和专利申请明确且完全以引用的方式并入。希望本说明书和实例仅被视为例示性的,其中本发明的真实范围和精神由以下权利要求书来指定。
- 还没有人留言评论。精彩留言会获得点赞!