微生物的检查方法、微生物的检查试剂盒、微生物检查用微阵列、霉菌检测用载体、霉菌的检测方法、以及霉菌检测用试剂盒与流程
本发明涉及基于基因序列来确定生物的种类等的基因检查技术,特别涉及用于检测土壤传染性病害相关的植物病原菌的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列。
另外,本发明涉及用于检测作为植物病害的病原菌的霉菌的霉菌检测用载体、霉菌的检测方法、以及霉菌检测用试剂盒。
背景技术:
近年来,在食品检查、环境检查等中,为了确定存在于食品、环境中的霉菌、食物中毒菌等微生物的种类,使用pcr(聚合酶链式反应)法等核酸扩增法,扩增作为标靶的基因的dna,检测其扩增产物,判定微生物的种类。
另一方面,在存在于植物组织或土壤、水中的土壤传染性病害相关的植物病原菌中,存在有与食品检查、环境检查等中的检测对象菌属于不同界的物质,即使使用这些检测对象菌的引物进行pcr,也很难使土壤传染性病害菌的dna扩增。
另外,近年来,在食品制造现场或临床现场、农业现场、文化遗产保护环境等中,检查是否存在霉菌等微生物而确认安全性、健全性、并且防止其繁殖十分重要。
此种霉菌的检查中,一般实行如下的形态观察法(培养法),即,从环境中采集试样而进行预培养,然后在每一个菌种最佳的培养基中进行20天左右的培养后,观察形态的特征,由此来鉴定霉菌(参照专利文献3)。
然而,该方法中,由于需要对每一个霉菌种类进行分离培养,因此存在有检查工序变得烦杂的问题。另外,由于培养需要长时间,因此存在有不适于例如人所生活的室内的检查或食物的检查、农业现场的植物病害诊断等要求迅速性的检查的问题。此外,如果没有形成表示形态的特征的胞子,则无法鉴定,因而还存在有有时会白费力气的问题。
另外,最近,还在霉菌的检查中实行了使用基因的鉴定法。例如,在对从环境中采集的霉菌进行培养后,从所培养的霉菌中提取dna,利用pcr法等扩增靶区域,分析其扩增产物,由此来鉴定环境中的霉菌。作为分析扩增产物的方法,提出过利用电泳来分析扩增产物的尺寸的方法、使用固定化有与扩增产物互补地结合的探针的dna芯片的方法等(参照专利文献4、5)。
专利文献1:日本特开平10-234399号公报
专利文献2:日本专利第5522820号公报
专利文献3:日本特开2007-195454号公报
专利文献4:日本专利第5670623号公报
专利文献5:日本专利第5196848号公报
专利文献6:日本专利第5522820号公报
专利文献7:日本专利第5077984号公报
专利文献8:日本特开平10-234381号公报
技术实现要素:
发明所要解决的问题
在此,本发明人等在土壤传染性植物病原菌当中,特别选择了使白菜等发生根肿病的根肿菌(plasmodiophora)属菌、使葫芦科蔬菜等发生苗立枯病等的腐霉(pythium)属菌、使马铃薯等发生疫病的疫霉(phytophthora)属菌作为检测对象菌。
此后,本发明人等进行了深入研究,开发出可以将这些检测对象菌的dna中的β-微管蛋白基因作为靶区域合适地扩增的引物组、和可以将rdna基因(核糖体rna基因)its区作为靶区域合适地扩增的引物组,并且开发出具备能够确定各自的扩增产物的探针(dna芯片基板上的单链寡聚dna)的微阵列,成功地特异性地检测出这些病原菌。
在此,专利文献1中公开过用于简便、迅速并且高灵敏度地检测或鉴定腐霉属菌的寡聚核苷酸。另外,专利文献2中公开过能够检测疫霉属菌的草莓重要病害的病原菌检测方法及检测用引物。
然而,这些技术无法检测根肿菌属菌。另外,最好能够更加合适地分别特异性地同时检测根肿菌属菌、腐霉属菌、以及疫霉属菌。
另外,作为在霉菌的检查中使用了基因的鉴定法,在使用dna芯片的情况下,首先制成与检测对象的霉菌的dna中的靶区域特异性地结合的探针,并固定化于dna芯片中。此后,培养从环境或制品、植物的样品中采集的霉菌,提取霉菌的dna,利用pcr法等扩增霉菌的dna中的靶区域。继而,将该扩增产物滴加至dna芯片上,使扩增产物与探针杂交,测定扩增产物中所含的标记性荧光强度等,由此来检测霉菌。
但是,由于在环境中的检测对象的霉菌中存在有各种各样的种类,因此最好可以利用1个dna芯片同时检测多种霉菌。为此,需要在dna芯片上固定化选自多种霉菌中的探针。
另一方面,与探针杂交的靶区域的扩增产物是使用给定的引物组利用pcr法等得到,然而根据霉菌的种类不同,有容易仅在单一的靶区域中产生假阳性反应的霉菌,因此有时最好利用多个引物组同时地扩增多个靶区域。另外,如果不是独立地扩增所培养的霉菌的靶区域,而是同时地扩增多个种类的霉菌,利用固定化有选自这些的多个种类的霉菌中的探针的dna芯片进行霉菌的检测,检查的迅速性就会提高。
然而,在进行同时地扩增多个靶区域的多重扩增的情况下,对探针也要求以更高的精度发挥作用的探针。另外,如果增加同时地扩增的检测对象的霉菌的个数,则对探针要求的精度进一步提高。
本发明人等以作为植物病原菌的多犯性植物炭疽病菌(colletotrichumacutatum)、腐皮镰孢菌(fusariumsolani)、番茄早疫病菌(alternariasolani)、以及立枯丝核菌(rhizoctoniasolani)这4种作为检测对象的霉菌,为了制成能够检测它们的霉菌检测用载体而进行了深入研究。
如果在这些的多个种类的霉菌的各自的dna中的特定的靶区域当中,选择具有仅与各个霉菌特异性地结合的碱基序列、并且选择与其他种类的霉菌不结合的碱基序列制成探针,则理论上能够利用各探针分别特异性地检测这些的多个种类的霉菌。
但是,实际上即使是如此所述地得到的探针,也未必会有效地发挥作用。由此,为了制成各探针,需要通过在利用实验确认探针的效果的同时,反复进行试错,来找出有效地发挥作用的探针。
在此,用于检测多犯性植物炭疽病菌的引物记载于专利文献6中,用于检测腐皮镰孢菌的探针记载于专利文献7中,用于检测立枯丝核菌的引物及探针记载于专利文献8中。
然而,还不知道有固定化有能够分别精度高且特异性地同时检测多犯性植物炭疽病菌、腐皮镰孢菌、番茄早疫病菌、以及立枯丝核菌这4种霉菌的探针的霉菌检测用载体。
本发明是鉴于上述情况而完成的,其目的在于,提供能够合适地检测根肿菌属菌、腐霉属菌、以及疫霉属菌的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列。
另外,本发明的目的在于,提供能够迅速并且精度高地特异性地同时检测作为植物病原菌的多犯性植物炭疽病菌、腐皮镰孢菌、番茄早疫病菌、以及立枯丝核菌这4种霉菌的霉菌检测用载体、霉菌的检测方法、以及霉菌检测用试剂盒。
用于解决问题的方法
为了达成上述目的,本发明的微生物的检查方法采用了如下的方法,即,是从植物组织或土壤、水、或其他的环境中采集试样、从所述试样中所含的微生物组中提取dna、使用提取出的dna进行pcr、基于所得的扩增产物来判定所述试样中的微生物的有无的微生物的检查方法,使用以根肿菌属菌的dna中的β-微管蛋白基因作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第一引物组、和所述提取出的dna进行pcr,基于所得的扩增产物,来判定所述试样中的根肿菌属菌的有无,所述正向引物包含序列编号1~3所示的碱基序列的至少任意一个,所述反向引物包含序列编号4、5所示的碱基序列的至少任意一个。
另外,本发明的微生物的检查试剂盒采用了如下的构成,即,是为了从植物组织或土壤、水、或其他的环境中采集试样、从所述试样中所含的微生物组中提取dna、使用提取出的dna进行pcr、基于所得的扩增产物来判定所述试样中的微生物的有无而使用的微生物的检查试剂盒,含有以根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的β-微管蛋白基因作为利用pcr的扩增的标靶的由正向引物和反向引物组成的引物组,所述正向引物包含序列编号1~3所示的碱基序列的至少任意一个,所述反向引物包含序列编号4、5所示的碱基序列的至少任意一个。
此外,本发明的微生物检查用微阵列采用了如下的构成,即,是从植物组织或土壤、水、或其他的环境中采集试样、从所述试样中所含的微生物组中提取dna、使用提取出的dna进行pcr、基于所得的扩增产物来判定所述试样中的微生物的有无的微生物检查用微阵列,固定化有第一探针,所述第一探针与使用根肿菌属菌的dna、和以根肿菌属菌的dna中的β-微管蛋白基因作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第一引物组利用pcr得到的第一扩增产物互补地结合,包含序列编号12所示的碱基序列及其互补序列的至少任意一个,所述正向引物包含序列编号1~3所示的碱基序列的至少任意一个,所述反向引物包含序列编号4、5所示的碱基序列的至少任意一个。
另外,本发明的霉菌检测用载体采用了如下的霉菌检测用载体,其特征在于,固定化有选自具有以下的(a)、(b)、或(c)中记载的碱基序列的探针组中的两个以上的探针。
(a)具有序列编号101~106所示的碱基序列的探针。
(b)可以在严格的条件下与包含与序列编号101~106所示的碱基序列互补的碱基序列的核酸片段杂交的探针。
(c)具有与(a)或(b)的探针互补的碱基序列的探针。
另外,本发明的霉菌检测用载体优选采用如下的构成,即,固定化有分别选自:用于检测多犯性植物炭疽病菌(colletotrichumacutatum)的、包含具有选自its区的序列编号101所示的碱基序列的探针、以及具有选自β-微管蛋白基因中的序列编号102所示的碱基序列的探针的第一探针组;用于检测腐皮镰孢菌(fusariumsolani)的、包含具有选自its区的序列编号103所示的碱基序列的探针、以及具有选自β-微管蛋白基因中的序列编号104所示的碱基序列的探针的第二探针组;用于检测番茄早疫病菌(alternariasolani)的、包含具有选自its区的序列编号105所示的碱基序列的探针的第三探针组;以及用于检测立枯丝核菌(rhizoctoniasolani)的、包含具有选自its区的序列编号106所示的碱基序列的探针的第四探针组的各组中的探针。
另外,本发明的霉菌的检测方法采用了如下的方法,即,包括利用pcr使检测对象的霉菌的dna中的靶区域扩增、并确认扩增产物的有无的工序的霉菌的检测方法,在pcr用反应液中,含有由包含序列编号107所示的碱基序列的正向引物和包含序列编号108所示的碱基序列的反向引物组成的用于使its区扩增的引物组、以及由包含序列编号109所示的碱基序列的正向引物和包含序列编号110所示的碱基序列的反向引物组成的用于使β-微管蛋白基因扩增的引物组、和试样,在所述试样中含有多犯性植物炭疽病菌(colletotrichumacutatum)、腐皮镰孢菌(fusariumsolani)、番茄早疫病菌(alternariasolani)、以及立枯丝核菌(rhizoctoniasolani)的至少任意一个的dna的情况下,使用所述pcr用反应液,使所述试样中所含的dna中的靶区域扩增,将所得的扩增产物滴加到上述的霉菌检测用载体上,使之与具有互补的碱基序列的探针结合。
另外,本发明的霉菌检测用试剂盒采用了如下的构成,即,是包含用于使检测对象的霉菌的dna中的靶区域扩增的引物组、固定有用于确认扩增产物的有无的探针的载体的霉菌检测用试剂盒,所述引物组包含由包含序列编号107所示的碱基序列的正向引物和包含序列编号108所示的碱基序列的反向引物组成的用于使its区扩增的引物组、以及由包含序列编号109所示的碱基序列的正向引物和包含序列编号110所示的碱基序列的反向引物组成的用于使β-微管蛋白基因扩增的引物组,所述载体固定化有分别选自:用于检测多犯性植物炭疽病菌(colletotrichumacutatum)的、包含具有选自its区的序列编号101所示的碱基序列的探针、以及具有选自β-微管蛋白基因中的序列编号102所示的碱基序列的探针的第一探针组;用于检测腐皮镰孢菌(fusariumsolani)的、包含具有选自its区的序列编号103所示的碱基序列的探针、以及具有选自β-微管蛋白基因中的序列编号104所示的碱基序列的探针的第二探针组;用于检测番茄早疫病菌(alternariasolani)的、包含具有选自its区的序列编号105所示的碱基序列的探针的第三探针组;以及用于检测立枯丝核菌(rhizoctoniasolani)的、包含具有选自its区的序列编号106所示的碱基序列的探针的第四探针组的各组中的探针。
需要说明的是,在本说明书及技术方案的范围中,“探针组”是指探针的集合,不是仅指包含多个探针的情况,而是包括包含一个探针的情况在内地称作探针组。
发明效果
根据本发明,可以恰当地检测根肿菌属菌、腐霉属菌、以及疫霉属菌。
另外,根据本发明,可以迅速并且精度高地特异性地同时检测作为植物病原菌的多犯性植物炭疽病菌、腐皮镰孢菌、番茄早疫病菌、以及立枯丝核菌。
附图说明
图1是表示本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列中所用的引物的碱基序列的图。
图2是表示本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列中所用的以β-微管蛋白基因作为标靶的探针的碱基序列的图。
图3是表示使用本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的结果(试验1)的图。
图4是表示使用本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的结果(试验2)的图。
图5是表示使用本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的结果(试验3)的图。
图6是表示使用本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列同时检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的结果(试验4)的图。
图7是表示使用本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列同时进行根肿菌属菌、腐霉属菌、以及疫霉属菌等的结果(试验5)的图。
图8是表示本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列中所用的以rdna基因its区作为标靶的探针的碱基序列的图。
图9是表示使用本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列检测根肿菌属菌、腐霉属菌、以及疫霉属菌的结果(试验6)的图。
图10是表示使用本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列同时检测根肿菌属菌、和腐霉属菌或疫霉属菌的结果(试验7)的图。
图11是表示固定化于本发明的实施方式的霉菌检测用载体中的探针的碱基序列的图。
图12是表示用于使利用本发明的实施方式的霉菌检测用载体检测的对象的霉菌的靶区域扩增的引物的碱基序列的图。
图13是表示针对固定化于本发明的实施方式的霉菌检测用载体中的探针检测的荧光强度(s/n比值)的图。
具体实施方式
以下,对本发明的实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列进行详细说明。
本实施方式的微生物的检查方法的特征在于,是从植物组织或土壤、水、或其他的环境中采集试样、从试样中所含的微生物组中提取dna、使用提取出的dna进行pcr、基于所得的扩增产物来判定试样中的微生物的有无的微生物的检查方法,使用以根肿菌属菌的dna中的β-微管蛋白基因作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第一引物组、和提取出的dna进行pcr,基于所得扩增产物,判定试样中的根肿菌属菌的有无,所述正向引物包含序列编号1~3所示的碱基序列的至少任意一个,所述反向引物包含序列编号4、5所示的碱基序列的至少任意一个。
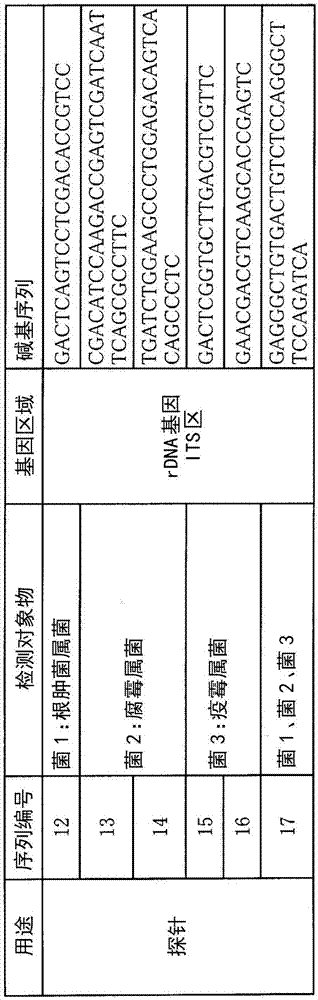
另外,本实施方式的微生物的检查方法的特征在于,使第一扩增产物与固定化有第一探针的微阵列接触,检测与第一探针互补地结合了的第一扩增产物的标记,所述第一探针与使用根肿菌属菌的dna和第一引物组利用pcr得到的第一扩增产物互补地结合,包含序列编号12所示的碱基序列及其互补序列的至少任意一个。
根肿菌属菌是土壤传染性植物病原菌,寄生于白菜、卷心菜类等十字花科蔬菜等中,引起根肿病。是仅寄生于活的植物细胞中而引起疾病的绝对寄生菌。
本说明书中,碱基序列全都是沿从5’末端到3’末端方向来理解的碱基序列。
根据本实施方式的微生物的检查方法,通过使用上述的第一引物组进行pcr,可以使此种根肿菌属菌的dna中的β-微管蛋白基因恰当地扩增。
另外,通过使用上述的固定化有第一探针的微阵列,可以特异性地检测根肿菌属菌。
另外,本实施方式的微生物的检查方法的特征在于,以根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的β-微管蛋白基因作为利用pcr的扩增的标靶,使用第一引物组和提取出的dna进行pcr,基于所得的扩增产物,同时地判定试样中的根肿菌属菌、腐霉属菌、以及疫霉属菌的有无。
另外,本实施方式的微生物的检查方法的特征在于,使第二扩增产物与固定化有第二探针的微阵列接触,检测与第二探针互补地结合了的第二扩增产物的标记,所述第二探针与使用腐霉属菌的dna和第一引物组利用pcr得到的第二扩增产物互补地结合,包含序列编号13或14所示的碱基序列及它们的互补序列的至少任意一个。
腐霉属菌是多犯性的土壤传染性植物病原菌,对于以葫芦科蔬菜、茄科蔬菜等为首的很多蔬菜类引起苗立枯病、腐败病等。
此外,本实施方式的微生物的检查方法的特征在于,使第三扩增产物与固定化有第三探针的微阵列接触,检测与第三探针互补地结合了的第三扩增产物的标记,所述第三探针与使用疫霉属菌的dna和第一引物组利用pcr得到的第三扩增产物互补地结合,包含序列编号15或16所示的碱基序列的至少任意一个。
疫霉属菌是在土壤中或植物体内生长的植物病原菌,19世纪的中叶在欧洲引起马铃薯饥荒的致病疫霉(フィトフトラ·インフェスタンス)十分有名。
根据本实施方式的微生物的检查方法,通过使用上述的第一引物组进行pcr,可以使此种腐霉属菌和疫霉属菌的dna中的β-微管蛋白基因恰当地扩增。
另外,通过使用上述的固定化有第二探针的微阵列,可以特异性地检测腐霉属菌,通过使用上述的固定化有第三探针的微阵列,可以特异性地检测疫霉属菌。
另外,根据本实施方式的微生物的检查方法,通过使用上述的第一引物组进行pcr,可以使根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的β-微管蛋白基因恰当地扩增,通过使用固定化有第一探针、第二探针、以及第三探针的微阵列,可以分别特异性地同时检测这些微生物。
此外,本实施方式的微生物的检查方法的特征在于,使第四扩增产物与固定化有第四探针的微阵列接触,检测与第四探针互补地结合了的第四扩增产物的标记,所述第四探针与使用根肿菌属菌、腐霉属菌、疫霉属菌、以及其他的微生物的至少任意一个的dna和第一引物组利用pcr得到的第四扩增产物互补地结合,包含序列编号17所示的碱基序列及其互补序列的至少任意一个。
根据本实施方式的微生物的检查方法,通过使用上述的固定化有第四探针的微阵列,可以检测根肿菌属菌、腐霉属菌、疫霉属菌、以及例如杂色曲霉(アスペルギルス·バージカラー)等其他的微生物。
需要说明的是,其他的微生物并不限定于杂色曲霉,也可以将上述的固定化有第四探针的微阵列作为真菌共通用途来利用。
此外,本实施方式的微生物的检查方法的特征在于,使用以根肿菌属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第二引物组、和提取出的dna进行pcr,基于所得的扩增产物,判定试样中的根肿菌属菌的有无,所述正向引物包含序列编号6所示的碱基序列,所述反向引物包含序列编号9所示的碱基序列。
另外,本实施方式的微生物的检查方法的特征在于,使第五扩增产物与固定化有第五探针的微阵列接触,检测与第五探针互补地结合了的第五扩增产物的标记,所述第五探针与使用根肿菌属菌的dna和第二引物组利用pcr得到的第五扩增产物互补地结合,包含序列编号18所示的碱基序列及其互补序列的至少任意一个。
根据本实施方式的微生物的检查方法,通过使用上述的第二引物组进行pcr,可以使根肿菌属菌的dna中的rdna基因its区恰当地扩增。
另外,通过使用上述的固定化有第五探针的微阵列,可以特异性地检测根肿菌属菌。
另外,本实施方式的微生物的检查方法的特征在于,使用以腐霉属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第三引物组、和提取出的dna进行pcr,基于所得的扩增产物,判定试样中的腐霉属菌的有无,所述正向引物包含序列编号7或8所示的碱基序列的至少任意一个,所述反向引物包含序列编号10所示的碱基序列。
另外,本实施方式的微生物的检查方法的特征在于,使第六扩增产物与固定化有第六探针的微阵列接触,检测与第六探针互补地结合了的第六扩增产物的标记,所述第六探针与使用腐霉属菌的dna和第三引物组利用pcr得到的第六扩增产物互补地结合,包含序列编号19所示的碱基序列及其互补序列的至少任意一个。
根据本实施方式的微生物的检查方法,通过使用上述的第三引物组进行pcr,可以使腐霉属菌的dna中的rdna基因its区恰当地扩增。
另外,通过使用上述的固定化有第六探针的微阵列,可以特异性地检测腐霉属菌。
另外,根据本实施方式的微生物的检查方法,通过使用第二引物组和第三引物组进行pcr,可以使根肿菌属菌和腐霉属菌的dna中的rdna基因its区恰当地扩增,通过使用固定化有第五探针和第六探针的微阵列,可以分别特异性地同时检测根肿菌属菌和腐霉属菌。
另外,本实施方式的微生物的检查方法的特征在于,使用以腐霉属菌或疫霉属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第四引物组、和提取出的dna进行pcr,基于所得的扩增产物,判定试样中的腐霉属菌或疫霉属菌的有无,所述正向引物包含序列编号8所示的碱基序列,所述反向引物包含序列编号11所示的碱基序列。
另外,本实施方式的微生物的检查方法的特征在于,使第七扩增产物与固定化有第七探针的微阵列接触,检测与第七探针互补地结合了的第七扩增产物的标记,所述第七探针与使用腐霉属菌或疫霉属菌的dna和第四引物组利用pcr得到的第七扩增产物互补地结合,包含序列编号20或21所示的碱基序列及它们的互补序列的至少任意一个。
根据本实施方式的微生物的检查方法,通过使用上述的第四引物组进行pcr,可以使腐霉属菌和疫霉属菌的dna中的rdna基因its区恰当地扩增。
另外,通过使用上述的固定化有第七探针的微阵列,可以检测腐霉属菌和疫霉属菌。
在此,在本实施方式的微生物的检查方法中,在作为引物组没有使用以β-微管蛋白基因作为标靶的第一引物组、而使用以rdna基因its区作为标靶的引物组的情况下,通过组合使用第三引物组(序列编号7、8、10)和第四引物组(序列编号8、11),并且使用固定化有第六探针(序列编号19+互补序列)和第七探针(序列编号20、21+互补序列)的微阵列,可以对于腐霉属菌和疫霉属菌的检测如下所示地进行判定。
首先,在对于第六探针和第七探针双方检测到扩增产物的标记的情况下,可知存在有腐霉属菌,疫霉属菌的存在与否不明。另外,在对于第六探针没有检测到扩增产物的标记、对于第七探针检测到扩增产物的标记的情况下,可知不存在腐霉属菌,存在有疫霉属菌。另外,在对于第六探针和第七探针双方没有检测到扩增产物的标记的情况下,可知腐霉属菌和疫霉属菌均不存在。
需要说明的是,在本实施方式的微生物的检查方法中,如上所述,在作为引物组使用以β-微管蛋白基因作为标靶的第一引物组的情况下,通过使用固定化有第一探针(序列编号12+互补序列)、第二探针(序列编号13、14+互补序列)、以及第三探针(序列编号15、16)的微阵列,可以分别特异性地同时检测根肿菌属菌、腐霉属菌、以及疫霉属菌。
本实施方式的微生物的检查试剂盒的特征在于,是为了从植物组织或土壤、水、或其他的环境中采集试样、从试样中所含的微生物组中提取dna、使用提取出的dna进行pcr、基于所得的扩增产物判定试样中的微生物的有无而使用的微生物的检查试剂盒,包含以根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的β-微管蛋白基因作为利用pcr的扩增的标靶的由正向引物和反向引物组成的引物组,所述正向引物包含序列编号1~3所示的碱基序列的至少任意一个,所述反向引物包含序列编号4、5所示的碱基序列的至少任意一个。
根据本实施方式的微生物的检查试剂盒,通过使用此种引物组进行pcr,可以使根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的β-微管蛋白基因恰当地扩增。
另外,本实施方式的微生物的检查试剂盒的特征在于,包含以根肿菌属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的引物组,所述正向引物包含序列编号6所示的碱基序列,所述反向引物包含序列编号9所示的碱基序列。
根据本实施方式的微生物的检查试剂盒,通过使用此种引物组进行pcr,可以使根肿菌属的dna中的rdna基因its区恰当地扩增。
另外,根据本实施方式的微生物的检查试剂盒,通过使用上述各引物组进行pcr,可以使根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的β-微管蛋白基因、和根肿菌属的dna中的rdna基因its区分别恰当地同时扩增。
另外,本实施方式的微生物的检查试剂盒的特征在于,包含以腐霉属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的引物组,所述正向引物包含序列编号7或8所示的碱基序列的至少任意一个,所述反向引物包含序列编号10所示的碱基序列。
根据本实施方式的微生物的检查试剂盒,通过使用此种引物组进行pcr,可以使腐霉属菌的dna中的rdna基因its区恰当地扩增。
另外,根据本实施方式的微生物的检查试剂盒,通过使用上述各引物组进行pcr,可以使根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的β-微管蛋白基因、和根肿菌属、以及腐霉属菌的dna中的rdna基因its区分别恰当地同时扩增。
另外,本实施方式的微生物的检查试剂盒的特征在于,包含以腐霉属菌或疫霉属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的引物组,所述正向引物包含序列编号8所示的碱基序列,所述反向引物包含序列编号11所示的碱基序列。
根据本实施方式的微生物的检查试剂盒,通过使用此种引物组进行pcr,可以使腐霉属菌和疫霉属菌的dna中的rdna基因its区恰当地扩增。
另外,根据本实施方式的微生物的检查试剂盒,通过使用上述各引物组进行pcr,可以使根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的β-微管蛋白基因、和根肿菌属菌、腐霉属菌、以及疫霉属菌的dna中的rdna基因its区分别恰当地同时扩增。
在使用本实施方式的微生物的检查方法、以及微生物的检查试剂盒时,从试样中提取dna的方法没有特别限定,例如可以如下所示地进行。
首先,采集微生物的菌落,利用液氮等冷冻菌落,使菌落中所含的微生物的细胞破碎。然后,从所得的微生物的细胞的破碎物中提取基因组dna。可以利用基于ctab法(cetyltrimethylammoniumbromide)的方法、使用dna提取装置的方法等一般的方法来进行基因组dna的提取。另外,也可以从土壤中直接提取霉菌的dna。该情况下,也是可以利用基于直接溶菌法(directlysismethod)的方法、使用土壤dna提取试剂盒的方法等一般的方法来进行dna的提取。
然后,使所提取的基因组dna中的靶区域扩增。即,使基因组dna中的包含靶区域的dna片段扩增。作为该靶区域的扩增方法,可以合适地使用pcr法。作为pcr装置,可以使用一般的热循环仪等。
作为pcr用反应液,例如可以使用包含以下的组成的反应液。即,可以合适地使用包含核酸合成基质(dntpmixture(dctp、datp、dttp、dgtp))、引物组、核酸合成酶(extaqhotstartdnapolymerase等)、荧光标记试剂(cy5-dctp等)、试样的dna、缓冲液、以及作为剩余的成分的水的pcr反应液。需要说明的是,作为缓冲液,例如可以使用ampdirect(r)(株式会社岛津制作所制)。
在使用本实施方式的微生物的检查方法、以及微生物的检查试剂盒时,例如可以通过在如下所示的反应条件下进行pcr,而使各微生物的靶区域恰当地扩增。
(a)95℃10分钟、(b)95℃(dna变性工序)30秒、(c)56℃(退火工序)30秒、(d)72℃(dna合成工序)60秒((b)~(d)循环40次)、(e)72℃10分钟
另外,在本实施方式及实施例中,引物及探针并不限定于各个碱基序列本身,可以使用在各个碱基序列中缺失、置换或附加了1个或数个碱基的碱基序列。另外,也可以使用包含能够在严格的条件下与包含与各个碱基序列互补的碱基序列的核酸片段杂交的核酸片段的碱基序列。
需要说明的是,所谓严格的条件,是指形成特异的杂交物、而不形成非特异的杂交物的条件。例如,可以举出相对于包含各个碱基序列的dna具有高相同性(相同性为90%以上、优选为95%以上)的dna与包含与各个碱基序列的dna互补的碱基序列的dna进行杂交的条件。通常而言,是指在比完全杂交物的溶解温度(tm)低约5℃~约30℃、优选低约10℃~约25℃低的温度发生杂交的情况。对于严格的条件,可以使用j.sambrook等人在molecularcloning,alaboratorymannual、secondedition、coldspringharborlaboratorypress(1989)、特别是11.45节“conditionsforhybridizationofoligonucleotideprobes”中记载的条件等。
本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列中所用的引物及探针均为16~40mer(碱基)左右的长度,可以利用dna合成装置来合成。
本实施方式的微生物检查用微阵列的特征在于,是从植物组织或土壤、水、或其他的环境中采集试样、从试样中所含的微生物组中提取dna、使用提取出的dna进行pcr、基于所得的扩增产物来判定试样中的微生物的有无的微生物检查用微阵列,固定化有第一探针,所述第一探针与使用根肿菌属菌的dna、以及以根肿菌属菌的dna中的β-微管蛋白基因作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第一引物组利用pcr得到的第一扩增产物互补地结合,包含序列编号12所示的碱基序列及其互补序列的至少任意一个,所述正向引物包含序列编号1~3所示的碱基序列的至少任意一个,所述反向引物包含序列编号4、5所示的碱基序列的至少任意一个。
根据本实施方式的微生物检查用微阵列,通过使用上述的固定化有第一探针的微阵列,可以特异性地检测根肿菌属菌。
另外,本实施方式的微生物检查用微阵列的特征在于,固定化有第二探针,所述第二探针与使用腐霉属菌的dna、和第一引物组利用pcr得到的第二扩增产物互补地结合,包含序列编号13或14所示的碱基序列及它们的互补序列的至少任意一个。
根据本实施方式的微生物检查用微阵列,通过使用上述的固定化有第二探针的微阵列,可以特异性地检测腐霉属菌。
另外,根据本实施方式的微生物检查用微阵列,通过使用固定化有第一探针和第二探针的微阵列,可以分别特异性地同时检测根肿菌属菌和腐霉属菌。
另外,本实施方式的微生物检查用微阵列的特征在于,固定化有第三探针,所述第三探针与使用疫霉属菌的dna、和第一引物组利用pcr得到的第三扩增产物互补地结合,包含序列编号15或16所示的碱基序列的至少任意一个。
根据本实施方式的微生物检查用微阵列,通过使用上述的固定化有第三探针的微阵列,可以特异性地检测疫霉属菌。
另外,根据本实施方式的微生物检查用微阵列,通过使用固定化有第一探针、第二探针、以及第三探针的微阵列,可以分别特异性地同时检测根肿菌属菌、腐霉属菌、以及疫霉属菌。
此外,本实施方式的微生物检查用微阵列的特征在于,固定化有第四探针,所述第四探针与使用根肿菌属菌、腐霉属菌、疫霉属菌、以及其他的微生物的至少任意一种的dna、和第一引物组利用pcr得到的第四扩增产物互补地结合,包含序列编号17所示的碱基序列及其互补序列的至少任意一个。
根据本实施方式的微生物检查用微阵列,通过使用上述的固定化有第四探针的微阵列,可以检测根肿菌属菌、腐霉属菌、疫霉属菌、以及例如杂色曲霉等其他的微生物。
另外,本实施方式的微生物检查用微阵列的特征在于,固定化有第五探针,所述第五探针与使用根肿菌属菌的dna、以及以根肿菌属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第二引物组利用pcr得到的第五扩增产物互补地结合,包含序列编号18所示的碱基序列及其互补序列的至少任意一个,所述正向引物包含序列编号6所示的碱基序列,所述反向引物包含序列编号9所示的碱基序列。
根据本实施方式的微生物检查用微阵列,通过使用上述的固定化有第五探针的微阵列,可以特异性地检测根肿菌属菌。
另外,本实施方式的微生物检查用微阵列的特征在于,固定化有第六探针,所述第六探针与使用腐霉属菌的dna、以及以腐霉属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第三引物组利用pcr得到的第六扩增产物互补地结合,包含序列编号19所示的碱基序列及其互补序列的至少任意一个,所述正向引物包含序列编号7或8所示的碱基序列的至少任意一个,所述反向引物包含序列编号10所示的碱基序列。
根据本实施方式的微生物检查用微阵列,通过使用上述的固定化有第六探针的微阵列,可以特异性地检测腐霉属菌。
另外,根据本实施方式的微生物检查用微阵列,通过使用固定化有第五探针和第六探针的微阵列,可以分别特异性地同时检测根肿菌属菌和腐霉属菌。
此外,本实施方式的微生物检查用微阵列的特征在于,固定化有第七探针,所述第七探针与使用腐霉属菌或疫霉属菌的dna、以及以腐霉属菌或疫霉属菌的dna中的rdna基因its区作为利用pcr的扩增的标靶的由正向引物和反向引物组成的第四引物组利用pcr得到的第七扩增产物互补地结合,包含序列编号20或21所示的碱基序列及它们的互补序列的至少任意一个,所述正向引物包含序列编号8所示的碱基序列,所述反向引物包含序列编号11所示的碱基序列。
根据本实施方式的微生物检查用微阵列,通过使用上述的固定化有第七探针的微阵列,可以检测腐霉属菌和疫霉属菌。
本实施方式的微生物检查用微阵列只要是固定化有用于对检测对象的微生物进行检测的上述探针的至少1个的微阵列,就没有特别限定,例如可以使用点样型dna微阵列、合成型dna微阵列等。
例如,在作为本实施方式的微生物检查用微阵列制成粘贴型的dna芯片的情况下,可以通过利用dna点样机将探针固定化于玻璃基板上,形成与各探针对应的斑点而制成。另外,在制成合成型dna芯片的情况下,可以通过利用光刻技术在玻璃基板上合成具备上述序列的单链寡聚dna而制成。此外,基板并不限定于玻璃制,也可以使用塑料基板或硅晶片等。另外,基板的形状并不限定于平板状的形状,也可以设为各种各样的立体形状的形状,也可以使用为了能够进行化学反应而向其表面导入了官能团的基板等。
然后,通过将扩增产物滴加到本实施方式的微生物检查用微阵列上,检测与固定化于该微生物检查用微阵列中的探针杂交了的扩增产物的标记,而确认扩增产物的有无。由此,就可以确定检查对象的微生物。
可以使用荧光扫描装置等一般的标记检测装置来进行标记的检测,例如可以通过使用东洋钢钣株式会社的bioshot(r)测定扩增产物的荧光强度来进行。测定结果优选作为s/n比值(signaltonoiseratio)值获得。s/n比值是利用(中值荧光强度值-背景值)÷背景值算出。需要说明的是,作为标记并不限定于荧光,也可以使用其他的标记。
如上说明所示,根据本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列,可以恰当地检测根肿菌属菌、腐霉属菌、以及疫霉属菌。
以下,对本发明的霉菌检测用载体、霉菌的检测方法、以及霉菌检测用试剂盒的一个实施方式进行详细说明。但是,本发明并不限定于以下的本实施方式及后述的实施例的具体的内容。
[霉菌检测用载体]
本实施方式的霉菌检测用载体只要是在基板上固定化有用于检测图11所示的特定的霉菌的探针(序列编号101~106)的至少任意一个的载体,就没有特别限定。该霉菌检测用载体例如可以作为点样型或合成型的dna芯片或dna微阵列等来制造。
(检测对象霉菌)
利用本实施方式的霉菌检测用载体检测的对象的霉菌为多犯性植物炭疽病菌(colletotrichumacutatum)、腐皮镰孢菌(fusariumsolani)、番茄早疫病菌(alternariasolani)、以及立枯丝核菌(rhizoctoniasolani)4种。
通过使用本实施方式的霉菌检测用载体,确认在土壤中等是否存在这些霉菌,就可以在植物的培育时预防由这些病原菌造成的植物的疾病。另外,通过确认在土壤中不存在这些霉菌,也可以防止例如过多的农药播撒等。
(探针)
本实施方式的用于检测对象霉菌的探针是包含由序列编号101~106分别确定的碱基序列的核酸片段。需要说明的是,本说明书中,序列编号22~100缺号。
其中,具有序列编号101所示的碱基序列的探针是用于检测多犯性植物炭疽病菌的、选自its区的探针。另外,具有序列编号102所示的碱基序列的探针是用于检测多犯性植物炭疽病菌的、选自β-微管蛋白基因中的探针。
另外,具有序列编号103所示的碱基序列的探针是用于检测腐皮镰孢菌的、选自its区的探针。另外,具有序列编号104所示的碱基序列的探针是用于检测腐皮镰孢菌的、选自β-微管蛋白基因中的探针。
另外,具有序列编号105所示的碱基序列的探针是用于检测番茄早疫病菌的、选自its区的探针。另外,具有序列编号106所示的碱基序列的探针是用于检测立枯丝核菌的、选自its区的探针。
本实施方式的霉菌检测用载体中,如上所述,作为探针,使用了选自霉菌的基因组dna中的its区和β微管蛋白基因中的探针。
its区是向rna转录后被剪接的部分。由此,与编码区相比保存性低,富于变化,而霉菌的种类间的类似性高,产生假阳性反应的情况较多。由此,在dna芯片中固定化多个种类的霉菌的探针而用于霉菌的识别的情况下,根据霉菌的种类不同,如果仅使用选自its区的探针,有时会导致检测精度的降低。另一方面,在β-微管蛋白基因中,对于每种霉菌存在较多独特的序列。因而,本实施方式的霉菌检测用载体中,通过根据霉菌的种类,将its区和β-微管蛋白基因双方作为靶区域使用,就可以减少假阳性反应。
具体而言,对于腐皮镰孢菌,优选使用选自its区及β-微管蛋白基因中的探针双方,仅在这两者中获得阳性反应的情况下判定为检测到该霉菌。对于该霉菌,通过如此设置,就可以减少基于假阳性反应的错误判断的风险。
另一方面,对于多犯性植物炭疽病菌,在至少选自its区或β-微管蛋白基因中的探针的任意一方获得阳性反应的情况下,判定为该霉菌存在。
另外,对于番茄早疫病菌和立枯丝核菌,在仅选自its区的探针中获得阳性反应的情况下,判定为该霉菌存在。这些霉菌的选自its区的探针的特异性高、比较难以产生假阳性反应,因此对于这些霉菌,可以使用仅选自its区的探针进行检测。
因而,本实施方式的霉菌检测用载体优选对于腐皮镰孢菌,将选自its区及β-微管蛋白基因中的探针一起固定化,在双方的探针显示出阳性的情况下,判定为检测对象的霉菌存在。另外,优选对于多犯性植物炭疽病菌,将选自its区及β-微管蛋白基因中的探针一起固定化,在任意一个探针显示出阳性的情况下,判定为检测对象的霉菌存在。对于番茄早疫病菌和立枯丝核菌,将仅选自its区的探针固定化,在该探针显示出阳性的情况下,判定为检测对象的霉菌存在。
(探针的合成)
固定化于本实施方式的霉菌检测用载体中的上述探针均为30~55碱基左右的长度,可以利用一般的dna合成装置合成。后述的实施例中固定化于霉菌检测用载体中的包含序列编号101~106所示的碱基序列的探针均使用了利用dna合成装置合成的探针。需要说明的是,后述的实施例中pcr中所用的包含序列编号107~110所示的碱基序列的引物也是19~26碱基左右的长度,使用了利用dna合成装置合成的引物。
另外,本实施方式的包含序列编号101~106所示的碱基序列的探针并不限定于该序列本身,可以使用在序列编号101~106所示的碱基序列中缺失、置换或附加了1个或多个碱基的探针。另外,也可以使用能够在严格的条件下与包含与序列编号101~106所示的碱基序列互补的碱基序列的核酸片段杂交的探针。另外,也可以使用相对于这些探针或包含序列编号101~106所示的碱基序列的探针具有互补的碱基序列的探针。
需要说明的是,对于图12所示的包含序列编号107~110的碱基序列的各引物(序列编号107及108的引物组、以及序列编号109及110的引物组中的各引物),也同样地并不限定于该序列本身,也可以使用在序列编号107~110所示的碱基序列中缺失、置换或附加了1个或多个碱基、且可以扩增与使用包含序列编号107~110所示的碱基序列的引物时相同的区域的引物。另外,也可以使用如下的引物,其包含能够相对于包含与具有序列编号107~110所示的碱基序列互补的碱基序列的核酸片段在严格的条件下杂交的核酸片段,且可以扩增与使用包含序列编号107~110所示的碱基序列的引物时相同的区域。
(霉菌检测用载体的制成)
本实施方式的霉菌检测用载体可以使用具有序列编号101~106所示的碱基序列的探针,利用现有的一般的方法来制造。
例如,在作为本实施方式的霉菌检测用载体制成粘贴型的dna芯片的情况下,可以通过利用dna点样机将探针固定化于玻璃基板上、形成与各探针对应的斑点而制成。另外,在制成合成型dna芯片的情况下,可以通过利用光刻技术在玻璃基板上合成具备上述序列的单链寡聚dna而制成。此外,基板并不限定于玻璃制,也可以使用塑料基板或硅晶片等。另外,基板的形状并不限定于平板状的形状,也可以设为各种各样的立体形状的形状,也可以使用为了能够进行化学反应而向其表面导入了官能团的基板等。
本实施方式的霉菌检测用载体可以采用固定化有具有序列编号101~106所示的碱基序列的探针的全部或一部分的载体。
另外,本实施方式的霉菌检测用载体可以采用对每个菌种固定化有至少1个用于检测各个菌种的探针的载体。
此外,本实施方式的霉菌检测用载体可以采用固定化有在序列编号101~106所示的碱基序列中缺失、置换或附加了1个或多个碱基的探针的全部或一部分的载体,也可以采用固定化有能够在严格的条件下与包含与序列编号101~106所示的碱基序列互补的碱基序列的核酸片段杂交的探针的全部或一部分的载体,还可以采用固定化有相对于这些探针或包含序列编号101~106所示的碱基序列的探针具有互补的碱基序列的探针的全部或一部分的载体。
[霉菌的检测方法]
本实施方式的霉菌的检测方法是包括使检测对象的霉菌的dna中的靶区域扩增、确认扩增产物的有无的工序的霉菌的检测方法,在pcr用反应液中含有由包含序列编号107所示的碱基序列的正向引物和包含序列编号108所示的碱基序列的反向引物组成的用于使its区扩增的引物组、以及由包含序列编号109所示的碱基序列的正向引物和包含序列编号110所示的碱基序列的反向引物组成的用于使β-微管蛋白基因扩增的引物组和试样、且在试样中含有多犯性植物炭疽病菌、腐皮镰孢菌、番茄早疫病菌、以及立枯丝核菌的至少任意一个的dna的情况下,只要是使用pcr用反应液使试样中所含的dna中的靶区域扩增、将所得的扩增产物滴加到霉菌检测用载体上而使之与具有互补的碱基序列的探针结合的方法即可,并不限定于具体的实施方式及实施例的构成,例如可以采用包括(1)霉菌的采集和dna的提取、(2)靶区域的扩增、以及(3)扩增产物的确认的方法。
(1)霉菌的采集和dna的提取
在霉菌的采集和dna的提取中,有各种方法,没有特别限定,例如可以采用如下的方法,即,采集培育植物的土壤,悬浮于适当量的水中,其后以任意的倍率进行阶段性稀释,将各个阶段性稀释液涂布于培养基上而培养后,从所培养的霉菌中提取dna。
另外,也可以采集土壤、从所采集的土壤中直接提取包含植物病原霉菌的土壤微生物(细菌、线虫等微生物)的dna。作为其方法,可以利用直接溶菌法(directlysismethod)、使用市售的土壤dna提取试剂盒等一般的方法来进行。
此外,也可以在从植物样品的患病组织等中采集病原霉菌并分离培养后提取dna。例如,使用剪刀等采集患病组织片,将所采集的植物组织片用次氯酸或乙醇进行表面杀菌后,放置于专用培养基等中,进行植物组织中所含的霉菌的培养。
另外,也可以用空气采样器将空中漂浮霉菌胞子采集于琼脂培养基中,培养后提取dna。
上述说明中,作为霉菌的培养中所用的培养基,也可以使用pda(土豆葡萄糖琼脂培养基、potatodextroseagar)之类的一般的培养基,另外在预先确定了捕集对象霉菌的情况下,也可以使用加入了抗生物质等的被称作所谓的选择培养基的培养基。另外,作为培养条件,优选在20℃~25℃在暗处静置65小时以上。
在进行霉菌的培养的情况下,然后,对所培养的霉菌的菌落依照每种菌落独立地进行采集或一次性采集两个以上的菌落,利用液氮等冷冻菌落,使菌落中所含的霉菌的细胞破碎。
此后,从如此所述地得到的霉菌的细胞的破碎物中提取基因组dna。可以利用基于ctab法(cetyltrimethylammoniumbromide)的方法、使用dna提取装置的方法等一般的方法来进行基因组dna的提取。
(2)靶区域的扩增
然后,使所提取的基因组dna中的靶区域扩增。即,使基因组dna中的包含靶区域的dna片段扩增。该靶区域的扩增方法没有特别限定,可以合适地使用pcr法。pcr法中,使用含有用于扩增靶区域的引物组的pcr反应液,使靶区域扩增。作为pcr装置,可以使用一般的热循环仪等。
本实施方式的霉菌的检测方法中,例如可以通过在如下所示的反应条件下进行pcr,而恰当地使各种霉菌的靶区域扩增。
(a)95℃10分钟、(b)95℃(dna变性工序)30秒、(c)56℃(退火工序)30秒、(d)72℃(dna合成工序)60秒((b)~(d)循环40次)、(e)72℃10分钟
作为pcr用反应液,例如优选使用包含以下的组成的反应液。即,可以合适地使用包含核酸合成基质(dntpmixture(dctp、datp、dttp、dgtp))、引物组、核酸合成酶(novataqhotstartdnapolymerase等)、荧光标记试剂(cy5-dctp等)、试样的基因组dna、缓冲液、以及作为剩余的成分的水的pcr反应液。需要说明的是,作为缓冲液,例如可以使用ampdirect(r)(株式会社岛津制作所制)。
本实施方式中,以霉菌的基因组dna中的its区和β微管蛋白基因作为靶区域,进行dna片段的扩增。
此时,作为用于使its区扩增的引物组,优选使用图12所示的包含序列编号107及108的碱基序列的引物组(序列编号107:正向引物、序列编号108:反向引物)。
另外,作为用于使β微管蛋白基因扩增的引物组,优选使用图12所示的包含序列编号109及110的碱基序列的引物组(序列编号109:正向引物、序列编号110:反向引物)。
(3)扩增产物的确认
然后,通过将扩增产物滴加到本实施方式的霉菌检测用载体上,检测与固定化于该霉菌检测用载体中的探针杂交了的扩增产物的标记,而确认扩增产物的有无。由此,就可以确定存在于检查对象中的霉菌。
标记的检测可以使用荧光扫描装置等一般的标记检测装置来进行,例如可以通过使用东洋钢钣株式会社的bioshot(r)测定扩增产物的荧光强度来进行。测定结果优选作为s/n比值(signaltonoiseratio)值获得。本说明书中记载的s/n比值是利用(中值荧光强度值-背景值)÷背景值算出。需要说明的是,作为标记并不限定于荧光,也可以使用其他的标记。
[霉菌检测用试剂盒]
在本实施方式的霉菌检测用试剂盒中,包含用于使检测对象的霉菌的dna中的靶区域扩增的引物组、和固定有用于确认扩增产物的有无的探针的霉菌检测用载体。
具体而言,作为引物组,包含由包含序列编号107所示的碱基序列的正向引物和包含序列编号108所示的碱基序列的反向引物组成的用于使its区扩增的引物组、以及由包含序列编号109所示的碱基序列的正向引物和包含序列编号110所示的碱基序列的反向引物组成的用于使β-微管蛋白基因扩增的引物组。
另外,作为霉菌检测用载体,可以合适地使用固定化有分别选自:用于检测多犯性植物炭疽病菌的、包含具有选自its区的序列编号101所示的碱基序列的探针、以及具有选自β-微管蛋白基因中的序列编号102所示的碱基序列的探针的第一探针组;用于检测腐皮镰孢菌的、包含具有选自its区的序列编号103所示的碱基序列的探针、以及具有选自β-微管蛋白基因中的序列编号104所示的碱基序列的探针的第二探针组;用于检测番茄早疫病菌的、包含具有选自its区的序列编号105所示的碱基序列的探针的第三探针组;以及用于检测立枯丝核菌的、包含具有选自its区的序列编号106所示的碱基序列的探针的第四探针组的各组中的探针的载体。
另外,也优选采用固定化有第一探针组、第一探针组、第一探针组、以及第一探针组的全部探针的载体。
此种本实施方式的霉菌检测用试剂盒是为了通过如下操作来检测霉菌而使用,即,将使用上述引物组扩增了的扩增产物滴加到该霉菌检测用载体上,使扩增产物与具有互补的碱基序列的探针结合。
根据本实施方式的霉菌检测用载体、霉菌的检测方法、以及霉菌检测用试剂盒,通过使用可以特异性地识别上述4种霉菌的探针,就可以恰当地检测这些霉菌。由此,在土壤环境检查等中,能够迅速并且精度高地特异性地同时检测作为植物病害的病原菌的这些霉菌。
[实施例]
(试验1)
利用本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列,使用以β-微管蛋白基因作为标靶的引物组及探针,进行了用于验证可否分别单独地检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的试验。
具体而言,使用由以β-微管蛋白基因作为标靶的包含序列编号1所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌(プラズモディオフォラ·ブラシカエ)、瓜果腐霉(ピシウム·アファニデルマタム)、致病疫霉(フィトフトラ·インフェスタンス)、以及杂色曲霉(アスペルギルス·バージカラー)的dna中的β-微管蛋白基因分别独立地利用pcr进行了扩增。
另外,使用由以β-微管蛋白基因作为标靶的包含序列编号1所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物的引物组,将根肿菌根肿病菌、终极腐霉(ピシウム·ウルティマム)、致病疫霉、以及杂色曲霉的dna中的β-微管蛋白基因分别独立地利用pcr进行了扩增。
此后,向分别固定化有包含序列编号12、序列编号13、序列编号15、以及序列编号17所示的碱基序列的探针的微阵列上,滴加上述的利用pcr的扩增产物,检测出扩增产物的荧光标记。
作为绝对寄生菌的根肿菌根肿病菌使用了从京都府立大学植物病理学研究室受让的根肿菌根肿病菌。腐霉属菌和疫霉属菌从nbrc(独立行政法人制品评价技术基础机构生物技术中心nitebiologicalresourcecenter)获取。也包括后述的试验在内,从该中心获取的菌株如下所示。
瓜果腐霉(pythiumaphanidermatum)nbrc7030
终极腐霉(pythiumultimum)nbrc100125
生姜腐霉(pythiumzingiberis)nbrc30818
致病疫霉(phytophthorainfestans)nbrc9174
作为pcr反应液,使用ampdirect(r)(株式会社岛津制作所制),使用了以下的组成的反应液。各引物使用了由operontechnologies株式会社合成的引物。
·ampdirect(g/crich)4.0μl
·ampdirect(addition-4)4.0μl
·dntpmixture(datp、dctp、dgtp、dttp各2.5mm)1.0μl
·cy-5dctp0.2μl
·extaqhotstartdnapolymerase(5u/μl)0.2μl
·正向引物(10μm)1.0μl
·反向引物(10μm)1.0μl
·试样的dna(100pg/μl)1.0μl
·水(加水至整体为20.0μl)
利用pcr法的基因的扩增是利用核酸扩增装置(takarapcrthermalcyclerdice(r)gradienttakarabio株式会社制)、在与实施方式中说明的条件相同的下面的条件下进行。
(a)95℃10分钟
(b)95℃30秒
(c)56℃30秒
(d)72℃60秒((b)~(d)循环40次)
(e)72℃10分钟
然后,向pcr扩增产物中混合缓冲液(3×ssc柠檬酸-生理盐水+0.3%sds),在94℃加热5分钟,滴加到上述微阵列上。将该微阵列在45℃静置1小时,使用上述缓冲液将没有杂交的pcr产物从微阵列中洗掉。
此后,使用标记检测装置(bioshot(r),东洋钢钣株式会社制),测定固定化于上述微阵列中的各探针中的荧光强度(与探针结合了的扩增产物的荧光强度),取得各探针中的s/n比值。将其结果表示于图3中。
图3中,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号12和17所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将瓜果腐霉和致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号13和17、序列编号15和17所示的碱基序列的探针结合,检测出标记。
此外,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,检测出标记。
同样地,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号12和17所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将终极腐霉和致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号13和17、序列编号15和17所示的碱基序列的探针结合,检测出标记。
此外,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,检测出标记。
(试验2)
利用本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列,使用以β-微管蛋白基因作为标靶的引物组及探针,进行了用于验证可否分别单独地检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的进一步试验。
具体而言,使用由以β-微管蛋白基因作为标靶的包含序列编号2所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、瓜果腐霉、致病疫霉、以及杂色曲霉的dna中的β-微管蛋白基因分别独立地利用pcr进行了扩增。
另外,使用由以β-微管蛋白基因作为标靶的包含序列编号2所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、生姜腐霉、致病疫霉、以及杂色曲霉的dna中的β-微管蛋白基因分别独立地利用pcr进行了扩增。
此后,向分别固定化有包含序列编号12、序列编号14、序列编号16、以及序列编号17所示的碱基序列的探针的微阵列上,滴加上述的利用pcr的扩增产物,检测出扩增产物的荧光标记。
pcr反应液、以及利用pcr法的基因的扩增为与试验1相同的组成以及在相同的条件下进行。
此后,与试验1相同地进行pcr扩增产物与探针的杂交,利用标记检测装置测定各探针中的荧光强度,取得s/n比值。将其结果表示于图4中。
图4中,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号12和17所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将瓜果腐霉和致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号14和17、序列编号16和17所示的碱基序列的探针结合,检测出标记。
此外,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,检测出标记。
同样地,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号12和17所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将生姜腐霉和致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号14和17、序列编号16和17所示的碱基序列的探针结合,检测出标记。
此外,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,检测出标记。
(试验3)
利用本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列,使用以β-微管蛋白基因作为标靶的引物组及探针,进行了用于验证可否分别单独地检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的进一步试验。
具体而言,使用由以β-微管蛋白基因作为标靶的包含序列编号3所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、生姜腐霉、致病疫霉、以及杂色曲霉的dna中的β-微管蛋白基因分别独立地利用pcr进行了扩增。
另外,使用由以β-微管蛋白基因作为标靶的包含序列编号3所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组,将这4种微生物的dna中的β-微管蛋白基因分别独立地利用pcr进行了扩增。
此后,向分别固定化有包含序列编号12、序列编号14、序列编号16、以及序列编号17所示的碱基序列的探针的微阵列上,滴加上述的利用pcr的扩增产物,检测出扩增产物的荧光标记。
pcr反应液、以及利用pcr法的基因的扩增为与试验1相同的组成以及在相同的条件下进行。
此后,与试验1相同地进行pcr扩增产物与探针的杂交,利用标记检测装置测定各探针中的荧光强度,取得了s/n比值。将其结果表示于图5中。
图5中,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号12和17所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将生姜腐霉和致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号14和17、序列编号16和17所示的碱基序列的探针结合,检测出标记。
此外,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,检测出标记。
同样地,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号12和17所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将生姜腐霉和致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号14和17、序列编号16和17所示的碱基序列的探针结合,检测出标记。
此外,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,检测出标记。
(试验4)
利用本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列,使用以β-微管蛋白基因作为标靶的引物组及探针,进行了用于验证可否同时检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的试验。
具体而言,使用由以β-微管蛋白基因作为标靶的包含序列编号1所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、瓜果腐霉、致病疫霉、以及杂色曲霉的dna中的β-微管蛋白基因使用一个pcr反应液利用pcr同时地进行了扩增。
另外,使用由以β-微管蛋白基因作为标靶的包含序列编号1所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、终极腐霉、致病疫霉、以及杂色曲霉的dna中的β-微管蛋白基因使用一个pcr反应液利用pcr同时进行了扩增。
此后,向分别固定化有包含序列编号12、序列编号13、序列编号15、以及序列编号17所示的碱基序列的探针的微阵列上,滴加上述的利用pcr的扩增产物,检测出扩增产物的荧光标记。
pcr反应液、以及利用pcr法的基因的扩增为与试验1相同的组成以及在相同的条件下进行。但是,pcr反应液使用了作为试样的dna每种霉菌包含1.0μl、合计包含4.0μl的反应液。
此后,与试验1相同地进行pcr扩增产物与探针的杂交,利用标记检测装置测定各探针中的荧光强度,取得了s/n比值。将其结果表示于图6中。
图6中,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌、瓜果腐霉、以及致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号12、13、15所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,有可能检测出标记。
同样地,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌、终极腐霉、以及致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号12、13、15所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号1所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,有可能检测出标记。
(试验5)
利用本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列,使用以β-微管蛋白基因作为标靶的引物组及探针,进一步进行了用于验证可否同时检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的试验。
具体而言,使用由以β-微管蛋白基因作为标靶的包含序列编号2所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、瓜果腐霉、致病疫霉、以及杂色曲霉的dna中的β-微管蛋白基因使用一个pcr反应液利用pcr同时进行了扩增。
另外,使用由以β-微管蛋白基因作为标靶的包含序列编号2所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、生姜腐霉、致病疫霉、以及杂色曲霉的dna中的β-微管蛋白基因使用一个pcr反应液利用pcr同时进行了扩增。
此外,使用由以β-微管蛋白基因作为标靶的包含序列编号3所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将这4种dna中的β-微管蛋白基因使用一个pcr反应液利用pcr同时进行了扩增。
另外,使用由以β-微管蛋白基因作为标靶的包含序列编号3所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将这4种微生物的dna中的β-微管蛋白基因使用一个pcr反应液利用pcr同时进行了扩增。
此后,向分别固定化有包含序列编号12、序列编号14、序列编号16、以及序列编号17所示的碱基序列的探针的微阵列上,滴加上述的利用pcr的扩增产物,检测出扩增产物的荧光标记。
pcr反应液、以及利用pcr法的基因的扩增为与试验1相同的组成以及在相同的条件下进行。但是,pcr反应液使用了作为试样的dna每种霉菌包含1.0μl、合计包含4.0μl的反应液。
此后,与试验1相同地进行pcr扩增产物与探针的杂交,利用标记检测装置测定各探针中的荧光强度,取得了s/n比值。将其结果表示于图7中。
图7中,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌、瓜果腐霉、以及致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号12、14、16所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,有可能检测出标记。
同样地,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌、生姜腐霉、以及致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号12、14、16所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号2所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,有可能检测出标记。
此外,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌、生姜腐霉、以及致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号12、14、16所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号4所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,有可能检测出标记。
同样地,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌、生姜腐霉、以及致病疫霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物分别与包含序列编号12、14、16所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号3所示的碱基序列的正向引物和包含序列编号5所示的碱基序列的反向引物组成的引物组、将杂色曲霉的dna中的β-微管蛋白基因利用pcr进行扩增而得的扩增产物与包含序列编号17所示的碱基序列的探针结合,有可能检测出标记。
(试验6)
利用本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列,使用以rdna基因its区作为标靶的引物组及探针,进行了用于验证可否分别单独地检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的试验。
具体而言,使用由以rdna基因its区作为标靶的包含序列编号6所示的碱基序列的正向引物和包含序列编号9所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、终极腐霉、以及致病疫霉的dna中的rdna基因its区分别独立地利用pcr进行了扩增。
另外,使用由以rdna基因its区作为标靶的包含序列编号7所示的碱基序列的正向引物和包含序列编号10所示的碱基序列的反向引物组成的引物组,将这3种微生物的dna中的rdna基因its区分别独立地利用pcr进行了扩增。
此外,使用由以rdna基因its区作为标靶的包含序列编号8所示的碱基序列的正向引物和包含序列编号10所示的碱基序列的反向引物组成的引物组,将这3种微生物的dna中的rdna基因its区分别独立地利用pcr进行了扩增。
另外,使用由以rdna基因its区作为标靶的包含序列编号8所示的碱基序列的正向引物和包含序列编号11所示的碱基序列的反向引物组成的引物组,将这3种微生物的dna中的rdna基因its区分别独立地利用pcr进行了扩增。
此后,向分别固定化有包含序列编号18、序列编号19、序列编号20、以及序列编号21所示的碱基序列的探针的微阵列上,滴加上述的利用pcr的扩增产物,检测出扩增产物的荧光标记。
pcr反应液、以及利用pcr法的基因的扩增为与试验1相同的组成以及在相同的条件下进行。
此后,与试验1相同地进行pcr扩增产物与探针的杂交,利用标记检测装置测定各探针中的荧光强度,取得了s/n比值。将其结果表示于图9中。
图9中,表示出使用由包含序列编号6所示的碱基序列的正向引物和包含序列编号9所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物与包含序列编号18所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号7所示的碱基序列的正向引物和包含序列编号10所示的碱基序列的反向引物组成的引物组、将终极腐霉的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物与包含序列编号19所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号8所示的碱基序列的正向引物和包含序列编号10所示的碱基序列的反向引物组成的引物组、将终极腐霉的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物也与包含序列编号19所示的碱基序列的探针结合,检测出标记。
此外,表示出使用由包含序列编号8所示的碱基序列的正向引物和包含序列编号11所示的碱基序列的反向引物组成的引物组、将终极腐霉和致病疫霉的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物与包含序列编号20和21所示的碱基序列的探针结合,检测出标记。
(试验7)
利用本实施方式的微生物的检查方法、微生物的检查试剂盒、以及微生物检查用微阵列,使用以rdna基因its区作为标靶的引物组及探针,进行了用于验证可否同时检测根肿菌属菌、腐霉属菌、以及疫霉属菌等的试验。
具体而言,使用由以rdna基因its区作为标靶的、包含序列编号6所示的碱基序列的正向引物和包含序列编号9所示的碱基序列的反向引物组成的引物组、以及由包含序列编号7所示的碱基序列的正向引物和包含序列编号10所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、以及终极腐霉的dna中的rdna基因its区使用一个pcr反应液利用pcr同时进行了扩增。
另外,使用由以rdna基因its区作为标靶的、包含序列编号6所示的碱基序列的正向引物和包含序列编号9所示的碱基序列的反向引物组成的引物组、以及由包含序列编号8所示的碱基序列的正向引物和包含序列编号11所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、以及终极腐霉的dna中的rdna基因its区使用一个pcr反应液利用pcr同时进行了扩增。
此外,使用由以rdna基因its区作为标靶的、包含序列编号6所示的碱基序列的正向引物和包含序列编号9所示的碱基序列的反向引物组成的引物组、以及由包含序列编号8所示的碱基序列的正向引物和包含序列编号11所示的碱基序列的反向引物组成的引物组,将根肿菌根肿病菌、以及致病疫霉的dna中的rdna基因its区使用一个pcr反应液利用pcr同时进行了扩增。
此后,向分别固定化有包含序列编号18、序列编号19、序列编号20、以及序列编号21所示的碱基序列的探针的微阵列上,滴加上述的利用pcr的扩增产物,检测出扩增产物的荧光标记。
pcr反应液、以及利用pcr法的基因的扩增为与试验1相同的组成以及在相同的条件下进行。但是,pcr反应液使用了作为试样的dna每种霉菌包含1.0μl、合计包含2.0μl的反应液。
此后,与试验1相同地进行pcr扩增产物与探针的杂交,利用标记检测装置测定各探针中的荧光强度,取得了s/n比值。将其结果表示于图10中。
图10中,表示出使用由包含序列编号6所示的碱基序列的正向引物和包含序列编号9所示的碱基序列的反向引物组成的引物组、以及由包含序列编号7所示的碱基序列的正向引物和包含序列编号10所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌、以及终极腐霉的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物分别与包含序列编号18、19所示的碱基序列的探针结合,检测出标记。
另外,表示出使用由包含序列编号6所示的碱基序列的正向引物和包含序列编号9所示的碱基序列的反向引物组成的引物组、以及由包含序列编号8所示的碱基序列的正向引物和包含序列编号11所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物与包含序列编号18所示的碱基序列的探针结合,检测出标记,并且表示出将终极腐霉的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物与包含序列编号20、21所示的碱基序列的探针结合,检测出标记。
此外,表示出使用由包含序列编号6所示的碱基序列的正向引物和包含序列编号9所示的碱基序列的反向引物组成的引物组、以及由包含序列编号8所示的碱基序列的正向引物和包含序列编号11所示的碱基序列的反向引物组成的引物组、将根肿菌根肿病菌的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物与包含序列编号18所示的碱基序列的探针结合,检测出标记,并且表示出将致病疫霉的dna中的rdna基因its区利用pcr进行扩增而得的扩增产物与包含序列编号20、21所示的碱基序列的探针结合,检测出标记。
以下,对为了确认本发明的实施方式的霉菌检测用载体、霉菌的检测方法、以及霉菌检测用试剂盒的效果而进行的试验进行具体的说明。
[试验8]
作为霉菌检测用载体,使用了genesilicon(r)(东洋钢钣株式会社制),并使用了固定化有图11所示的序列编号101~106的探针的载体。各探针使用了由operontechnologies株式会社合成的探针。另外,利用微阵列点样仪进行了各探针向基板上的固定化。
作为检测对象的霉菌,使用了从独立行政法人制品评价技术基础机构生物技术本部生物遗传资源部门(nitebiologicalresourcecenter)获取的菌株。具体而言,使用了以下的4种菌株。
(1)多犯性植物炭疽病菌(colletotrichumacutatum)nbrc32850
(2)腐皮镰孢菌(fusariumsolani)nbrc7707
(3)番茄早疫病菌(alternariasolani)nbrc7516
(4)立枯丝核菌(rhizoctoniasolani)nbrc30984
对每种菌株培养了这些霉菌。培养是使用pda培养基在25℃的暗处静置7天而进行。
此外,采集所培养的霉菌的菌落,分别地装入到加入了φ0.5mm氧化锆珠的样品瓶中,浸入液氮中而将试样冷冻后,使用振荡装置,使霉菌的细胞破碎。
然后,利用dna提取装置提取霉菌的基因组dna,利用pcr法,对每个菌株扩增了各霉菌的its区及β-微管蛋白基因(对于(3)、(4)而言实际被扩增的仅为its区)。
此时,作为its区扩增用引物组,使用了图12所示的包含序列编号107的碱基序列的正向引物及包含序列编号108的碱基序列的反向引物。另外,作为β-微管蛋白基因扩增用引物组,使用了图12所示的包含序列编号109的碱基序列的正向引物及包含序列编号110的碱基序列的反向引物。
需要说明的是,以上的引物使用了由operontechnologies株式会社合成的引物。
作为pcr用反应液,使用ampdirect(r)(株式会社岛津制作所制),对每个菌株,制成以下的组成的反应液20μl。
1.ampdirect(g/crich)4.0μl
2.ampdirect(addition-4)4.0μl
3.dntpmix1.0μl
4.cy-5dctp0.2μl
5.its1-fwprimer(序列编号107)(2.5μm)1.0μl
6.its1-rvprimer(序列编号108)(2.5μm)1.0μl
7.btfprimer(序列编号109)(10μm)1.0μl
8.btrprimer(序列编号110)(10μm)1.0μl
9.templatedna1.0μl(100pg/μl)
10.novataqhotstartdnapolymerase0.2μl
11.水(加水至整体为20.0μl)
使用上述pcr用反应液,利用核酸扩增装置(takarapcrthermalcyclerdice(r)gradienttakarabio株式会社制),在以下的条件下进行了dna的扩增。
(a)95℃10分钟
(b)95℃30秒
(c)56℃30秒
(d)72℃60秒((b)~(d)循环40次)
(e)72℃10分钟
然后,向pcr扩增产物中混合缓冲液(3×ssc柠檬酸-生理盐水+0.3%sds),在94℃加热5分钟,滴加到上述霉菌检测用载体(dna芯片)上。将该霉菌检测用载体在45℃静置1小时,使用上述缓冲液将没有杂交的pcr产物从dna芯片中洗掉。
此后,使用标记检测装置(bioshot(r),东洋钢钣株式会社制),测定固定化于霉菌检测用载体中的各探针中的荧光强度(与探针结合了的扩增产物的荧光强度),取得各探针中的s/n比值。
如上所述,分别独立地扩增多犯性植物炭疽病菌、腐皮镰孢菌、番茄早疫病菌、以及立枯丝核菌的dna中的靶区域,使所得的扩增产物与各探针杂交,其结果是,序列编号101~106的探针中的s/n比值如图13所示。
即,在试样的霉菌(检测对象的霉菌种)为多犯性植物炭疽病菌的情况下,在用于检测多犯性植物炭疽病菌的序列编号101及102的探针中,s/n比值为3以上,可以判断为阳性。另外,在用于检测其他的霉菌的序列编号103~106的探针中,s/n比值均小于3,可以判断为阴性。因而可知,为了检测多犯性植物炭疽病菌,这些探针有效地发挥了作用。
另外,在试样的霉菌为腐皮镰孢菌的情况下,在用于检测腐皮镰孢菌的序列编号103及104的探针中,s/n比值同时为3以上,可以判断为阳性。另外,在用于检测其他的霉菌的序列编号101、102、105、106的探针中,s/n比值均小于3,可以判断为阴性。因而可知,为了检测腐皮镰孢菌,这些探针有效地发挥了作用。
此外,在试样的霉菌为番茄早疫病菌的情况下,在用于检测番茄早疫病菌的序列编号105的探针中,s/n比值为3以上,可以判断为阳性。另外,在用于检测其他的霉菌的序列编号101~104、106的探针中,s/n比值均小于3,可以判断为阴性。因而可知,为了检测番茄早疫病菌,这些探针有效地发挥了作用。
另外,在试样的霉菌为立枯丝核菌的情况下,在用于检测立枯丝核菌的序列编号106的探针中,s/n比值为3以上,可以判断为阳性。另外,在用于检测其他的霉菌的序列编号101~105的探针中,s/n比值均小于3,可以判断为阴性。因而可知,为了检测立枯丝核菌,这些探针有效地发挥了作用。
[试验9]
在进行使检测对象的多个霉菌的dna中的靶区域同时扩增的多重pcr的情况下,进行了用于确认固定化于本实施方式的霉菌检测用载体中的探针是否有效地发挥作用的试验。
霉菌检测用载体使用了与试验8相同的载体。另外,检测对象的霉菌也使用了与试验8相同的4种菌株。
本试验中,将多犯性植物炭疽病菌、腐皮镰孢菌、番茄早疫病菌、以及立枯丝核菌使用pda培养基在25℃的暗处静置7天而分别进行了培养。
此后,从所培养的各霉菌中采集菌落并混合,将包含该4菌种的试样装入到加入了φ0.5mm氧化锆珠的样品瓶中,浸入液氮中而冷冻试样后,使用振荡装置,使霉菌的细胞破碎。
然后,利用dna提取装置提取霉菌的基因组dna,利用pcr法,同时地扩增了各霉菌的its区及β-微管蛋白基因(对于番茄早疫病菌、以及立枯丝核菌而言仅为its区)。pcr法中所用的引物组与试验8中的引物组相同。
作为pcr用反应液,使用ampdirect(r)(株式会社岛津制作所制),制成20μl的以下的组成的反应液。
1.ampdirect(g/crich)4.0μl
2.ampdirect(addition-4)4.0μl
3.dntpmix1.0μl
4.cy-5dctp0.2μl
5.its1-fwprimer(2.5μm)1.0μl
6.its1-rvprimer(2.5μm)1.0μl
7.btfprimer(10μm)1.0μl
8.btrprimer(10μm)1.0μl
9.templatedna(1.0μl/菌株)(100pg/μl)1.0μl×4
10.novataqhotstartdnapolymerase0.2μl
11.水(加水至整体为20.0μl)
使用上述各pcr用反应液,利用核酸扩增装置(takarapcrthermalcyclerdice(r)gradienttakarabio株式会社制),在与试验8相同的条件下进行了dna的扩增。
然后,向pcr扩增产物中混合缓冲液(3×ssc柠檬酸-生理盐水+0.3%sds),在94℃加热5分钟,滴加到霉菌检测用载体(dna芯片)上。将该霉菌检测用载体在45℃静置1小时,使用上述缓冲液将没有杂交的pcr产物从dna芯片中洗掉。
此后,使用标记检测装置(genepix4100amoleculardevices公司制),测定固定化于霉菌检测用载体中的各探针中的荧光强度,取得各探针中的s/n比值。将其结果表示于图13中。
如上所述,将多犯性植物炭疽病菌、腐皮镰孢菌、番茄早疫病菌、以及立枯丝核菌的dna中的靶区域利用1个pcr反应液同时扩增,使所得的扩增产物与各探针杂交,其结果是,在用于检测多犯性植物炭疽病菌的序列编号101的探针中,s/n比值为3以上,在相同的序列编号102所示的碱基序列的探针中,s/n比值小于3。根据这些结果,对于多犯性植物炭疽病菌,可以判断为阳性。
另外,在用于检测腐皮镰孢菌的序列编号103、104的探针中,s/n比值同时为3以上,对于腐皮镰孢菌,可以判断为阳性。
此外,在用于检测番茄早疫病菌的序列编号105的探针中,s/n比值为3以上,对于番茄早疫病菌,可以判断为阳性。
另外,在用于检测立枯丝核菌的序列编号106的探针中,s/n比值为3以上,对于立枯丝核菌,可以判断为阳性。
因而,在进行了使检测对象的多个霉菌的dna中的靶区域同时扩增的多重pcr的情况下,也可以确认本实施方式的固定化于霉菌检测用载体中的探针有效地发挥了作用。
[试验10]
进行了用于确认本实施方式的固定化于霉菌检测用载体中的探针不与检测对象以外的霉菌的dna中的靶区域的扩增产物杂交、不产生假阳性反应的试验。
霉菌检测用载体使用了与试验8相同的载体。
作为检测对象以外的霉菌,使用了从独立行政法人理化学研究所生物资源中心微生物材料开发室(japancollectionofmicroorganisms)及独立行政法人制品评价技术基础机构生物技术本部生物遗传资源部门(nitebiologicalresourcecenter)获取的菌株。具体而言,使用了以下的6种霉菌的菌株。
(1)黄曲霉(aspergillusflavus)jcm10252
(2)球毛壳霉(chaetomiumglobosum)nbrc6347
(3)月状弯孢霉(curvularialunata)nbr100165
(4)熟物曲霉菌(eurotiumrepens)jcm1580
(5)指状青霉菌(penicilliumdigitatum)jcm9863
(6)实腐茎点霉(phomadestructiva)nbrc7482
对每个菌株使用pda培养基在25℃的暗处静置7天而培养了这些霉菌。
此外,采集所培养的霉菌的菌落,分别地装入到加入了φ0.5mm氧化锆珠的样品瓶中,浸入液氮中而冷冻试样后,使用振荡装置,使霉菌的细胞破碎。
然后,利用dna提取装置提取霉菌的基因组dna,利用pcr法,与试验8相同地对每个菌株进行了各霉菌的its区及/或β-微管蛋白基因的扩增反应。
然后,向pcr扩增产物中混合缓冲液(3×ssc柠檬酸-生理盐水+0.3%sds),在94℃加热5分钟,滴加到上述霉菌检测用载体(dna芯片)上。将该霉菌检测用载体在45℃静置1小时,使用上述缓冲液将未杂交的pcr产物从dna芯片中洗掉。
此后,使用标记检测装置(bioshot(r),东洋钢钣株式会社制),测定固定化于霉菌检测用载体中的各探针中的荧光强度,取得各探针中的s/n比值。将其结果表示于图13中。
如上所述,进行黄曲霉、球毛壳霉、月状弯孢霉、熟物曲霉菌、指状青霉菌、以及实腐茎点霉的dna中的靶区域的扩增反应,使所得的扩增产物与各探针杂交,其结果是,序列编号101~106的探针中的s/n比值均小于3,可以判断为阴性。因而可知,本实施方式的霉菌检测用载体中的各探针对于检测对象以外的这些霉菌不产生假阳性反应,有效地发挥了作用。
本发明并不限定于以上的实施方式或实施例,可以在本发明的范围内进行各种变更实施。
例如,可以在pcr反应液中单独地使用上述各引物组,也可以将多个引物组以全部的组合在一个pcr反应液中同时地使用。另外,在微生物检查用微阵列中,上述各探针可以在全部的组合中分别单独地使用,或以多个使用等,适当地进行变更。
另外,例如,在本实施方式的霉菌检测用载体中,可以逐个斑点地、或者每次多个斑点地将各探针固定化。另外,也可以将用于检测本实施方式的检测对象霉菌以外的霉菌的其他的探针与本实施方式的探针一起固定化。
产业上的可利用性
本发明可以在植物组织或土壤检查、流行病学的环境检查、环境检查、临床试验、以及家畜卫生等中恰当地利用。
另外,本发明在对作为植物病原菌的多犯性植物炭疽病菌、腐皮镰孢菌、番茄早疫病菌、以及立枯丝核菌进行特异性的多重检测的情况下可以恰当地利用。
- 还没有人留言评论。精彩留言会获得点赞!