新颖乳杆菌种微生物及包含其的用于动物饲料的组合物的制作方法
本发明涉及一种新颖乳杆菌种及包含所述乳杆菌种的动物饲料组合物。
背景技术:
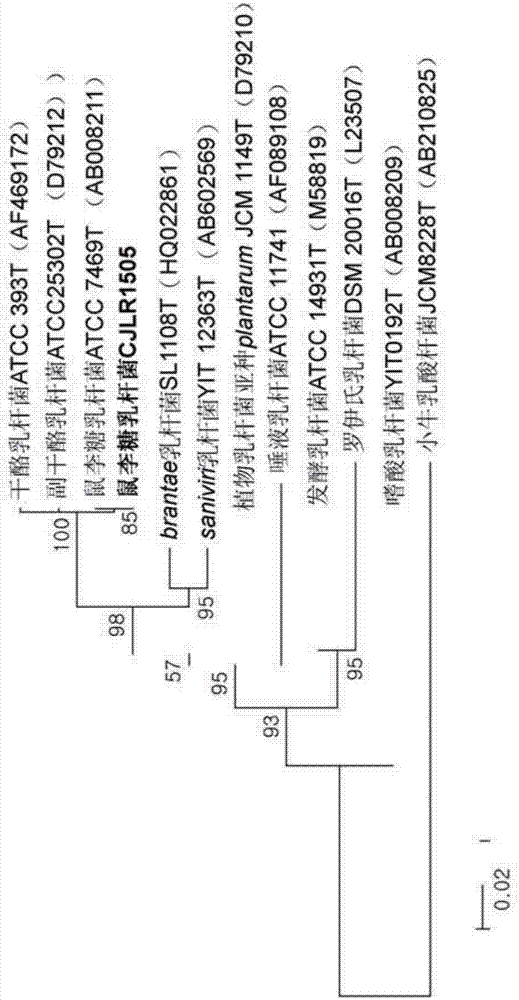
:乳杆菌(lactobacillussp.)种为可在动物(包括人类)的肠道中以及在乳制品及蔬菜的发酵期间常见的同型发酵(homo-fermentative)乳酸菌或异型发酵(hetero-fermentative)乳酸菌。乳杆菌种维持肠的酸性ph,以抑制例如大肠杆菌(e.coli)种及梭菌(clostridium)种等有害细菌的增殖以及改善腹泻及便秘。已知乳杆菌种在维生素合成、抗癌活性、降低血清胆固醇等方面发挥作用。已根据乳杆菌种微生物的前述性质对作为饲料添加剂的益生菌进行了诸多研究。牲畜的细菌性腹泻会导致生长率及存活率降低。因此,为了提高牲畜生产率,已以一定药物剂量向动物饮食中添加各种抗生素。然而,近年来,由于抗生素的过度使用,已在世界范围内论述了抗生素抗性问题及肉制品中残留的抗生素物质的有害效应。因此,许多国家的政府已开始限制抗生素在动物饲料中的使用,并想出饲养牲畜动物的有机方式(韩国专利公开第10-1998-78358号)(麦克尤恩(mcewen)及费多尔卡克雷(fedorka-cray),抗菌剂在动物中的使用及抗性(antimicrobialuseandresistanceinanimals),临床传染病(clinicalinfectiousdiseases),2002年6月,第34卷,第s93页到第s106页)。技术实现要素:技术问题本发明人已发现属于乳杆菌属的鼠李糖乳杆菌(lactobacillusrhamnosus)cjlr1505的热灭活或死细胞(deadcells,死菌)(以下,被称为无活性细胞)具有以下效果。首先,鼠李糖乳杆菌cjlr1505的无活性细胞具有抑制有害肠杆菌竞争性地粘附到肠上皮细胞的能力,从而有助于形成肠细菌丛。鼠李糖乳杆菌cjlr1505的无活性细胞会产生脂磷壁酸(lipoteichoicacid),所述脂磷壁酸防止有害肠杆菌沉降在肠黏膜上。脂磷壁酸是从细胞壁在小肠中被破坏的无活性细菌细胞洗脱得到的细胞壁成分。因此,例如大肠杆菌种及沙门氏菌种等有害肠杆菌不会吸附到肠环境中的肠黏膜的表面,而是通过肠分泌及肠蠕动被排泄出。另外,将鼠李糖乳杆菌cjlr1505的无活性细胞用于动物饲料中会有效地增加动物的增重率,并因其使甘油三酯降解的能力而使饲料转化效率(feedefficiency)增加。此外,摄入包含鼠李糖乳杆菌cjlr1505的无活性细胞的饲料会有效地增强动物的免疫力。本发明提供一种鼠李糖乳杆菌cjlr1505作为新颖乳杆菌种以及一种包含所述乳杆菌种的无活性细胞的动物饲料组合物,且旨在当动物摄取包含所述动物饲料组合物的饲料时提高动物的增重率并改善动物抵抗疾病的免疫力。技术解决方案本发明的一个实施例提供一种鼠李糖乳杆菌cjlr1505(lactobacillusrhamnosuscjlr1505)(kccm11721p)。本发明的另一实施例提供一种包含鼠李糖乳杆菌cjlr1505(kccm11721p)或此菌株的无活性细胞的动物饲料组合物。本发明的再一实施例提供一种生产鼠李糖乳杆菌cjlr1505(kccm11721p)无活性细胞的方法,所述方法包括:对鼠李糖乳杆菌cjlr1505(kccm11721p)进行培养以制备培养液,使用热交换器在介于70℃到160℃范围内的温度下间接加热所述培养液,将经间接加热的所述培养液以介于10-100l/min范围内的速率快速冷却到介于10℃到60℃范围内的温度,以及从经快速冷却的所述培养液中分离出鼠李糖乳杆菌cjlr1505(kccm11721p)的无活性细胞。有利效果根据本发明的鼠李糖乳杆菌cjlr1505的无活性细胞具有使甘油三酯降解、吸附内毒素、抑制致病菌的生长、以及使消化酶活化的能力。由于此种能力,包含鼠李糖乳杆菌cjlr1505的无活性细胞的动物饲料可提高动物的每日增重率并改善动物抵抗疾病的免疫力。附图说明图1示出鼠李糖乳杆菌(lactobacillusrhamnosus)cjlr1505的电子显微镜图像。图2示出鼠李糖乳杆菌cjlr1505的系统发生树(phylogenetictree)。图3示出在对鼠李糖乳杆菌cjlr1505及作为标准菌株的鼠李糖乳杆菌kccm32450(lactobacillusrhamnosuskccm32450)粘附到肠上皮细胞的能力进行评估之后,粘附到肠上皮细胞的这两个菌株的无活性细菌细胞的数目的电子显微镜图像。具体实施方式现在将更详细地阐述本发明。所属领域中的技术人员将容易地认识到并理解未包括在本文中的公开内容,且因此不再对其予以赘述。本发明的一个实施例指向鼠李糖乳杆菌cjlr1505(lactobacillusrhamnosuscjlr1505)(kccm11721p)。本发明人对猪崽的小肠的远侧端部进行了取样,以无菌蒸馏水对样本进行了洗涤,并将经洗涤的样本平板接种在补充有0.001%的溴苯酚紫(bromophenicolpurple,bcp)的mrs培养基上。在37℃下进行厌氧培养之后,筛选出了47个乳酸生产菌株。对筛选出的菌株进行了次培养且通过形态学方法对筛选出的菌株中的23种进行了二次分离。对这23种的抗菌活性及消化酶活性进行了比较。在这些种中,对11种进行了三次分离。针对耐胆汁性、耐酸性、及对动物的肠壁中的细胞的吸附性对分离出的11个乳酸生产菌株进行了测量。最终分离出在糖发酵、抑制致病菌生长的能力、消化酶活性、及使甘油三酯降解的能力方面具有最好特性的一个菌株。将最终分离出的乳酸生产菌株命名为鼠李糖乳杆菌cjlr1505(lactobacillusrhamnosuscjlr1505),且在2015年7月8日存放在韩国微生物保藏中心(koreanculturecenterofmicroorganisms,kccm)(登录号kccm11721p)。鼠李糖乳杆菌cjlr1505的形态学性质及生理学性质示于表1中。[表1]如表1所示,鼠李糖乳杆菌cjlr1505是杆菌状(rod)的且不形成孢子。此菌株的活细胞与无活性细胞是通过细胞壁表面上的糖蛋白的活性而彼此区分开。使用api生化检验套件(apikitforbiochemicalassay)对鼠李糖乳杆菌cjlr1505进行了分析。结果,将鼠李糖乳杆菌cjlr1505确定为具有与鼠李糖乳杆菌(lactobacillusrhamnosus)相似的糖利用率,如表2所示。向马克基因公司(macrogen)请求鼠李糖乳杆菌cjlr1505的16srrna序列。结果,发现了鼠李糖乳杆菌cjlr1505的分子生物学性质与鼠李糖乳杆菌(lactobacillusrhamnosus)菌株的分子生物学性质相似(99%),如图2所示。[表2]鼠李糖乳杆菌cjlr1505的糖利用率的分析鼠李糖乳杆菌cjlr1505(kccm11721p)的耐酸性、耐胆汁性、抗菌活性、消化酶活性、及使甘油三酯降解的能力优异。由于这些优点,包含鼠李糖乳杆菌cjlr1505(kccm11721p)的动物饲料具有高效率且会有效地提高动物的增重率。鼠李糖乳杆菌cjlr1505(kccm11721p)的无活性细胞具有抑制有害肠杆菌竞争性地粘附到肠上皮细胞的能力,从而有助于形成肠细菌丛。鼠李糖乳杆菌cjlr1505(kccm11721p)的无活性细胞会产生脂磷壁酸(1ipoteichoicacid),所述脂磷壁酸防止有害肠杆菌沉降在肠黏膜上。脂磷壁酸是从细胞壁在小肠中被破坏的无活性细菌细胞洗脱得到的细胞壁成分。另外,鼠李糖乳杆菌cjlr1505(kccm11721p)的无活性细胞因与此菌株的活细胞相比具有更高的疏水性及更强的聚集趋势而可粘附到致病微生物及内毒素以增强动物抵抗疾病的免疫力。本发明的再一实施例指向一种包含鼠李糖乳杆菌cjlr1505(kccm11721p)或此菌株的无活性细胞的动物饲料组合物。所述动物饲料组合物还可包含载体。所述载体无特别限制且可为所属领域中已知的任一载体。合适的载体的实例包括糖类(例如,乳糖、d-甘露醇、d-山梨醇、及蔗糖)、淀粉(例如,玉米淀粉及马铃薯淀粉)、以及无机盐(例如,磷酸钙、硫酸钙、及沉淀的碳酸钙)。所述动物饲料组合物可包含每克1.0×108cfu到×1010cfu的鼠李糖乳杆菌cjlr1505(kccm11721p)或此菌株的无活性细胞。具体来说,所述动物饲料组合物可包含每克1.0×108cfu到3.0×109cfu的鼠李糖乳杆菌cjlr1505(kccm11721p)或此菌株的无活性细胞。举例来说,所述动物饲料组合物可包含每克5×108cfu的鼠李糖乳杆菌cjlr1505(kccm11721p)或此菌株的无活性细胞。当无活性细菌细胞的含量处于以上所界定的范围内时,动物饲料组合物使甘油三酯降解、吸附内毒素、抑制致病菌生长、及使消化酶活化的能力可得以最大化。在又一实施例中,提供一种使用所述动物饲料组合物制备的动物饲料。所述动物饲料可通过将动物饲料组合物与一般饲料混合来制备。一般饲料可包含典型配料,例如,玉米、大豆、大豆油、及氨基酸。根据又一实施例,所述动物饲料可通过将动物饲料组合物与另一动物饲料组合物混合来制备。对动物饲料无特别限制,只要所述动物饲料能喂食给例如牛、猪、及马等牲畜即可。举例来说,动物饲料可为猪饲料。本发明的另一实施例指向一种生产鼠李糖乳杆菌cjlr1505(kccm11721p)的无活性细胞的方法,所述方法包括:对鼠李糖乳杆菌cjlr1505(kccm11721p)进行培养以制备培养液,使用热交换器在介于70℃到160℃范围内的温度下间接加热所述培养液,将经间接加热的所述培养液以介于10-100l/min范围内的速率快速冷却到介于10℃到60℃范围内的温度,以及从经快速冷却的所述培养液中分离出鼠李糖乳杆菌cjlr1505(kccm11721p)的无活性细胞。具体来说,可通过以下程序来制备鼠李糖乳杆菌cjlr1505(kccm11721p)的无活性细胞。首先,在mrs琼脂培养基中对鼠李糖乳杆菌cjlr1505(kccm11721p)进行培养以制备培养液。在一个实施例中,可使用环将鼠李糖乳杆菌cjlr1505(kccm11721p)平板接种在mrs琼脂培养基上并在37℃下培养24小时以制备培养液。接着,使用热交换器在介于70℃到160℃范围内的温度下间接加热培养液。具体来说,可在介于80℃到150℃范围内的温度下、更具体来说在介于90℃到120℃范围内的温度下间接加热培养液。将经间接加热的培养液以介于10-100l/min范围内的速率快速冷却到介于10℃到60℃范围内的温度、具体来说介于20℃到50℃范围内的温度、例如4℃。接着,从经快速冷却的培养液中分离出鼠李糖乳杆菌cjlr1505(kccm11721p)的无活性细胞。所述方法还可包括:将防护剂与分离出的无活性细胞混合,然后进行喷雾干燥。防护剂无特别限制,且可例如选自由酵母提取物、右旋糖、粗糖、及其混合物组成的群组。与防护剂混合以及随后的喷雾干燥会防止无活性细胞因外部环境因素而被污染且有利于无活性细胞的分布。喷雾干燥是指在热空气流下一次喷出液体以获得干燥的液体产物的工艺。合适的喷雾干燥工艺的实例包括但不限于使用旋转盘的离心喷雾及使用压力喷嘴的压力式喷雾。更具体来说,将无活性细胞与酵母提取物、右旋糖、及粗糖混合,且对所得混合物进行喷雾干燥以获得粉末。举例来说,可将无活性细胞与糖(例如,粗糖)及/或淀粉(例如,右旋糖)混合,悬浮在水(例如,蒸馏水)中,并进行喷雾干燥以获得粉末。在喷雾干燥期间,热空气是在介于120-200℃范围内、优选地介于130-170℃范围内的温度下通过入口进入,并在介于30-150℃范围内、优选地介于50-100℃范围内的温度下通过出口逸出。然而,喷雾干燥并非仅限于这些条件。以100重量份的此混合物计,添加介于0.04-50重量份范围内、更优选地介于0.1-10重量份范围内的量的酵母提取物。以100重量份的此混合物计,添加介于1-100重量份范围内、更具体来说介于10-50重量份范围内的量的右旋糖。以100重量份的此混合物计,添加介于0.2-50重量份范围内、更具体来说介于0.4-10重量份范围内的量的粗糖。在喷雾干燥之后,可将死细菌细胞粉末与无机盐(例如,磷酸钙、硫酸钙、或碳酸钙)混合。无机盐(例如,碳酸钙)因其吸水性而有利于控制无活性细胞粉末的水分含量。更具体来说,以动物饲料的总重量计,可使用介于0.05-50%(w/w)范围内、更具体来说介于0.5-30%范围内、更具体来说介于0.5-5%范围内的量的无活性细胞粉末,且可使用介于1-80%范围内、具体来说介于5-50%范围内、更具体来说介于5-20%范围内的量的无机盐(例如,碳酸钙)。动物饲料组合物含有每克至少108cfu、优选地介于108-1010cfu范围内、更优选地介于109-1010cfu范围内的无活性细胞。所述组合物视需要还含有介于5-99%范围内、优选地介于50-90%范围内、更优选地介于1-10%范围内的无机材料。将参照以下实例更详细地阐述本发明。然而,应理解,提供这些实例仅是为了说明,而不应被视为以任何方式限制本发明。将不再对对于所属领域中的技术人员显而易见的细节予以赘述。实例实验例1到实验例6在安全性、耐酸性、耐胆汁性、抗菌活性、消化酶活性、及使甘油三酯降解的能力方面对鼠李糖乳杆菌cjlr1505(kccm11721p)进行了评估。使用已知的鼠李糖乳杆菌kccm32450作为比较菌株。实验例1:鼠李糖乳杆菌cjlr1505(kccm11721p)的安全性的评估根据由韩国生物风险协会(koreabioventureassociation)提供的安全性标准测试方法通过进行溶血测试、明胶液化测试、及苯基丙氨酸脱氨酶测试,对鼠李糖乳杆菌cjlr1505(kccm11721p)的安全性进行了评估。进行了测试以探究是否产生了有害代谢物(例如,氨)。结果示于表3中。[表3]如从表3中的结果可以看出,鼠李糖乳杆菌cjlr1505(kccm11721p)在包括明胶液化测试及苯基丙氨酸脱氨酶测试在内的所有测试中均为阴性。鼠李糖乳杆菌cjlr1505(kccm11721p)不产生氨。结果证明鼠李糖乳杆菌cjlr1505(kccm11721p)在溶血测试中是安全的。实验例2:鼠李糖乳杆菌cjlr1505(kccm11721p)的耐酸性的评估在mrs培养基中对菌株鼠李糖乳杆菌cjlr1505及比较菌株鼠李糖乳杆菌kccm32450进行了预先培养。以ph值被调整为2、3、及7的mrs肉汤将这两个菌株稀释了10-6倍。在37℃下对稀释的细菌溶液进行了培养,在预定时间点平板接种在mrs琼脂(agar)培养基上,并厌氧培养了48h。在培养之后,对菌落的数目进行了计数。耐酸性实验的结果示于表4中。[表4]如从表4中的结果可以看出,鼠李糖乳杆菌cjlr1505的活细胞的数目与比较菌株鼠李糖乳杆菌kccm32450相比减少更少,表明鼠李糖乳杆菌cjlr1505的耐酸性更好。实验例3:鼠李糖乳杆菌cjlr1505(kccm11721p)的耐胆汁性的评估在mrs培养基中对菌株鼠李糖乳杆菌cjlr1505及比较菌株鼠李糖乳杆菌kccm32450进行了预先培养。将这两种菌株培养物调整到ph为4。向此培养物中添加了胆汁酸溶液(oxgall;牛胆),以使得浓度为0%、0.3%、及1%。以mrs肉汤将此混合物稀释了10-6倍。在37℃下对稀释的细菌溶液进行了培养,在预定时间点平板接种在mrs琼脂(agar)培养基上,并厌氧培养了48h。在培养之后,对菌落的数目进行了计数。结果归纳在表5中。[表5]如从表5中的结果可以看出,在ph为4的0.3%的牛胆汁(oxgall)溶液及1%的牛胆汁溶液两者中未发现鼠李糖乳杆菌cjlr1505的成活细胞的数目显著减少。另外,鼠李糖乳杆菌cjlr1505的活细胞的数目与标准菌株的活细胞的数目相比减少更少,表明即使在动物中存在胆汁酸时鼠李糖乳杆菌cjlr1505仍可生长。实验例4:鼠李糖乳杆菌cjlr1505(kccm11721p)的抗菌活性的评估将四种致病菌(大肠杆菌(e.coli)k88、大肠杆菌(e.coli)atcc25922、鼠伤寒沙门氏菌(salmonellatyphimurium)kccm25922、及猪霍乱沙门氏菌(salmonellacholerasuis)kccm10709)液体培养了24h。以无菌棉签将培养物(分别为105-6cfu)平板接种在胰酶大豆肉汤(trypticsoybroth,tsb)培养基(美国的bd公司(bd,usa))上。在平板接种之后,以pbs缓冲液将鼠李糖乳杆菌cjlr1505及鼠李糖乳杆菌kccm32450稀释到109cfu/ml。将稀释的细菌溶液(分别为50μl)平板接种在纸盘(paperdisc)(直径为4mm)上并使其静置在室温下,直到稀释的细菌溶液充分渗透到纸盘中,然后在37℃下需氧培养了18h。以3,000×g将培养液离心分离了10分钟。以pbs缓冲液将上清液洗涤了三次从而仅分离出细菌细胞。将抑制区的大小确定为整个透明区的直径与琼脂孔(agarwell)的直径之间的差值。结果示于表6中。[表6]10-15mm:+,15-20mm:++,21-25mm:+++如从表6中的结果可以看出,菌株鼠李糖乳杆菌cjlr1505及标准菌株鼠李糖乳杆菌kccm32450两者显示出对致病微生物增殖的抑制效果,但发现了菌株鼠李糖乳杆菌cjlr1505与标准菌株鼠李糖乳杆菌kccm32450相比具有更好的抗菌活性。这些结果与菌株鼠李糖乳杆菌cjlr1505的固有效果而非与从此菌株产生的代谢物的效果相关联,证明了此菌株当喂食给动物时可抑制有害微生物的增殖。实验例5:鼠李糖乳杆菌cjlr1505(kccm11721p)的消化酶活性的评估进行了实验以判断菌株鼠李糖乳杆菌cjlr1505(kccm11721p)是否具有能够使碳水化合物、蛋白质、及磷降解的酶。将0.5%的脱脂奶(skimmilk)添加到mrs琼脂培养基中以探究此菌株是否具有蛋白酶(protease)活性。将0.2%的甲基纤维素(methylcellulose)添加到mrs琼脂培养基中以探究此菌株是否具有纤维素酶(cellulase)活性。将0.2%(w/v)的玉米淀粉(cornstarch)添加到mrs琼脂培养基中以探究此菌株是否具有α-淀粉酶活性(α-amylase),且制备了补充有0.5%的植酸钙(ca-phytase)的培养基以探究此菌株是否具有植酸酶(phytase)活性。将分离出的菌株划线(streaking)接种到所制备的培养基上,培养了24h并进行了观察。以2%的刚果红(congored)试剂(美国的西格玛公司(sigma,usa))对培养基进行了处理并以1m氯化钠(nacl)进行了洗涤(washing)。通过观察颜色变化而确定了α-淀粉酶活性及纤维素酶活性。依据是否形成透明区确定了蛋白酶活性及植酸酶活性。结果阐述于表7中。[表7]1-10mm:+,11-20mm:++,21-30mm:+++,31-35mm:++++从表7中的结果可以看出,菌株鼠李糖乳杆菌cjlr1505与标准菌株鼠李糖乳杆菌kccm32450相比具有更高的消化酶活性。这些结果证明了鼠李糖乳杆菌cjlr1505当喂食给牲畜动物时可提高饲料转化效率。实验例6:鼠李糖乳杆菌cjlr1505(kccm11721p)使甘油三酯降解活化的能力的评估探究了鼠李糖乳杆菌cjlr1505的胆汁盐水解酶(bilesalthydrolase,bsh)活性。结果,在补充有2mm牛脱氧胆酸盐水合物(taurodeoxycholatehydrate(tdca),美国的西格玛公司)的mrs固体培养基中形成了白色沉淀物,证明了此菌株的酶活性。鼠李糖乳杆菌cjlr1505显示出与作为tdca阳性对照的标准菌株鼠李糖乳杆菌kccm32450相似的沉淀分布曲线。然而,在补充有2mm甘氨脱氧胆酸钠(sodiumglycodeoxycholate(gdca),美国的西格玛公司)的培养基中未观察到沉淀,且细菌的生长受到限制。结果阐述于表8中。[表8]结合胆汁酸/菌株名称鼠李糖乳杆菌cjlr1505鼠李糖乳杆菌kccm32450tdca++gdca+-+:生长,-:不生长如从表8中的结果可以看出,鼠李糖乳杆菌cjlr1505具有高耐胆汁性且产生了能够使甘油三酯降解的bsh。这些结果表明鼠李糖乳杆菌cjlr1505为当喂食给动物时可影响动物的每日增重的功能菌株。实验例7到实验例9使用环将鼠李糖乳杆菌cjlr1505(kccm11721p)及作为标准菌株的鼠李糖乳杆菌kccm32450中的每一者平板接种在mrs琼脂培养基上并在37℃下培养了48小时。接着,使用热交换器在100℃的温度下间接加热了培养液,并以介于30-100l/min范围内的速率快速冷却到10℃。从经快速冷却的培养液中分离出此菌株的无活性细胞。对无活性细胞粘附到肠上皮细胞的能力进行了测试。将鼠李糖乳杆菌cjlr1505的无活性细胞的疏水性及此菌株的无活性细胞的聚集趋势与此菌株的活性细胞的疏水性及聚集趋势进行了比较。将包含鼠李糖乳杆菌cjlr1505的无活性细胞的常用饲料的每日增重及饲料转化率与不含此菌株的无活性细胞的常用饲料的每日增重及饲料转化率进行了比较。实验例7:鼠李糖乳杆菌cjlr1505(kccm11721p)粘附到肠上皮细胞的能力的评估作为动物细胞的ht-29细胞是从韩国细胞系库(koreacelllinebank,kclb)提供,且根据金姆等人(金姆等人(kimetal.),从猪胃肠道分离出的乳杆菌菌株及双歧杆菌菌株的益生菌性质(probioticpropertiesoflactobacillusandbifidobacteriumstrainsisolatedfromporcinegastrointestinaltract),应用微生物学及生物技术(appliedmicrobiologyandbiotechnology),2007年4月,第74卷,第1103页到第1111页)及希拉诺等人(希拉诺等人(hiranoetal.),鼠李糖乳杆菌对试管内的人类肠细胞的肠出血性大肠杆菌感染的影响(theeffectoflactobacillusrhamnosusonenterohemorrhagicescherichiacoliinfectionofhumanintestinalcellsinvitro),微生物学及免疫学(microbiologyandimmunology),2003年,第47卷,第405页到第109页)的方法,对鼠李糖乳杆菌cjlr1505(kccm11721p)粘附到肠上皮细胞的能力进行了测试。以pbs缓冲液(buffer)将单层(monolayer)成形ht-29细胞洗涤了三次,且向其中添加了0.5ml不含抗生素的rpmi1640培养基。使浓度为~109cells/ml(细胞/毫升)的鼠李糖乳杆菌cjlr1505的无活性细胞及鼠李糖乳杆菌kccm32450的无活性细胞悬浮在rpmi中,将其接种到孔板中,并在37℃下培养了2h。在培养完成之后,以pbs缓冲液将每一种培养物洗涤了三次,以移除此菌株的未粘附的无活性细胞以及确认在洗涤之后此菌株粘附到肠上皮细胞的能力。在进行革兰氏染色(gramstaining)之后,在显微镜下对无活性细胞的数目进行了计数,以评估粘附到肠上皮细胞的能力。实验结果示于图3中。实验结果显示出,确认到在2h后鼠李糖乳杆菌cjlr1505的无活性细菌细胞的数目为5.4×108cells/ml,其大于标准菌株鼠李糖乳杆菌kccm32450的无活性细胞的数目(3.2×106cells/ml),从而确认到鼠李糖乳杆菌cjlr1505粘附到肠上皮细胞的能力更好。实验例8:鼠李糖乳杆菌cjlr1505的活细胞及无活性细胞的疏水性以及此菌株的活细胞及无活性细胞的聚集趋势的评估对自聚集(self-aggregation)及同时聚集(simultaneousaggregation)进行了评估,以确认鼠李糖乳杆菌cjlr1505的活细胞与无活性细胞之间的疏水性及聚集趋势的差异。通过以下程序对自聚集进行了评估。首先,将鼠李糖乳杆菌cjlr1505的活细胞或无活性细胞稀释到od600为0.5。向3ml稀释的菌株中添加了1ml甲苯,然后涡流(vortex)了90秒。然后,使此混合物静置在37℃的水浴(waterbath)中达1h。在移除甲苯之后,对水层的od600进行了测量。通过以下程序对同时聚集进行了评估。首先,将鼠李糖乳杆菌cjlr1505的活细胞或无活性细胞与作为致病微生物的相同量的大肠杆菌(e.coli)k88、鼠伤寒沙门氏菌(salmonellatyphimurium)kccm25922、或猪霍乱沙门氏菌(salmonellacholerasuis)kkccm10709进行了混合(即,致病微生物:活细胞或无活性细胞=1∶1(分别为1.5ml))。向3ml此混合物中添加了1ml甲苯,然后涡流了90秒。然后,使所得混合物静置在37℃的水浴中达1h。在移除甲苯之后,对水层的od600进行了测量。通过100×(初始od600-1小时后的od600)/初始od600对疏水性进行了计算。自聚集及同时聚集的结果阐述于表9中。[表9]如从表9中的结果可以看出,鼠李糖乳杆菌cjlr1505的无活性细胞的自聚集及同时聚集比此菌株的活细胞高2倍到3倍。微生物种的细胞外疏水性及微生物种的聚集趋势受细胞表面蛋白质的特性及表面结构的影响。鼠李糖乳杆菌cjlr1505的无活性细胞的细胞外疏水性及鼠李糖乳杆菌cjlr1505的无活性细胞的聚集趋势增加,这是因为此菌株的无活性细胞的表面蛋白质结构与此菌株的活性细胞的表面蛋白质结构不同,如图1所示。因此,预期鼠李糖乳杆菌cjlr1505可用作粘附到内毒素的功能菌株,从而影响抗病性。实验例9:包含鼠李糖乳杆菌cjlr1505的无活性细胞的饲料与一般常用饲料的比较以0.2%(w/w)的剂量将含有鼠李糖乳杆菌cjlr1505的无活性细胞的最终混合物添加到常用饲料中,以制备断奶猪崽饮食中的实验饲料。使用断奶猪崽的常用饲料作为对照饲料。对断奶猪崽喂食此饲料28天。对此动物的初始体重(kg)、最终体重(kg)、每日增重(g)、每日饲料摄入量(g)、及饲料转化率进行了测量。结果示于表10中。[表10]如从表10中的结果可以看出,被投喂鼠李糖乳杆菌cjlr1505的无活性细胞的群组与对照群组相比在每日增重及饲料转化率方面显示出显著更好的结果。pct/ro/134表当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1