安卡拉病毒毒株FAdV‑HB及其灭活疫苗的制备和应用的制作方法
本发明涉及动物疫苗制备技术领域,具体地指一种安卡拉病毒毒株FAdV-HB及其灭活疫苗的制备和应用。
背景技术:
禽腺病毒(Fowl adenovirus)根据不同的群特异性抗原分为三个群:I群,II群和III群。I群禽腺病毒包括传统的禽腺病毒(Fowl adenovirus,FAV)及其它禽类分离物,共12个血清型,代表株为鸡胚致死孤儿病毒(chicken embryo lethal orphan,CELO)。Ⅱ群禽腺病毒包括火鸡出血性肠炎病毒(HEV)、雉鸡大理石脾病毒和鸡大脾病毒,它们与I群禽腺病毒无抗原相关性(Domermuth et al.,1980)。Ⅲ群禽腺病毒是与减蛋综合征(egg drop syndrome,EDS)有关的一类病毒,可从鸡、鸡、鹅体内分离得到,致病性差异很大(Russell W C.,1995),它们只是部分含有I群禽腺病毒的共同抗原(McFerran et al.,1978)。
I群禽腺病毒呈现世界性分布,可感染多种禽类,在鸭鹅体内多呈隐性感染,但是对鸡的致病力较强。其所有12个血清型均能引起包涵体肝炎(IBH),只有血清4型禽腺病毒是心包积水肝炎综合征(HHS)的主要病原。很多研究表明,腺病毒相关病毒(adeno-associated viruses,AAV)传染性法氏囊病毒和鸡传染性贫血病毒可有效增强I群禽腺病毒的致病性(Fadly et al.,1976)。
心包积水-肝炎综合征是由血清4型禽腺病毒(FAdV-4)引起的一种新型家禽疾病,其典型症状是导致3~5周龄肉鸡突然死亡,并伴有严重的心包积水和肝炎,因此而得名。又因本病1987年首次于报道于巴基斯坦安卡拉地区,故该病又被称为安卡拉病。随后本病逐渐蔓延至世界各地,给养禽业造成巨大的经济损失。FAdV-4具有明显的致病年龄段,对3-5周龄的致病力最强,即可通过水平传播也可通过垂直传播。其主要病变为心包腔积有清亮或淡黄色的水样或果冻状液体,肝脏有局灶性坏死出血。病理组织切片观察肝脏,肝细胞出现大量的嗜碱性核内包涵体。
本病主要发生于3~5周龄的肉鸡、817麻鸡,偶见于20周龄肉种鸡和蛋鸡,其中以3~7周龄的鸡易发病。发病鸡群多于感染后3周龄开始死亡,4~5周龄达高峰,高峰持续期4~8d,5~6周龄死亡减少。病程8~15d,死亡率高达80%。发病鸡无明显先兆而突然倒地,沉郁,羽毛成束,出现呼吸道症状,两腿划空。鸡感染后可成为终身带毒者,并可间歇性排毒。
自2014年江苏省第一次报到禽腺病毒的爆发,本病已在全国多地集中爆发,尤其是河南湖北和山东等地,对养禽产业造成巨大损失。通过对我国流行的Ⅰ群禽腺病毒进行血清型和基因型分析,发现我国主要流行A、B、C三种基因型,共6个血清型(火鸡1型、1型、4型、5型、8a/b型)。调查发现近期在豫南、皖北、苏北、鲁西北和胶东地区流行的禽腺病毒主要是血清4型和8a/b型,对鸡群的致死率较高,发病急,蔓延迅速,对我国的养禽业造成了巨大的威胁。因此,研制安全有效的I群禽腺病毒灭活疫苗,为提高国内I群禽腺病毒疫苗的防控能力和防止I群禽腺病毒蔓延具有重要的使用意义。
技术实现要素:
本发明目的是提供一种安卡拉病毒毒株FAdV-HB及其灭活疫苗的制备和应用。该安卡拉病毒毒株FAdV-HB具有免疫原性好、增殖滴度高
该制备方法将FAdV-HB毒株接种在鸡肝癌细胞(LMH)上,使病毒能在鸡肝癌细胞(LMH)上增殖,制备出能产生较高抗体的安卡拉病毒灭活疫苗。疫苗的生产工艺、安全性、保护效果、免疫程序和有效期实验研究表明该疫苗是安全有效的。
为实现上述目的,本发明提供的一株安卡拉病毒毒株FAdV-HB,从湖北应城发病鸡场的肝脏组织样品中分离得到,经PCR扩增,连接T载体进行测序检测鉴定该病毒为安卡拉病毒。该毒株FAdV-HB命名为:I群禽腺病毒株FAdv-HB,该毒株于2017年1月3日送交中国.武汉.武汉大学中国典型培养物保藏中心(CCTCC)保藏,保藏编号为CCTCC NO:V201703。
上述毒株FAdV-HB的形态特征:
FAdV-HB属于I群禽腺病毒,呈球形,病毒颗粒直径70-90nm(电镜图),无囊膜,其基因组为单分子的、线状、双股DNA,二十面体对称结构;DNA的分子量大小约45kb,占整个病毒粒子的11.3%~13.5%,其余部分为蛋白;病毒粒子具有252壳粒,其中二十面体的顶角壳粒为12个五邻体(penton),每个五邻体有二条纤维突起,长度为100A-370A,这些纤突以五邻体为基底由衣壳表面伸出,纤突顶端形成头节区;五邻体和纤突的头节区可与细胞表面的病毒受体结合,在病毒感染细胞过程中起着非常重要的作用;此外,二十面体上还有240个非顶角壳粒,称为六邻体(Hexon);六邻体是病毒粒子内最大的蛋白,是禽腺病毒的主要表面抗原蛋白,含有型、型间特异性抗原表位及中和性抗原表位;病毒含有约14条多肽,多肽II为hexon,III为五邻体;IIIa为五邻体周围蛋白;IV为纤维蛋白62K,V为核心蛋白;VI为六邻体相关蛋白;VII为核心蛋白II;VIII为五邻体相关蛋白;IX为9个六邻体组的特异性蛋白;TP为DNA的末端蛋白。
利用上述安卡拉病毒毒株FAdV-HB制备灭活疫苗的方法,其特征在于:包括以下步骤:
1)将上述毒株FAdV-HB接种鸡肝癌细胞上,培养,收获病毒液,
2)经甲醛灭活后与矿物油佐剂混合乳化制成安卡拉灭活疫苗,用于预防安卡拉。
本发明还提供了一种上述制备得到的灭活疫苗在预防安卡拉病中的应用。
本发明的有益效果在于:
1、本发明提供FAdV-HB毒株,能在鸡肝癌细胞(LMH)上稳定增殖。由这个毒株制备的毒株FAdv-HB灭活疫苗能有效预防安卡拉病。
2、本发明制备的疫苗稳定性好,试验证明具有良好的安全性,免疫保护效果达到100%。
附图说明
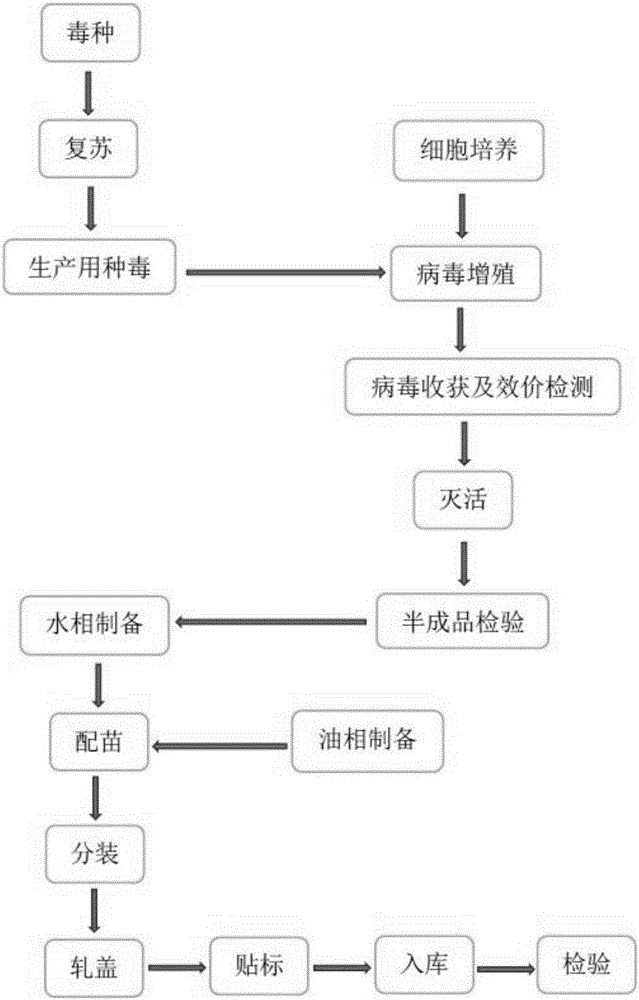
图1为本发明的总体技术流程图;
图2为安卡拉病毒的电镜图;
图3为凝胶电泳图;
图中,1:阴性对照、M:2000Plus Maker、2:PCR产物;
图4为安卡拉病毒接种LMH细胞的细胞病变情况图;
图中,4A为正常细胞对照图,4B为接毒后细胞病变图
图5为免疫鸡与未免疫对照鸡攻毒后剖解的病理变化图;
图6为遗传进化分析图。
具体实施方式
为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。
实施例1 安卡拉灭活疫苗的制备
1、FAdV-HB毒株的分离鉴定
自2013年以来,湖北,山东,河南多地肉鸡场爆发一种致死率高达80%的禽病,该病多对3-5周龄肉鸡致死,并且多数死鸡剖检呈现明显心包积水和肝炎症状。2015年,发明人在湖北麻城鸡场出现严重心包积水和肝炎的病死鸡的脏器中成功分离到本株毒。
具体操作步骤如下:
1.1 病毒分离
无菌采集病死鸡病变明显的脏器(心脏、肝脏)剪碎匀浆后,按1:4(v/v)的比例加入灭菌PBS,反复冻融3次后3000r/min离心30min,取上清加入青链霉素,使终浓度均为10000单位/ml,4℃过夜。用0.22μm的滤器过滤除菌,滤过液无菌检验合格后-80℃低温冰箱中保存备用。将上滤过液经卵黄囊接种6日龄SPF鸡胚,0.2ml/胚,弃24h内死胚,取接种48h-168h内死亡鸡胚的尿囊液和胎儿,用上述方法处理后连续传3代,观察第3代死胚肝脏和病变。死胚胚体缩小,出血,肝脏肿大出血。收集死胚胚体和尿囊液,-80℃保存备用。
1.2 空斑纯化
将尿囊液用0.22μm的滤器过滤除菌。将LMH传代细胞接6孔板,使其生长成无空隙的单层细胞。倒掉生长液,并用PBS液将已长好的单层细胞洗2次,2ml PBS/孔/次。加1000倍稀释的尿囊液悬液0.5mL/孔,并使之均匀布满于细胞表面,置37℃吸附1h。吸附结束后,用PBS液洗2次,2ml PBS/孔/次。加预温至46~50℃的1.6%的低熔点琼脂和2%的无酚红的DMEM等体积混合液(加1%的胎牛血清),2mL/孔,并迅速使其均匀覆盖于细胞层,然后4℃放置10min左右。待琼脂完全凝固,置于37℃温箱培养3天。当肉眼观察到有局部病灶(即琼脂下细胞层中有白色“斑点”)出现后,用中性红染色液(配制浓度为1%,用时用无菌PBS 1:10稀释,每孔加1-2mL。染色(避光操作),并使之均匀布满于琼脂层表面,37℃温箱避光放置1h后,吸去中性红染色液,即可见红色背景下无色的蚀斑。
用白色无菌枪头挑选较大的蚀斑于2%胎牛血清的F12维持液中,-80℃保存备用。同样的方法接毒挑斑纯化至少三代后保留毒液于-80℃备用。
1.2 病毒的鉴定
1.2.1 引物设计与合成 参照GENEBANK上公布的基因序列,设计39对引物扩增病毒全基因组,引物由武汉奥科鼎盛生物科技有限公司合成。
FADV-1F CATCATCTTATATAACCGCGTCT
FADV-1R CCTCCTCGGATCGTGTCAT
FADV-2F TTGAGCGAATCTTTACACCG
FADV-2R TCCACCATAGTTCCCTCCC
FADV-3F GTGGATTGGCGGAATAGGG
FADV-3R TTGGGTTGACGAAGTAAGAGCA
FADV-4F GCGTCCTTCTTGATCCTCG
FADV-4R CGTCCACCTGTCCTGCTTC
FADV-5F ACTTGTTCGTCTTCGGGTGTC
FADV-5R CCTGTTCCTCCAACTGCCTC
FADV-6F GGATGCTACTCTGGCGTTGT
FADV-6R CGACTCCTTTCGCTGGTG
FADV-7F GCGAGTCTGAGGGAGAAATG
FADV-7R CCACAACGAGCAGCTAACG
FADV-8F GGGGTGTTCGGTGTCGTA
FADV-8R TAGACATCATCACGCTTCACAA
FADV-9F GGGCGTTGCTGAGCATTT
FADV-9R CACCTTACCGTCCGATTTCTA
FADV-10F ATGAAACGCACAAAGACGG
FADV-10R AGACAAGTCGGGAGACATCG
FADV-11F GATGGTATCGCTGTTGGAAGTC
FADV-11R GTCACCGACAGATCCGGATTAC
FADV-12F TATCGCTGTTGGAAGTCGC
FADV-12R AGAGGAGTCGTCGTGGGTC
FADV-13F TCTATACGTGCTTTCGGTGGT
FADV-13R GCTGCGGGTTCAGTTTGA
FADV-14F TATCGCTCGGGACAGGTAGT
FADV-14R GCCGTAGTCGTAGAAGGTGC
FADV-15F TTGCTCCGCTTGTTCGTG
FADV-15R CGGTAAGTGTCCCTTAATAATGG
FADV-16F GCGGAATCAGAGGGTCGGGACT
FADV-16R ATCGGGCACCGTCAGCAAGG
FADV-17F AACGCTGCTCCCCTTTTA
FADV-17R GCCCGTAGTCAGGTCTCG
FADV-18F ACAGACAGGACGGACCAGC
FADV-18R TGCGAACCTAGACGAAACG
FADV-19F GAGATGGTGACGGAGGTG
FADV-19R CCAGTTTCTGTGGTGGTTG
FADV-20F CCAACGCCACTACCAACT
FADV-20R GAAAGCGGTGACGAGGAT
FADV-21F GTGGACCATCCCGTTCAGT
FADV-21R GCATCGAGCAGTGCGTGT
FADV-22F TGTGCGGGTGCTTGTGGT
FADV-22R GCGAGGTAGGAGGCGACTAA
FADV-23F CTGGTCGTCTTCTTCTTCGG
FADV-23R CAGAGTCGCTAGAGTGGCTAAA
FADV-24F CGGTTACTATTCGGCAGATGG
FADV-24R GATAAGCCTCGATGGTTTCCT
FADV-25F CCTTCCATCACGGTTTCG
FADV-25R TGCTCATCTGGTCCTCTTCC
FADV-26F GCCCGAAATCTACAATCCC
FADV-26R ACCTCCCATCATGCCTCC
FADV-27F CAGACCAACAGCCCTACGC
FADV-27R CGAGCACTTTGAGCACCC
FADV-28F GCCACTAAGCAAGCCAACG
FADV-28R CCTGATCCACGAGCAAGGT
FADV-29F ACGATGACTGGGAACTGGC
FADV-29R GGACAAATGGACGATCAATAAA
FADV-30F CCGCTACACCCTTCTATGCT
FADV-30R CGGTCCCTTCTGTGATTGC
FADV-31F CGGAGATTTGCGATTGTGAGT
FADV-31R TGACTCATCATGGGTGTGGC
FADV-32F ACACTAACTTCCTCATTGACCCTC
FADV-32R TGTCTGTCTGAACCTGCCTACC
FADV-33F ACGATGGCGTGATAGGCGGAGC
FADV-33R ATGAACCGTAGCCCCGCCCTTT
FADV-34F ACTACCGAGATCAGCCTGAAGA
FADV-34R CAGACTAAGGGAAAGTTGGAGAA
FADV-35F GAAATGCTTCCTCCTTCACG
FADV-35R AAGTTTATAGGGATCTCGGGTTA
FADV-36F AACCCGAGATCCCTATAAACTT
FADV-36R TAGTGCCTGTCCATTTGCC
FADV-37F TGGCAAATGGACAGGCACT
FADV-37R TTGATTCGGTGGAGGTCGT
FADV-38F CCCACTACCGCTACCACCAC
FADV-38R ATCACGCTGACGCTCCTCC
FADV-39F AGCATGAATCAACTCGGTGTC
FADV-39R CATCATCTTATATAACCGCGTCT。
1.2.2 病毒基因组的提取
取1ml收获的鸡胚尿囊液12,000r/min(4℃)离心10min,除去杂质,收集上清。参照北京全式金EsayPure Viral DNA/RNA Kit说明书提取病毒基因组,最后每200μl尿囊液的病毒DNA用20μlDEPC水溶解。
1.2.3 PCR扩增
PCR反应体系如下:基因组3μl,10×Trans Buffer 5μl,dNTP 3μl,TransTaq DNA Polymerase 1μl,上、下游引物各2μl,补H2O至50μl。按以下程序进行PCR扩增:95℃变性5min后进行94℃变性30s,55℃退火30s,72℃延伸3min的35个循坏,最后72℃延伸10min,保存于16℃。PCR产物用0.8%琼脂糖凝胶电泳检测。
1.2.4 PCR产物测序分析
将上述PCR扩增产物经1%琼脂凝胶回收后,连接pMD-18T载体,筛选2个阳性克隆送武汉奥科鼎盛生物科技有限公司测序。测序结果经遗传进化分析后,确定本发明的分离株为安卡拉病毒C种基因4型(进化分析图)。将该毒株命名为I群禽腺病毒株FAdv-HB,于2017年1月3日送交中国.武汉.武汉大学中国典型培养物保藏中心(CCTCC)保藏,其保藏号为:CCTCC NO:V201703。
2 FAdV-HB株的特性
2.1 血凝特性试验
红细胞凝集特性:无菌采集SPF鸡、鸡以及大鼠的血液5ml,制备鸡红细胞和鸡红细胞以及鼠红细胞,4℃备用。用常规方法检测分离的病毒株是否具有凝集这些红细胞的特性。结果:分离毒株对这些红细胞均无凝集特性。
2.2 理化特性检验
分离毒株FAdV-HB株的理化特性:根据《动物病毒学》介绍的方法,将病毒液分别用5-溴尿嘧啶-2’-脱氧核苷(BUDR)、氯仿、乙醚、盐酸(pH3.0)、氢氧化钠(pH10.0)以及温度(60℃,1h)处理后,另设PBS处理的病毒液为对照组,接种鸡胚(0.2ml/胚),观察鸡胚病变,并4d后取尿囊液和组织PCR检测。若鸡胚无明显病变,且PCR检测为阴性则为阴性,否则为阳性。结果:分离毒株经BUDR、氢氧化钠(pH10.0)和温度(60℃,1h)处理后,PCR检测结果为阴性,表明分离毒株的核酸类型为DNA,病毒不耐碱、不耐热,60℃处理1h后即可被灭活;而经氯仿、乙醚、盐酸(pH3.0)以及PBS处理后,PCR检测结果为阳性,表明病毒没有脂质囊膜,对乙醚和氯仿有抵抗力,耐酸。
2.3 琼脂扩散试验
按“中华人民共和国兽药典”第三部(中国兽药典委员会编,中国农业出版社,2010版,以下简称“中国兽药典”)琼脂扩散试验用含0.01%硫柳汞的PBS制备1%琼脂平板,并在其上按六角形方法打孔,孔径为5mm,孔距为3mm。加样时,中央孔滴加抗原,周围孔滴加制备的安卡拉病毒标准阳性血清以及制备的标准阴性血清。抗原与阳性血清的滴加量均以孔满为度。加样后,将琼脂平板置15~30℃反应48~72小时判定。抗原与制备的安卡拉病毒标准阳性血清形成明显的沉淀线,与制备的安卡拉病毒标准阴性血清未形成沉淀线。
2.4 回归试验
选择5周龄安卡拉病毒抗体阴性雏鸡共10只对分离FAdV-HB株进行回归试验。选取5只鸡大腿内侧肌肉接种病毒,每只0.2ml(2.5×10-4TCID50/ml),选取5只鸡做为空白对照组,注射等量的PBS。将感染试验鸡和空白对照鸡分别置于不同鸡栏饲养,每天观察各组鸡的采食饮水、精神状态等,感染后第15日剖杀所有鸡,观察各个脏器的病理变化,无菌采集病料,对病料进行处理后提取病毒基因组进行PCR鉴定。
根据安卡拉病Hexon基因保守序列设计出一对鉴定引物,扩增片段为564bp,引物序列如下:
F:5’-TGCTCGTTG TGGATGGTGAA-3’
R:5’-CTC CGTGTTGGGCT GGTC-3’;
PCR反应体系如下:基因组2μl,10×Trans Buffer 2.5μl,TransTaq DNA Polymerase 0.5μl,上、下游引物各1μl,补H2O至25μl。反应程序如下:95℃变性5min后进行94℃变性30s,55℃退火30s,72℃延伸45s的35个循坏,最后72℃延伸10min,保存于16℃。PCR产物用0.8%琼脂糖凝胶电泳检测。
感染后逐日观察,记录鸡的临床表现。第3天开始部分感染鸡逐渐出现临床症状,主要表现为采食量下降,精神沉郁,站立不稳;病鸡逐渐卧地不起,不再采食,突然倒地死亡,死亡多发生在夜间;第4天和第5天为死亡的高峰期,从第6天开始病鸡群逐渐恢复精神和食欲,不再死亡。对照组鸡食欲及精神状况表现正常,未有死亡。对死亡的鸡进行剖检可观察到:心包腔积有清亮或淡黄色的水样,肝脏表面有局灶性坏死。第10天剖检所有未死亡的感染试验鸡和空白对照鸡,感染实验组部分鸡同样可观察到心包腔积有清亮或淡黄色的水样,肝脏表面有局灶性坏死,而剖检对照组未发现脏器病理变化。对所有试验鸡的脏器经过匀浆处理后,冻融三次,根据安卡拉病毒Hexon基因设计鉴定引物,并对组织进行PCR扩增,结果扩增出来564bp大小的目的片段,说明感染的病毒在鸡体内得到了复制,是引起鸡发病的致病原。
2.5 毒种传代试验
将分离到的安卡拉病毒株按常规方法在鸡肝癌细胞(LMH)上进行传代,当传到第10代时,病毒的含量可达到107.5TCID50/ml。将LMH第10代的病毒液记为H1代,一直传到H6代,并测定每一代病毒的含量,均可达到107.0TCID50/ml。
2.6 纯净性试验
2.6.1 无菌检验 将上述步骤2.5得到的H6代毒种按照“中国兽药典”规定的方法进行,利用硫乙酸盐培养基(检查T.G,参见中国兽药典第三部)、酪胨琼脂斜面(简称G.A,参见中国兽药典第三部)和葡萄糖蛋白胨汤(简称G.P,参见中国兽药典第三部)进行无菌检验。
2.6.2 支原体检验 将安卡拉病毒的H6代毒种接种改良Frey氏培养基(参见中国兽药典第三部),按“中国兽药典”规定方法进行检验。
2.6.3 外源病毒检测 安卡拉病毒基础种子批病毒液,进行适当稀释,与安卡拉病毒高免阳性血清进行中和,中和后的病毒液按现行中国兽药典规定的方法进行外源病毒检测。
鸡胚检查法和细胞检查法检测禽流感病毒和新城疫病毒显示安卡拉病毒基础种子批血凝试验为阴性,也未出现红细胞吸附现象,表明该H6代次毒未受到禽流感病毒和新城疫病毒的污染;ELISA法检测禽淋巴白血病病毒显示安卡拉病毒基础种子批S/P值小于0.2,表明该H6代次未受到禽淋巴白血病病毒的污染。结果表明安卡拉病毒基础种子批无细菌、支原体、外源病毒污染。结果见表1,表明本发明所涉及的病毒是纯净的。
2.6.4 FAdV-HB株病毒含量测定 将LMH细胞用0.25%的胰酶消化,用含有10%胎牛血清的F12培养基将细胞吹打下来,取合适的细胞量铺于96孔细胞培养板中,每孔100μl,置37℃、5%CO2细胞培养箱培养,待细胞形成单层后,用含有2%胎牛血清的F12细胞维持液在灭菌离心管中将病毒液作10-1~10-10连续10倍的稀释,将稀释好的病毒液接种到96孔微量培养板中,每一稀释度接种一纵排共8孔,每孔接种100μl;同时设立不接毒的正常细胞对照,37℃培养3~4d,在倒置显微镜下观察结果,按Reed-Muench法计算半数细胞培养感染量(TCID50)。
距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)
lgTCID50=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数。
表1 安卡拉病毒HB株H6代毒种纯净、病毒含量检测结果
2.6.5 免疫原性试验取第H6代的病毒液,灭活前病毒含量应≥107.0TCID50/ml,灭活后按本规程制成疫苗。将20只3日龄白来航鸡(SPF鸡)随机分成两组,每组10只。免疫组颈部皮下接种该疫苗0.3ml/只,免疫四周后采血分离血清,并用ELISA方法检测每只鸡的抗体水平。采血分离血清后接种FAdV-HB株0.2ml(病毒含量为2.5×10-4.5TCID50)并观察发病及死亡情况。在感染第10日剖杀所有鸡,观察记录心脏及肝脏组织病理变化,根据发病判定标准统计发病情况。空白组同样方法注射等量PBS。结果显示免疫组10/10都能得到保护,而对照组有8/10发病。表明该代基础种子病毒免疫原性良好,具有较好的保护效果。
发病判定标准:
(1)鸡群出现精神沉郁、食欲减退,行动蹒跚、卧地不起等症状
(2)攻毒后10天内死亡。
(3)对攻毒后10天,未死的鸡进行剖检,出现心包积液或肝脏出血。
以上三项出现任意一项判为发病。
攻毒试验结果见表2所述。
表2 安卡拉病毒HB毒株代免疫原性测定结果
注:“-”表示没有发病,“+”表示发病
2.6.6 特异性试验
经安卡拉病毒特异性血清中和后,FAdV-HB株H6代病毒液接种已长满80%的鸡肝癌细胞(LMH),72小时后细胞未出现病变,未经安卡拉病毒特异性血清中和的病毒液接种的细胞出现病变。表明病毒完全被安卡拉病毒特异性血清中和。分别经禽流感(H9)病毒特异性血清、新城疫病毒特异性血清、禽白血病病毒特异性血清中和后,FAdV-HB株H6代病毒液接种已长满80%的LMH细胞,72小时后细胞出现病变,表明病毒不能被安卡拉病毒特异性血清中和,结果见表3。
表3 特异性试验
2.6.7 对鸡的毒力试验
将已知病毒含量的H6代病毒液每0.2ml/只,(病毒含量为2.5×10-4.5TCID50),腿部肌肉接种3周龄雏鸡10只,同时设立空白对照组10只。观察感染后的试验组合对照组的死亡情况,并在感染10日后剖杀所有试验鸡,观察记录心脏及肝脏病理变化,根据制定的发病判定标准统计发病情况,感染组发病数达到9/10,空白对照组发病数为0/10。结果表明FAdV-HB株H6代基础种子病毒液有较强的毒力。试验结果见表4。
表4 H6代病毒液对鸡的毒力试验结果
注:“-”表示没有发病,“+”表示发病
3 安卡拉病毒病灭活疫苗的制备
3.1 制苗用病毒液的制备
3.1.1 传代
制苗材料的选择:选择用鸡肝癌细胞(LMH)作为制苗材料。
细胞传代:将细胞从液氮罐中取出,37℃水浴使其融化,转入细胞培养瓶中,加入细胞培养液,置37℃、5%CO2培养箱中培养,待细胞长满单层时,加入0.25%EDTA的胰酶消化细胞,进行传代扩大细胞。
选取长势良好的细胞,待细胞长至80%时,弃掉原培养基,加入生产用毒种,37℃、5%CO2培养箱中培养。待细胞病变达到80%以上时,收获细胞,-80度冰箱反复冻融3次备用。
3.1.2 病毒含量的测定 参照2.4.4测定病毒的含量,每毫升的病毒含量应≥107.0TCID50。
3.2 灭活 向检测合格的病毒液中加入甲醛溶液,使甲醛溶液的终浓度为0.2%,边加边摇,使其充分混合,然后置37℃条件下灭活,从抗原液温度升至37℃开始计时,灭活24小时。灭活完毕后,对灭活后的病毒液取样,进行无菌检验及灭活检验,取样后置2~8℃保存,应不超过30日。
3.3 半成品检验
3.3.1 无菌检验 取灭活的病毒液按现行《中国兽药典》附录进行检验,应无菌生长。
3.3.2 灭活检验
取灭活的病毒接种6日龄SPF鸡胚,每枚0.2ml,置相对湿度60%-65%、温度37℃条件下孵育。24h内死亡鸡胚不计,收获尿囊液。提取病毒基因组,PCR鉴定,应没有预期条带。同时设有同批未经灭活的病毒液作为对照,应出现预期大小的条带。并盲传1代,PCR鉴定如没有预期条带,即为灭活完全。
3.4 油乳剂灭活苗的制备
3.4.1 油相制备 取油94份(以毫升为单位),加入硬脂酸铝2份(以克为单位),边加热边搅拌,直到透明为止,再加入6份司本80(以毫升为单位),充分混匀,高压灭菌后冷却至室温备用。
3.4.2 水相制备 取检验合格的灭活病毒液,使每羽份终产品中抗原含量≥1.7×107.0EID50。按每100份病毒液加入4份灭菌的吐温80,直到吐温80彻底溶解。
3.4.3 乳化 将1份油相注入乳化罐内,慢速搅拌同时缓缓加入1份水相,加完后,中速混合,然后高速乳化。在乳化终止前加入1%硫柳汞液,使其终浓度为0.01%。
3.4.4 分装 将乳化好的疫苗定量分装,加盖密封。贴标签,置2~8℃保存。
4 成品检验
4.1 性状
外观 乳白色乳状液。
剂型 为油包水型。取一清洁吸管,吸取少量疫苗滴于冷水中,除第一滴呈云雾状扩散外,以后各滴均不应扩散。
稳定性 取10ml疫苗装于试管内,以3500r/min离心15分钟,应不出现破乳现象,但允许出现轻微分层,管底析出水相层深度不超过0.5ml为合格。
粘度 用1ml吸管(下口内径为1.2mm,上口内径为2.7mm),吸取25℃左右的疫苗lml,令其垂直自然流出,记录流出0.4ml所需时间,应不超过8秒。
4.2 无菌检验 按《中国兽药典》附录15页进行检验,应无菌生长。
4.3 安全检验 颈部皮下免疫1-3日龄安卡拉病毒抗体阴性鸡(S/P<0.5)10只,每只0.3ml,观察14日,结果显示无不良反应,且全部健活。
4.4 效力检验 可采用血清学方法和免疫保护性试验进行检验。
血清学方法选取1-3日龄安卡拉病毒抗体阴性鸡(S/P<0.5)10只,每只颈部皮下接种疫苗0.3ml。14日后,连同相同条件下饲养的非免疫对照鸡10只,分别采血分离血清,用酶联免疫吸附试验(ELISA)测定血清抗体,10只免疫鸡的抗体均为阳性(S/P≥0.5),10只非免疫对照鸡的抗体均为阴性(S/P<0.5)。
免疫保护性试验 选1-3日龄安卡拉病毒抗体阴性鸡(S/P<0.5)10只,每只肌肉注射疫苗0.3ml。免疫14日后,连同非免疫对照鸡10只用FAdV-HB株进行腿部部肌肉接种,每只0.2ml(病毒含量为2.5×10-4.5TCID50),感染后第10日剖杀所有鸡观察心脏及肝脏病理变化,统计发病情况。免疫鸡应至少8只保护,对照组应至少8只发病。
发病判定标准:
(1)出现精神不振、行动蹒跚、卧地不起、羽毛杂乱等
(2)攻毒后10天内死亡。
(3)对攻毒后10天,未死的鸡进行剖检,出现心包积液或肝脏出血。
以上三项出现任意一项判为发病。
实施例2 安卡拉病毒病活疫苗的安全性试验
1 疫苗与试验动物
用本发明人试制的安卡拉灭活疫苗,批号分别为0101、0102、0103。供试用的鸡品种为白来航,由山东济南斯派福瑞禽业科技有限公司提供。
2 疫苗的安全性试验
本实施例检测了以上3批实验室疫苗的安全性,对白来航雏鸡进行免疫,用于检测该批实验室疫苗对白来航雏鸡的安全性,包括疫苗对白来航雏鸡一次单剂量接种的安全性、单剂量重复接种的安全性和一次超剂量接种的安全性。
2.1 对白来航雏鸡一次单剂量接种的安全性
将三批疫苗以单剂量分别接种1-3日龄雏鸡(白来航)后,雏鸡采食、临床症状等均表现正常,未见异常变化,疫苗免疫后14日接种部位也未见异常变化,说明该疫苗对白来航雏鸡单剂量接种安全性好。(表5)
表5 三批疫苗单剂量接种白来航雏鸡的安全性检测
2.2 对白来航雏鸡单剂量重复接种的安全性
将三批疫苗以单剂量分别接种1-3日龄白来航雏鸡后,间隔14日后每只再以单剂量重复接种0.3ml疫苗,继续观察14日,观察鸡群的临床症状及采食,结果显示白来航雏鸡在单剂量重复接种疫苗后采食、临床症状等均表现正常,未见异常变化,疫苗免疫后28日接种部位也未见异常变化,说明该疫苗对白来航雏鸡单剂量重复接种安全性好。(表6)
表6 三批疫苗单剂量重复接种白来航雏鸡的安全性检测
2.3 对白来航雏鸡一次超剂量接种的安全性
将三批疫苗以超剂量分别接种1-3日龄白来航雏鸡后,雏鸡采食、临床症状等均表现正常,未见异常变化,疫苗免疫后14日接种部位也未见异常变化,说明该疫苗对雏鸡一次超剂量接种安全性好。(表7)
表7 三批疫苗一次超剂量剂量接种白来航雏鸡的安全性检测
实施例3 安卡拉灭活疫苗的疫苗效力试验
1 安卡拉灭活疫苗与试验动物
用本发明人试制的3批安卡拉灭活疫苗,批号分别为0101、0102、0103。安卡拉病毒抗体阴性的1-3日龄健康雏鸡为实验动物,由济南斯派福瑞禽业科技有限公司提供。
2 实验方法
将40只1-3日龄健康雏鸡随机分为4组,每组10只,实验室制备的三批疫苗(批号为0101、0102、0103)每批免疫1组,每只腿部肌肉注射疫苗0.3ml。剩下1组为相同条件下的非免疫对照。
3 免疫保护性试验
3.1 抗体水平检测
免疫14日后对30只免疫抗体监测组鸡群连同非免疫对照鸡10只进行翅静脉采血,待血清析出后3000rpm离心5min分离血清,血清-20℃保存或立即用I型禽腺病毒ELISA检测方法检测抗体水平。
结果显示三批疫苗免疫鸡的抗体水平(S/P值)都能达到0.5以上,其中0101批疫苗免疫鸡平均抗体(S/P值)为2.209,0102批疫苗免疫鸡平均抗体(S/P值)为2.187,0103批疫苗免疫鸡平均抗体(S/P值)为2.172,表明三批疫苗都能产生较高的抗体水平,且三批疫苗免疫鸡产生的抗体水平基本一致,无显著批间差异(P>0.05)。(结果见表8)
3.2 免疫保护力试验
免疫14日采血后,三个免疫组连同对照组共40只鸡,于腿部肌肉接种FAdV鸡胚适应毒株0.2ml(病毒含量为2.5×10-4.5TCID50)。感染10日后剖杀所有鸡并观察记录心脏及肝脏的组织病理变化,根据制定的发病判定标准统计发病情况。非免疫对照组鸡会出现采食量下降,精神沉郁,站立不稳;病鸡逐渐卧地不起,不再采食等临床症状,10日后剖杀鸡会出现安卡拉的典型病理变化,如心包腔积有清亮或淡黄色的水样,肝脏表面有局灶性坏死(见图5)。根据制定的发病判定标准统计各组鸡的发病情况以及疫苗的保护力。
统计数据显示0101批次的疫苗能使8/10的试验鸡得到保护,0102批次的疫苗能使9/10的试验鸡得到保护,0103批次的疫苗能使8/10的试验鸡得到保护,而非免疫对照组8/10发病。结果表明三个批次的疫苗都能产生良好的免疫保护效果(结果见表8)。
发病判定标准:
(1)出现精神不振、行动蹒跚、卧地不起、羽毛杂乱等
(2)攻毒后10天内死亡。
(3)对攻毒后10天,未死的鸡进行剖解观察病变,若出现心包积液或肝脏出血。以上三项出现任意一项判为发病。
表8 三批疫苗免疫35日后ELISA抗体水平及攻毒保护情况
注:“-”表示没有发病,“+”表示发病
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 还没有人留言评论。精彩留言会获得点赞!