水稻紫叶基因PL1的分子标记及其鉴定方法和应用与流程
本发明涉及分子生物学领域,特别是一种水稻紫叶基因PL1的分子标记及其鉴定方法和应用。
背景技术:
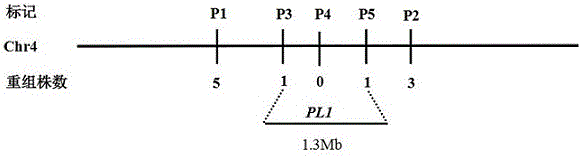
:水稻是人类最重要的粮食作物之一,更是我国的第一大粮食作物,因此如何提高水稻的产量是我国农业生产的关键问题。上世纪70年代,以袁隆平为代表的我国水稻育种家们成功地培育出的三系法杂交水稻极大地提高了水稻的单产,缓解了我国人口迅速增长与粮食短缺的矛盾。但在杂交水稻种子生产过程中,如何保证水稻杂交种和不育系的纯度是一个困扰育种家们的难题。常规人工除杂技术费用高,周期长,且许多性状受栽培技术及环境因素的影响而不易辨别,影响除杂的效果。利用叶色标记去杂具有成本低、效果好、不易受环境影响等特点,因此,开展叶色标记研究对保证杂交稻制种和不育系繁殖纯度具有重要的实际意义,不仅缩短鉴定周期,而且节省费用,对杂交稻的生产有着极其重要的意义。水稻紫叶性状是一个明显的叶色标记,越来越多的育种学家已将其运用于不育系种子纯度的鉴定。例如将隐性紫叶性状导入水稻不育系,不育系在苗期表现紫色,而其配组的杂种FI为正常绿色,两者很容易区别,这样在育秧期间就可以根据叶色差于人工剔除混杂的不育系及三系杂交稻中的保持系秧苗,达到去杂保纯的目的。而在不育系繁种时,如果隐性紫叶不育系与其它正常绿叶稻串粉结实,其长成的幼苗表现为绿色,在制种田里就可以去除,从而确保制种田里不育系的纯度。以下为相关报道记载:曹立勇等,作物学报,1999(1):44-49;紫叶标记籼型光—温敏核不育系中紫S的选育及其配组的杂种优势:曹立勇等利用籼型紫叶稻CN-pl成功地选育出籼型紫叶不育系“中紫S”。杨腾帮等,福建农业科技,2005(1):3-5,具有隐性紫叶标记性状的籼型光敏核不育系明紫02S的选育;杨腾帮等,福建农业科技,2005(5):54-56;隐性紫叶光温敏核不育水稻明紫03S的选育:杨腾帮等将紫叶性状导入到不育系中,选育出明紫-2S和明紫-3S。余显权等,贵州农业科学,2003,31(3):3-7,隐性紫叶水稻的改良及其应用探讨:余显权等利用原始材料Parptecknck杂交转育出99Hll4紫S。向关伦等,种子,2007,26(1):93-95,水稻不育系紫ⅡA的选育:向关伦等利用庚紫与珍汕97B和II-32B杂交选育出紫IIA。邓国富等,中国稻米,2008(5):26-28,水稻紫红叶标记不育系先红A的选育及应用:邓国富等将紫叶稻IR1552的紫色性状导入到籼型三系不育系和两系不育系中,成功地选育出籼型紫叶三系不育系先红A。在水稻紫叶性状基因的定位克隆研究方面,到目前为止,报道的定位基因有一个即PSH1,其被定位在1号染色体23.5kb的范围内,在此定位区间范围内,有6个候选基因(WangWY.etal.(2009)Genome,52:268-274)。被克隆的基因有两个,其中紫叶基因PL(Purpleleaf)是一个与花青素合成相关的转录因子,它负责转运CB基因和A基因产生的花色素,使水稻地上部分表现为紫色。该位点有3个等位基因PLi、PLj和PLw,其中PLw由玉米的2个基因,即OsB1和OsB2基因构成(Sakamoto,W.etal.Plantandcellphysiology,2001(42):982-991)。OsC1基因与玉米的C1基因同源,对50个水稻种质资源的OsC1基因测序结果表明,OsC1在水稻驯化的过程中,似乎没有遭受人工选择(Chin,HS.etal.Rice,2016,DOI10.1186/s12284-016-0080-y)。水稻紫叶基因PL1的的分子标记的获得,可以加快紫叶基因PL1的克隆和功能分析。同时,所获得的分子标记还可以运用于杂交种F1纯度的鉴定和紫叶不育系的培育,提高育种效率。技术实现要素:本发明提供了一种水稻紫叶基因PL1分子标记及其鉴定方法和应用,通过检测水稻紫叶基因PL1分子标记,可以确定有无紫叶基因PL1导入到育种品系中,从而提高该性状的选择效率、加快育种进度。为实现上述目的,本发明的技术方案为:所述分子标记分别是P1、P2、P3、P4、和P5,其对应的引物分别是:P1:上游引物:5'—AAATTATTGTTCACACGAAC—3';下游引物:5'—CTAAGAGAGGGTGTAATCCG—3';P2:上游引物:5'—AAAACTGCATTCATCCTAAA—3';下游引物:5'—TGTTTGTGGAGTGATTATCT—3';P3:上游引物:5'—tcctcatcggcttcttcttc—3';下游引物:5'—AGAACCCGTTCTACGTCACG—3;P4:上游引物:5'—GGCAATGTCAGTTCCTGATTT—3';下游引物:5'—AGGACGAGCACAACATACCC—3';P5:上游引物:5'—AGAGTGATGAGATGATGCTT—3';下游引物:5'—TACGCACACTGTTTACACG—3'。以上所述的水稻紫叶基因PL1分子标记的获取方法,包括以下步骤:将一个紫叶品种“广紫06”与绿叶品种Sasanishiki杂交,获得F1,自交后获得F2分离群体,选择F2群体中隐性的紫叶单株用于紫叶基因PL1的连锁分析和初步定位,获得以上所述的水稻紫叶基因PL1分子标记。本发明还提供了水稻紫叶基因PL1分子标记在水稻紫叶基因PL1的定位与克隆中的应用。以上所述的水稻紫叶基因PL1分子标记鉴定方法,包括以下步骤:以待鉴定水稻材料全基因组DNA为模板,利用以上所述的分子标记P1、P2、P3、P4和P5对应引物中的一对或多对进行PCR扩增,对扩增产物进行检测:(1)采用分子标记P1引物进行扩增,若扩增出130bp的扩增片段,则表明有紫叶基因PL1的存在;(2)采用分子标记P2引物进行扩增,若扩增出197bp的扩增片段,则表明有紫叶基因PL1的存在;(3)采用分子标记P3引物进行扩增,若扩增出83bp的扩增片段,则表明有紫叶基因PL1的存在;(4)采用分子标记P4引物进行扩增,若扩增出182bp的扩增片段,则表明有紫叶基因PL1的存在;(5)采用分子标记P5引物进行扩增,若扩增出107bp的扩增片段,则表明有紫叶基因PL1的存在。其中,以上所述PCR的反应体系如下:引物(4pmol/μL)2.5μLdNTP(2.5mmol/L)2.0μLDNA模板(25ng/μL)1.0μLTaqDNA聚合酶(5U/μL)0.2μL10×PCR缓冲液1.0μLddH2O3.3μL以上所述PCR的反应条件为:94℃变性5min,94℃30s,56℃30s,72℃60s,扩增35个循环,最后72℃终延伸10min。以上所述的分子标记鉴定方法,DNA扩增产物经聚丙烯酰胺凝胶电泳检测,并通过银染显色记录扩增的DNA条带。本发明的目的还在于提供了以上所述的分子标记方法在选育水稻紫叶品种中的应用。本发明的有益效果为:(1)本发明发现了一种水稻紫叶基因PL1的分子标记,该分子标记为一单核隐性基因标记,在生产上可以直接利用,利用该分子标记可以有效地解决不育系繁制种或杂交种F1筛选时机械混杂或生物学混杂引起的种子纯度问题。(2)本发明的分子标记稳定,不受栽培技术及环境因素的影响,因此可在苗期就能快速鉴定杂交稻种子或不育系的纯度,提高选择的效率或育种效率,加快育种进程。(3)通过加快水稻紫叶基因PL1的克隆,能进一步深化对紫叶基因PL1功能以及水稻驯化机制的理解。附图说明图1是水稻紫叶基因PL1在第4染色体上的初步定位示意图。图2是分子标记引物(P3和P5)对F2代24个紫稻单株扩增的结果。其中,图2A:分子标记引物P3对20个紫稻单株扩增的带型,第4株是交换单株;图2B:分子标记引物P5对20个紫稻单株扩增的带型,第10株是交换单株。具体实施方式下面结合实施实例,对本发明作进一步说明,但本发明的实施方式并不局限于以下实施例。实施例1:紫叶性状的遗传分析和基因定位(1)广紫06/Sasanishiki的F2分离群体的构建与遗传分析利用紫叶品种“广紫06”与绿叶品种Sasanishiki杂交获得F1杂交种,种植F1杂交种,自交获得F2分离群体,用于遗传分析。根据田间表型调查统计分析发现,在F2分离群体的542个单株中,绿叶单株有411株,紫叶单株有131株。卡方分析表明,绿叶单株和紫叶单株的比例符合3:1的分离比例(c2=0.199,R˃0.05),这表明“广紫06”的紫叶性状受一对隐性主效核基因控制。(2)PL1的分子标记连锁分析及初步定位从F2分离群体的542个单株中,选取131株紫叶表型的单株用于目标基因的初步定位,利用初步定位筛选出来的多态性分子标记对这131个隐性单株进行连锁分析,结果发现,PL1和4号染色体上的分子标记P1和P2存在连锁,两标记处各出现5和3个交换单株,且这些交换单株都不相同,表明目标基因位于标记P1和P2之间;为进一步缩小并明确目标基因的位置,继续利用分子标记P1和P2之间的三对分子标记P3、P4和P5,对这131个隐性单株进行连锁分析,如图1所示,结果表明,在分子标记P3、P4和P5处,分别有1个、0个、1个交换单株,而且分子标记P3上的1个交换单株包含在分子标记P1的5个交换单株内,分子标记P5上的1个交换单株包含在分子标记P2的3个交换单株内,并且和分子标记P1和P3上的交换单株不重复,证实了该基因位于第4染色体上,并且定位于分子标记P3和P5之间。如图2A所示,分子标记引物P3对紫稻单株的扩增带型,第4株是交换单株;如图2B所示,分子标记引物P5对紫稻单株的扩增带型,第10株是交换单株;结合图1所示,物理距离约为1.3Mb。上述连锁分析和初步定位过程,所采用的DNA提取方法和PCR反应条件分别为:A.用常规的CTAB法提取紫叶品种“广紫06”亲本、绿叶品种Sasanishiki亲本和F2分离群体各单株的DNA;B.PCR的反应体系如下:引物(4pmol/μL)2.5μLdNTP(2.5mmol/L)2.0μLDNA模板(25ng/μL)1.0μLTaqDNA聚合酶(5U/μL)0.2μL10×PCR缓冲液1.0μLddH2O3.3μLPCR反应条件为:94℃变性5min,94℃30s,56℃30s,72℃60s,扩增35个循环,最后72℃终延伸10min。DNA扩增产物经聚丙烯酰胺凝胶电泳检测,通过银染显色记录扩增的DNA条带。由上述过程可以看出利用这些与水稻紫叶基因PL1连锁的分子标记可以有效地开展水稻紫叶基因PL1的分子标记辅助选择育种、杂交种F1和不育系纯度的鉴定;同时可以利用大的分离群体,加快对水稻紫叶基因PL1的精细定位与图位克隆。(3)F2株系后代筛选分析利用获得的分子标记P3和P5,在F2株系后代中筛选了53个杂合单株构建F3定位群体,杂合单株分单株收获种植,每个株系均出现了绿叶与紫叶表型的分离,且绿叶单株和紫叶单株的分离比符合3:1的比例,其筛选准确率达到100%。说明利用PL1基因的分子标记P3和P5进行水稻紫叶性状的标记辅助选择是有效的。(4)结果分析上述结果表明,利用P1、P2、P3、P4和P5可对水稻紫叶基因PL1进行分子标记,其对应的引物如表1:表1定位的引物及其序列引物名称上游引物序列(5’-3’)下游引物序列(5’-3’)扩增产物大小(bp)P1AAATTATTGTTCACACGAACCTAAGAGAGGGTGTAATCCG广紫06:130Sasanishiki:192P2AAAACTGCATTCATCCTAAATGTTTGTGGAGTGATTATCT广紫06:197Sasanishiki:128P3tcctcatcggcttcttcttcAGAACCCGTTCTACGTCACG广紫06:83Sasanishiki:121P4GGCAATGTCAGTTCCTGATTTAGGACGAGCACAACATACCC广紫06:182Sasanishiki:156P5AGAGTGATGAGATGATGCTTTACGCACACTGTTTACACG广紫06:107Sasanishiki:128实施例2分子标记方法以待鉴定水稻材料全基因组DNA为模板,利用以上所述的分子标记P1、P2、P3、P4和P5对应引物中的一对或多对进行PCR扩增,对扩增产物进行检测。(一)用常规的CTAB法提取供体亲本、受体亲本和F2分离群体各单株的DNA;(二)PCR的反应体系如下:引物(4pmol/μL)2.5μLdNTP(2.5mmol/L)2.0μLDNA模板(25ng/μL)1.0μLTaqDNA聚合酶(5U/μL)0.2μL10×PCR缓冲液1.0μLddH2O3.3μLPCR反应条件为:94℃变性5min,94℃30s,56℃30s,72℃60s,扩增35个循环,最后72℃终延伸10min。DNA扩增产物经聚丙烯酰胺凝胶电泳检测,通过银染显色记录扩增的DNA条带。(三)结果分析(1)采用分子标记P1引物进行扩增,若扩增出130bp的扩增片段,则表明有紫叶基因PL1的存在;若能扩增出192bp的扩增片段,则表明有绿叶亲本Sasanishiki的扩增片段;(2)采用分子标记P2引物进行扩增,若扩增出197bp的扩增片段,则表明有紫叶基因PL1的存在;若能扩增出128bp的扩增片段,则表明有绿叶亲本Sasanishiki的扩增片段;(3)采用分子标记P3引物进行扩增,若扩增出83bp的扩增片段,则表明有紫叶基因PL1的存在;若能扩增出121bp的扩增片段,则表明有绿叶亲本Sasanishiki的扩增片段;(4)采用分子标记P4引物进行扩增,若扩增出182bp的扩增片段,则表明有紫叶基因PL1的存在;若能扩增出156bp的扩增片段,则表明有绿叶亲本Sasanishiki的扩增片段;(5)采用分子标记P5引物进行扩增,若扩增出107bp的扩增片段,则表明有紫叶基因PL1的存在;若能扩增出128bp的扩增片段,则表明有绿叶亲本Sasanishiki的扩增片段;基于上述5个分子标记来检测水稻不育系,可验证是否含有紫叶基因PL1的存在,可进行紫叶水稻不育系的选育,从而加快不育系的育种进度;同时可利用上述5个分子标记来检测杂种F1,快速区分真假杂种,提高杂种F1种子的纯度。序列表<110>广西大学<120>水稻紫叶基因PL1的分子标记及其鉴定方法和应用<160>10<210>1<211>20<212>DNA<213>人工序列<221>分子标记P1上游引物<400>1AAATTATTGTTCACACGAAC20<210>2<211>26<212>DNA<213>人工序列<221>分子标记P1下游引物<400>2CTAAGAGAGGGTGTAATCCG20<210>3<211>20<212>DNA<213>人工序列<221>分子标记P2上游引物<400>3AAAACTGCATTCATCCTAAA20<210>4<211>20<212>DNA<213>人工序列<221>分子标记P2下游引物<400>4TGTTTGTGGAGTGATTATCT20<210>5<211>20<212>DNA<213>人工序列<221>分子标记P3上游引物<400>5TCCTCATCGGCTTCTTCTTC20<210>6<211>20<212>DNA<213>人工序列<221>分子标记P3下游引物<400>6AGAACCCGTTCTACGTCACG20<210>7<211>21<212>DNA<213>人工序列<221>分子标记P4上游引物<400>7GGCAATGTCAGTTCCTGATTT21<210>8<211>20<212>DNA<213>人工序列<221>分子标记P4下游引物<400>8AGGACGAGCACAACATACCC20<210>9<211>20<212>DNA<213>人工序列<221>分子标记P5上游引物<400>9AGAGTGATGAGATGATGCTT20<210>10<211>20<212>DNA<213>人工序列<221>分子标记P5下游引物<400>10TACGCACACTGTTTACACG20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1