拟南芥At‐UGE2基因及其过表达突变株和缺失突变株在调节植物性状中的应用的制作方法
本发明属于植物基因工程领域,涉及一种拟南芥UDP‐葡萄糖4‐异构酶基因At‐UGE2及其过表达突变株35S::UGE2和缺失突变株uge2在调节植物产量相关性状及抗逆性状方面的转基因植物中的应用。
背景技术:
:
在植物生长发育过程中,经常会遭受诸如:低温、高温、干旱、盐碱等逆境环境因素的影响,这些因素往往会对植物的生长过程构成严重的非生物胁迫。由于植物自身的移动受限制,它们只能通过适应环境改变来维持生存,因此在漫长的适应进化过程中,植物不断形成了一套抵御逆境胁迫的生理机制。研究植物在逆境下的生理变化规律和分子机理,有利于深入解析植物的抗逆机制,在农业生产指导中培育具有优良性状的抗逆品种,从而提高农作物的产量和经济效益。
植物在逆境胁迫下易发生细胞失水,植物可通过快速调节细胞内可溶性糖、脯氨酸等渗透物质的含量来应对。糖类是植物细胞中重要的有机化合物,它与植物的生长发育和抵御逆境胁迫息息相关。核苷糖是植物体内一类重要的单糖物质,可由核苷二磷酸或核苷一磷酸与不同单糖异构体的羟基连接形成。核苷糖可由核苷糖互变转化酶催化反应,改变糖基团从而生成不同的糖类及其他代谢中间产物。研究发现,调控核苷糖生物合成、转化过程的这类酶是也植物响应逆境胁迫的重要功能基因,其中,UDP‐D‐葡萄糖4‐异构酶(亦称UDP‐半乳糖4‐异构酶,UGE;EC 5.1.3.2)是目前研究比较清楚的一类核苷糖互变转化酶,它催化了UDP‐D‐葡萄糖(UDP‐glucose,UDP‐glc)与UDP‐D‐半乳糖(UDP‐galactose,UDP‐gal)之间的互变反应。该反应过程具体为:(1)UGE催化UDP‐D‐葡萄糖C4位上羟基的氢转移到NAD+上,形成中间产物4‐呋喃糖和NADH;(2)NADH烟酰胺环上的H再转移到糖C4位的对应面上,形成UDP‐D‐半乳糖。UDP‐D‐半乳糖是半乳糖参与生物合成过程的活性形式,它是植物合成细胞壁多糖的重要物质,在植物细胞壁果胶、半纤维素、纤维素以及胞质的多糖中都含有大量半乳糖残基;UDP‐D‐半乳糖还与多种植物糖蛋白的核心寡糖连接,参与细胞信号转导过程;它还是贮存代谢物棉子糖和水苏糖的合成底物;此外,它还参与了单半乳糖二酰甘油脂(monogalactosyl diacylglycerol,MGDG)和双半乳糖二酰甘油脂(digalactosyl diacylglycerol,DGDG)的合成,这两类半乳 糖脂占植物叶绿体膜脂组成的75%左右,对于叶绿体功能的稳定至关重要。因此,UGE作为UDP‐D‐半乳糖合成途径中的关键酶,对于维持细胞内UDP‐D‐半乳糖与UDP‐D‐葡萄糖的动态平衡起到关键调节作用。研究表明,UGE基因的功能缺陷会引起酵母菌和植物发生严重的半乳糖不耐受,产生半乳糖毒性;在人类中,UGE基因的功能缺陷会导致血糖中的半乳糖含量升高造成半乳糖血症。目前,已从细菌、酿酒酵母、人类、水稻、大麦、马铃薯、瓜豆、白菜以及模式植物拟南芥中克隆到UGE基因,UGE基因的氨基酸编码序列在各种物种中都高度保守,同源性约为50%。在拟南芥基因组中共发现5个UGE编码基因,但它们介导的催化反应倾向不同,UGE1和UGE3倾向于催化糖类降解过程中释放的UDP‐D‐半乳糖生成UDP‐D‐葡萄糖,为新的生物合成反应提供原料,而UGE2、4、5倾向于催化UDP‐D‐葡萄糖向UDP‐D‐半乳糖转化,为细胞壁多糖和叶绿体膜半乳糖脂的合成提供底物。此外,这5个UGE基因在拟南芥组织器官中的表达模式也不同,UGE1主要在种子和根下胚轴中表达,UGE3在种子、花序及花中表达,UGE2和UGE5在衰老的叶片中表达,UGE4在根尖伸长区表达。在拟南芥中这五个UGE基因经常是协同发挥作用的,例如UGE2和UGE4在植物营养生长阶段共同作用于细胞壁多糖的生物合成,UGE2和UGE3在植物生殖生长阶段共同促进花粉的发育,而UGE1和UGE5在非生物胁迫下可非特异性地促进UGE酶活进而维持胁迫下植物的生长。UGE1基因在拟南芥中目前研究的最为系统清楚,与野生型植株相比UGE1基因缺失或过表达分别造成了UGE总酶活性降低10%或提升250%;在含有1%半乳糖的培养基上生长时,野生型拟南芥生长受到抑制,UGE1缺失突变株的抑制程度更强,UGE1过表达突变株则生长正常;在含有半乳糖的培养基上生长一段时间,野生型植株的UDP‐半乳糖含量升高,UDP‐葡萄糖含量下降,而在UGE1过表达突变体中UDP‐半乳糖和UDP‐葡萄糖的含量没有变化。造成以上的差异的原因可能是由于野生型和UGE1缺失突变株中UGE酶活达到上限,不能及时清理细胞内积累的UDP‐半乳糖,造成细胞毒性,进而抑制植株生长,而过表达UGE1突变株中UGE表达量及酶活较高,能更大限度地耐受半乳糖毒性,使植株得以正常生长。其它相关研究也发现,UGE基因不仅参与调控植物生长发育的某些过程,还部分地参与了植物对逆境胁迫的响应。例如,在已报道的拟南芥响应逆境胁迫的基因芯片数据中,低温、干旱、高盐等都可诱导UGE基因的表达升高;水稻UGE1基因的表达量受干旱、高盐及紫外线胁迫诱导,并在缺氮条件下负责糖类的分配;将水稻的UGE1基因转入拟南芥中表达,虽未改变拟南芥的形态特征,但却改变了其中棉子糖含量和对非生物胁迫的抗性。因此,UGE基因不仅为植物生长代谢提供了原料核苷糖,还参与了植物对逆境胁迫的响应,系统深入的研究其功能具有重要的理论价值和现实意义。
技术实现要素:
:
本发明的目的在于提供一种拟南芥UDP‐葡萄糖4‐异构酶基因At‐UGE2及其过表达突变株35S::UGE2和缺失突变株uge2在调控植物产量相关性状及抗逆性状中的应用。
为实现本发明的上述目的,本发明采用了如下的技术方案:
拟南芥At‐UGE2基因在调控植物营养生长和生殖生长阶段中的应用。
拟南芥At‐UGE2基因在培育延缓激素脱落酸或乙烯和黑暗诱导的离体叶片衰老中的应用。
拟南芥At‐UGE2基因在培育具有高、低温胁迫抗性的转基因植物中的应用。
拟南芥At‐UGE2基因的过表达突变株35S::UGE2在培育具有增强产量相关性状的转基因植物中的应用。
如所述的拟南芥At‐UGE2基因的过表达突变株35S::UGE2在培育具有增强产量相关性状的转基因植物中的应用,其中所述的增强产量相关性状是指叶面积大、叶片数多、开花时间提前、单株荚果数多、种子体积增大、种子产量提高。
拟南芥At‐UGE2基因的过表达突变株35S::UGE2在培育延缓激素脱落酸或乙烯和黑暗诱导的离体叶片衰老的转基因植物中的应用。
拟南芥At‐UGE2基因的过表达突变株35S::UGE2在培育具有高、低温胁迫抗性的转基因植物中的应用。
拟南芥At‐UGE2基因的缺失突变株uge2在培育降低植物产量相关性状的转基因植物中的应用。
如所述的拟南芥At‐UGE2基因的缺失突变株uge2在培育降低植物产量相关性状的转基因植物中的应用,其中所述的降低植物产量相关性状是指叶面积小、叶片数少、开花时间延迟、单株荚果数减少、种子体积减小、种子产量降低。
拟南芥At‐UGE2基因的缺失突变株uge2在培育具有加速激素脱落酸或乙烯和黑暗诱导的离体叶片衰老的转基因植物中的应用。
拟南芥At‐UGE2基因的缺失突变株uge2在培育对高、低温胁迫抗性降低的转基因植物中的应用。
根据所述的应用,其中所述的转基因植物是将拟南芥的At‐UGE2基因以及来源于其 他植物的同源基因,完整克隆或其中部分片断化连接到具有使表达量升高的不同种类的表达载体上,通过对不同表达载体的遗传转化获得At‐UGE2基因表达量升高的转基因植物。
根据所述的应用,其中所述的转基因植物是将拟南芥中的At‐UGE2基因以及来源于其他植物的同源基因,利用植物基因敲除技术同源重组、随机插入突变、RNA干扰、CRISPR/Cas9,获得的At‐UGE2基因表达完全缺失或部分缺失的转基因植物。
上述应用中,所述的转基因植物包括两类,一是将拟南芥的At‐UGE2基因以及来源于其他植物的同源基因,完整克隆或其中部分片断化连接到具有使其表达量升高的不同种类的表达载体上,通过对不同表达载体的遗传转化获得At‐UGE2基因表达量升高的转基因植物;二是将拟南芥中的At‐UGE2基因以及来源于其他植物的同源基因,利用同源重组、随机插入突变、RNA干扰、CRISPR/Cas9等植物基因敲除技术,获得的At‐UGE2基因表达完全缺失或部分缺失的转基因植物。
本发明的技术方案是基于以下原理得出的:At‐UGE2基因在植物生长发育过程中有重要作用,过表达突变株35S::UGE2在拟南芥营养生长和生殖生长阶段都表现出显著增强产量相关性状的优势,与野生型相比其叶面积较大、叶片数多、开花时间提前、单株荚果数多、种子体积增大、种子产量提高等优势,缺失突变株uge2则相反,各项产量性状都比野生型弱;At‐UGE2基因参与了脱落酸、乙烯和黑暗诱导的植物离体叶片衰老过程,过表达突变株35S::UGE2对于这三种因素诱导的离体叶片衰老有延缓效果,叶绿素降解较慢,而缺失突变株uge2的离体叶片衰老加速,叶绿素降解较快;At‐UGE2基因还参与了植物对温度胁迫的响应,过表达突变株35S::UGE2对高温胁迫和低温胁迫的抗性较强,细胞膜离子渗漏较弱,而缺失突变株uge2对高、低温胁迫都较敏感,抗性较弱。
本发明所述的拟南芥At‐UGE2基因在GeneBank中的编号是AT4G23920,编码区序列全长1053bp,编码350个氨基酸,主要在细胞质表达,催化UDP‐D‐半乳糖与UDP‐D‐葡萄糖的转换,为细胞壁多糖的合成提供原料。
本发明所述的At‐UGE2基因的过表达突变株35S::UGE2,由下述方法构建而得:用正常条件(22℃)土培生长四周的拟南芥叶片提取总RNA,以oligo(dT)为引物逆转录的cDNA为模版克隆At‐UGE2基因的编码区,然后将测序后确认序列完全正确的基因片段构建到连有CaMv 35S组成型表达启动子的过表达载体pBI121上,利用液氮冻融法将该表达载体转入农杆菌中,进而以农杆菌侵染花序的方法进行拟南芥遗传转化。通过表达载体上 携带的卡那霉素抗性及PCR扩增目标基因双重手段验证,最终获得35S::UGE2过表达转基因植株。
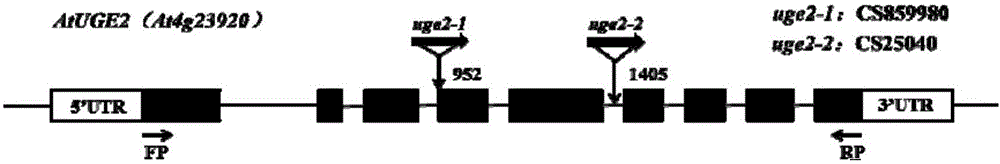
本发明所述的At‐UGE2缺失突变株uge2,是从拟南芥生物资源中心ABRC(Arabidopsis Biological Resource Center)购买的两个T‐DNA插入纯合子突变株,种子编号分别为CS25040和CS859980,突变体株的产生是由于载体pROK2上一段T‐DNA的插入。CS25040的插入位点在At‐UGE2基因的第五和第六外显子间,CS859980插入位点在At‐UGE2基因的第三和第四外显子间,T‐DNA的插入导致了At‐UGE2基因表达量缺失。
在本发明中,拟南芥UGE基因家族成员At‐UGE2基因的功能与植物生长发育过程、激素和黑暗诱导离体叶片衰老及温度胁迫响应有关,组成型高表达At‐UGE2可增强植物产量相关性状、延缓激素和黑暗诱导的衰老,增强高、低温胁迫抗性。因此研究该基因的功能不仅对探索植物生长发育规律及阐明植物抗逆机制有重要的理论意义,操作At‐UGE2基因的表达水平对培育优良性状的农作物及农业生产中的运用也有现实价值。
附图说明:
图1 At‐UGE2基因结构及缺失突变株的T‐DNA插入位置。
图2A‐C:At‐UGE2基因T‐DNA插入突变株的鉴定;图2A、T‐DNA插入突变株uge2‐1(CS25040)的纯合子鉴定;图2B、T‐DNA插入突变株uge2‐2(CS859980)的纯合子鉴定;图2C、半定量RT‐PCR分析22℃正常生长和4℃处理7d的野生型与过表达突变株35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2叶片中At‐UGE基因转录水平。
图3A‐D:At‐UGE2基因过表达突变株35S::UGE2的构建及鉴定;图3A、重组质粒pBI121/UGE2的酶切鉴定;图3B、农杆菌中重组质粒载体pBI121/UGE2的PCR鉴定;图3C、第三代过表达突变株35S::UGE2的抗生素(卡那霉素)筛选;图3D、半定量RT‐PCR分析22℃正常生长和4℃处理7d的野生型与过表达突变株35S::UGE2‐2叶片中At‐UGE基因转录水平。
图4A‐C:在不同半乳糖浓度MS培养基上生长2周的拟南芥野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2无菌苗表型;图4A、在不同半乳糖浓度MS培养基上生长2周的野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2无菌苗的表型及光系统Ⅱ最大光化学量子产量Fv/Fm值;图4B、在不同半乳糖浓度MS培养基上生长2周的野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2无菌苗的叶绿素含量;图4C、在不同半乳糖MS培养基上生长2周的野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2无菌苗的类胡萝卜素含量。
图5A‐C:过表达突变株35S::UGE2在植物营养生长阶段具有增强产量相关性状的表现;图5A、22℃正常培养4周的拟南芥野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2土培苗表型;图5B、刚抽薹的野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2土培苗的叶片表型;图5C、野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2土培苗单株荚果排列表型。
图6A‐B:野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2土培苗的干种子大小及单株种子产量;图6A、收获后干燥1个月的野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2土培苗种子表型;图6B、收获后干燥1个月的野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2土培苗种子单株产量。
图7A‐D:外源施加激素和黑暗诱导野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2离体叶片衰老表型;图7A、外源施加脱落酸诱导野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2离体叶片衰老表型及光系统Ⅱ最大光化学量子产量Fv/Fm值;图7B、外源施加脱落酸诱导野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2离体叶片衰老叶绿素和类胡萝卜素含量;图7C、外源施加乙烯诱导野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2离体叶片衰老表型及光系统Ⅱ最大光化学量子产量Fv/Fm值;图7D、黑暗诱导野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2离体叶片衰老表型及光系统Ⅱ最大光化学量子产量Fv/Fm值。
图8A‐C:野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2的高温胁迫抗性分析;图8A、热驯后热激的高温胁迫处理(条件:先38℃热驯2h,22℃恢复1h,之后48℃热激3h)4周土培苗恢复3天的表型及光系统Ⅱ最大光化学量子产量Fv/Fm值;图8B、直接热激的高温胁迫处理(条件:48℃直接热激3h)4周土培苗恢复3天的表型及光系统Ⅱ最大光化学量子产量Fv/Fm值;图8C、高温胁迫处理(热驯热激和直接热激)4周土培苗恢复5天的细胞膜离子渗漏分析。
图9A‐C:野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2的低温胁迫抗性分析;图9A、低温胁迫处理(条件:‐6℃冻1h和‐8℃冻1h)4周土培苗恢复3天的表型及光系统Ⅱ最大光化学量子产量Fv/Fm值;图9B、低温胁迫处理(条件:‐6℃冻1h和‐8℃冻1h)4周土培苗恢复3天的叶片细胞膜离子渗漏分析;图9C、低温胁迫处理(条件:‐4℃、‐6℃、‐8℃、‐10℃及‐12℃冻1h)2周无菌苗恢复3天的表型及光系统Ⅱ最大光化学量子产量Fv/Fm值。
具体实施方式:
下面结合附图,用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明
实施例1:
At‐UGE2基因缺失突变株uge2‐1和uge2‐2的获得和表达量检测。
(一)At‐UGE2基因缺失突变株uge2‐1和uge2‐2纯合子的PCR鉴定:
本发明所述的拟南芥At‐UGE2基因在GeneBank中的编号是AT4G23920,编码区序列全长1053bp,编码350个氨基酸,其核苷酸序列和氨基酸序列如序列表1和2(SEQ ID No 1:At‐UGE2基因编码区核苷酸序列和SEQ ID No 2:At‐UGE2基因编码氨基酸序列)所示,主要在细胞质表达,催化UDP‐D‐半乳糖与UDP‐D‐葡萄糖的转换,参与细胞壁碳水化合物的生物合成。
本发明从拟南芥生物资源中心(Arabidopsis Biological Resource Center,ABRC)购买了At‐UGE2基因的两个T‐DNA插入突变体株(种子编号为:CS25040和CS859980)(图1),其侧翼序列如序列表3(SEQ ID No 3:At‐UGE2基因T‐DNA插入突变株CS25040侧翼序列)和序列表4(SEQ ID No 4:At‐UGE2基因T‐DNA插入突变株CS859980侧翼序列)所示,通过PCR鉴定T‐DNA插入情况,所用引物如下:
CS25040FP 5’端引物:5’‐CTATCCCATTCTTAGCCCTGC‐3’
CS25040RP3’端引物:5’‐ACATCGTTCTGACTCGGAATG‐3’
LBpROK2引物:5’‐ATTTTGCCGATTTCGGAAC‐3’
CS859980FP5’端引物:5’‐TTTGGTTTAGGAAACGTGTGC‐3’
CS859980RP3’端引物:5’‐ACTAGGATGTGCACCAACAGG‐3’
LBpROK2引物:5’‐ATTTTGCCGATTTCGGAAC‐3’
结果如图2A和图2B所示,经鉴定T‐DNA插入突变株CS25040和CS859980皆为纯合子,并将其分别命名为uge2‐1和uge2‐2用于后续实验。
(二)半定量RT‐PCR分析过表达突变株35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2中At‐UGE2基因转录水平:
提取22℃正常培养下生长4周的拟南芥土培苗叶片总RNA,进行半定量RT‐PCR分析,所用引物如下:
At‐UGEF:5’‐ATGGCGAAGAGTGTTTTG‐3’
At‐UGER:5’‐TTATGAAGAGGAGCCATTG‐3’
Actin2F:5’‐TGTGCCAATCTACGAGGGTTT‐3’
Actin2R:5’‐TTTCCCGCTCTGCTGTTGT‐3’
结果如图2C所示,T‐DNA插入已导致突变株uge2‐1和uge2‐2中At‐UGE2基因的转录表达缺失。
实施例2:
At‐UGE2基因过表达突变株35S::UGE2的构建及鉴定:
构建At‐UGE2过表达突变株35S::UGE2的具体方法为:用22℃正常条件土培生长四周的拟南芥叶片提取总RNA,以oligo(dT)为引物逆转录的cDNA为模版克隆At‐UGE2基因的编码区,然后将测序后确认序列完全正确的基因片段构建到连有CaMv 35S组成型表达启动子的过表达载体pBI121上(图3A),利用液氮冻融法将该表达载体转入农杆菌中(图3B),进而以农杆菌侵染花序的方法进行拟南芥遗传转化。收获的第一代种子以50mg/L使用终浓度的卡那霉素进行抗性筛选并通过PCR扩增目的片段验证,对筛选得到的第一代阳性植株进行单株繁种,收获的第二、三代种子同样进行抗生素筛选及PCR验证,最终获得了四个具有抗性的株系,命名为#1、#2、#3、#4(图3C),并选取了#1、#2用于后续实验,命名为35S::UGE2‐1和35S::UGE2‐2。半定量RT‐PCR的结果也证实,在过表达突变株35S::UGE2‐1和35S::UGE2‐2中(图2C和3D),At‐UGE2基因的转录表达水平比野生型显著提高了。
实施例3:
利用半乳糖毒性实验验证At‐UGE2基因缺失突变株和过表达突变株表型。
细胞内过量的半乳糖会对植物产生严重的半乳糖毒性,主要表现在抑制植株生长,叶绿素含量降低,出现黄化苗。At‐UGE2基因在拟南芥中主要催化了UDP‐葡萄向UDP‐半乳糖的转化,在外源施加一定浓度的半乳糖后,At‐UGE2基因的功能缺陷可能会导致植株产生半乳糖毒性。因此,本发明将拟南芥野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐2和缺失突变株uge2‐1、uge2‐2的种子经表面消毒后分区点种于半乳糖浓度依次增加的0mM、50mM、100mM、150mM、200mM的MS培养基上,经过4℃春化1天后放置于正常条件下培养(温度22℃,湿度50%‐60%,光周期12h白天/12h黑暗),2周后观察记录无菌苗的表型及光系统Ⅱ最大光化学量子产量(Fv/Fm)值。结果如图4所示,与野生型相比缺失突变株uge2‐1和uge2‐2随着培养基中半乳糖浓度的升高,生长受到显著抑制,叶片出现黄化现象,叶绿素和类胡萝卜素含量降低,而野生型和过表达株突变株能耐受的半乳糖浓度更高,且过表达突变株35S::UGE2‐1、35S::UGE2‐2在高浓度半乳糖下的生长略优于野生型。
实施例4:
过表达突变株35S::UGE2在植物营养生长和生殖生长阶段具有增强产量相关性状表现。
将拟南芥野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐2和缺失突变株uge2‐1、uge2‐2的种子播种于泥炭土中,正常条件下(温度22℃,湿度50%‐60%,光周期12h白天/12h黑暗)培养生长,4周时拍照记录所有基因型植株的表型,在植株刚抽薹时统计叶片数、莲座叶直径、总叶面积、生物量等指标,在第一朵花开时统计株高和茎分枝数,在种子成熟后期统计荚果数目和形态,收获种子后统计单株种子产量和种子大小。结果如图5A所示,相同的生长周期下(4周),过表达突变株土培苗的长势较好,其次为野生型,缺失突变株的苗体型最小;而在植株由营养生长向生殖生长转变的刚抽薹时,过表达突变株的土培苗有较多的叶片数、较大的莲座叶直径和总叶面积、生物量积累最高,其次为野生型,缺失突变株最弱(图5B和表1);在第一朵花开时,过表达突变株的株高最高,茎分枝数最多,其次为野生型和缺失突变株(表1);在单株荚果数和荚果长度上,过表达突变株也比野生型和缺失突变株有略微优势(表1和图5C);统计单株种子产量,过表达突变株明显高于野生型和缺失突变株,并且过表达突变株干种子的体积明显增大了,看起来更饱满(图6A和6B)。
表1、野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐1和缺失突变株uge2‐1、uge2‐2土培苗刚抽薹时的叶片数、莲座直径(cm)、总叶面积(cm2)、生物量(g),以及第一朵花开时的株高(cm)和茎分枝数,单株荚果数统计(n=5)
实施例5:
激素(脱落酸和乙烯)和黑暗诱导At‐UGE2各基因型植株离体叶片的衰老。
植物激素脱落酸和乙烯参与了叶片的衰老过程,外源施加脱落酸和乙烯可以加速叶片的衰老,诱导衰老相关基因表达,导致生理失调及叶绿素降解,最终叶片发黄衰老脱落。光是调控植物衰老的重要环境因子,植株或其它离体器官在黑暗条件下不能进行光合作用,因此黑暗会加速衰老的进程。本发明通过外源施加激素脱落酸和乙烯、以及避光黑暗处理,诱导野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐2和缺失突变株uge2‐1、uge2‐2离体叶片的衰老。结果如图7所示,激素和黑暗处理能加速离体叶片的衰老发生,但在相同处理时间下,过表达突变株离体叶片的叶绿素降解程度较轻,光系统Ⅱ最大光化学量子产量Fv/Fm值减弱较慢,对诱导衰老的耐受性最强,其次为野生型,缺失突变株对诱导衰老较为敏感。
实施例6:
过表达突变株35S::UGE2对高、低温胁迫有较强的抗性。
(一)At‐UGE2各基因型植株的高温胁迫抗性分析:
将拟南芥野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐2和缺失突变株uge2‐1、uge2‐2的种子播种于泥炭土中,正常条件下培养(温度22℃,湿度50%‐60%,光周期12h白天/12h黑暗)4周左右进行高温胁迫处理,处理条件为:一是热驯热激,38℃热驯2小时,22℃恢复培养1小时,然后迅速升温至48℃热激处理3小时;二是直 接热激,将22℃正常培养的植株直接迅速升温至48℃热激处理3小时,最后将所有处理后的植株放置于22℃正常条件下恢复培养3天后观察记录植株表型及光系统Ⅱ最大光化学量子产量(Fv/Fm)值,检验高温胁迫后植株的损伤程度。结果如图8所示,两种不同条件的高温胁迫处理后,过表达突变株的抗性最好,Fv/Fm荧光值较高,说明叶片光系统Ⅱ的状态好,细胞膜离子渗漏最低,其次是野生型,缺失突变株的高温抗性最弱。
(二)At‐UGE2各基因型植株的低温胁迫抗性分析:
将拟南芥野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐2和缺失突变株uge2‐1、uge2‐2的种子播种于泥炭土中,正常条件下培养(温度22℃,湿度50%‐60%,光周期12h白天/12h黑暗)4周左右进行低温胁迫处理,处理条件为:4℃冷驯24小时,然后以2℃/小时的速率降温到‐2℃诱导结冰2小时,防止产生过冷,之后同样以2℃/小时的速率降温到‐6℃处理1小时或‐8℃处理1小时。低温处理完成后以2℃/小时的速率升温到4℃黑暗放置过夜(12‐16小时),最终放置于22℃,光照10%左右的条件下恢复培养3天后观察记录植株表型及光系统Ⅱ最大光化学量子产量(Fv/Fm)值,检验低温胁迫后植株的损伤程度。结果如图9A和9B所示,相同的冷冻处理条件,过表达突变株的抗性最好,细胞膜渗漏最低,其次是野生型,缺失突变株的低温抗性最弱,膜渗漏最强。
将拟南芥野生型(Col‐0)、过表达突变株35S::UGE2‐1、35S::UGE2‐2和缺失突变株uge2‐1、uge2‐2的种子经表面消毒后分区点种于MS培养基上,经过4℃春化1天后放置于正常条件下培养(温度22℃,湿度50%‐60%,光周期12小时白天/12小时黑暗),2周后进行低温胁迫处理,处理条件为:4℃冷驯24小时,然后以2℃/小时的速率降温到‐2℃诱导结冰2小时,防止产生过冷,之后同样以2℃/小时的速率降温到指定的零下温度处理1小时。低温处理完成后以2℃/小时的速率升温到4℃黑暗放置过夜(12‐16小时),最终放置于22℃,光照10%左右的条件下恢复培养3天后观察记录植株表型及光系统Ⅱ最大光化学量子产量(Fv/Fm)值,检验低温胁迫后植株的损伤程度。结果如图9C所示,冷冻处理后,过表达突变株能忍耐更低的零下低温处理,其次为野生型,缺失突变株对低温的抗性最弱。
拟南芥At‐UGE2基因的以上实验数据证明,该基因参与了植物生长发育调节和胁迫应答等过程,本发明对深入理解不同发育阶段和胁迫处理后UGE酶介导的UDP‐葡萄糖和UDP‐半乳糖在细胞内的代谢转换有实质性的意义和价值;鉴于过表达突变株35S::UGE2具有增强产量相关性状及抗逆性的优势,并且以往的大量研究证明以拟南芥为材料鉴定 的大多数功能基因都能应用到其它植物中,因此本发明还为植物品种改良提供了一个优质基因,阐明了一种新的提高植物产量相关性状及抗逆性的方法和机制,具有重要的经济意义和运用前景。
最后,还需注意的是,以上列举的仅是本发明的其中几个具体实施例。显然,本发明不限于以上实施例,还可以有许多改进。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的改进,均应认为是本发明的保护范围。
<110> 中国科学院昆明植物研究所
<120> 拟南芥At-UGE2基因及其过表达突变株和缺失突变株在调节植物性状中的应用
<160> 4
<210> 1
<211> 1053
<212> DNA
<213> 拟南芥(Arabidopsis thaliana)
<400> 1
atggcgaaga gtgttttggt taccggcggc gctggctata tcggaagtca tactgttctt 60
caactgcttg aaggtggtta ctccgccgtc gttgttgaca attacgacaa ttcctctgct 120
gcttcgcttc agcgcgtgaa gaaactcgcc ggcgaaaacg gaaaccgcct ctccttccac 180
caggtggatc tccgagacag gcctgcgctt gagaagatat tctcagaaac aaagtttgat 240
gcagtgatac actttgctgg acttaaagca gtaggtgaga gtgtggagaa gcctttgctc 300
tattataata ataacattgt tggcactgtt actcttttgg aggttatggc tcaatacggc 360
tgcaaaaatc ttgtattttc atcatcagct actgtctatg gctggcctaa ggaggttcct 420
tgcactgagg agtcaccaat ttctgccact aacccatatg gccgtacaaa gctttttatc 480
gaagagattt gccgggatgt acatcgttct gactcggaat ggaagatcat attgcttaga 540
tacttcaacc ctgttggtgc acatcctagt ggttacattg gtgaagatcc tcttggagtt 600
cccaacaatc tcatgcctta tgtccaacaa gttgcagttg gccggagacc tcaccttact 660
gtctttggaa ccgactacaa gacaaaggat ggtacagggg ttagagatta cattcatgtc 720
atggatttag cagatggaca catagctgct ctgcgtaagc tagatgatct caaaatcagt 840
tgtgaggtat acaatcttgg aacgggtaat ggaacatcgg tcctagaaat ggtcgctgcc 900
tttgaaaaag catccggaaa gaaaatccct ttggtgatgg ctggacgacg tcctggagac 960
gctgaagttg tttacgcctc aacggaaaaa gcagagcgcg aactaaattg gaaggctaag 1020
aatgggatag aggagatgtg tagggatcta tggaattggg caagcaataa cccctacggc 1080
tacaattcct cctccaatgg ctcctcttca taa 1053
<210> 2
<211> 350
<212> PRT
<213> 拟南芥(Arabidopsis thaliana)
<400> 2
Met Ala Lys Ser Val Leu Val Thr Gly Gly Ala Gly Tyr Ile Gly Ser
1 5 10 15
His Thr Val Leu Gln Leu Leu Glu Gly Gly Tyr Ser Ala Val Val Val
20 25 30
Asp Asn Tyr Asp Asn Ser Ser Ala Ala Ser Leu Gln Arg Val Lys Lys
35 40 45
Leu Ala Gly Glu Asn Gly Asn Arg Leu Ser Phe His Gln Val Asp Leu
50 55 60
Arg Asp Arg Pro Ala Leu Glu Lys Ile Phe Ser Glu Thr Lys Phe Asp
65 70 75 80
Ala Val Ile His Phe Ala Gly Leu Lys Ala Val Gly Glu Ser Val Glu
85 90 95
Lys Pro Leu Leu Tyr Tyr Asn Asn Asn Ile Val Gly Thr Val Thr Leu
100 105 110
Leu Glu Val Met Ala Gln Tyr Gly Cys Lys Asn Leu Val Phe Ser Ser
115 120 125
Ser Ala Thr Val Tyr Gly Trp Pro Lys Glu Val Pro Cys Thr Glu Glu
130 135 140
Ser Pro Ile Ser Ala Thr Asn Pro Tyr Gly Arg Thr Lys Leu Phe Ile
145 150 155 160
Glu Glu Ile Cys Arg Asp Val His Arg Ser Asp Ser Glu Trp Lys Ile
165 170 175
Ile Leu Leu Arg Tyr Phe Asn Pro Val Gly Ala His Pro Ser Gly Tyr
180 185 190
Ile Gly Glu Asp Pro Leu Gly Val Pro Asn Asn Leu Met Pro Tyr Val
195 200 205
Gln Gln Val Ala Val Gly Arg Arg Pro His Leu Thr Val Phe Gly Thr
210 215 220
Asp Tyr Lys Thr Lys Asp Gly Thr Gly Val Arg Asp Tyr Ile His Val
225 230 235 240
Met Asp Leu Ala Asp Gly His Ile Ala Ala Leu Arg Lys Leu Asp Asp
245 250 255
Leu Lys Ile Ser Cys Glu Val Tyr Asn Leu Gly Thr Gly Asn Gly Thr
260 265 270
Ser Val Leu Glu Met Val Ala Ala Phe Glu Lys Ala Ser Gly Lys Lys
275 280 285
Ile Pro Leu Val Met Ala Gly Arg Arg Pro Gly Asp Ala Glu Val Val
290 295 300
Tyr Ala Ser Thr Glu Lys Ala Glu Arg Glu Leu Asn Trp Lys Ala Lys
305 310 315 320
Asn Gly Ile Glu Glu Met Cys Arg Asp Leu Trp Asn Trp Ala Ser Asn
325 330 335
Asn Pro Tyr Gly Tyr Asn Ser Ser Ser Asn Gly Ser Ser Ser
340 345 350
<210> 3
<211> 365
<212> DNA
<213> 拟南芥(Arabidopsis thaliana)
<400> 3
agatgaataa tatctgttaa tataattcac aattcgttgt attatctccc atactccata 60
atatatcaca atttatgatt gtaatgtaaa tctgtcaaat ggtttgttgt ctataagaca 120
tcataagtca catacccctg taccatcctt tgtcttgtag tcggttccaa agacagtaag 180
gtgaggtctc cggccaactg caacttgttg gacataaggc atgagattgt tgggaactcc 240
aagaggatct tcaccaatgt aaccactatg atgtgcacca acagggttga agtatctaag 300
caatatgatc ttccattccg agtcagaacg atgtacatcc cggcaaatct cttcgataaa 360
aagct 365
<210> 4
<211> 445
<212> DNA
<213> 拟南芥(Arabidopsis thaliana)
<400> 4
tctgttttcc atcttgtatt ttcatcatca gctactgtct atggctggcc taaggaggtt 60
ccttgcactg aggagtcacc aatttctgcc actaacccat atggcacgta caaaggtatc 120
acctttagcc tgagtattga cccaagccca ccttgtgata gtggtgatga atgataataa 180
tcaggaaatg aatctgactg acattatttg cttgtgctgt gtaagctgca gcccgggccg 240
tccaccacgc gtgccctaag ntgagtcgta agggccttcg accacgcgtg ccctatagtg 300
agtcgtaaca cacacctgcc ccatagtgat tcgtaatgac gcttttacac cgactgccac 360
atggtccccc ccctcacata ttcttgtatc atcccctgct ctccgctcaa gcctcgccct 420
acattatttt tgggacccca gtccc 445
- 还没有人留言评论。精彩留言会获得点赞!