黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与流程
本发明属于现代生物技术与家畜育种领域,涉及基因单核苷酸多态性(SNP)的检测,特别涉及一种检测黄牛长链非编码RNA ADNCR基因T>A的单核苷酸多态性(SNP)的四引物扩增受阻突变体系PCR(T-ARMS-PCR)方法。
背景技术:
动物育种技术主要包括以表型和表型值为基础的常规育种技术和以DNA多态为基础的分子育种技术。作为分子育种技术体系的重要组成部分,分子标记辅助选择(marker-assisted selection,MAS)育种技术首先检测重要基因的DNA多态性,然后分析DNA多态与遗传性状之间的相关性,最后再根据与遗传性状显著相关的DNA标记进行性状选择。作为现代分子生物学技术发展过程中孕育而生的新技术,MAS育种技术可以在DNA水平上快速准确地分析个体的遗传组成,该方法通过有性杂交将目的基因转移到需要改良的亲本中,将目标基因型的鉴定与传统育种相结合,从而实现对基因型的直接选择,提高育种目标的定向性。该方法在克服表型鉴定的困难、早期选择、进行无损害的性状评价和选择及提高回交育种效率等方面具有优越性。
在MAS育种技术体系中,寻找重要功能基因、筛查重要基因遗传变异位点,并分析重要功能基因遗传变异位点与生长性能的相关性,是分子标记辅助选择技术应用的前提和关键。作为分子遗传标记的重要方式之一。单核苷酸多态性(SNP)指序列间单碱基替换或插入缺失,且在群体中的发生频率大于1%的多态类型(Kwok and Gu 1999)。根据其在基因组中的位置可以划分为外显子多态性(包括错义突变、同义突变和无义突变)、基因间区多态性、内含子或3’-/5’-调控区多态性。
SNP作为一种遗传标记,具有发生频率高、能稳定遗传、易进行自动化检测等优点,并且在不同物种、不同品种间SNP分布都存在差异,所以SNP可以作为评价群体遗传多样性的重要指标。目前,在遗传多样性研究中,杂合度是常用的一种变量,这种情况下,杂合度是指在基因组上检测到的所有SNP标记在不同样本间的差异程度(Purcell et al.2007)。发现并且充分利用个体间基因变异对家畜育种而言是非常重要的。近几年来,通过在家畜上已经定位出了很多与重要经济性状相关的位点。Fan等检测820个商品猪的全基因组SNP,并且对背膘厚、眼肌面积等性状进行分析,发现了与上述性状相关的候选基因,如MC4R、BMP2等(Fan et al.2011)。Jiang等通过对2093头中国荷斯坦奶牛的产奶性状进行研究,共检测出了105个与产奶性状显著相关的SNP标记位点(Jiang et al.2010)。此外,很多影响牛数量性状(包括体尺、繁殖力、产奶量、寿命、难产率等)的SNP位点及其候选基因逐渐被定位出来。SNP作为一种标记辅助选择(Marker-assisted selection)在家畜育种中具有重要的应用价值。
迄今为止,检测SNPs的技术非常多,包括限制性片段长度多态性聚合酶链反应(PCR-RFLP)、单构链多态性PCR(PCR-SSCP)、等位基因特异性PCR(AC-PCR)、直接测序法、新型高通量SNP检测技术和引入突变位点的PCR-RFLP(Forced-PCR-RFLP)法等。在这些技术中,PCR-RFLP法是最早应用于分子人类学的SNP检测技术,因为该技术简单且易操作,对于检测单拷贝上(线粒体和Y染色体)的SNP,准确度非常高,但由于PCR-RFLP分析受到特定的自然酶切位点的限制,故在实际应用中也有一定的局限性;PCR-SSCP技术简便、快速、灵敏,但最后确定突变的位置和类型,还需进一步测序,且电泳条件要求较严格,故多用于DNA研究中的未知基因突变的检测和临床实验;直接测序法是最为准确的SNP检测方法,但其检测费用极其昂贵,且需要有测序仪等大型仪器,还需要非常熟练的技术人员和经验,故对于在一段很短的序列上存在多个SNP的检测是有优势的,但不适用于生产实际;新型高通量SNP检测技术,如SNP芯片、GWAS和第二代测序等对于样本量较小的实验研究,成本过高,在生产实际中应用较为局限;四引物扩增受阻突变体系PCR(T-ARMS-PCR)方法是一种新型的SNP检测方法,该方法只需要设计特定的引物,两个反应就能得到一个SNP位点的分型,能针对特定的基因位点,且四引物扩增受阻突变体系PCR不需要酶切,因此既减少了试验费用,又缩短了时间。总之,四引物扩增受阻突变体系PCR方法,不仅具有DNA测序法的准确性,又克服了费用昂贵、繁琐操作、假阳性的缺点,而且对所检测的序列位点无特殊性要求,因此,四引物扩增受阻突变体系PCR方法受到育种工作中的青睐,在动物分子育种的MAS体系中具有广阔应用前景。
随着经济发展和人们生活水平的不断提高,社会对黄牛产品的需求不断加强,但由于近年来牛肉、牛奶等产品严重短缺,所以黄牛育种专家期望更早、更好、更快地获得黄牛产品的优良品种。在高产、优质和高效的黄牛育种目标上,黄牛育种专家一直关注生长发育性状,但仅靠传统育种手段是不行的,还需要依靠分子育种技术。即首先在DNA水平上筛查和检测与黄牛生长发育性状密切相关的DNA标记,然后进行基因多态性的检测,最后是进行基因多态性与生长发育性状的关联分析,从而实现早期选择。
LncRNA是一种长度在200-100000nt之间的RNA分子,不编码蛋白但却参与细胞内多种过程调控(Mercer et al.,2009),其种类、数量、功能都不明确。目前发现的许多lncRNA都具有保守的二级结构,一定的剪切形式以及亚细胞定位。它们在基因组上相对于蛋白编码基因的位置,可以分为5种:正义链(sense)、反义链(antisense)、双向(bidirectional)、内含子间(intronic)、基因间(intergenic)(Kapranov et al.,2007;Core et al.,2008;Guttman et al.,2009;Mercer et al.,2009;Orom et al.,2010),其所在的位置与其功能有一定的相关性。但人们对lncRNA的认识还处在初级阶段,lncRNA起初被认为是基因组转录的"噪音",是RNA聚合酶II转录的副产物,不具有生物学功能(Struhl,2007)。然而,近年来的研究表明,lncRNA参与了X染色体沉默、基因组印记以及染色质修饰、转录激活、转录干扰,核内运输等多种重要的调控过程,lncRNA的这些调控作用也开始引起人们广泛的关注。哺乳动物基因组序列中4%~9%的序列产生的转录本是lncRNA,相应的蛋白编码RNA的比例是1%(Ponting etal.,2009),虽然近年来关于lncRNA的研究进展迅猛,但是绝大部分的lncRNA的功能仍然是不清楚的,随着研究的推进,各类lncRNA的大量发现,lncRNA的研究将是RNA基因组研究非常吸引人的一个方向,使人们逐渐认识到基因组存在人类知之甚少的"暗物质"。
lncRNAs通常较长,具有mRNA样结构,经过剪接,具有polyA尾巴与启动子结构,分化过程中有动态的表达与不同的剪接方式。lncRNAs启动子同样可以结合转录因子,如Oct3/4,Nanog、CREB、Sp1、c-myc、Sox2与p53,局部染色质组蛋白同样具有特征性的修饰方式与结构特征。大多数的lncRNAs在组织分化发育过程中,都具有明显的时空表达特异性,如有人针对小鼠的1300个lncRNAs进行研究,发现在脑组织中的不同部位,lncRNAs具有不同的表达模式。在肿瘤与其他疾病中有特征性的表达方式。序列上保守性较低,只有约12%的lncRNA可在人类之外的其它生物中找到。
lncRNAs的作用机制主要包括以下几种:①RNA诱饵,占据转录因子的DNA结合位点;②miRNAs吸附剂,与miRNAs靶基因竞争性结合miRNAs;③作为支架与蛋白质结合,形成核酸蛋白质复合体;④与mRNA形成互补双链,抑制翻译、调节可变剪切或调节mRNA降解。
长链非编码RNA ADNCR,是通过高通量测序新发现的一种长链非编码RNA。长链非编码RNA ADNCR在牛上的全长为1730bp,包含2个外显子,主要在前体脂肪细胞的细胞质中表达。Li等发现长链非编码RNA ADNCR能抑制牛脂肪细胞的分化。通过检测其上游约3kb处的编码基因PLDXC2的表达量发现过表达的长链非编码RNA ADNCR并不能改变PLDXC2的表达量,说明长链非编码RNA ADNCR不能通过cis作用脂肪细胞分化。通过在线软件预测及后续试验验证发现长链非编码RNA ADNCR通过靶向miRNA-204并与其竞争性结合到SIRT1基因上进而参与脂肪的调控中。SIRT1基因是SIRTs家族的一员,通过与NCoR以及SMART结合去抑制PPARγ的活性进而抑制脂肪细胞的分化和成脂基因的表达。
目前,有关长链非编码基因的SNP研究比较少,而长链非编码RNA ADNCR的SNP研究更是没有,尤其是,尚未见到利用四引物扩增受阻突变体系PCR方法对黄牛长链非编码RNA ADNCR的SNP g.1263T>A多态性进行的研究。
技术实现要素:
本发明的目的在于提供一种黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用,从而加快良种选育速度。
为达到上述目的,本发明采用了以下技术方案:
一种黄牛长链非编码RNA ADNCR基因单核苷酸多态的四引物扩增受阻突变体系PCR(T-ARMS-PCR)检测方法,包括以下步骤:
以待测黄牛全基因组DNA为模板,以引物对P1为四引物扩增受阻突变体系PCR(T-ARMS-PCR)引物,通过PCR扩增黄牛长链非编码RNA ADNCR基因片段,该片段包含黄牛长链非编码RNA ADNCR基因T>A单核苷酸多态位点;再对PCR扩增得到的片段进行琼脂糖凝胶电泳;根据琼脂糖凝胶电泳结果鉴定黄牛长链非编码RNA ADNCR基因T>A单核苷酸位点的多态性。
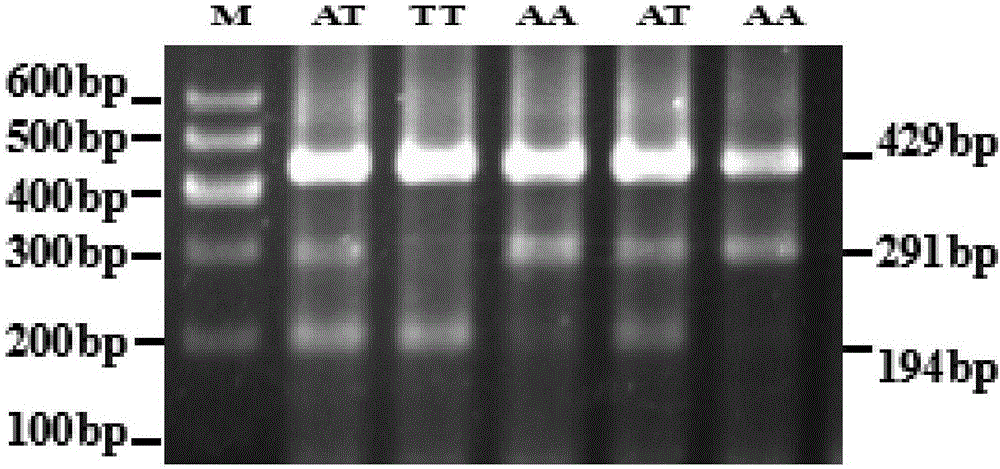
所述单核苷酸位点的多态性为:野生纯合基因型TT表现为429bp和194bp两条带纹;杂合子基因型TA表现为429bp、291bp和194bp三条带纹;突变纯合基因型AA表现为429bp和291bp两条带纹。
一种黄牛长链非编码RNA ADNCR基因单核苷酸多态的检测试剂盒,该试剂盒包括用于PCR扩增黄牛长链非编码RNA ADNCR基因中T>A单核苷酸多态位点的引物对P1。
所述的引物对P1为:
内引物上游:5'-ATGTACTCCTATTTCCTTGTGTTCGCAT-3';
内引物下游:5'-CAAAGTGCCCTGTAAAATGTAAAGTGTTT-3';
外引物上游:5'-GTCTTTATCTGGTTTTACATGCCCCTAC-3';
外引物下游:5'-GACATGCCTGGTCTCTTACTGTTTGTAC-3'。
上述黄牛长链非编码RNA ADNCR基因单核苷酸多态的四引物扩增受阻突变体系PCR(T-ARMS-PCR)检测方法在黄牛分子标记辅助选择育种中的应用。
所述单核苷酸多态位点的单核苷酸(TT基因型)可作为秦川牛坐骨端宽的DNA标记。
本发明的有益效果体现在:
本发明提供了针对黄牛长链非编码RNA ADNCR基因单核苷酸多态性位点(g.1263T>A的单核苷酸多态性)的四引物扩增受阻突变体系PCR(T-ARMS-PCR)检测方法,通过设计的引物经PCR扩增后再经琼脂糖凝胶电泳鉴定,能够简单、快速、低成本、精确的检测该位点的单核苷酸的多态性,有利于快速建立生长发育性状优良的黄牛遗传资源群体,加快良种选育速度。
本发明对黄牛品种的单核苷酸多态性位点基因型进行了检测和基因频率分析,对上述单核苷酸多态性位点与黄牛部分生长性状进行关联分析,结果表明该位点能够作为提高秦川牛坐骨端宽(P=0.032)的分子标记,从而为黄牛良种选育提供依据。
附图说明
图1为黄牛长链非编码RNA ADNCR基因单核苷酸多态(SNP)位点(g.1263T>A位点)的PCR扩增产物电泳结果,包含AA、AT以及TT基因型的结果,M为Marker I。
图2为黄牛长链非编码RNA ADNCR基因PCR扩增产物测序图;a:基因型为AA,b:基因型为TA,c:基因型为TT,黑色方框标出的部分表示突变序列:g.1263T>A。
具体实施方式
下面结合附图和实施例对本发明做详细说明,所述是对本发明的解释而不是限定。
本发明利用PCR扩增方法对黄牛长链非编码RNA ADNCR基因在g.1263T>A位点突变可能产生的单核苷酸多态性进行检测,并将其与生长性状进行关联分析,验证其是否可以作为黄牛分子育种中辅助选择的分子标记,从而加快良种选育速度。
(一)实验药品与试剂
1.生化试剂与生物学试剂:①Taq DNA聚合酶(购自Fermantas即MBI公司);②蛋白酶K(购自华美生物工程公司)③Marker I(购自天根生化科技(北京)有限公司)。
2.普通试剂:普通试剂从华美生物工程公司购买,为进口分装产品:Tris、EDTA、NaCl、NaOH、KCl、Na2HPO4、KH2PO4、Tris饱和酚、氯仿、异戊醇、无水乙醇、醋酸钠、十二烷基磺酸钠(SDS)、溴化乙锭(EB)、溴酚蓝、二甲基苯氰FF、乙酸、蔗糖、硼酸、琼脂糖等。
3.溶液与缓冲液:所有溶液与缓冲液均采用去离子超纯水配制。高压灭菌条件为15bf/in(1.034×105Pa),25min。试剂配制方法均参考Sambrook等编著的《分子克隆实验指南》。
1)提取组织样DNA所用溶液:除了基因组DNA提取时的公用溶液外,还配制以下试剂:①2mol/L NaCl:11.688g溶于水,定容至100mL,高压灭菌。②组织DNA提取液(100mL):l mol/L Tris-Cl(pH 8.0)l mL,0.5mol/L EDTA(pH 8.0)20mL,2mol/L NaCl 5mL,定容至100mL。
2)琼脂糖电泳分析所用溶液:①1×TBE缓冲液:取10×TBE 100mL定容至1000mL。②上样缓冲液:0.25%溴酚蓝,0.25%二甲苯青FF,40.0%(w/v)蔗糖水溶液。
(二)黄牛长链非编码RNA ADNCR基因在g.1263T>A位PCR引物的设计
在NCBI上检索牛长链非编码RNA ADNCR基因的序列(Gene ID:107992386),并利用Primer Premier 5.0设计(参考SEQ.ID.NO.1)能够扩增包含牛长链非编码RNA ADNCR基因第1内含子区域T>A位点的四引物扩增受阻突变体系PCR引物,其引物序列如下:
内引物上游:5'-ATGTACTCCTATTTCCTTGTGTTCGCAT-3'(SEQ.ID.NO.2);
内引物下游:5'-CAAAGTGCCCTGTAAAATGTAAAGTGTTT-3'(SEQ.ID.NO.3);
外引物上游:5'-GTCTTTATCTGGTTTTACATGCCCCTAC-3'(SEQ.ID.NO.4);
外引物下游:5'-GACATGCCTGGTCTCTTACTGTTTGTAC-3'(SEQ.ID.NO.5)。
根据上述引物,利用四引物扩增受阻突变体系PCR对黄牛基因组扩增,能够扩增包含黄牛长链非编码RNA ADNCR基因在g.1263T>A位点的SNP的不同的基因型片段。理论上,当该位点的T发生纯合子突变时,PCR产物经琼脂糖凝胶电泳检测之后是429bp和291bp大小的两条带纹;当该位点的T发生杂合子突变时,PCR产物经琼脂糖凝胶电泳检测之后是429bp、291bp和194bp大小的三条带纹。当该位点的T不发生突变时,PCR产物经琼脂糖凝胶电泳检测之后是429bp和194bp两条带纹。
(三)PCR扩增待测黄牛的长链非编码RNA ADNCR基因片段
1、黄牛样本的采集
实验所用的动物为秦川牛品种的252个样本,其中:秦川牛(QC)样品252份采自陕西省扶风县秦川牛保种场(表1)。采用随机采样方式采取个体耳组织样品,这些样品为70%乙醇保存,冰盒低温带回实验室后置于-80℃冻存。
表1.黄牛样本的采集
2、组织样品中基因组DNA的提取与分离
1)取约10mg耳组织样,放于1.5mL的离心管中,用小剪刀尽量剪碎。
2)加入600μL组织DNA提取液,10%SDS至终浓度为1%,蛋白酶K至终浓度为100μg/mL,55.0℃消化过夜,最好保证组织样较均匀地分布在组织提取液中。
3)将溶液冷却至室温,加入等体积的Tris饱和酚,盖紧管盖,缓慢地来回颠倒离心管,至少持续10min以上,12000r/min离心15min。
4)取上清液,加入等体积的Tris饱和酚:氯仿(1:1),盖紧管盖,缓慢地来回颠倒离心管,至少持续10min以上,12000r/min离心15min。
5)取上清液,加入等体积的氯仿:异戊醇(24:1),盖紧管盖,缓慢地来回颠倒离心管,至少持续10min以上,12000r/min离心15min。
6)取上清液,加入2倍体积的冰冷无水乙醇和1/10体积的3mol/L乙酸钠,盖紧管盖,缓慢地来回颠倒离心管,直至液体清亮,出现白色絮状DNA。
7)挑出DNA,放进一个1.5mL的离心管中,加入500μL 70%乙醇,盖紧管盖,缓慢地来回颠倒离心管,然后12000r/min离心3~5min,小心倒掉乙醇,将管倒置于吸水纸上。
8)再一次向离心管中加入500μL 70%乙醇,盖紧管盖,缓慢地来回颠倒离心管,然后12000r/min离心3~5min,小心倒掉乙醇,将管倒置于吸水纸上。
9)待干燥后,加入60μL灭菌超纯水,为使其完全溶解,4℃保存过夜,待检测。
3、琼脂糖凝胶电泳检测基因组DNA
1)将凝胶电泳槽洗干净,用胶带纸将两端封住,插上梳子。
2)称取0.24g的琼脂糖,转入三角瓶中,加入1×TBE 30mL使其悬浮,微波炉中火加热,待沸腾2次拿出,待其冷却至不烫手时加入终浓度为0.5μg/mL的EB。然后快速将琼脂糖溶液导入,轻微摇动,防止出现气泡。
3)混匀后(约60℃),立即将琼脂糖溶液到入槽内。如出现气泡,立即用移液器移出。
4)完全冷却凝固(约25~40min)后,拔掉梳子,去掉两端胶带纸,将凝胶移入电泳槽中。
5)向电泳槽中加入1×TBE缓冲液,使液面高出胶面2~5mm。
6)取DNA样品2~4μL,加2μL上样缓冲液后混匀,统一上样(注意枪头的顺序应前后对应),并将DNA Marker加在一边。
7)80V电压电泳2h。
8)在紫外分析仪上观察,如果有RNA则需要纯化,如果有明显降解不能用,需重新提取相应样品的DNA。
4、DNA的纯化
1)500μL的DNA溶液中加入10%SDS使其终浓度为0.1%,加入蛋白酶K至终浓度达到100μg/mL。
2)55℃保温10h左右。
3)等体积苯酚:氯仿:异戊醇(25:24:1)和氯仿分别抽提一次。
4)12000r/min离心5min分相,吸取上层水相至另一离心管中。
5)加入1/10体积3mol/L醋酸钠和2倍体积冰冷无水乙醇沉淀DNA。
6)倒掉液体,70%乙醇洗涤后凉干,加入60μL灭菌超纯水溶解,4℃待检测。
5、分光光度法检测DNA
用紫外光光度计测定DNA样品在260nm、280nm处的OD值。计算DNA含量和OD260/OD280的比值。如OD260/OD280比值小于1.6,说明样品中含有较多的蛋白质或酚,则应进行纯化;若比值大于1.8,则应该考虑去除RNA纯化。
DNA浓度(ng/μL)=50×OD260值×稀释倍数
DNA检测完毕后,取出一定的量稀释至50ng/μL,存于-20℃备用,其余的存放于-80℃。
6、四引物扩增受阻突变体系PCR
1)扩增体系
25μL的总反应体系,其中1.0μL的基因组DNA,上、下游内引物各0.4μL,上、下游外引物各0.8μL,12.5μL的2×Eco Taq PCR Mix以及9.1μL ddH2O
2)PCR扩增反应的程序
(1)94℃预变性5min,然后进入步骤(2);
(2)循环一:94℃变性30s,68℃复性30s,72℃延伸25s;共18个循环,每个循环中复性温度降低1℃,然后进入步骤(3);
(3)循环二:94℃变性30s,60℃复性30s,72℃延伸205s;共24个循环,然后进入步骤(4);
(4)72℃延伸10min。
3)PCR产物琼脂糖凝胶电泳分析
PCR产物上样量为4μL,且琼脂糖凝胶电泳采用的琼脂糖凝胶的质量浓度为2%。电泳结果参见图1,野生纯合基因型TT表现为429bp和194bp两条带纹;杂合子基因型TA表现为429bp、291bp和194bp三条带纹;突变纯合基因型AA表现为429bp和291bp两条带纹,与测序分型结果一致,参见图2。
(五)黄牛长链非编码RNA ADNCR基因SNP位点的频率统计分析
1)基因和基因型频率
基因型频率是指一个群体中某一性状的某种基因型个体数占总个体数的比率。PTT=NTT/N,其中PTT代表某一位点的TT基因型频率;NTT表示群体中具有TT基因型的个体数;N为检测群体的总数量。
基因频率是指一个群体中某一基因数对其等位基因总数的相对比率。计算的公式可以写成:PT=(2NTT+NTa1+NTa2+NTa3+NTa4+……+NTan)/2N
式中,PT表示等位基因T频率,NTT表示群体中具有TT基因型的个体数量,NTai表示群体中具有Tai基因型个体数量,a1~an为等位基因T的n个互不相同的复等位基因。
在秦川牛品种中长链非编码RNA ADNCR基因单核苷酸(SNP)位点中的基因型频率及等位基因频率如表2所示。秦川牛等位基因“A”的频率为0.732,相应的等位基因“T”的频率为0.268,等位基因“A”和“T”的频率均大于1%,故为稳定存在单核苷酸(SNP)类型。
表2.黄牛ADNCR基因在g.1263T>A位点上的SNP基因频率分布表
注:HWE:哈代温伯格平衡;Ho:纯合度;He:杂合度;Ne:有效等位基因数;PIC:多态信息含量。
(六)黄牛长链非编码RNA ADNCR基因SNP位点基因效应的关联分析
基因型数据:PCR扩增后琼脂糖凝胶电泳识别的基因型。
生产数据:秦川牛的体重、胸围、尻长、坐骨端宽等体尺性状数据。
关联分析模型:利用SPSS(18.0)软件来分析品种,不同因素与生长形状相关性。首先要对所得数据描述性的统计分析,来确定是不是存在离群值。然后根据数据的特性,利用方差分析、多元线性模型或者t分析进而来分析基因型的效应。在数据处理的过程中,依据影响体重、体尺生长发育的指标的因素的不同,考虑到个体的效应,基因之间的互作以及基因型的效应,采用固定的模型来进行相关分析。此外,根据实际条件来进行取舍,完整模型如下所示:Y=μ+G+E,其中,Y:个体表型记录;u:总体均值;G:标记基因型效应;E:随机误差。
结果表明:黄牛长链非编码RNA ADNCR基因不同基因型频率与等位基因频率的分布对黄牛某些生产性状(如秦川牛的坐骨端宽)的影响均有显著差异。
由表3可以看出,在对252个秦川牛个体的研究中,长链非编码RNA ADNCR基因的单核苷酸多态性对秦川牛的坐骨端宽性状有显著影响(P<0.05)。因此,长链非编码RNA ADNCR基因的T>A单核苷酸多态性是黄牛生长发育的遗传标记。
表3.长链非编码RNA ADNCR基因SNP对秦川牛生长性状的影响
注:不同字母a、b表示两者之间差异显著。
核苷酸序列表
<110> 西北农林科技大学
<120> 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用
<160> 5
<210> 1
<211> 436
<212> DNA
<213>黄牛(bovine)
<221> allele
<222>(271)
<400> 1
attgcaaggt ctttatctgg ttttacatgc ccctacctat ggccatctaa gttagcaata 60
ctatcttgtg tcacttaaaa ttgctctgcc tttgcttcat ttcttcccag atgtacatga 120
aaactagtca tcttcatagc agattttctt actgaattat cacaattttt atttgctttt 180
aaactagtgg agcctaagaa gctctttgga gcaaatgtta cgaggtcagt ggcattacat 240
actatgtact cctatttcct tgtgttcgta tagcacttta cattttacag ggcactttga 300
tttatttctt catttgttca ttcattcaac cacccagttc acttaaatag ttattgagca 360
cctactggaa ccaagttcct gtgctaggtc ttgtgatata cagtgagagg tacaaacagt 420
aagagaccag gcatgt 436
<210> 2
<211> 28
<212> DNA
<213> 人工合成
<400> 2
atgtactcct atttccttgt gttcgcat 28
<210> 3
<211> 29
<212> DNA
<213> 人工合成
<400> 3
caaagtgccc tgtaaaatgt aaagtgttt 29
<210> 4
<211> 28
<212> DNA
<213> 人工合成
<400> 4
gtctttatct ggttttacat gcccctac 28
<210> 5
<211> 28
<212> DNA
<213> 人工合成
<400> 5
gacatgcctg gtctcttact gtttgtac 28
- 还没有人留言评论。精彩留言会获得点赞!
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺
- 一种用于评估皮肤防御情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤防晒情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤抗皱情况的引物和探针及试剂盒的制作方法
- 人PLIN1基因rs2289487位点多态性检测方法及试剂盒的制作方法
- 测定人NEFM基因rs12515位点多态性的方法及试剂盒的制作方法
- 一种人TERF1基因rs3863242位点多态性检测技术的制作方法
- 测定人CCNH基因rs3093816位点多态性的方法及试剂盒的制作方法
- 测定人NEFL基因rs2979704位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs854560位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs662位点多态性的方法及试剂盒的制作方法
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺