一种柑橘果实特异性启动子及应用的制作方法
本发明属于生物技术领域,具体涉及一种柑橘果实特异性表达启动子及应用。
背景技术:
我国柑橘水果产量达到3300多万吨,成为世界第一柑橘生产大国。柑橘产量基本供需平衡,市场对果实品质提出更高要求。消费要求从“好看、好吃”发展到“色、香、味、形”兼备,培育和改良优良品质的柑橘新品种是当前柑橘产业发展的新需要。
在基因功能及遗传改良研究中,为了使外源基因在受体生物中高效稳定地表达,应用组成型强启动子(如35S)来驱动目的基因超量表达成为研究者常用的策略之一。但组成型启动子驱动外源基因在植物全株均高效表达,造成植物体内营养的大量消耗,往往影响了植物的生长发育,对于解析基因功能或遗传改良均不利。
技术实现要素:
有鉴于此,本发明的第一目的在于一种柑橘果实特异性启动子,所述柑橘果实特异性启动子具有SEQ ID NO.1所示序列,即具有以下序列:
5'-TGTATTGAGAGCAGTTGGGGTTTTATTTGATGCGTCTTTAATCACATTAAAAACCTTTTGTTTGACGCGTCTGTGCTTATTTTGAACAGCAAAAAGGTTAAAAGATTTCATGTATAAAGCGCTTCTACTCTTGATTTTGTCAAATTTTGAGTTCAATTGGTTCTGGAGAAGGTTCAGATCTTTAGGTTGCTAAAATGTAATTGGAGGTTTGTACCTTTATCCTACTTTTGCCTTAAATAACAAGAGTGGATTTCACTCAATTTTTTGTTGCAGATAAAGGCCGGAAAGGACCCAGACATCTATAGATGCATTTATAATAGAAATAATACGGATGAGGCCCTGAGACACATCTAACTTAATTTTAATAATATGGTGAAGTTTGTGAAACTCAACTTTGTAGCAAGTCTTCATATTTAGTGTGTGTGTTTATTATGCATTTGCAGTTTGGTCTAATTTTAATTGAACCTTCTTAACTGTATTGCATATACTCAGTTGGTGATTGCACGAGGAAATTTGCAGTAGAAATCATGACTCATGGGTTGGGAAGTTTAGGGATGAATGTGCGCAACTTTAAACATGAAATGAAAAACCTTTTTTTCTTTTTCTTTTTCTTTTTCACACGCAATTTTCCAAATGCCGACATTTCTCCATGTTTCGGACCGCAGGCAAACTTTTACAATTTGACGGACTCAAGGACCAGAGAGCCCAGAATTTACCGGGCCTTTACCTCGTATTTGGTTATTGGGCTTTTTTCTGCAGAATTGGACCGAGAAATTGGGCCAGCTCAAGAAACTGTTGGCACTGCAAGGCAACTAGTCACTGGGTAGTGACTCATTCTGGTTCCAGAAATCGAACAGTGCGTGCTCCGTTGTCAGATGTAAAGATTGACAAAGTGTGTGTGGCCGGGACAATAAAGAAAAAGGCCGAAGAACCCAAATGGATCAGATTCTAACGCGGACTAGTACGAAGAAGATCGAAACAATGCTGTGCTTGTGTTGAGTCTCATAATTGGAAAGGCAAAAACAGTCCATCCAAATGATAACAATGATTTTGAAGAGGCCTTGAAAGAATTTTGTTGACTTGGCGGCGCGTTATTAAGAAATTTTCAGGCAAAGGCTATTTTCTATCTAATTTTAGTGATGTCTATCAGATTATAATAAGCAGGGCGGCTGCCTATTTTCTATTCTAATTTTACAAAATTTTGCTCCCAAAACCCAAGCCATTTTTAAGCTCACCTGATTATATCCTCTTGGCAAATTGTTCCACTACACAATTTTTGAAGGAGGCGTTTGGTTAGTTATCGATCAGAAGGTATGTACATTTAAGTGATTATCAGGAATTGCGGCAGTTTAATCTACCGGGCTAAACACATATATTTTTGAGAATTATATTACAATTTACTGATATTTTCAGGAAGCCTAAACCCATGTAACTAAAGCACAGTCGGAGCCCTAATGAGCATTGCAAAAATATTAATTGTGTCAAATAGAAATGAGATCTACCCTCACTTAATCACAATTTTTTTTAAAAAAAGTAATAGGAAGTTCGATCTAATGCATTTTTGGAAGCCGGTTAATGAAGTTTGAATTTACTCAATGTGCTTGTAATAGAAATTGGATATGTCCCAATTACTGTTATTTCTCTTGGTATTTATTTTTATTCTTAGATAATCAAAAATATAAAATTTAGGCTTTTATTATGTTATATAATTATGTAACAATCGTGGAATGAAATCCAACGATTATAAAAATATAAGATAAAAAATTATATTATTTTTACAATCGTTAAATTTTTAATTTAACGATTGTATAATTATATATGTTACATCGTTATATAACATAATAATCATCATAAATTTAATATTTTTTGTGCTTTTAAAAAGTTAACAGGAAGAAGATTGCAGGGAATTGCATTGTCGGGAAAATCATTGATGCCTTTGAAGACATATACGGTGGATAGAAGAGAGAGATGGTAAAAGCATTAAGCTAATTAAATATTACCGATAAAGAAGACACGTGGCAACAAGAGATGGCCCGCGAAGGCACCAGAGATTTCGTCTAATAGAAAGCATCCAGAATCCTCTACATAAATCATATTAGTCCTATATATAGGCCTCTCTTGTCTCATCCTTCTCCATCTTCAAATTGATTGATCAAAGCATTTCCGAAGTTGTTGAGCATTTAATTAGCGTCCCAGTTTGCCATA-3'。
优选地,本发明所述柑橘果实特异性启动子具有SEQ ID NO.1所示序列至少90%以上同源性,且具有启动外源基因在柑橘果实特异性表达的功能。
优选地,本发明所述柑橘果实特异性启动子为SEQ ID NO.1所示序列修饰后的序列,且具有启动外源基因在柑橘果实特异性表达的功能。
本发明的另一目的在于提供一种重组表达载体,所述重组表达载体包括具有SEQ ID NO.1所示序列的柑橘果实特异性启动子。
优选地,本发明所述重组表达载体包括SEQ ID NO.1所示序列至少90%以上同源性的启动子,或SEQ ID NO.1所示序列修饰后的启动子,且具有启动外源基因在柑橘果实特异性表达的功能。
本发明的再一目的为提供一种重组微生物,上述重组微生物由上述重组表达载体分别转化微生物所获得。
优选地,本发明所述微生物是土壤农杆菌(Agrobacterium tumefaciens)。
更优选地,本发明土壤农杆菌包括具有SEQ ID NO.1所示序列至少90%以上同源性,或SEQ ID NO.1所示序列修饰后的序列的启动子,且具有启动外源基因在柑橘果实特异性表达的功能。
本发明还提供了上述柑橘果实特异性启动子、重组表达载体或重组微生物在植物转化中的应用;其中,所述在植物转化中的应用还可以为在柑橘果实改良中的应用。
本申请发明人将甜橙Cs8g18360基因起始密码子5'上游2.2Kb左右序列作为该基因的启动子序列,将该启动子命名为CFP1。经发明实施例验证,该启动子为果实特异性启动子。此启动子序列还未见到任何报道或阐述,本发明的启动子区或其变体适于与任何目的基因融合,所形成的构建物转入植物当中使目的基因在植物细胞中表达。
本发明所阐明的柑橘果实特异性启动子区可以作为一个启动子序列插在重组基因构建物中而用于植物的转化。在这一植物基因表达构建物当中,启动子区具有本发明所示的序列或任何与之相关的有启动子活性的变体。它所连接的是除了以天然形式存在的此柑橘果实特异性启动子以外的任何目的基因序列;目的基因的DNA序列可以来自同源植物、外源植物、真菌、藻类、细菌、病毒或动物基因;也可以是人工设计、合成的DNA序列。目的基因可以是单一的基因或一系列的基因。在植物细胞中目的基因适合于转录为功能性的RNA;还可以是mRNA,再通过核糖体翻译成蛋白质;或可以抑制与之相关mRNA翻译的RNA形式。两者都能造成细胞生化成分及相关过程的变化。因此,此目的基因可以是一段编码有功能的蛋白质或其一部分的正义序列,或一段反义序列。可以利用多种转化手段将本发明所涉及的植物表达构建物转入植物当中,任何适合于植物或植物细胞的转化方法都可以使用;如用含有重组Ti质粒的农杆菌侵染,电击法,细胞和原生质体显微注射法,基因枪转化法和花粉管导入法等。然后被转化的细胞在合适条件下可以再生成完整的植株,前面所描述的嵌合基因构建物已稳定整合于其基因组之中;也可以是含有这种转化细胞的植物组织或植株,以及由其衍生出的植株或得出的种子。
本发明还进一步提供了一个控制植物基因表达的方法。在植物基因表达构建物中柑橘果实特异性启动子与目的基因相连接,此启动子可以被激活而驱动目的基因的表达。为了研究此启动子序列的功能特征,可以将此柑橘果实特异性启动子片段与报告基因连接。常用的报告基因有CAT基因、GUS基因、荧光素酶(luciferase,LUC)基因和绿色荧光蛋白(GFP)基因等。GFP荧光反应不需要外加底物和辅助因子,只需紫外光或蓝光激发,即可发出绿色荧光,用荧光显微镜甚至肉眼就可以观察到。而且对于单细胞水平的表达也可识别。
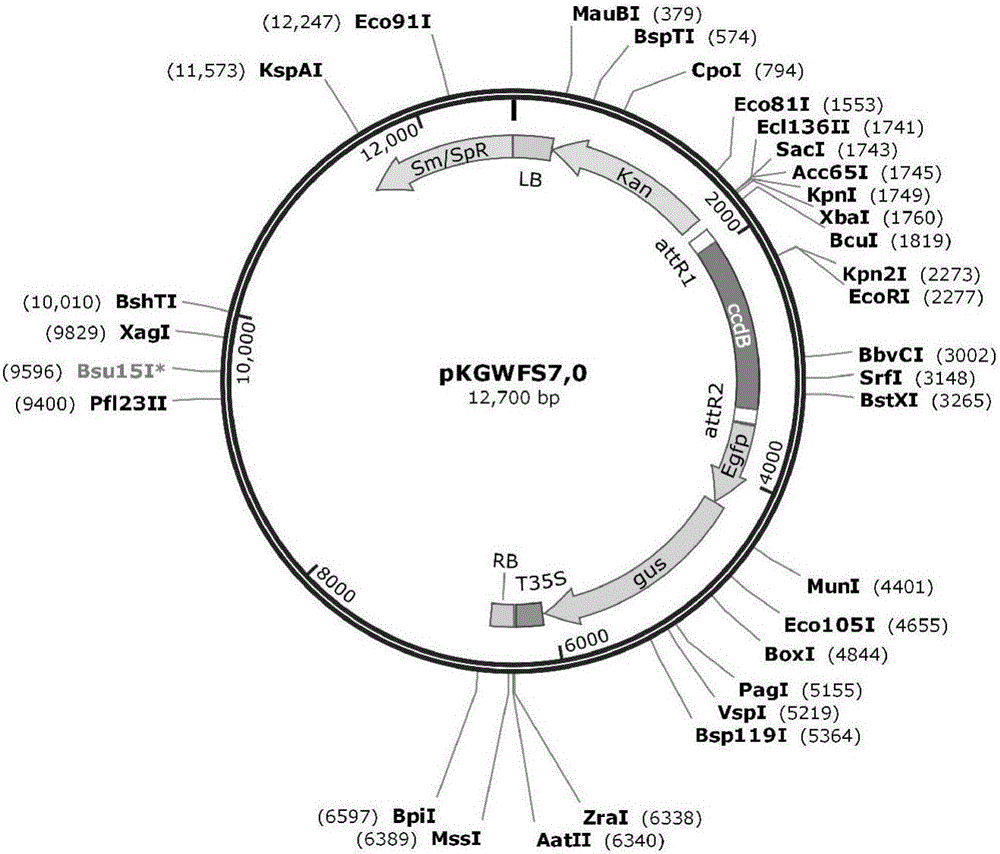
本实施例通过克隆SEQ ID NO.1所示的启动子序列,将该启动子序列通过gateway克隆技术同源重组至pKGWFS7表达载体,载体结构如图1,表达载体构建示意图如图2,以带有35S启动子的pKGWFS7重组质粒为阳性对照,农杆菌介导法分别转化山金柑,利用体式荧光显微镜检测GFP基因的表达。
附图说明
图1为pKGWFS7载体结构图;
图2为启动子表达载体构建示意图;
图3为目的启动子序列的扩增,A为CFSP1-F/CFSP1-R在红夏橙基因组DNA中的扩增结果,B为35S-F/35S-R在pBI121质粒DNA中的扩增结果,图中M代表1Kb DNA ladder;
图4为利用attB1/attB2进行PCR阳性验证的结果,A为CFP1启动子的PCR验证结果,B为35S启动子的PCR验证结果。图中M代表1Kb DNA ladder;
图5为gateway克隆一轮PCR扩增结果。图中M代表1Kb DNA ladder;
图6为gateway克隆二轮PCR扩增结果。图中M代表1Kb DNA ladder;
图7为LR反应PCR阳性验证结果。图中M代表1Kb DNA ladder;
图8为农杆菌菌液PCR阳性验证结果,A为pKGWFS7-5'/P1-3'在包含CFP1重组表达载体的农杆菌菌液中的扩增结果,B为pKGWFS7-5'/35S-3'在包含35S重组表达载体的农杆菌菌液中的扩增结果。图中M代表1Kb DNA ladder;
图9为转基因山金柑PCR阳性鉴定结果,A为attB1/attB2在35S::GFP中的扩增结果,B为pKGWFS7-5'/P1-3'在CFP1::GFP中的扩增结果。图中M代表1Kb DNA ladder,1-15各数字代表受检测的独立转基因系,P代表质粒阳性对照,W代表未转基因的阴性对照;
图10为不同山金柑组织GFP表达情况。图中S代表茎,L代表叶,O代表子房及花托,OS为子房切面图。图中标尺为2mm。
具体实施方式
以下通过具体实施例进一步对本发明的技术方案进行说明,应理解以下仅为本发明的示例性说明,并不用于限制本发明权利要求的保护范围。
实施例1
1.启动子序列克隆与表达载体构建
(1)以甜橙基因组数据库(http://citrus.hzau.edu.cn/orange/)中Cs8g18360基因及5'上游序列作为参考序列,设计、合成引物。以红夏橙[Citrus sinensis(L.)Osbeck]基因组DNA为模板,引物对CFSP1-F/CFSP1-R扩增包含SEQ ID NO.1所示启动子序列的DNA片段;以pBI121质粒DNA为模板,引物对35S-F/35S-R扩增35S启动子序列。PCR反应体系如下:25μl 2X Phanta Max Buffer,1μl dNTP Mix(10mM each),1μl Phanta Max Super-Fidelity DNA Polymerase(1U/μl)(均购自于南京诺唯赞生物),200ng模板DNA,正、反向引物各20μM,ddH2O补充至终体积50μl。热循环参数为:95℃(预变性)3min,1个循环;95℃(变性)30sec,57℃(退火,扩增35S启动子序列使用55℃)30sec,72℃(延伸)80sec(扩增35S启动子序列使用30sec),32个循环;72℃(终延伸)5min,1个循环;12℃保存。
(2)1.5%琼脂糖凝胶电泳检测PCR产物,分别切取2.3Kb、0.85Kb左右大小的目的条带,使用Gel Extraction Kit(Omega,USA)回收目的条带DNA。图3为启动子序列扩增结果。
(3)使用Cloning Kit(购自于北京全式金生物)将回收产物与Cloning Vector进行连接,热激转化至大肠杆菌Trans5α。
(4)挑取单克隆细胞扩繁,PCR验证阳性,结果如图4所示。阳性克隆菌液送武汉擎科创新生物科技有限公司测序,测序序列与甜橙基因组参考序列比对,序列正确的菌液提取质粒,置于-20℃保存。
(5)利用引物对attB1+P1-F/attB2+P1-R,attB1+35S-F/attB2+35S-R,以上述测序正确的质粒为模板进行gateway克隆一轮PCR扩增,扩增结果如图5所示。
(6)利用引物对attB1/attB2,以上述PCR产物为模板分别进行gateway克隆二轮PCR扩增,扩增结果如图6所示。1.5%琼脂糖凝胶电泳检测PCR产物,分别切取0.9Kb、2.3Kb左右大小的目的条带,使用Gel Extraction Kit(Omega,USA)回收目的条带DNA。
(7)上述回收产物与中间载体pDONR207进行BP反应并转化大肠杆菌Trans5α。BP反应使用Invitrogen公司的BPII酶进行催化,反应体系如下:V(回收产物)=质粒大小*16.5/质粒浓度(ng/μl),V(pDONR207)=5.5*16.5/质粒浓度(ng/μl),V(ddH2O)=2-(X+Y),V(BP Clonase)=0.5μl,25℃水浴12-16h。
(8)挑取单克隆细胞扩繁,PCR验证阳性,阳性克隆菌液送武汉擎科创新生物科技有限公司测序,测序序列与甜橙基因组参考序列比对,序列正确的菌液提取质粒。测序正确的质粒与终载体pKGWFS7进行LR反应并转化大肠杆菌Trans5α。LR反应使用Invitrogen公司的LRII酶进行催化,反应体系如下:V(质粒)=质粒大小*16.5/质粒浓度(ng/μl),V(pKGWFS7)=质粒大小*16.5/质粒浓度(ng/μl),V(ddH2O)=2-(X+Y),V(LR Clonase)=0.5μl,25℃水浴12-16h。
(9)挑取单克隆细胞扩繁,利用引物对pKGWFS7-5'/35S-3',pKGWFS7-5'/P1-3',分别进行PCR阳性验证,结果如图7所示。阳性克隆菌液送武汉擎科创新生物科技有限公司测序,测序序列与甜橙基因组参考序列比对,序列正确的菌液提取质粒,置于-20℃保存。
其中,本实施例中引物对(依次为SEQ ID NO.2~NO.14)如下:
[1]引物对
2.农杆菌介导法转化山金柑(Fortunella hindsii Swingle):
(1)柑橘外植体准备。
将山金柑种子用自来水清洗干净,于1M NaOH中浸泡10min去除果胶,然后流水冲洗干净;在超净台上将种子置于有效氯浓度为3%的次氯酸钠溶液中浸泡15min(期间摇动2-3次),进行种子表面灭菌,无菌蒸馏水洗涤3-5次。在超净台上,用无菌手术刀和镊子将种子外表皮剥除,接种于MT播种培养基中。暗培养1周后转至光培养2个月左右。切取0.8-1.5cm长的上胚轴用于遗传转化,采取斜切的方式,使上胚轴生理学上下端的切口处于同一面。
(2)土壤农杆菌的制备。
步骤2中提取并测序正确的终载体质粒加入200ul农杆菌EHA105感受态中,冰浴30min,液氮速冻5min,再37℃水浴5min,冰浴2min,加入800ulLB液体培养基,28℃,200rpm,培养4-5h。2000-3000rpm离心菌液2min,弃上清,取下层200ul菌液涂含50mg/L壮观霉素和25mg/L利福平的LB平板。28℃培养48h,挑单克隆细胞扩繁,利用引物对pKGWFS7-5'/35S-3',pKGWFS7-5'/P1-3'分别进行PCR扩增检测。图8为PCR阳性验证结果。
(3)农杆菌侵染液的制备。验证为阳性的农杆菌于固体LB培养基(含有50mg/L壮观霉素和25mg/L利福平)上涂平板,28℃培养2d。用无菌手术刀刮取菌体于悬浮培养基中,180rpm,28℃,振荡培养1.5-2h备用,用紫外分光光度计检测菌液浓度,调整OD600在0.8-1.2。
(4)侵染与共培养。将切好的外植体浸泡在制备好的农杆菌菌液中,静置侵染20min后弃菌液,用无菌吸水纸吸干外植体表面菌液,切口朝上置于共培培养基上,21℃暗培养3d。
(5)共培养后的山金柑上胚轴置于含400mg/L头孢霉素的无菌蒸馏水中清洗5min,之后无菌蒸馏水清洗3-5次,无菌吸水纸吸干外植体表面水分,置于生芽培养基上光照培养,培养温度26±2℃,光照强度1500-2000Lx,每日光照16h。每个月继代一次。
(6)待山金柑上胚轴切口处再生抗性芽长出三至四片叶时,将其接种至生根培养基诱导生根。待根长达到2-3CM时,将再生抗性苗从培养基中取出,洗净残留的培养基,移栽至盛有灭菌腐殖质基质的有孔塑料杯中培养1周,注意保温保湿。之后移栽至小盆中,视其生长情况移栽至大盆中培养。
[2]培养基配方:
[3]基本培养基:MT(Murashige and Tucker,1969)
[4]播种培养基:MT+蔗糖25g/L+琼脂8g/L
[5]悬浮培养基:MT+麦芽提取物0.5g/L+L-谷氨酰胺1.5g/L
[6]共培培养基:MT+AS 20mg/L
[7]生芽培养基:MT+BA 0.5mg/L+KT 0.5mg/L+NAA 0.1mg/L+琼脂8.0g/L+卡那霉素50mg/L+头孢霉素400mg/L
[8]生根培养基:1/2MT+NAA 0.5mg/L+IBA 0.1mg/L+活性炭0.5g/L+蔗糖25g/L+琼脂8.0g/L+卡那霉素25mg/L+头孢霉素400mg/L
上述培养基pH调至5.8-6.0。
3.转基因山金柑阳性检测:
(1)采用改良的CTAB法提取移栽至大盆的抗性植株基因组DNA。
(2)利用引物对attB1/attB2、pKGWFS7-5'/P1-3'分别扩增分析获得的抗性植株基因组DNA。PCR反应体系如下:5μl TaqMix,正反向引物各0.2μl(10μM),DNA 1μl(50-150ng/μl),ddH2O补充至终体积10μl。热循环参数为:95℃(预变性)5min,1个循环;95℃(变性)30sec,55℃(退火)30sec,72℃(延伸)1min,32个循环;72℃,8min,1个循环;12℃保存。
(3)1.0%琼脂糖凝胶电泳检测PCR产物,阳性鉴定结果如图9所示,35S有10个阳性转基因系,CFP1有2个阳性转基因系。
其中,引物对如下:
[9]引物对(SEQ ID NO.10~14)
4.山金柑不同组织GFP基因表达情况检测:鉴定为阳性的转基因山金柑,采集叶、茎和子房检测GFP基因表达情况。所用仪器为体式荧光显微镜(Leica MZFLIII),滤光片为GFP。经鉴定,如图10所示,转基因未成功的阴性对照(CK)各组织均无绿色荧光,35S::GFP各组织均有绿色荧光,而CFP1::GFP中,茎、叶均无绿色荧光,但子房出现绿色荧光。我们知道,子房发育成果实,说明该启动子具有果实特异性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
SEQUENCE LISTING
<110> 华中农业大学
<120> 一种柑橘果实特异性启动子及应用
<160> 19
<170> PatentIn version 3.5
<210> 1
<211> 2205
<212> DNA
<213> Citrus sinensis(L.)Osbeck
<400> 1
tgtattgaga gcagttgggg ttttatttga tgcgtcttta atcacattaa aaaccttttg 60
tttgacgcgt ctgtgcttat tttgaacagc aaaaaggtta aaagatttca tgtataaagc 120
gcttctactc ttgattttgt caaattttga gttcaattgg ttctggagaa ggttcagatc 180
tttaggttgc taaaatgtaa ttggaggttt gtacctttat cctacttttg ccttaaataa 240
caagagtgga tttcactcaa ttttttgttg cagataaagg ccggaaagga cccagacatc 300
tatagatgca tttataatag aaataatacg gatgaggccc tgagacacat ctaacttaat 360
tttaataata tggtgaagtt tgtgaaactc aactttgtag caagtcttca tatttagtgt 420
gtgtgtttat tatgcatttg cagtttggtc taattttaat tgaaccttct taactgtatt 480
gcatatactc agttggtgat tgcacgagga aatttgcagt agaaatcatg actcatgggt 540
tgggaagttt agggatgaat gtgcgcaact ttaaacatga aatgaaaaac ctttttttct 600
ttttcttttt ctttttcaca cgcaattttc caaatgccga catttctcca tgtttcggac 660
cgcaggcaaa cttttacaat ttgacggact caaggaccag agagcccaga atttaccggg 720
cctttacctc gtatttggtt attgggcttt tttctgcaga attggaccga gaaattgggc 780
cagctcaaga aactgttggc actgcaaggc aactagtcac tgggtagtga ctcattctgg 840
ttccagaaat cgaacagtgc gtgctccgtt gtcagatgta aagattgaca aagtgtgtgt 900
ggccgggaca ataaagaaaa aggccgaaga acccaaatgg atcagattct aacgcggact 960
agtacgaaga agatcgaaac aatgctgtgc ttgtgttgag tctcataatt ggaaaggcaa 1020
aaacagtcca tccaaatgat aacaatgatt ttgaagaggc cttgaaagaa ttttgttgac 1080
ttggcggcgc gttattaaga aattttcagg caaaggctat tttctatcta attttagtga 1140
tgtctatcag attataataa gcagggcggc tgcctatttt ctattctaat tttacaaaat 1200
tttgctccca aaacccaagc catttttaag ctcacctgat tatatcctct tggcaaattg 1260
ttccactaca caatttttga aggaggcgtt tggttagtta tcgatcagaa ggtatgtaca 1320
tttaagtgat tatcaggaat tgcggcagtt taatctaccg ggctaaacac atatattttt 1380
gagaattata ttacaattta ctgatatttt caggaagcct aaacccatgt aactaaagca 1440
cagtcggagc cctaatgagc attgcaaaaa tattaattgt gtcaaataga aatgagatct 1500
accctcactt aatcacaatt ttttttaaaa aaagtaatag gaagttcgat ctaatgcatt 1560
tttggaagcc ggttaatgaa gtttgaattt actcaatgtg cttgtaatag aaattggata 1620
tgtcccaatt actgttattt ctcttggtat ttatttttat tcttagataa tcaaaaatat 1680
aaaatttagg cttttattat gttatataat tatgtaacaa tcgtggaatg aaatccaacg 1740
attataaaaa tataagataa aaaattatat tatttttaca atcgttaaat ttttaattta 1800
acgattgtat aattatatat gttacatcgt tatataacat aataatcatc ataaatttaa 1860
tattttttgt gcttttaaaa agttaacagg aagaagattg cagggaattg cattgtcggg 1920
aaaatcattg atgcctttga agacatatac ggtggataga agagagagat ggtaaaagca 1980
ttaagctaat taaatattac cgataaagaa gacacgtggc aacaagagat ggcccgcgaa 2040
ggcaccagag atttcgtcta atagaaagca tccagaatcc tctacataaa tcatattagt 2100
cctatatata ggcctctctt gtctcatcct tctccatctt caaattgatt gatcaaagca 2160
tttccgaagt tgttgagcat ttaattagcg tcccagtttg ccata 2205
<210> 2
<211> 22
<212> DNA
<213> 人工序列
<400> 2
tgtattgaga gcagttgggg tt 22
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
cgttggtaag ggcagaggac 20
<210> 4
<211> 18
<212> DNA
<213> 人工序列
<400> 4
caggtcccca gattagcc 18
<210> 5
<211> 18
<212> DNA
<213> 人工序列
<400> 5
agagtccccc gtgttctc 18
<210> 6
<211> 36
<212> DNA
<213> 人工序列
<400> 6
aaaaagcagg cttctgtatt gagagcagtt ggggtt 36
<210> 7
<211> 35
<212> DNA
<213> 人工序列
<400> 7
agaaagctgg gtgtatggca aactgggacg ctaat 35
<210> 8
<211> 32
<212> DNA
<213> 人工序列
<400> 8
aaaaagcagg cttccaggtc cccagattag cc 32
<210> 9
<211> 31
<212> DNA
<213> 人工序列
<400> 9
agaaagctgg gtgagagtcc cccgtgttct c 31
<210> 10
<211> 29
<212> DNA
<213> 人工序列
<400> 10
ggggacaagt ttgtacaaaa aagcaggct 29
<210> 11
<211> 29
<212> DNA
<213> 人工序列
<400> 11
ggggaccact ttgtacaaga aagctgggt 29
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<400> 12
ggttctgtca gttccaaacg 20
<210> 13
<211> 18
<212> DNA
<213> 人工序列
<400> 13
gttcgccagt ctttacgg 18
<210> 14
<211> 18
<212> DNA
<213> 人工序列
<400> 14
ccctaaactt cccaaccc 18
- 还没有人留言评论。精彩留言会获得点赞!