抗菌肽改构的多肽及其在细胞转染中的应用的制作方法
本发明涉及生物
技术领域:
中,抗菌肽改构的多肽及其在细胞转染中的应用。
背景技术:
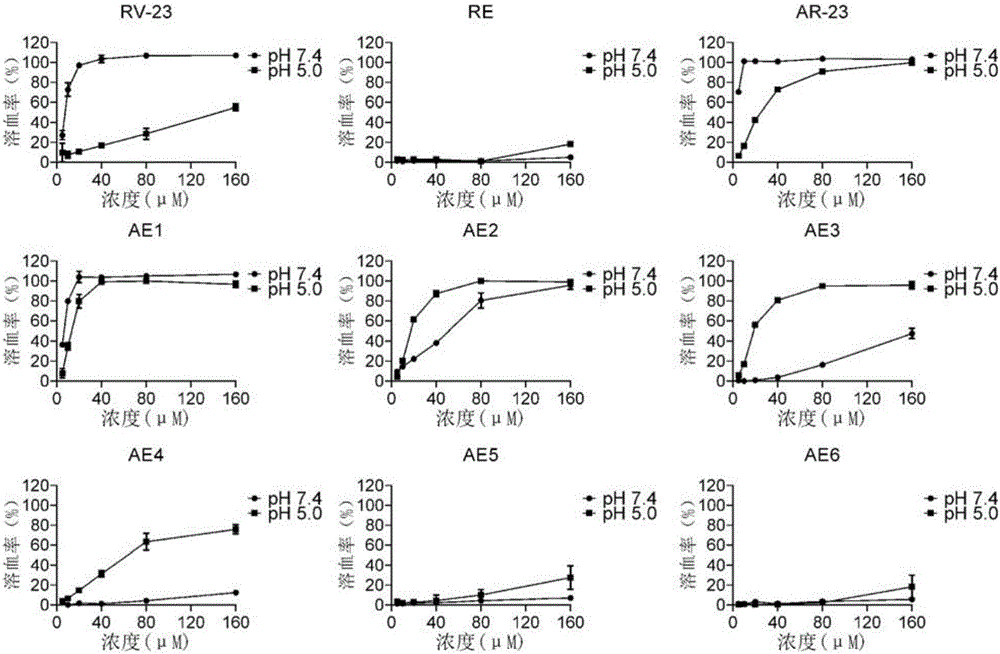
:基因治疗是利用正常的基因来替代或填补基因疾病中某些病变或缺失基因的一种治疗方法。它能够广泛地治疗各类先天性和后天性疾病,通过调节控制生物活性蛋白在细胞内的表达进而达到抑制疾病恶化的效果,治疗甚至治愈疾病,但由于缺乏安全高效的载体,其临床应用受到一定的限制。目前,基因载体主要分病毒型和非病毒型两大类。病毒载体是目前基因治疗的主要工具,但存在安全隐患和免疫原性,体内不能反复应用。非病毒载体是病毒载体的重要补充途径,转染效率较低,但一般比病毒载体安全,体内可反复应用。基于表达质粒的转染,目前人们努力改善非病毒载体。作为非病毒载体的阳离子多聚物有多聚赖氨酸、鱼精蛋白、多聚精氨酸、聚乙烯亚胺(polyethylenimine,PEI)、壳聚糖等。1995年OtmanBoussif报道了PEI可作为非病毒载体,而后,其成为阳离子多聚物研究领域最快的物质。然而,PEI/DNA复合物被细胞吞噬后不能有效从内含体释放是其转染效率相对低下的主要原因。研究表明,蜂毒肽melittin能够增强PEI介导的基因转染,其原理是利用melittin对细胞膜的穿透作用(打孔)增加PEI/DNA从内含体释放及进入细胞核的能力,进而增加基因转染效率,此后,melittin被用于交联多种基因载体,促进其从内含体释放及进入细胞核,进而增加基因转染效率。然而melittin在中性pH条件下的细胞毒性较大,阻碍了其应用。但是,此策略也存在矛盾:melittin的穿膜活性对促进基因转染非常重要,但是也会产生很高的细胞毒性。因此,如何在增加转染效率的同时,降低细胞毒性是一个急需解决的问题。本申请的发明人在前期的研究中发现来自塔氏蛙(Ranatagoi)的melittin相关肽AR-23和来自加州红腿蛙(Ranadraytonii)的RV-23均有较强的抗菌作用,从溶血率曲线上看,与melittin相比,AR-23及RV-23细胞毒性明显较低。AR-23和RV-23均由23个氨基酸残基组成。其中,AR-23与melittin有78%的同源性,有与melittin完全一致的亮氨酸拉链的结构,但其C端只有3个氨基酸。RV-23的亮氨酸和异亮氨酸数目与melittin完全一样,不同的是它并不形成亮氨酸拉链的结构。相比之下,RV-23其抗菌活性与melittin及AR-23相差不大,但毒性远低于melittin和AR-23。技术实现要素:本发明所要解决的技术问题是如何在不影响细胞活性的情况下提高哺乳动物细胞的转染效率。为解决上述技术问题,本发明首先提供了可用于细胞转染的多肽。本发明所提供的多肽,为下述A1)或A2):A1)将AR-23的第8位、第11位、第17位、第21位和第23位的氨基酸残基经过一个或两个氨基酸残基的取代和/或缺失和/或添加得到的多肽;A2)将RV-23的第1位、第8位、第11位、第17位、第21位和第22位的氨基酸残基经过一个或两个氨基酸残基的取代和/或缺失和/或添加得到的多肽。上述多肽中,AR-23的氨基酸序列可为序列表中序列1。RV-23的氨基酸序列可为序列表中序列2。上述多肽中,A1)所述多肽可为将AR-23进行下述M1-M5这五种中的五种、四种、三种、两种或一种突变得到的衍生物:M1、将AR-23的第8位氨基酸残基突变为Glu;M2、将AR-23的第11位氨基酸残基突变为Glu;M3、将AR-23的第17位氨基酸残基突变为Glu;M4、将AR-23的第21位氨基酸残基突变为Glu;M5、将AR-23的第23位氨基酸残基突变为Glu。A2)所述多肽可为将RV-23进行下述N1-N6这六种中的六种、五种、四种、三种、两种或一种突变得到的衍生物:N1、将RV-23的第1位氨基酸残基突变为Glu;N2、将RV-23的第8位氨基酸残基突变为Glu;N3、将RV-23的第11位氨基酸残基突变为Glu;N4、将RV-23的第17位氨基酸残基突变为Glu;N5、将RV-23的第21位氨基酸残基突变为Glu;N6、将RV-23的第22位氨基酸残基突变为Glu。上述多肽中,A1)所述多肽可为A11)-A16)中的任一种:A11)序列表中序列6所示的多肽(将其命名为AE4);A12)序列表中序列5所示的多肽(将其命名为AE3);A13)序列表中序列7所示的多肽(将其命名为AE5);A14)序列表中序列8所示的多肽(将其命名为AE6);A15)序列表中序列4所示的多肽(将其命名为AE2);A16)序列表中序列3所示的多肽(将其命名为AE1);A2)所述多肽为序列表中序列9所示的多肽(将其命名为RE)。上述多肽可人工合成,也可先合成其编码基因,再进行生物表达得到。为解决上述技术问题,本发明还提供了与所述多肽相关的生物材料。本发明所提供的与所述多肽相关的生物材料,为下述B1)至B16)中的任一种:B1)编码所述多肽的核酸分子;B2)含有B1)所述核酸分子的表达盒;B3)含有B1)所述核酸分子的重组载体;B4)含有B2)所述表达盒的重组载体;B5)含有B1)所述核酸分子的重组微生物;B6)含有B2)所述表达盒的重组微生物;B7)含有B3)所述重组载体的重组微生物;B8)含有B4)所述重组载体的重组微生物;B9)含有B1)所述核酸分子的转基因动物细胞系;B10)含有B2)所述表达盒的转基因动物细胞系;B11)含有B3)所述重组载体的转基因动物细胞系;B12)含有B4)所述重组载体的转基因动物细胞系;B13)含有B1)所述核酸分子的转基因植物细胞系;B14)含有B2)所述表达盒的转基因植物细胞系;B15)含有B3)所述重组载体的转基因植物细胞系;B16)含有B4)所述重组载体的转基因植物细胞系。上述生物材料中,所述核酸分子可为如下1)或2)或3)或4)所示的核酸分子:1)编码所述多肽的DNA分子;2)编码所述多肽的cDNA分子3)与1)或2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述多肽的cDNA分子或基因组DNA分子;4)在严格条件下与1)或2)限定的核苷酸序列杂交,且编码所述多肽的cDNA分子或基因组DNA分子。本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述多肽的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明的所述多肽的核苷酸序列75%或者更高同一性的核苷酸,只要编码所述多肽且具有抑菌作用,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码所述多肽的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。上述生物材料中,所述严格条件是在2×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次15min。上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。上述生物材料中,B2)所述的含有编码所述多肽的核酸分子的表达盒,是指能够在宿主细胞中表达所述多肽的DNA,该DNA不但可包括启动所述多肽基因转录的启动子,还可包括终止所述多肽基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用现有的表达载体构建含有所述多肽基因表达盒的重组载体。上述生物材料中,所述载体可为质粒、黏粒、噬菌体或病毒载体。上述生物材料中,B5)-B8)所述的微生物可为酵母、细菌、藻或真菌。上述生物材料中,B9)-B16)所述的转基因植物细胞系和转基因动物细胞系均不包括繁殖材料。为解决上述技术问题,本发明还提供了所述多肽或所述生物材料的下述任一应用:X1、在作为细胞转染增强剂中的应用;X2、在作为细胞转染产品中的应用;X3、在制备细胞转染增强剂中的应用;X4、在制备细胞转染产品中的应用;X5、在提高细胞转染效率中的应用;X6、在细胞转染中的应用。上述应用中,所述细胞转染可为阳离子聚合物介导的细胞转染。所述阳离子聚合物可用于细胞转染。所述阳离子聚合物可为聚乙烯亚胺。上述应用中,所述细胞可为m1或m2:m1、动物细胞;m2、哺乳动物细胞(如HeLa细胞或HepG2细胞)。为解决上述技术问题,本发明还提供了细胞转染产品。本发明所提供的细胞转染产品,包括下述Y1-Y4中的任一种:Y1、所述多肽;Y2、所述生物材料;Y3、所述多肽与可用于细胞转染的阳离子聚合物;Y4、所述生物材料与可用于细胞转染的阳离子聚合物。上述细胞转染产品可仅以上述Y1-Y4中的任一种作为其活性成分,还可以将上述Y1-Y4中的任一种与其他物质一起作为其活性成分。上述细胞转染产品中,所述阳离子聚合物可为聚乙烯亚胺。上述细胞转染产品中,所述细胞可为m1或m2:m1、动物细胞;m2、哺乳动物细胞(如HeLa细胞或HepG2细胞)。本发明提供了一组由抗菌肽改构的得到的多肽。这些多肽与初始抗菌肽相比,在酸性环境的溶血能力显著增强并且在中性环境的溶血能力降低,这些多肽还可以增强PEI介导的哺乳动物细胞转染效率,但对其细胞活性影响不大。将AR-23经改构得到的衍生多肽——AE4、AE3、AE2、AE5与AE6均可以降低其细胞毒性:AE4、AE3与AE2在酸性条件下的溶血率均显著高于相应多肽在中性条件下的溶血率;AE5在酸性条件下的溶血率也具有高于相应多肽在中性条件下的溶血率的趋势;AE6在浓度为160μM时,其在酸性条件下的溶血率显著高于在中性条件下的溶血率。将RV-23改构得到的衍生多肽RE在酸性条件下的溶血率显著高于其在中性条件下的溶血率。与PEI/DNA相比,将AR-23经改构得到的衍生多肽——AE1、AE2、AE3、AE4、AE5和AE6与PEI/DNA混合后,对Hela细胞的转染效率较PEI/DNA复合物分别提高至6.4倍、11.9倍、51.9倍、32.0倍、30.8倍和24.0倍,对HepG2细胞的转染效率较PEI/DNA复合物分别提高至2.5倍、2.6倍、3.8倍、3.7倍、3.6倍和5.2倍,而AR-23与PEI/DNA混合后对Hela细胞和HepG2细胞的转染效率分别是PEI/DNA复合物转染效率的0.2倍和1.4倍;与PEI/DNA相比,将RV-23改构得到的衍生多肽RE与PEI/DNA混合后,对Hela细胞和HepG2细胞的转染效率较PEI/DNA分别提高至42.0倍和8.3倍,而RV-23与PEI/DNA混合后对Hela细胞和HepG2细胞的转染效率分别是PEI/DNA复合物转染效率的1.2倍和0.1倍,因此,AR-23和RV-23几乎不增加PEI/DNA转染Hela细胞和HepG-2细胞的能力。本发明的多肽与可用于细胞转染的阳离子聚合物(如聚乙烯亚胺(PEI))连用能够明显增强细胞转染的效率。表明,本发明的多肽可作为细胞转染增强剂,提高阳离子聚合物介导的细胞转染的效率。附图说明图1为不同多肽在不同pH溶液中的溶血活性。图2为不同多肽增强PEI介导的对HeLa细胞的转染效率。图3为不同多肽增强PEI介导的对HepG2细胞的转染效率。图4为多肽转染HeLa细胞后对其细胞活性的影响。图5为多肽转染HepG2细胞后对其细胞活性的影响。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中的HeLa细胞和HepG2细胞为国家实验细胞资源共享平台产品,HeLa细胞的资源编号为3111C0001CCC000011,HepG2细胞的资源编号为3111C0001CCC000035。下述实施例中的荧光素梅质粒(pGL3-ControlVectorpGL3)为Promega公司产品,货号E1471;lipofectamine2000为ThermoFishSCIENTIFIC公司产品,货号为11668027;聚乙烯亚胺(PEI)为SIGMA公司产品,货号为408727。实施例1、抗菌肽AR-23和RV-23的衍生多肽在促进基因转染中的应用本实施例所提供的多肽为AE1、AE2、AE3、AE4、AE5、AE6和RE。AE1为将抗菌肽AR-23(序列表中序列1)的第11位的赖氨酸残基替换为谷氨酸残基得到的衍生多肽;AE2为把AE1的第21位的赖氨酸残基替换为谷氨酸残基得到的衍生多肽;AE3为把AE2的第23位的精氨酸残基替换为谷氨酸残基得到的衍生多肽;AE4为把AE3的第8位的丙氨酸残基替换为谷氨酸残基得到的衍生多肽;AE5为把AE3的第17位的异亮氨酸残基替换为谷氨酸残基得到的衍生多肽;AE6为把AE5的第8位的丙氨酸残基替换为谷氨酸残基得到的衍生多肽;RE为把抗菌肽RV-23(序列表中序列2)的第1位和第8位的精氨酸残基以及第11位、第17位、第21位和第22位的赖氨酸残基分别替换为谷氨酸残基得到的衍生多肽,人工合成各多肽,各多肽的氨基酸序列如表1所示。表1、多肽氨基酸序列一、多肽溶血能力测定按照如下方法分别测定AE1、AE2、AE3、AE4、AE5、AE6和RE的溶血能力,分别利用AR-23和RV-23作为对照。实验重复三次:首先配置pH5.0(150mM氯化钠,15mM柠檬酸,pH5.0)和pH7.4(150mM氯化钠20mMHepespH7.4)的两种缓冲液。将人新鲜柠檬酸钠抗凝外周血用pH5.0的缓冲液洗三次,并用pH5.0的缓冲液配成1.25%压积的红细胞悬液,混匀,取160μl到96孔板中;用pH5.0的缓冲液溶解多肽配置多肽溶液,各多肽溶液的浓度均分别为800、400、200、100、50、25μM;取40μl多肽溶液加入到含有160μl红细胞悬液的96孔板中,混匀,每孔含有40μl多肽溶液与160μl红细胞悬液,每种浓度的多肽溶液一个孔,每孔均含有一种多肽,使得每孔中红细胞压积均为1%,每种多肽均有以下浓度:160、80、40、20、10、5μM;利用pH5.0的缓冲液替换多肽溶液的无多肽孔作为阴性对照;利用TritonX100替换多肽溶液的含有0.1%(v/v)TritonX100的孔作为阳性对照;均设三个复孔;37℃孵育30min,800×g离心5min,吸取100μl上清到新的96孔板,检测OD450值。根据公式:溶血率=(OD450实验-OD450阴性对照)/(OD450阳性对照-OD450阴性对照)×100%,计算各多肽在pH5.0的缓冲液中的溶血率(表2与图1)。按照上述方法,将pH5.0的缓冲液替换为pH7.4的缓冲液,其他步骤均不变,计算各多肽在pH7.4的缓冲液中的溶血率(表3与图1)。表2、多肽在pH5.0的缓冲液中的溶血作用表3、多肽在pH7.4的缓冲液中的溶血作用结果显示,AR-23和AE1在酸性条件(pH5.0)下的溶血率均比在中性条件(pH7.4)下的溶血率低;AE4、AE3与AE2在酸性条件(pH5.0)下的溶血率均显著高于相应多肽在中性条件(pH7.4)下的溶血率;AE5在酸性条件(pH5.0)下的溶血率也具有高于相应多肽在中性条件(pH7.4)下的溶血率的趋势;AE6在浓度为160μM时,其在酸性条件(pH5.0)下的溶血率显著高于在中性条件(pH7.4)下的溶血率,而在其他浓度下,AE6在酸性条件(pH5.0)下与在中性条件(pH7.4)下的溶血率无显著差异。表明,将AR-23经改构得到的衍生多肽——AE4、AE3、AE2、AE5与AE6均可以降低其细胞毒性。RV-23在酸性条件(pH5.0)下的溶血率比在中性条件(pH7.4)下的溶血率低,而将RV-23改构得到的衍生多肽RE在酸性条件(pH5.0)下的溶血率显著高于其在中性条件(pH7.4)下的溶血率,表明,将RV-23改构得到的衍生多肽RE可以降低其细胞毒性。二、多肽对聚乙烯亚胺(PEI)介导的细胞转染效率影响按照如下方法分别测定AE1、AE2、AE3、AE4、AE5、AE6和RE在细胞转染中的作用,分别利用AR-23和RV-23作为对照,转染细胞为HeLa细胞和HepG2细胞,实验重复三次:将PEI用无血清DMEM培养基配成5.335μg/ml的PEI溶液,将荧光素梅质粒(pGL3-ControlVectorpGL3)用无血清DMEM培养基配成8μg/ml的质粒溶液,将AR-23、RV-23和AE1分别利用无血清DMEM培养基配成浓度均为10μM的AR-23溶液、RV-23溶液和AE1溶液,将RE、AE2、AE3、AE4、AE5和AE6分别利用无血清DMEM培养基配成浓度均为40μMRE溶液、AE2溶液、AE3溶液、AE4溶液、AE5溶液和AE6溶液;将各多肽溶液分别与质粒溶液等体积混匀,室温孵育15min,得到含有不同多肽与质粒的混合液,再将PEI溶液分别与上述各混合液等体积混匀,室温孵育15min,得到含有不同多肽的多肽/PEI/DNA复合物溶液。将无血清DMEM培养基与质粒等体积混合后室温孵育15min得到液体1,再将PEI溶液与液体1等体积混匀,室温孵育15min,得到不含多肽的PEI/DNA复合物溶液,作为对照。将HeLa细胞按1.2×104/孔接种于含有10%胎牛血清的DMEM培养基的无菌96孔板中,37℃,5%二氧化碳培养箱中过夜培养;吸去96孔板中培养基,将100μl不同的多肽/PEI/DNA复合物溶液分别加入96孔板中,每孔一种多肽/PEI/DNA复合物溶液,均设3个复孔;利用lipofectamine2000作为阳性对照,利用PEI/DNA复合物溶液作为阴性对照,继续培养4-6小时,每孔加100μl含20%胎牛血清的DMEM培养基,继续培养24小时,PBS轻柔洗三遍,用20μl细胞裂解液(Promega)裂解细胞,每孔取10μl用荧光检测荧光值(所用试剂盒为PromegaE1501,所用仪器为PromegaGlomaxTM96microplateluminometer)。另取5μl用于测定每孔蛋白浓度(所用试剂盒为Thermo23227,所用仪器为SpectraMaxM5Molecular),计算转染效率(表4和图2),转染效率=每孔的荧光值与每孔的蛋白含量比值。按照上述方法,将“将HeLa细胞按1.2×104/孔接种于无菌96孔板中”替换为“将HepG2细胞按1×104/孔接种于无菌96孔板中”,其他步骤均不变,计算多肽作用下的HepG2细胞的转染效率(表4和图3)。表4、多肽作用下PEI介导的细胞转染效率(URL/mg蛋白)多肽HelaHepG2PEI/DNA+RV-236.90E+07±2.77E+075.34E+06±2.80E+06PEI/DNA+RE2.48E+09±2.65E+073.09E+08±7.25E+07PEI/DNA+AR-231.07E+07±4.34E+055.31E+07±1.24E+07PEI/DNA+AE13.78E+08±6.12E+079.31E+07±3.39E+07PEI/DNA+AE27.03E+08±4.12E+079.64E+07±1.26E+07PEI/DNA+AE33.06E+09±3.48E+081.40E+08±2.38E+07PEI/DNA+AE41.89E+09±9.89E+071.38E+08±2.21E+07PEI/DNA+AE51.82E+09±2.26E+081.35E+08±1.15E+07PEI/DNA+AE61.42E+09±7.19E+071.93E+08±1.78E+07PEI/DNA5.91E+07±1.16E+073.74E+07±9.27E+06Lipofectamine20008.35E+07±9.96E+064.08E+07±5.18E+06结果显示,AE1、AE2、AE3、AE4、AE5、AE6和RE均能不同程度的增强PEI介导的对HeLa和HepG2细胞的转染效率:与PEI/DNA相比,将AR-23经改构得到的衍生多肽——AE1、AE2、AE3、AE4、AE5和AE6与PEI/DNA混合后,对Hela细胞的转染效率较PEI/DNA复合物分别提高至6.4倍、11.9倍、51.9倍、32.0倍、30.8倍和24.0倍,对HepG2细胞的转染效率较PEI/DNA复合物分别提高至2.5倍、2.6倍、3.8倍、3.7倍、3.6倍和5.2倍,而AR-23与PEI/DNA混合后对Hela细胞和HepG2细胞的转染效率分别是PEI/DNA复合物转染效率的0.2倍和1.4倍;与PEI/DNA相比,将RV-23改构得到的衍生多肽RE与PEI/DNA混合后,对Hela细胞和HepG2细胞的转染效率较PEI/DNA分别提高至42.0倍和8.3倍,而RV-23与PEI/DNA混合后对Hela细胞和HepG2细胞的转染效率分别是PEI/DNA复合物转染效率的1.2倍和0.1倍。AR-23和RV-23几乎不增加PEI/DNA转染Hela细胞和HepG-2细胞的能力,将AR-23经改构得到的衍生多肽——AE1、AE2、AE3、AE4、AE5和AE6和将RV-23改构得到的衍生多肽RE均能显著提高PEI介导的对HeLa和HepG2细胞的转染效率:与AR-23相比,AE1、AE2、AE3、AE4、AE5和AE6作用下Hela细胞的转染效率分别提高至35.3倍、65.7倍、286.0倍、176.6倍、170.1倍和132.7倍,HepG2细胞的转染效率分别提高至1.8倍、1.8倍、2.6倍、2.6倍、2.5倍和3.6倍;与RV-23相比,RE作用下Hela细胞和HepG2细胞的转染效率分别提高至35.9倍和57.9倍。三、多肽在细胞转染时对细胞活性的影响按照如下方法分别测定AE1、AE2、AE3、AE4、AE5、AE6和RE在细胞转染中对细胞活性的影响,分别利用AR-23和RV-23作为对照,转染细胞为HeLa细胞和HepG2细胞,实验重复三次:将HeLa细胞按1.2×104/孔接种于含有10%胎牛血清的DMEM培养基的无菌96孔板中,37℃,5%二氧化碳培养箱中过夜培养;吸去96孔板中培养基,将100μl不同的多肽/PEI/DNA复合物溶液分别加入96孔板中,每孔一种多肽/PEI/DNA复合物溶液,均设3个复孔;lipofectamine2000和PEI/DNA复合物溶液作为对照,只含有无血清DMEM培养基作为调零孔组作为空白对照,只含有无血清DMEM培养基和细胞作为阳性对照,继续培养4-6小时,每孔加100μl含20%胎牛血清的DMEM培养基,继续培养24小时,每孔加20μl5mg/ml的MTT,孵育4小时,弃上清,向每孔中加入150μlDMSO,震荡后检测OD490,根据公式计算各孔的细胞活性:细胞活性=(OD490实验-OD490阴性对照)/(OD490阳性对照-OD490阴性对照)×100%,结果如下表5和图4。按照上述方法,将“将HeLa细胞按1.2×104/孔接种于无菌96孔板中”替换为“将HepG2细胞按1×104/孔接种于无菌96孔板中”,其他步骤均不变,计算各孔的细胞活性(表5和图5)。表5、多肽在细胞转染时HeLa细胞和HepG2细胞的细胞活性(%)结果显示,AE1、AE2、AE3、AE4、AE5、AE6和RE在细胞转染中的细胞活性均高于Lipofectamine2000处理的细胞活性,且与PEI/DNA复合物处理的细胞活性差异不大,表明,AE1、AE2、AE3、AE4、AE5、AE6和RE可以提高细胞的转染效率,但对细胞活性的影响不大。<110>中国人民解放军军事医学科学院野战输血研究所<120>抗菌肽改构的多肽及其在细胞转染中的应用<160>9<170>PatentInversion3.5<210>1<211>23<212>PRT<213>人工序列<220><223><400>1AlaIleGlySerIleLeuGlyAlaLeuAlaLysGlyLeuProThrLeu151015IleSerTrpIleLysAsnArg20<210>2<211>23<212>PRT<213>人工序列<220><223><400>2ArgIleGlyValLeuLeuAlaArgLeuProLysLeuPheSerLeuPhe151015LysLeuMetGlyLysLysVal20<210>3<211>23<212>PRT<213>人工序列<220><223><400>3AlaIleGlySerIleLeuGlyAlaLeuAlaGluGlyLeuProThrLeu151015IleSerTrpIleLysAsnArg20<210>4<211>23<212>PRT<213>人工序列<220><223><400>4AlaIleGlySerIleLeuGlyAlaLeuAlaGluGlyLeuProThrLeu151015IleSerTrpIleGluAsnArg20<210>5<211>23<212>PRT<213>人工序列<220><223><400>5AlaIleGlySerIleLeuGlyAlaLeuAlaGluGlyLeuProThrLeu151015IleSerTrpIleGluAsnGlu20<210>6<211>23<212>PRT<213>人工序列<220><223><400>6AlaIleGlySerIleLeuGlyGluLeuAlaGluGlyLeuProThrLeu151015IleSerTrpIleGluAsnGlu20<210>7<211>23<212>PRT<213>人工序列<220><223><400>7AlaIleGlySerIleLeuGlyAlaLeuAlaGluGlyLeuProThrLeu151015GluSerTrpIleGluAsnGlu20<210>8<211>23<212>PRT<213>人工序列<220><223><400>8AlaIleGlySerIleLeuGlyGluLeuAlaGluGlyLeuProThrLeu151015GluSerTrpIleGluAsnGlu20<210>9<211>23<212>PRT<213>人工序列<220><223><400>9GluIleGlyValLeuLeuAlaGluLeuProGluLeuPheSerLeuPhe151015GluLeuMetGlyGluGluVal20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1