一种优化的、高效率的农杆菌介导的花生转化方法与流程
本发明所属的技术领域是农业生物技术领域和植物基因工程领域。
背景技术:
花生是重要的油料和经济作物,富含油脂和蛋白质。花生种质基础有限,抗病资源缺乏,其生产一直受病虫害及极端气候的危害,导致其产量和品质下降。因此,进行花生遗传改良,培育新的抗虫抗病品种具有十分现实的意义。采用传统的杂交育种、诱变育种均很难有目的性状创新,而利用基因工程技术育种可以人为地选择生产上的模式品种进行外源基因的导入,获得目的性状基因转移,从而可目标明确地达到种质改良的目的。目前,植物基因转化中比较常用的方法是农杆菌介导法。农杆菌介导法可以转移较大的DNA片段,易产生单位点整合,不易引起分子重排,同时还具有技术简单和费用较低等优点。
花生属于双子叶作物,是农杆菌的天然宿主,但也存在豆科作物共有的外源基因导入难度大的缺点。这使得花生的转基因育种工作受到一定限制,进展比较缓慢。巴西Lacorte等人于1991年,我国莱阳农学院研究人员于1990年分别报道了农杆菌对花生的侵染力。印度Eapen和George于1994年首次报道通过农杆菌转化获得转基因花生。美国Cheng M等人于1996年和1997年报道通过农杆菌转化获得5个独立的转化系,共繁殖了52株转基因植株,但转化率仅为0.2%~0.3%。同一实验室的LiZhijian等改进实验方法,通过优化农杆菌菌液浓度及抗生素使用浓度等因素缩短了获得枝条所需的时间,转化效率提高到1.5%。1999年国内方小平等以花生品种鄂花4号龄苗嫩叶作外植体,与A GLI菌株共培养,经卡那霉素筛选获得转基因花生,转化效率为2%左右。2000年,印度Rohini等用LBA404菌株采用相同接种技术获得转基因花生,转化效率提高到3.3%。
近年来,花生的遗传转化随着体细胞植株再生技术的进步取得了一定进展,已经能够通过农杆菌介导的方式获得转基因花生再生株系。但是这些花生转化系统还是普遍存在着转化周期长,筛选难度大,转化效率低及重复性差的问题。因此,无论是从花生的遗传改良角度,还是从其作为基因功能分析载体作物的角度,建立一种周期短、高效率、易操作、低成本的花生转化体系都是现实而必要的。
技术实现要素:
本发明的目的在于提供一种以花生子叶为转化外植体的农杆菌介导的周期短、高效率、易操作、低成本的遗传转化方法。本发明就遗传转化中涉及的农杆菌菌液浓度、侵染时间、共培养时间、超声波处理时间、烟草提取液浓度、抗生素使用浓度及培养基中新添加的植物激素及自由基清除剂浓度等影响条件进行了优化改进。该方法只需常规菌株和培养基,无需基因枪等昂贵设备。操作简便易行,实验周期短,转化效率高。
本发明的目的通过下述技术方案来实现:
(1)活化、重悬待转化的重组农杆菌菌液,调整OD600值为0.5~0.8;用酒精、升汞依次处理花生子叶外植体;用无菌水冲洗干净后浸泡2.5h;纵切后将子叶胚芽节点处切除得到待转化外植体;
(2)用加有烟草提取物的农杆菌菌液侵染外植体5~15min,侵染同时进行超声波处理2~8min,去除多余的菌液后,将外植体置入共培养基中,26℃条件下暗培养2~4d;
(3)共培养后,将外植体取出用含100~300mg/L Cef和300~500mg/L Carb的无菌水冲洗4~5遍后,用灭菌滤纸吸干,接到含100~300mg/L Cef和300~500mg/L Carb的抗性芽诱导培养基上,在26℃、16h光照条件下选择培养14d;当有绿色芽点形成后,去除子叶,在诱导培养基上每两周继代一次;
(4)当绿色芽点生长到1~2cm后,接种到分化培养基上促进芽分化及伸长,随着芽丛的继续生长,将其切分成小块,每两周继代一次,继续分化培养;
(5)当诱芽长至3~4cm高并有3~4片小叶时,将诱芽切下,转接到生根培养基诱导生根,待幼苗根系发育完全,洗净根上的培养基,移栽到含灭菌沙土的花盆中;每个月用Hoagland营养液浇一次,同时每十天用自来水浇灌一次。
对于上文所述技术方案,步骤(1)所述待转化的重组农杆菌可以选自任何携带特定目的基因的重组农杆菌;具体的,在本发明实施例中选用了两种携带不同目的基因的农杆菌,分别按照本发明所述方法对花生进行转化,并分别对转化效果进行了数据分析,从而证明了本发明所述方法,其有效性不受限于重组农杆菌的种类;具体的,本发明实施例中使用的两种重组农杆菌,其一为带有表达载体pCAMBIA1301的农杆菌GV3101,其T-DNA区含有GUS基因,由CaMV35S作为启动子,以潮霉素(HB)作为抗性筛选标记。其制备方法的文献:农杆菌介导的花生遗传转化体系的优化.乔利仙等.核农学报2012,26(9):1244~1248;另一个是带有表达载体pBI121的农杆菌EHA105,其T-DNA区含有DREB2A基因,由rd29A作为启动子,以遗传霉素(G418)作为抗性筛选标记。其制备方法的文献:北陵鸢尾(Iris typhifolia Kitag.)DREB转录因子的克隆及其对烟草的遗传转化[J].李雪.东北林业大学.2015(01)67;
对于上文所述技术方案,步骤(1)所述花生种子的品种为阜花12、17、18号;丰花1 号;鲁花14、16号。实际上,本发明所述方法,适用于所有类型的花生品种。
优选的情况下,对于上文所述技术方案,步骤(1)所用的酒精、升汞处理方法为,用70%~75%酒精处理花生子叶外植体1~2min,之后用0.1%~0.2%升汞处理子叶外植体10~20min。
优选的情况下,对于上文所述技术方案,步骤(2)所述加有烟草提取物的农杆菌菌液为,每100ml农杆菌菌液中添加烟草提取物1~3ml。
优选的情况下,对于上文所述技术方案,步骤(2)所述超声波处理的功率为50w,工作频率为40KHz。
优选的情况下,对于上文所述技术方案,所述共培养基为改良的MS培养基,其中添加1~2mg/L ZT、4~8mg/L 6-BA、0.1~0.5g/L酪蛋白水解物、0.05~0.15g/L肌醇。pH值为5.2。
优选的情况下,对于上文所述技术方案,所述抗性芽诱导培养基为改良的MS培养基,其中添加1~2mg/L ZT、4~8mg/L6-BA、0.1~0.5g/L酪蛋白水解物、2~4g/L L-脯氨酸、0.05~0.15g/L肌醇、0.1~0.3mmol/L维生素C、0.1~0.4mmol/L GSH、0.02~0.1mmol/L维生素E。pH值为5.8。
优选的情况下,对于上文所述技术方案,所述分化培养基为改良的MS培养基,其中添加100~300mg/L Cef、300~500mg/L Carb、1~2mg/L ZT、1~2mg/L NAA、1~3mg/L KT、1~4g/L酪蛋白水解物、0.05~0.15g/L肌醇、20~40g/L山梨醇、0.1~0.3mmol/L维生素C、0.1~0.4mmol/L GSH、0.02~0.1mmol/L维生素E。pH值为5.8。
优选的情况下,对于上文所述技术方案,所述生根培养基为改良的1/2MS培养基,其中添加1~2mg/L NAA、0.05~0.15g/L肌醇。pH值为5.8。
优选的情况下,对于上文所述技术方案,所述灭菌沙土成分重量比是沙:土:蛭石:珍珠岩为10:10:1:1。
本发明相对于现有技术有如下的优点及效果:
(1)本发明优化了花生再生芽的生成途径,利用细胞全能性及花生子叶节点的高度分化能力减少了变异。同时省去了传统农杆菌侵染过程前的预培养过程,大大缩短了获得再生转化植株的周期。因为不同基因型的花生子叶节点大多具有活跃的分生能力及脱分化作用,因此本发明在花生的遗传转化过程中不受基因型的限制。
(2)本发明通过烟草提取物的添加及对花生外植体的超声波处理安全有效地提高了花生的分化率。传统方法在侵染过程中多在农杆菌液中添加乙酰丁香酮,但该类物质化学毒性强,成本高,对诱导芽生长易产生褐化的影响。而烟草提取物自身会产生酚类物质,对花生外植体没有附加伤害。超声波法是通过空化和微机械损伤作用改变花生外植体细胞膜和细胞壁的通透性,创造微创口,促进细胞内外物质的交换,从而便于外源基因的导入。
(3)本发明通过在花生转化的共培养基、诱导培养基及分化培养基中添加适当的玉米素ZT来有效地促进花生外植体的细胞分裂,加速抗性芽分化,减少了继代培养的次数,缩短了转化周期,同时对叶片有抑制衰老的作用。传统转化方式通常在培养基中添加2,4-D来诱导外植体,但人工合成的2,4-D存在一定的化学毒性,而且2,4-D的甲基化作用诱导出的畸形胚的比例较高。而ZT是从玉米中提炼出来的天然细胞分裂素,对花生外植体有打破休眠,促进萌发,延缓叶片衰老及黄化的作用。
(4)本发明通过在花生转化的诱导培养基及分化培养基中添加适当的自由基清除剂来有效地减轻花生外植体的褐化现象。自由基清除剂可以提高细胞内抗氧化酶的活性,降低细胞的脂类过氧化程度,从而保护细胞免受损伤。通过在培养基中添加维生素C、维生素E,GSH物质可以提高原生质体的分裂频率,改善原生质体的培养状况,遏止引起褐化现象的酚类物质的产生和积累。
(5)本发明只需常规的菌株培养,无需基因枪、金粉等昂贵的实验耗材。本发明操作简便易行,实验周期短,转化率高,在不同基因型花生品种间转化效果稳定,可以满足花生规模化转基因的要求,对于花生转基因研究及功能基因的分析具有重要的意义。
附图说明
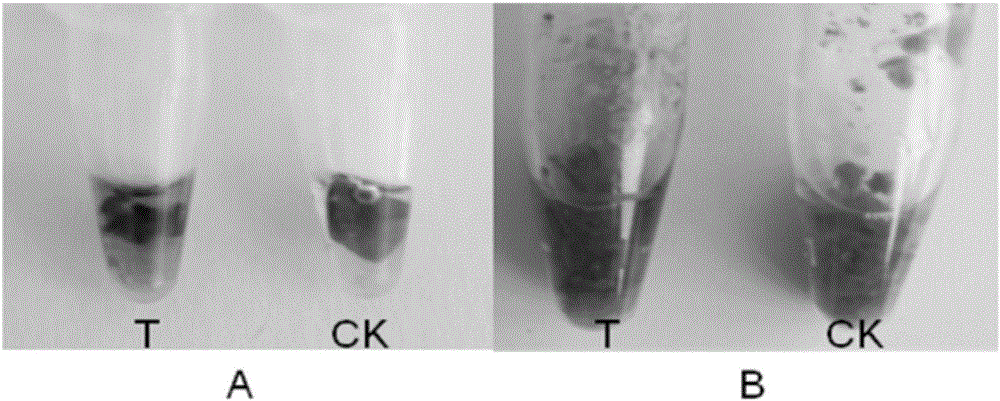
图1是花生外植体转GUS基因的染色鉴定图,图中A为叶片GUS染色鉴定;图中B为愈伤组织GUS染色鉴定(T:转基因组,CK:对照组);
图2是添加ZT促进抗性芽细胞分裂图,图中A为添加2,4-D诱导外植体生长情况;图中B为添加ZT诱导外植体生长情况;
图3是自由基清除剂抑制外植体衰老及褐化现象图,图中A为未添加自由基清除剂植株生长情况;图中B为添加自由基清除剂植株生长情况;
图4是花生转DREB2A基因的PCR鉴定图,图中A为转DREB2A基因的阜花17号植株PCR鉴定图(M:DL2000;1:阴性对照;2:水对照;3:阳性对照;4~13:转化花生株系)图中B为转DREB2A基因的阜花18号植株PCR鉴定图(M:DL2000;1:阴性对照;2:水对照;3:阳性对照;4~13:转化花生株系)。
具体实施方式
下面结合附图和具体实施方式对本发明的技术方案作进一步的详细说明。本发明包括但不限于以下实施方式。根据现有技术对本发明所进行的不脱离本发明实质内容的改变,仍属于本发明的保护范围。
实施例1农杆菌介导GUS报告基因导入花生
(1)将带有表达载体pCAMBIA1301(含有潮霉素抗性和GUS基因)的农杆菌GV3101活化并重悬(农杆菌介导的花生遗传转化体系的优化 乔利仙 于新玲 隋炯明 范乾程 孙世孟 王晶珊 核农学报2012,26(9):1244~1248),调整OD600为0.6。选取成熟饱满、表面无裂痕的花生种子(阜花12号),用70%酒精处理1.5min,0.1%升汞(W/V)处理10min,用无菌水冲洗10次后在无菌水中浸泡2.5h。置于无菌滤纸上吸去水分,去种皮,将子叶沿纵向分开,用解剖刀沿子叶节点切除胚芽,得到待转化的外植体。
(2)取烟草小苗嫩叶2g,于无菌离心管中捣碎取汁液,然后加入2ml无菌水,振荡混匀后静置5min,获得烟草提取物。其中每100ml农杆菌菌液中添加烟草提取物1~3ml,再用加有烟草提取物的农杆菌菌液侵染花生外植体10min,侵染同时把装有外植体的三角瓶置于超声波清洗器(功率50w,工作频率40KHz)中央进行超声波处理。对烟草提取物浓度及超声波处理时间两个因素设置不同梯度进行优化筛选,得出烟草提取物的最佳浓度为2ml/100ml,超声波处理最适时间为6min(如表1所示)。然后用无菌滤纸洗干多余的菌液,随后将外植体置入共培养基中(MS+2mg/L ZT+5mg/L 6-BA+0.3g/L酪蛋白水解物+0.1g/L肌醇+30g/L蔗糖+4g/L植物凝胶),26℃条件下暗培养3d。
(3)共培养3d后,将花生外植体取出用含Cef为200mg/L、Carb为350mg/L的无菌水冲洗5遍后,用灭菌滤纸吸干,接到含潮霉素为20mg/L、Cef为200mg/L、Carb为350mg/L的抗性芽诱导培养基上(MS+2mg/L ZT+8mg/L 6-BA+0.3g/L酪蛋白水解物+2.8g/L L-脯氨酸+0.1g/L肌醇+0.15mmol/L维生素C+0.2mmol/L GSH+0.05mmol/L维生素E+30g/L蔗糖+4g/L植物凝胶),在26℃、16h光照条件下选择培养14d;当有绿色芽点形成后,去除子叶,在诱导培养基上每两周继代一次,继续培养促进芽伸长。
(4)当绿色芽点生长到1~2cm后,接种到潮霉素为20mg/L、Cef为200mg/L、Carb为350mg/L的分化培养基上(MS+1mg/L ZT+1mg/L NAA+2mg/L KT+2g/L酪蛋白水解物+0.1g/L肌醇+30g/L山梨醇+0.15mmol/L维生素C+0.2mmol/L GSH+0.05mmol/L维生素E+30g/L蔗糖+4g/L植物凝胶)促进芽分化及伸长,随着芽丛的继续生长,将其切分成小块,每两周继代一次,继续伸长培养。
(5)当抗性诱芽长至3~4cm高并有3~4片小叶时,将诱芽切下,转接到生根培养基(1/2MS+1mg/L NAA+0.1g/L肌醇+30g/L蔗糖+4g/L植物凝胶)诱导生根,约2周后根开始形成。待幼苗根系发育完全,洗净根上的培养基,将根系健壮的小植株移栽到含灭菌沙土的花盆中。其中沙土成分为重量比沙:土:蛭石:珍珠岩为10:10:1:1的混合物。每个月用Hoagland 营养液浇一次,同时每十天用自来水浇灌一次。
(6)剪取花生叶片及愈伤组织于X-Gluc溶液(10mM EDTA、100mM磷酸盐、0.5mM铁氰酸钾、0.5mM亚铁氰酸钾和0.1%X-Gluc)中进行GUS染色鉴定,于37℃下过夜,在70%乙醇中脱叶绿素。GUS阳性转基因花生叶片及愈伤组织均出现肉眼可见的蓝色斑点,而对照组叶片及愈伤组织均未发生明显变化(如图1所示)。阜花12号转化率为68.6%。与传统的转化方式相比,其转化率得到了显著提高(如表2所示)。
表1烟草提取物浓度及超声波处理时间对花生(阜花12号)分化率的影响
表2两种转化方式对花生(阜花12号)转化效果的影响
实施例2农杆菌介导DREB2A基因导入花生
(1)将带有表达载体pBI121(含有G418抗性和DREB2A基因)的农杆菌EHA105活化并重悬(北陵鸢尾(Iris typhifolia Kitag.)DREB转录因子的克隆及其对烟草的遗传转化[J].李雪.东北林业大学.2015(01)67),调整OD600为0.7。选取成熟饱满、表面无裂痕的花生(阜花17号、阜花18号)种子,用75%酒精处理1min,0.1%升汞(W/V)处理15min,用无菌水冲洗10次后在无菌水中浸泡2.5h。置于无菌滤纸上吸去水分,去种皮,将子叶沿纵向分开,用解剖刀沿子叶节点切除胚芽,得到待转化的外植体。
(2)取烟草小苗嫩叶2g,于无菌离心管中捣碎取汁液,然后加入2ml无菌水,振荡混匀后静置5min,获得烟草提取物。优化筛选后,用加有3ml/100ml烟草提取物的农杆菌菌液侵染花生外植体8min,侵染同时把装有外植体的三角瓶置于超声波清洗器(功率50w,工作频率40KHz)中央进行超声波处理8min,然后用无菌滤纸洗干多余的菌液,随后将外植体置入共培养基中(MS+1.5mg/L ZT+6mg/L 6-BA+0.5g/L酪蛋白水解物+0.1g/L肌醇+30g/L蔗糖+4g/L植物凝胶),同时置入对照培养基中(MS+1.5mg/L 2,4-D+6mg/L 6-BA+0.5g/L酪蛋白水解物+0.1g/L肌醇+30g/L蔗糖+4g/L植物凝胶),26℃条件下暗培养4d。
(3)共培养4d后,将花生外植体取出用含Cef为250mg/L、Carb为400mg/L的无菌水冲洗5遍后,用灭菌滤纸吸干,接到含G418为30mg/L、Cef为250mg/L、Carb为400mg/L的抗性芽诱导培养基上(MS+1.5mg/L ZT+8mg/L6-BA+0.4g/L酪蛋白水解物+3.5g/L L-脯氨酸+0.1g/L肌醇+0.2mmol/L维生素C+0.3mmol/L GSH+0.08mmol/L维生素E+30g/L蔗糖+4g/L植物凝胶),同时置入对照培养基上(MS+1.5mg/L2,4-D+8mg/L6-BA+0.4g/L酪蛋白水解物+3.5g/L L-脯氨酸+0.1g/L肌醇+0.2mmol/L维生素C+0.3mmol/L GSH+0.08mmol/L维生素E+30g/L蔗糖+4g/L植物凝胶),在26℃、16h光照条件下选择培养14d,对比观察其生长状况。对照培养基诱导出的畸形胚的比例较高且外植体分化迟滞,而优化的培养基加速了细胞分裂,促进了抗性芽的分化,减少了继代培养的次数,缩短了转化周期(如图2所示)。当有绿色芽点形成后,去除子叶,在诱导培养基上每两周继代一次,继续培养促进芽伸长。
(4)当绿色芽点生长到1~2cm后,接种到G418为30mg/L、Cef为250mg/L、Carb为400mg/L的分化培养基(MS+1.5mg/L ZT+2mg/L NAA+2.5mg/L KT+3g/L酪蛋白水解物+0.1g/L肌醇+30g/L山梨醇+0.2mmol/L维生素C+0.3mmol/L GSH+0.08mmol/L维生素E+30g/L蔗糖+4g/L植物凝胶)及对照培养基(MS+1.5mg/L ZT+2mg/L NAA+2.5mg/L KT+3g/L酪蛋白水解物+0.1g/L肌醇+30g/L山梨醇+30g/L蔗糖+4g/L植物凝胶)上促进芽分化及伸长,对比观察其生长状况。对照培养基分化出的部分抗性外植体出现褐化现象,其叶片呈黄褐色或棕褐色,胚状体少,长势缓慢,部分培养基有丝状物或混浊物产生。而优化的培养基分化出的抗性外植体叶片呈翠绿色,胚状体增大,生长良好(如图3所示)。随着芽丛的继续生长,将其切分成小块,每两周继代一次,继续伸长培养。
(5)当抗性诱芽长至3~4cm高并有3~4片小叶时,将诱芽切下,转接到生根培养基(1/2MS+2mg/L NAA+0.1g/L肌醇+30g/L蔗糖+4g/L植物凝胶)诱导生根,约2周后根开始形成。待幼苗根系发育完全,洗净根上的培养基,将根系健壮的小植株移栽到含灭菌沙土的花盆中。其中沙土成分为重量比沙:土:蛭石:珍珠岩为10:10:1:1的混合物。每个月用Hoagland营养液浇一次,同时每十天用自来水浇灌一次。
(6)采用CTAB法提取转基因花生的基因组DNA,以质粒DNA为阳性对照进行PCR检测。上游引物:5'GCTCCTACAAATGCCATCATTGC3',下游引物:5'GATAGTGGGATTGTGCGTCATCCC 3'。PCR反应体系25μl,反应条件:95℃预变性5min;95℃变性30s,53℃退火30s,72℃延伸1min,30个循环;72℃延伸7min。反应产物用1.5%琼脂糖凝胶电泳检测,得到大小为205bp的特异性PCR产物(如图4所示)。阜花17号转化率为39.4%,阜花18号转化率为55.8%。与传统的转化方式相比,其转化率得到了显著提高(如表3所示)。
表3两种转化方式对花生转化效果的影响
上述实例为本发明最佳的实施方式,但本发明的实施方式并不受上述实施例的限制,本领域的技术人员在未背离本发明的精神实质与原理下所作的改变、修饰、替代、优化等均视为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!