对咽拭子样本或鼻咽拭子直接实时定量的PCR的方法与流程
本发明属于分子诊断生物学技术领域,具体涉及对咽拭子样本或鼻咽拭子样本直接实时定量的PCR的方法。
背景技术:
聚合酶链式反应(Polymerase Chain Reaction PCR)是在模板DNA、引物和四种脱氧核糖核苷酸存在下,依赖于DNA聚合酶的酶促合成反应技术。该技术自从美国Cetus公司人类遗传室Kary Mullis及同事于1958年发明以来,相关的衍生技术就快速开发出来,并在微生物学,遗传病学和法医等领域中得到广泛应用。尤其在病原体检测方面,当知道某一病原体的一段基因时,根据该段基因设计特异性的引物然后进行PCR扩增,使其达到检测量,然后通过合适的检测手段,即可以确定样本中是否存在该病原体。
实时荧光定量PCR技术是1996年由美国Applied Biosystems公司推出的,该技术是指在PCR反应体系中加入荧光基团或荧光染料,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析。与普通的PCR相比,荧光定量PCR技术检测具有特异性强,灵敏度高,重复性好,速度快,全封闭反应等优点,使其在医学、农学和临床检测学中得广泛使用。在进行荧光定量PCR检测时,首先要进行样本的核酸提取,目前核酸提取的方法主要有碱裂解法、层析柱法和磁珠法,前两种方法操作比较复杂且需要用离心机等大型设备;磁珠法操作简便,但存在多次洗脱操作导致核酸损失且存在污染风险,因此需要寻找不需要核酸提取直接PCR的方法对提高检测质量具有重要意义。
技术实现要素:
本发明的目的在于提供对咽拭子样本或鼻咽拭子样本直接实时定量的PCR的方法,以克服现有检测技术的不足,为咽拭子样本或鼻咽拭子样本提供一种快速、简便、高效、实用的检测方法,不要核酸提取过程,简化了操作过程,节约了时间和成本,且能大量处理样本,操作检测时可防止污染。
为达到上述目标提供了对咽拭子样本或鼻咽拭子直接实时定量的PCR的方法,包括以下步骤:
(1)制备裂解液和PCR反应液;
(2)将咽拭子样本或鼻咽拭子样本加入到含有步骤(1)中裂解液的PCR扩增管中,再加入磁珠到PCR扩增管中,振荡摇匀混合;
(3)将步骤(2)中的PCR扩增管在80-100℃高温处理10min后冷却到室温,然后在18-28℃反应5-10min;
(4)将PCR扩增管瞬时离心后放入到磁力架中,待磁珠吸附到磁力架一侧后将上清吸出;
(5)在PCR扩增管内加入配置好的PCR反应液,进行实时定量PCR反应;
所述步骤(1)中裂解液的成分为0-2M的NaCl、0-0.3%的Triton-X和0-0.2M的KCl。
所述步骤(2)样本与裂解液的体积比为1:3—1:10。
所述步骤(3)中的高温为100℃。
所述磁珠为市售的核酸提取使用的羟基磁珠,即超顺磁性核心及无机氧化硅的外壳,优选的,平均粒径为≤1000nm的单分散性羟基磁珠。
所有反应步骤都在同一个试管内进行,本发明所述方法可以手动操作以及机械自动化操作,且不要核酸提取过程,简化了操作过程,节约了时间以及成本。
本发明的有益效果是:为咽拭子样本或鼻咽拭子样本提供一种快速、简便、高效、实用的检测方法,不要核酸提取过程,简化了操作过程,节约了时间和成本,且能大量处理样本,操作检测时可防止污染。
附图说明
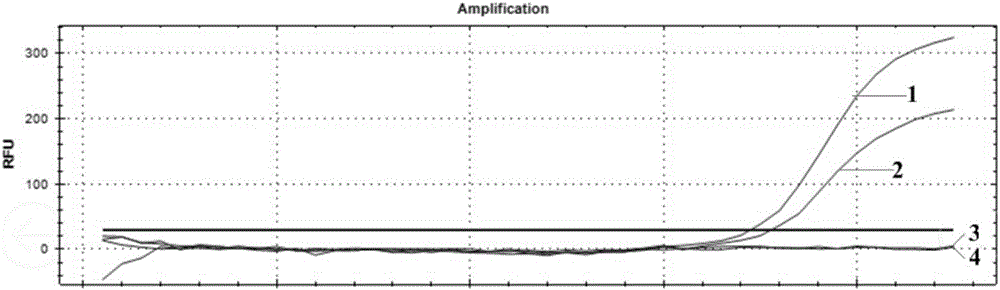
图1为实施例1的本发明方法应用于乙流临床样本的实时荧光定量PCR检测结果图,图中标号为1、2、3和4的四条曲线分别为1号样本、2号样本、3号样本和4号样本的实验结果;
图2为实施例2的本发明方法检测阴性的乙流咽拭子样本的敏感性结果图,图中标号为1、2、3和4的四条曲线分别为2.0×104TCID50/L,2.0×103TCID50/L,2.0×102TCID50/L,2.0×101TCID50/L的样本的实验结果;
图3为实施例3的本发明方法检测阴性的乙流咽拭子样本的重复性结果图,图中标号为1、2、3、4和5的五条曲线分别是5个孔内样本的实验结果;
图4为实施例5的本发明方法检测RSV的结果图,图中标号为1、2、3和4的四条曲线分别是2.0×104TCID50/L,2.0×103TCID50/L,2.0×102TCID50/L,2.0×101TCID50/L样本的检测结果;
图5为实施例5的广东华银医药科技有限公司的RSV核酸检测试剂盒(包含核酸提取试剂)检测RSV的结果图,图中标号为1、2、3和4的四条曲线分别是2.0×104TCID50/L,2.0×103TCID50/L,2.0×102TCID50/L,2.0×101TCID50/L样本的检测结果。
具体实施方式
以下结合附图和具体实施方式对本发明作进一步详细说明,实施例提供的方案为优选方案,但不作为对本申请的限定,实施例中所用的PCR扩增仪器为Bio-RAD CFX96和ABI 7500。
实施例1
本发明方法应用于乙流临床样本的实时荧光定量PCR检测
(1)配置成分为1MNaCl、0.01%Triton-X和0.01MKCl的裂解液100ml,按照磁珠和裂解液1:200的体积比加0.5ml磁珠到上述配好的裂解液中混匀,取4个相同的专用PCR管,每管分装80ul配置好的混有磁珠的裂解液;
(2)从绍兴疾控中心提供的2例乙流阳性和2例乙流阴性咽拭子四个样本中均取20ul分别加入到步骤(1)中的四个PCR管中分别作为1号样本、2号样本、3号样本和4号样本,盖好管盖;
(3)将步骤(2)中的四个PCR管放入在95℃中加热5min后室温(室温为18-28℃)放置10min;
(4)将步骤(3)中的四个PCR管放入到磁珠架上静置2min,然后用移液器在磁珠对侧吸弃液体,保留磁珠;
(5)在四个PCR管中均加入0.5ul(200U/ul)单位的逆转录酶和24.5ul的反应液(所述反应液包含浓度为30nmol/L的乙流的上下引物、30nmol/L乙流的探针、水和商业的一步法RT-QPCR试剂盒的buffer,推荐使用TAKARA和全式金公司的该试剂盒),封盖后涡旋振荡摇匀30s,确保磁珠和PCR反应混合均匀;
(6)将步骤(5)中的四个PCR管瞬时离心使PCR管中液体都在底部;
(7)将上述步骤(6)得到的四个PCR管放置在PCR扩增仪器(选用的为Bio-RAD CFX96)中进行扩增,45℃,10min;95℃,10min;进行40-45循环的95℃,15S和60℃,45S,在60℃检测荧光信号。
实验结果如图1所示,1号、2号、3号和4号曲线分别为1号样本、2号样本、3号样本和4号样本的实验结果,结果表明,按照本实施例的方法进行操作,可以有效准确的检测出乙流的咽拭子样本。
实施例2
本发明方法的敏感性测试
用实施例1步骤(2)中的阴性的乙流咽拭子样本作为稀释液,将中国药品生物制品检定所的甲乙流国家标准中的乙流最低检测限参考品S2 2.0×106TCID50/L进行稀释,分别获得2.0×104TCID50/L,2.0×103TCID50/L,2.0×102TCID50/L,2.0×101TCID50/L的四个样本,利用与实施1相同的方法对以上四个稀释样本进行实时荧光PCR检测(选用ABI7500进行PCR扩增)。
实验结果如图2所示:图中标号为1、2、3和4的四条曲线分别为浓度为2.0×104TCID50/L,2.0×103TCID50/L,2.0×102TCID50/L,2.0×101TCID50/L的样本的实验结果,结果表明,本发明可检测出的乙流的最低浓度为2.0×102TCID50/L,符合国家参考品的要求最低检测2.0×103TCID50/L的浓度要求。
实施例3
本发明方法的荧光PCR检测的重复性测试
用实施例1中的阴性的乙流咽拭子样本作为稀释液,将中国药品生物制品检定所的甲乙流国家标准中的乙流最低检测限参考品S2 2.0×106TCID50/L进行稀释,获得2.0×103TCID50/L的样本。利用与实施1相同的方法对样本进行5孔复检实时荧光PCR检测(Bio-RAD CFX96进行扩增),图中标号为1、2、3、4和5的五条曲线分别是5个孔内样本的实验结果。
检测结果如图3和如下表:
结果表明,本发明方法的检测可重复。
实施例4
本发明方法检测乙流与上海之江核酸提取试剂盒以甲、乙型流感病毒联合测定试剂盒中检测乙流比较
取绍兴疾控中心给予的2例阳性的乙流咽拭子样本分别作为5号样本和6号样本,利用与实施例1相同的方法(Bio-RAD CFX96进行扩增)和上海之江核酸提取试剂(磁珠柱法)以及甲、乙型流感病毒联合测定试剂盒进行检测,
结果如下表:
结果表明,本方法检测的结果与上海之江试剂盒检测的结果无显著差异。
实施例5
本发明方法检测RSV与广东华银医药科技有限公司的RSV核酸检测试剂盒(包含核酸提取试剂)检测RSV的比较
用实施例1中的阴性的乙流的咽拭子样本(经广东华银医药科技有限公司的RSV核酸检测试剂盒检测RSV为阴性)作为稀释液,将绍兴疾控中心提供的RSV的2.0×105TCID50/L进行稀释,分别获得2.0×104TCID50/L,2.0×103TCID50/L,2.0×102TCID50/L,2.0×101TCID50/L的四个样本,利用与实施例1相同的方法(采用Bio-RAD CFX96进行扩增,其中引物和探针换成RSV的引物和探针)和广东华银医药科技有限公司的RSV核酸检测试剂盒(包含核酸提取试剂)对四个样本分别检测,结果如图4、图5和下表:
图4为本发明方法检测的结果,图4中的标号为1、2、3和4的四条曲线分别是2.0×104TCID50/L,2.0×103TCID50/L,2.0×102TCID50/L,2.0×101TCID50/L样本的检测结果。
图5为广东华银医药科技有限公司的RSV核酸检测试剂盒的检测结果,图5中的标号为1、2、3和4的四条曲线分别是2.0×104TCID50/L,2.0×103TCID50/L,2.0×102TCID50/L,2.0×101TCID50/L样本的检测结果。
- 还没有人留言评论。精彩留言会获得点赞!