一种检测Pygo2基因突变位点的试剂盒的制作方法
本发明涉及生物技术和医学领域,具体涉及一种检测Pygo2基因突变位点的试剂盒。
背景技术:
Wnt信号通路广泛存在于无脊椎动物和脊椎动物中,是一类在物种进化过程中高度保守的信号通路。Wnt信号在动物胚胎的早期发育、器官形成、组织再生和其它生理过程中,具有至关重要的作用。如果这条信号通路中的关键蛋白发生突变或者异常表达,导致信号异常活化,就可能诱导癌症的发生。Wnt信号通路包括经典的Wnt信号通路与非经典的Wnt信号通路,在经典通路即Wnt-β-catenin信号通路中,Wnt因子通过激活细胞膜上的Frizzle/LRP5/6协同受体后抑制细胞内游离β-catenin蛋白的磷酸化和降解,细胞质中的β-catenin蛋白水平升高后将发生β-catenin蛋白的核移位,导致细胞核中β-catenin蛋白升高,胞核中β-catenin蛋白能够联合Pygo2、Bcl-9以及FoxM1蛋白共同与TCF/LEF-1转录因子家族形成复合体并激活Wnt信号通路下游靶基因的转录激活。
Pygo2蛋白是Wnt信号通路中β-catenin下游重要成员之一,目前越来越多的研究已经发现,在很多肿瘤中Pygo2蛋白均呈现高表达。
目前研究核心信号通路的核心分子调控机制,以及某些重要成员在细胞中的表达水平,已经成为治疗肿瘤的一种关键手段。近年来Wnt信号通路在癌症中的研究,以及Pygo2蛋白作为Wnt信号通路重要成员其表达水平的研究,已经成为研究开发肿瘤药物急需解决的重要问题。与此同时,其在多种肿瘤细胞中存在的各种基因突变也越来越多地被发现,尤其是在Pygo2蛋白NHD端及PHD端发生的突变,对Pygo2蛋白发挥功能起着非常重要的作用,例如在膀胱癌细胞中检测出NHD端R46S突变。
目前普遍应用的基因突变检测方法为限制小片段长度多态性分析法(RFLP法)和DNA直接测序等。RFLP法是将PCR与限制性酶切相结合的方法。但是该方法存在以下缺点:RFLP实验操作繁琐,检测周期长,成本高昂,存在第一轮酶切不完全导致的假阳性,非闭管操作,易于污染,难以满足临床检测要求。DNA直接测序的原理是:该方法存在以下缺点检测周期较长,花费昂贵,非闭管操作,难以避免交叉污染,通量不高。DNA直接测序的灵敏度较低,杂合突变、胶压缩、GC富集区的存在等问题使得很难通过一次测序获得精确的数据,需要多次重复测序才可能避免假阳性等,因此直接测序方法难适用于临床检测。
而临床迫切需要开发一种快速、准确、操作简便和避免交叉污染的检测Pygo2基因突变的试剂盒,满足临床用药和检测诊断方面的时效性要求。
Taqman探针是在Real-time PCR技术平台发展出的荧光检测技术,探针的5’端含有荧光报告基团,3’端含有荧光淬灭基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收,当进行PCR扩增时,Taq DNA聚合酶的5’端到3’端的外切酶活性将探针酶切降解,使得报告基团和淬灭基团分离,发出荧光信号,从而达到荧光信号的积累与PCR产物形成完全同步。
ARMS,(Amplification Refractory Mutation System),中文全称叫扩增受阻突变系统也叫等位基因特异性扩增法(Allele Specific Amplification,ASA),始建于1989年,是基于PCR技术的一种定向检测点突变的应用方法。ARMS是针对已知突变基因的一种检测方法之一。检测的原理是利用了实验室常用的DNA聚合酶—Taq酶缺乏3’端到5’端外切酶活性的特点,针对突变碱基设计的引物由于错配而导致扩增反应受阻,当这种阻碍效应达到一定程度时,3’端延伸受阻,反应无法继续进行,因此如果模板中不含有突变的目标序列,则扩增产物中检测不到目标条带。
Taqman-ARMS该技术基于Real-time PCR平台,结合ARMS突变富集和Taqman特异性荧光检测两种技术。利用ARMS引物对突变靶序列进行PCR扩增,Taqman探针对扩增产物进行特异性位点检测,在Real-time PCR基础上鉴定特定突变。
技术实现要素:
有鉴于此,本发明的目的之一在于提供快速、准确、操作简便和防止污染的检测Pygo2基因突变位点的试剂盒,解决了现有技术中进行基因突变检测程序繁琐、费用昂贵、费时、易污染和灵敏度低等问题,尤其是提供了病理组织之外的非创伤性如血清或血浆等检测。
为实现上述发明目的,本发明的技术方案为:
一种检测Pygo2基因突变位点的试剂盒,所述试剂盒包含检测Pygo2基因R46S突变位点的ARMS引物对和特异识别R46S突变的Taqman探针;所述ARMS引物对由SEQ ID No:1所示的上游引物和SEQ ID No:2所示的下游引物组成;所述Taqman探针的核苷酸序列如SEQ ID No:3所示,其5’端的荧光报告基团为:FAM,3’端的淬灭基团为BHQ。
Pygo2基因R46S突变位点在Pygo2基因的具体位置为密码子46处,其碱基的变化为AGC>AGG,SEQ ID No:1、2被称为内引物对。
优选的,所述试剂盒还包括DNA质量控制位点的检测引物对和识别所得扩增子的Taqman探针,所述引物对由SEQ ID No:4所示的上游引物和SEQ ID No:5所示的下游引物组成,所述Taqman探针的核苷酸序列如SEQ ID No:6所示,其5’端的荧光报告基团为:HEX,3’端的淬灭基团为BHQ。
SEQ ID No:4、5被称为外引物对,该外引物对扩增的区域是Pygo2基因中包含R46S突变位点所在区域片段,其序列如SEQ ID No:7所示。
更优选的,所述试剂盒由PCR缓冲液、dNTPs、引物对、Taqman探针、MgCl2、TaqDNA聚合酶和模板DNA组成,各组分反应时终浓度为:
更优选的,所述试剂盒的反应条件是:42℃逆转录20min;94℃预变性,5min;94℃变性,30s;58℃,30s;进行40个循环。
更优选的,利用所述试剂盒完成PCR反应后,如果样本外引物和内引物扩增曲线呈S型,有Ct值,且ΔCt值<7,可判断为突变;如果样本外引物扩增曲线呈S型,内引物扩增曲线平直,可以判为阴性;如果样本外引物扩增曲线平直,内引物欧增呈S型,可以判断为假阳性。
更优选的,所述试剂盒还包括两个阳性对照,该阳性对照为包含外引物扩增区域的质粒和Pygo2基因R46S突变位点所在区域片段质粒。
更优选的,所述试剂盒还包括阴性对照,该阴性对照为灭菌生理盐水。
本发明与现有技术相比,具有以下优势:
本发明公开的试剂盒,采用ARMS特异突变富集技术与Taqman探针特异检测技术相结合,无需测序,即可完成对样品基因型的判断;该试剂盒灵敏度高,最高可达到1%,同时特异性好,精度高,检测成功率为100%,同时可以检测多个样本,实现高通量检测;检测灵敏度高、检测范围宽;无需多次开盖,避免交叉污染,全部检测反应可在1小时内完成,且检测结果容易判断;该试剂盒可以检测来自外周血的DNA;根据试剂盒的检测结果为肿瘤的个性化用药提供指导。
附图说明
图1是本发明Pygo2基因R46S突变ARMS-qPCR试剂盒对野生型人DNA测试的扩增曲线图;
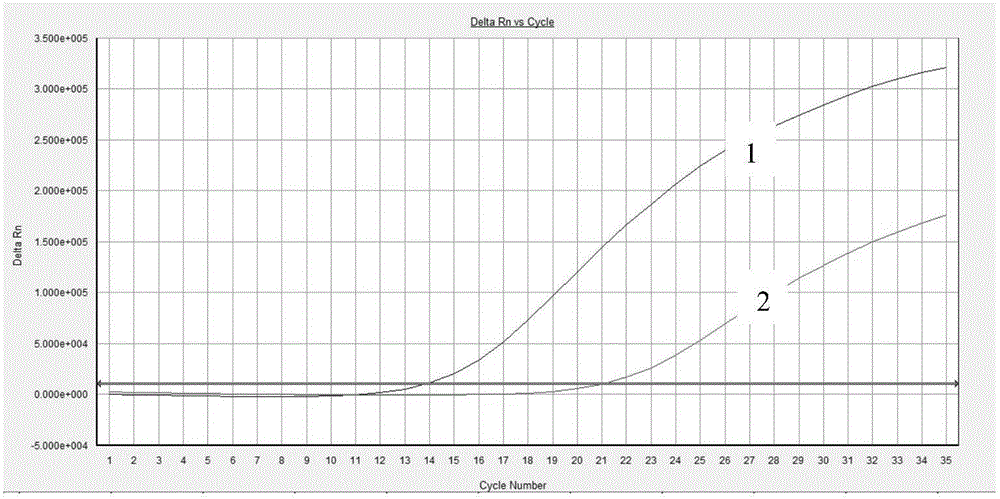
图2是本发明Pygo2基因R46S突变ARMS-qPCR试剂盒对含1%Pygo2突变的人DNA测试的扩增曲线图;
1为外引物扩增曲线,2为内引物扩增曲线。
图3是本发明Pygo2基因R46S突变ARMS-qPCR试剂盒对阳性样本DNA测试的扩增曲线图;
1、3分别是阳性样本外引物对和内引物对扩增出来的曲线,2为阳性质粒扩增出来的曲线;
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
本发明所使用的PCR缓冲液、dNTPs、TaqDNA聚合酶、MgCl2均购于上海岭兰生物科技有限公司,货号T1102,其中探针和引物均由上海基康生物技术有限公司合成。
【实施例1】引物探针设计
根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)(http://www.ncbi.nlm.nih.gov)报道的hPygo2mRNA序列(NCBI Reference Sequence:NM_138300.3),使用Applied Biosystems公司开发的Primer Express Software for Real-Time PCR软件设计特异的Pygo2引物与探针,本发明在上游引物的3’端倒数第3个位点上引入了第二个错配碱基,以增加对突变检测的特异性。
检测突变序列荧光探针:5'FAM-AGCGAAGGAAGTCAAATACTC-BHQ3'
检测突变序列上游引物:5'-GTCCAGAAAGAAGCGATGC-3'
检测突变序列下游引物:5'-CTCCACCTCCAGTGCTGAG-3'
外引物扩增序列荧光探针5'HEX-AGCGAAGGAAGTCAAATACTC-BHQ3'
外引物上游引物:5'-GCAAGGCCGGTCTGCAAATG-3'
外引物下游引物:5'-CCATTGGATTGGGAGGGAAG-3'
外引物扩增序列:
gcaaggccggtctgcaaatgaagagtccagaaaagaagcgaaggaagtcaaatactcagggccctgcatactcacatctgacggagtttgcaccacccccaactcccatggtggatcacctggttgcatccaacccttttgaagatgacttcggagcccccaaagtgggggttgcagcccctccattccttggcagtcctgtgcccttcggaggcttccgtgtgcaggggggcatggcgggccaggtacccccaggctacagcactggaggtggagggggcccccagccactccgtcgacagccaccccccttccctcccaatcctatgg
本发明实施例中,修饰荧光探针的5’端的荧光报告基团为:FAM、HEX;修饰荧光探针的3’端的淬灭基团为:BHQ,该荧光报告基团与淬灭基团不影响荧光定量PCR的扩增,只需根据探针的荧光报告基团和淬灭基团选择所用的仪器的型号设置可检测的荧光信号范围。其中FAM和HEX的激发波长为470-650nm。接收波长为500-700nm;引物合成后的纯化方式为:HAP、PAGE和HPLC纯化方式。
【实施例2】Pygo2基因R46S突变检测试剂盒特异性检测
构建Pygo2基因R46S突变检测试剂盒中的阳性质控品,具体为试剂盒中R46S突变的阳性对照品,用于试剂盒检测时的参照品。
上述阳性对照品通过如下方式获得:
通过筛选对应R46S突变DNA或者人工合成对应R46S突变DNA,克隆到pGM-T载体中,构建成重组质粒。然后将重组质粒分别转化大肠杆菌DH5α,经测序确定为重组质粒后,提取重组质粒,经纯化后稀释,制得阳性对照品,备用。
取稀释后的阳性对照品分别与野生型基因组DNA以不同比例混合,得到野生型样本(不含有阳性对照品)、1%突变样本(阳性对照品的模板与野生样本的模板的比例为1:100,野生型DNA的含量为45ng/反应),混合后使样品的OD260/OD280在1.8~2.0之间,制成阳性突变样本,备用。
结果见图1-2,由于采用了上述探针和上下游引物,能够在45ng/反应的野生型DNA背景下实现1%突变Pygo2基因100%检出,且野生型Pygo2基因零检出,说明本发明试剂盒具有很好的特异性以及极强的抗干扰能力,大大降低了假阳性。
【实施例3】血液样本基因DNA抽提
1)向96圆孔板的每孔中加入20μL蛋白酶K,加200μL抗凝全血到96圆孔板中。
2)加200μL Buffer BL,注意不要打湿每孔的边缘,用96圆孔硅胶片密封各孔,用力混合30s。
3)3000rpm简短离心使96圆孔硅胶片上的溶液到96圆孔板内。启动离心机,当速度达到3000rpm后即停止,在培养箱或烘箱中70℃温浴至少10min。
3000rpm简短离心使96圆孔硅胶片上的溶液到96圆孔板内。启动离心机,当速度达到3000rpm后即停止,取下96圆孔硅胶片,每孔加入200μL乙醇(96-100%)。
用96圆孔硅胶片密封各孔,用力混匀混合15s。3 000rpm简短离心使96圆孔硅胶片上的溶液到圆孔板内。启动离心机,当速度达到3 000rpm后即停止。
将96孔DNA板放到一洁净的96孔1.6ml深孔板。取下圆孔板上的96圆孔硅胶片,将每孔中的溶液转移至96孔DNA板中,6 000rpm离心4min。
丢弃96孔1.6ml深孔板的滤液,将96孔DNA板放回到96孔1.6ml深孔板上,每孔加入500μL Buffer W1B,用一新的BF-400膜密封96孔DNA板,6000rpm离心4min。
丢弃96孔1.6ml深孔板的滤液,将96孔DNA板放回到96孔1.6ml深孔板上,每孔加入850μL Buffer W2,用另一新的BF-400膜密封96孔DNA板,6000rpm离心4min。
弃滤液,将96孔DNA板放回到96孔1.6ml深孔板上,每孔加入400μL Buffer W2,用另一新的BF-400膜密封96孔DNA板,6000rpm离心4min。
将96孔DNA板放在一洁净的96孔1.6ml深孔板上,用BF-400膜密封96孔DNA板,6000rpm离心15min。
将96孔DNA板放在另一洁净的96孔1.6ml深孔板上,每孔加入100-200μL Eluent B或去离子水,室温静置2min,用另一新的BF-400膜密封96孔DNA板,6000rpm离心4min洗脱得到DNA。
DNA提取后,取样2微升,用1%琼脂糖凝胶电泳检测基因组DNA的质量,再用紫外分光光度计检测纯度和浓度,以灭菌纯化水调整终浓度为30ng/μL。
【实施例4】Pygo2基因R46S突变检测试剂盒检测血液样本
1、试剂配置
取提取的血液样本DNA、阴性对照、阳性对照5μL,加入PCR反应液,PCR反应液包括:无菌水、具有5'→3'外切活性的DNA聚合酶、dNTPs、10×PCR Buffer,和含Mg离子的溶液。其中,浓度为5U/μL的具有5'→3'外切活性的DNA聚合酶1μL,浓度为0.4mmol/L的dNTPs 0.8μL,10×PCR Buffer 5μL,浓度为4mmol/L的MgCl2 8μL,终浓度为200nM的引物分别1μL,探针0.5μL,灭菌纯化水27.7μL。
2、PCR扩增:
将各反应放入荧光定量PCR仪器的反应槽内,设置标记荧光基因种类、样品及类型
荧光检测通道选择:选择FAM通道(Reporter:FAM,Quencher:None);外引物扩增选择HEX(Reporter:HEX,Quencher:None)。参比荧光(Passive Reference)设置为ROX
扩增程序:42℃逆转录20min;94℃预变性,5min;94℃变性,30s;58℃,30s;进行40个循环。
3、数据分析
反应结束后,仪器自动保存结果,利用仪器自带的软件进行自动分析,记录样本的Ct值和结果。其中Ct值是从基线到指数增长的拐点所对应的循环次数。仪器软件根据个样本Ct值大小,可以判断检测结果。如果样本外引物和内引物扩增曲线呈S型,有Ct值,ΔCt=Ct(外引物对)-Ct(内引物对),且ΔCt值<7,可判断为突变;如果样本外引物扩增曲线呈S型,内引物扩增曲线平直,可以判为阴性;如果样本外引物扩增曲线平直,内引物扩增呈S型,可以判断为假阳性。
抽取脑胶质瘤患者血液样本37例,提取血液中的DNA作为模板,用该试剂盒按上述实施方案进行检测,同时抽取正常人血液样本10例,提取血液中的DNA作为模板。检测结果显示,37例胶质瘤患者血液样本中,试剂盒检测出36例脑胶质瘤样本有阳性结果,正常人样本结果均显示为阴性。由此可见,检测Pygo2基因R46S突变,可以辅助诊断脑胶质瘤,一致率为97.30%。阳性样本的扩增曲线图见附图3。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种慢性淋巴细胞白血病患者NOTCH1基因突变检测组合物的制作方法与工艺
- 一种用于检测B‑RAF基因突变的多重荧光PCR检测试剂盒的制作方法与工艺
- 一种用于检测K‑RAS基因突变的多重荧光PCR检测试剂盒的制作方法与工艺
- 检测人EGFR基因21L858R点突变的智能恒温扩增引物组、检测试剂盒及方法与流程
- 检测人KRAS基因突变的微滴PCR试剂盒的制作方法与工艺
- CBF‑AML c‑kit基因突变检测用的PCR扩增引物、试剂盒及检测方法与流程
- 检测人EGFR基因T790M点突变的智能恒温扩增引物组、检测试剂盒及方法与流程
- 一种检测Pygo2基因突变位点的试剂盒的制作方法与工艺
- 检测人JAK2基因突变的PCR试剂盒的制作方法与工艺
- 检测高IgE综合征STAT3基因突变的试剂盒和方法与流程