一种混合价态六钒酸烷氧衍生物及其制备方法与流程
本发明涉及一种混合价态六钒酸烷氧衍生物及其制备方法,属于有机无机杂化材料的技术领域。
背景技术:
我国钒资源丰富,价格相对低廉且目前尚未有合适的工艺和路线进行钒资源的深加工及利用,大部分钒都被用于钢铁冶炼等,钒资源的利用水平很低。这些因素使得新型钒基材料的开发和应用具有重要意义。近年来,钒氧化物及钒酸化合物在催化、储氢、电极材料等领域的研究取得了许多丰富成果,例如,钒系材料作为电极材料具有高比容量、可大流量充放电等突出优势。Occhiuzzi 等人通过不同价态氧化钒经过反应合成了准晶态的V10O24·12H2O 材料,表现出良好的电化学性质。钒酸化合物中具有Li1+xV3O8等具有混价骨架结构的钒青铜材料以及具有反尖晶石结构的LiNiVO4都具有较高的平均电位,有用作负极材料的潜力。这表明钒基材料一领域的研究有着广阔的应用前景和很高的经济价值。
多金属氧酸盐,简称多酸,一般是由V、Mo、W等过渡金属与氧桥连形成的簇状结构。多酸有着近200年的研究历史,不仅结构类型极其丰富,而且在催化、医药和材料等领域有着广泛的应用。多钒酸是多酸化学研究中的重要体系之一,其中钒氧簇可通过烷氧基配体进行修饰,不但可以制备有机-无机杂化材料,而且还能够将有机基团通过共价键引入多钒酸骨架,使得这些多钒酸衍生物可以通过常规的有机反应连接其它功能性有机分子。通过种类丰富的有机反应可以设计、合成出各种新颖的、具有特殊性能的钒氧簇-有机杂化材料。
目前已经开发出的能够有机修饰的钒氧簇主要是带有羟基或氨基的六钒酸三甲氧基取代衍生物,近年来国内外研究者利用羟基和氨基发生酯化、酰胺化反应已设计并合成出了许多结构新颖的钒酸衍生物,并且其中一些化合物具有自组装、荧光等特殊性质。但是目前已经开发出的可修饰的多钒酸烷氧衍生物中钒的化合价都是最高氧化态—五价,其构型也都是线型,即二维构型。还原态(四价)的多钒酸衍生物由于其钒原子上有未成对电子,因此具有特殊的光、电、磁学性质。例如,Charles Daniel 和Hans Hartl利用原钒酸酯在甲醇体系中通过溶剂热获得了一系列混合价态六钒酸衍生物 [V6O7(OR)12]n+ (R = -CH3,-C2H5)]。该系列化合物具有丰富的电化学性质,后来Marie-Pierre Santoni等利用该化合物在联吡啶钌作光敏剂的水溶液中实现了水的光催化分解,以分子氧为基准光化学量子效率达到了0.2。然而,遗憾的是这类型衍生物已报道的例子很少,而且末端基团均为甲基或乙基等惰性基团,不易发生有机反应,阻碍了这些衍生物的进一步修饰。
混合价态六钒酸三羟甲基多取代化合物在磁性、光催化、电极材料等领域有着非常重大的潜在应用价值;带活性有机基团的多取代衍生物更是能够在构筑多功能化多酸基有机无机杂化材料方面发挥重要作用。多酸基化合物以往的研究重点大多集中于结构设计和合成,关于其性质和实际应用目前刚刚起步;而多钒酸基材料的设计及合成研究还很少,特别是还原态多钒酸衍生物的合成、修饰及性质研究目前的报道更少。因此,开发新的还原态多钒酸有机杂化材料的合成方法及应用具有重要的意义。
技术实现要素:
为了弥补现有六钒酸烷氧取代化合物价态单一、结构简单的不足,本发明所要解决的技术问题是提供一种混合态或还原态的六钒酸衍生物及其合成方法,该类六钒酸衍生物可供后修饰构建多功能化有机无机杂化材料的。
本发明提供以一种混合价态或全还原态六钒酸烷氧衍生物,其结构为Linqivist型六钒酸骨架上的三个排布呈平面三角形的桥氧原子用三羟甲基类化合物分子的三个羟基氧取代,三个三羟甲基类化合物相邻分布在六钒酸骨架上,钒全部为四价或四价、五价钒混合分布。
阳离子不仅限于H+,NH4+,Na+,还包括其他金属阳离子和非金属阳离子等。
三羟甲基类化合物(Tris)包括三羟甲基氨基甲烷,季戊四醇,三羟甲基乙烷和三羟甲基丙烷,但不仅限于季戊四醇、三羟甲基氨基甲烷、三羟甲基乙烷、三羟甲基丙烷四种,还包括三羟甲基硝基甲烷等其他三羟甲基类有机配体。
具体包括如下结构:
H2[VIV3VV3O10{NH2C(CH2O)3}3]∙10H2O (1)
Na2[VIV6O7(OH)3{(OCH2)3CCH2OH}3]∙2H2O (2)
(NH4)3[VIV6O8(OH)2{(OCH2)3CCH3}3] (3)
(NH4)3[VIV6O8(OH)2{(OCH2)3CC2H5}3]∙3H2O (4)
上述化合物1-4分别属于立方晶系,正交晶系,六方晶系和三斜晶系; 化合物1晶胞参数为:a=19.094(2) Å, b=19.094(2) Å , c=19.094(2), α=90.00°, β=90.00°, γ=90.00°;化合物2晶胞参数为:a=10.2542(8) Å, b=27.096(2) Å, c=12.9530(10) Å, α=90.00°, β=90.00°, γ=90.00°;化合物3晶胞参数为:a=12.9234(4) Å, b=12.9234(4) Å, c=9.8515(3) Å, α=90.00°, β=90.00°, γ=120.00°;化合物4晶胞参数为:a=9.9874(3) Å, b=26.3528 (10) Å, c=16.3613 (4) Å, α=90.00°, β=127.6200°, γ=90.00°。
本发明还提供上述化合物的制备方法:
在偏钒酸铵、偏钒酸钠或偏钒酸钾的水溶液中加入水合肼、硫酸肼或苯肼将五价钒酸根VO32-还原为四价的钒酸根,然后加入三羟甲基类化合物,封入水热反应釜后,反应釜置于210℃烘箱中反应24h,自然降温至室温后,直接获得全还原态六钒酸烷氧衍生物晶体;反应混合液过滤,滤液静置7天后获得混合价态六钒酸烷氧衍生物晶体。
本发明的目的之二是提供一类新型的基于多钒酸的电极材料。将所合成的混合价态六钒酸烷氧衍生物作为锂电池负极材料进行充放电测试,结果发现这类化合物经过多次循环后其充电电容量并无明显减弱,甚至还有大幅度的增强,表明这类材料在充放电环境下具有较好的稳定性。从充电电容量的大小来看,化合物与目前商用锂电池负极材料的充电容量相当,更重要的是这类化合物可通过合理的修饰改性,提高其充电容量。
本发明的有益效果是所合成的化合物具有三个氨基,都能够被后修饰,产物的结构相比其他多酸衍生物更加丰富;三取代六钒酸化合物中钒为混合价态或全还原态,这使得三取代六钒酸衍生物及其后修饰产物可能具有独特的磁性、催化活性等性质;这些性质使得它们在构筑结构、性质丰富的多酸基有机无机杂化材料方面有着独特的优势。
附图说明
图1:化合物1、2、3、4的结构图。a:化合物1;b:化合物2;c:化合物3;d:化合物4。
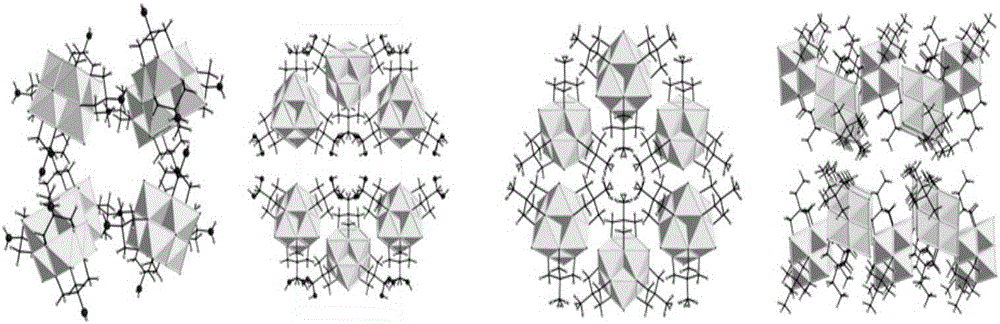
图2:化合物1、2、3、4的晶体堆积图,从左到右依次是化合物1,2,3,4。
图3:所使用的三羟甲基类化合物的结构图。
图4:合成过程化学式。
图5:化合物1-4的电化学性质测试。
图6:化合物1作为锂电池负极材料的充放电曲线图。
图7:化合物1作为锂电池负极材料的充放电循环性能图。
具体实施方式
下面结合实施例对本发明做进一步详细、完整的说明:
实施例1(TRIS=三羟甲基氨基甲烷)
化合物1合成过程:称取1.6935g(14mmol) NaVO3, 0.8413g(7mmol)三羟甲基氨基甲烷加入50ml水热反应釜内胆中,然后加入20ml去离子水和150ul(4.6mmol)N2H4∙H2O,搅拌均匀后反应釜封好置于烘箱中,210℃反应24h,冷却至室温后,过滤反应混合液,滤液静置7天析出黑色块状晶体,晶体用20ml去离子水,20ml无水乙醇洗涤后自然晾干。IR(KBr-pellets, cm-1): 3475(s), 1608(m), 1534(m), 1111(s), 1049(s), 947(s), 745(s), 613(s); UV-Vis (H2O): λmax=347nm; 元素分析(%): 理论值V6N3O29C12H46: N 4.19, C 14.38, H 4.63;测试值: N 4.48, C 14.53, H 4.87
实施例2(TRIS=季戊四醇)
化合物2合成过程:称取1.6935g(14mmol) NaVO3, 0.9455g(7mmol)季戊四醇加入50ml反应釜内胆,然后加入20ml去离子水和150ul(4.6mmol)N2H4∙H2O,反应釜置于烘箱中210℃反应24h,冷却至室温后,过滤反应混合液,滤液静置7天析出蓝色片状晶体。IR (KBr-pellets, cm-1): 3600(w), 3311(s), 1620(m), 1126(s), 1066(sh), 1033(s), 956(sh), 943(s), 798(w), 653(s); UV-Vis (H2O): λmax=346nm; 元素分析(%): 理论值for Na2V6O24C15H34: C 18.96, H 3.61; 测试值: C 19.52, H 3.21.
实施例3(TRIS=三羟甲基乙烷)
化合物3合成过程:称取1.6935g(14mmol) NaVO3, 0.8344g(7mmol)三羟甲基乙烷加入50ml反应釜内胆,然后加入20ml去离子水和150ul(4.6mmol)N2H4∙H2O,反应釜置于烘箱中210℃反应24h,冷却至室温后,析出蓝色柱状晶体。IR(KBr-pellets,cm-1):3594(w),2964(w),2893(m),2850(m),1403(m),1144(s),1047(s),974(s),943(sh),926(s),847(s),617(s); UV-Vis (H2O): λmax=346nm; 元素分析(%): 理论值 V6N3O19C15H41: N 4.81, C 20.63, H 4.73;测试值: N 5.03, C 20.46, H 4.76.
实施例4(TRIS=三羟甲基丙烷)
化合物4合成过程:称取1.6935g(14mmol) NaVO3, 0.9317g(7mmol)三羟甲基丙烷,然后加入20ml去离子水和150ul(4.6mmol)N2H4∙H2O,反应釜置于烘箱中210℃反应24h,冷却至室温后,析出蓝色块状晶体。IR (KBr-pellets, cm-1): 2967(m), 2905(m), 2855(m), 1397(m), 1120(s), 1050(s), 974(sh), 945(s), 828(w), 606(s); UV-Vis (H2O): λmax=346nm; 元素分析(%): 计算值 V6N3O21C18H53: N 4.41, C 22.68, H 5.60; 测试值: N 4.64, C 22.57, H 5.64.
实施例5 化合物1的电化学性质测试
称取约0.01g化合物1(0.01mmol)溶于10ml无水DMF中,加入0.38g电解质(C4H9)4NPF6,溶液加入电化学池中,玻碳电极作为工作电极,Ag/AgCl和铂电极分别作为参比电极和对电极,电化学池通氮气30min赶走溶解氧后上电化学工作站测试,扫描速度为25 mV s-l ,扫描电压范围-0.9V~1.4V。
实施例6 化合物2的电化学性质测试
称取约0.001g化合物2(0.001mmol)溶于10ml去离子水中,加入0.12g NaClO4/0.1g HClO4,溶液加入电化学池中,玻碳电极作为工作电极,Ag/AgCl和铂电极分别作为参比电极和对电极,电化学池通氮气30min赶走溶解氧后上电化学工作站测试,扫描速度为25 mV s-l ,扫描电压范围-0.9V~1.4V。
实施例7 化合物3的电化学性质测试
称取约0.001g化合物3(0.001mmol)溶于10ml去离子水中,加入0.12g NaClO4/0.1g HClO4,溶液加入电化学池中,玻碳电极作为工作电极,Ag/AgCl和铂电极分别作为参比电极和对电极,电化学池通氮气30min赶走溶解氧后上电化学工作站测试,扫描速度为25 mV s-l ,扫描电压范围-0.9V~1.4V。
实施例8 化合物4的电化学性质测试
称取约0.001g化合物4(0.001mmol)溶于10ml去离子水中,加入0.12g NaClO4/0.1g HClO4,溶液加入电化学池中,玻碳电极作为工作电极,Ag/AgCl和铂电极分别作为参比电极和对电极,电化学池通氮气30min赶走溶解氧后上电化学工作站测试,扫描速度为25 mV s-l ,扫描电压范围-0.9V~1.4V。
- 还没有人留言评论。精彩留言会获得点赞!