一种多肽液相合成缩宫素的方法与流程
本发明涉及多肽类药物的制备,具体其涉及一种液相合成缩宫素的方法,属于多肽液相合成技术领域。
背景技术:
缩宫素,也叫催产素,英文名oxytocin,分子式c43h66n12o12s2,分子量为1007.2,化学结构式如下:
缩宫素主要分布在人和哺乳动物的下丘脑垂体后叶,临床上用于催产、产后出血和引产。随着对其研究的逐渐深入,除了缩宫素常见的收缩子宫、泌乳等作用外,人们发现缩宫素还有许多复杂的生理功能,如参与学习、记忆过程、影响药物成瘾性及对社会适应性行为、母性行为、性行为、摄食、痛觉调节以及心血管、体温的调节等。
目前,国内的缩宫素原料药基本上自猪或牛下丘脑垂体后叶中提取,效价160iu/ml,而且,动物来源的产品存在生物安全性风险,同时,天然存在的相关杂质,如加压素等,难以被纯化除去。
迄今为止,缩宫素的液相合成法涉及安全难以掌控的反应条件(如氨钠法),反应步骤多,产率低;另一方面,虽然固相合成法的引入简化了缩宫素的合成工艺,但是,从国内外报道的文献来看,固相合成法合成缩宫素的产率、纯度和效价仍不能满足需求,其中boc固相合成法涉及氟化氢等危险化合物在工业上逐渐不被采用,而fmoc固相合成法均采用哌啶作为脱帽试剂。哌啶是一种液体,不易运输和储存,特别是作为受管制的易制毒化学品,对企业的采购、使用和物料管理带来不便。
缩宫素合成的最大的挑战还包括,二硫键的形成,其产率和纯度,不能满足工业生产的需求。
1953年,vincentduvigneaud首次用多肽液相合成法合成了缩宫素,并证实了其生物活性;随后又将此方法进行了改进。这些两种方法最终均采用金属钠/液氨脱去保护缩宫素的保护基和空气氧化法形成二硫键。其他的脱半胱氨酸保护基和环化形成二硫键的方法,包括,1)photaki合成了保护的缩宫素直链序列后,用甲醇钠/甲醇脱去巯基保护基bz或z,然后用1,2-二碘乙烷反应形成二硫键,最后用hbr/acoh脱去其他保护基得到缩宫素粗品,其纯化所得的缩宫素效价380iu/mg;mühlemann也采用了1,2-二碘乙烷作为氧化剂形成二硫键,环化收率30%;2)fujii等分别选用mbzl和acm为巯基保护基的半胱氨酸合成了保护的缩宫素直链序列,用三氟乙酸铊盐分别脱去mbzl和acm并形成二硫键,得到缩宫素粗品,产率分别为45%和39%;3)akaji等分别选用acm,tacm和but为巯基保护基的半胱氨酸合成了保护的缩宫素直链序列,用甲基三氯硅烷/二苯基亚砜分别脱去了acm,tacm,和but并形成二硫键,环化产率分别是56%,69%和64%。fernandoalbericio等用boc/mbharesin法和fmoc/palresin法进行了缩宫素固相合成的比较研究,还对形成二硫键的方法进行了研究,包括空气氧化法、碘氧化法、三氟乙酸铊盐氧化法。二硫键形成的研究结果表明,三氟乙酸铊盐的效果最佳(产率72%),碘氧化法的产率28%。
目前,国内报道的缩宫素合成方法主要有液相法和fmoc固相法。其中,中国发明专利zl2010102549195公布了一种液相合成缩宫素的方法:该方法用金属钠/液氨法脱去保护基,然后,用空气氧化法形成二硫键,收率25%,未见生物效价报道。中国发明专利zl2008100849408公布了一种液相法和固相法结合合成缩宫素的方法:该方法合成了半胱氨酸巯基用fmoc基团保护的两个片段,进行片段缩合(缩合时间为10-40小时),然后,用哌啶将巯基保护基fmoc脱去后,采用空气氧化法形成二硫键。该方法收率7-10%,产品的效价为600iu/ml,未见报道其纯度。这里用体积计算效价的方法,无法判断缩宫素的真实效价,因为每毫升所含缩宫素的量未知。中国发明专利(专利号zl2005101123565)公布了一种固相合成缩宫素的方法:该方法以rinkamide树脂为固相载体,fmoc保护氨基酸为单体,其中半胱氨酸采用fmoc-cys(trt)-oh,使用哌啶作为脱帽试剂,依次逐个合成了保护缩宫素氨基酸序列,然后,将肽链从树脂上切割下来,乙醚沉淀切肽溶液获得还原性缩宫素后,在偏碱性溶液中(ph7-8)用空气、或双氧水进行氧化,形成二硫键,收率21%,未见报道效价;中国发明专利(zl201210256922x)公布了一种固相合成缩宫素的方法:该方法以rinkamide树脂为固相载体,fmoc保护氨基酸为单体,其中n末端半胱氨酸采用boc-cys(trt)-oh,使用哌啶作为脱帽试剂,依次逐个合成了保护缩宫素氨基酸序列,然后,将肽链从树脂上切割下来,乙醚沉淀切肽溶液获得未环化的缩宫素后,在偏碱性溶液中用空气、或双氧水进行氧化,形成二硫键,其收率33%,未见报道效价。这些缩宫素固相合成法的共同点是:1)环化反应均在溶液中进行,均采用空气氧化法、或双氧水氧化法形成二硫键,收率最高为33%;2)n末端氨基在未保护(游离)状态下进行环化反应;3)脱帽试剂均采用哌啶;4)未见报道缩宫素的生物效价、或可参考的生物效价。
综上所述,目前国内外缩宫素的合成还存在一系列的挑战,如使用易制毒化学品哌啶、乙醚等,剧毒且昂贵的试剂三氟乙酸铊盐等,难以掌控的反应条件(如金属钠/液氨、hf等),而且,合成所得缩宫素产品的收率和效价都较低。
在本发明中,结合使用了boc多肽合成法和fmoc多肽合成法,所有反应均在温和条件下进行,未使用国内外所有液相合成缩宫素的文献报道的氨钠法脱帽反应;首次未使用剧毒试剂或不安全的反应条件进行缩宫素的液相合成,极大降低了缩宫素的合成成本,为工业化生产缩宫素提供了参考。本发明中所有的化学反应均在温和的条件下进行,不涉及剧烈难以控制的反应条件和剧毒的化学试剂,得到了高纯度(99%以上)、高效价(588iu/mg,)的缩宫素产品。
技术实现要素:
本发明针对目前缩宫素合成技术存在的问题,提供一种合成效率高、成本较低、环境友好、反应条件温和、纯度和效价高,可以工业化生产的缩宫素液相合成工艺。最终所得的缩宫素纯品,按照欧洲药典(8.0版),含量测定法测定本发明所生产的缩宫素含量为98.1%,效价588iu/mg。
本发明的方法步骤如下:
分别合成片段1、片段2和片段3,然后片段1和片段2组装合成化合物4,化合物4皂化后得到化合物5,化合物5和片段3组装得到保护缩宫素氨基酸序列(化合物6),经环化和脱帽反应后,乙酸乙酯结晶得到缩宫素粗品,最后采用c18反相硅胶色谱纯化,得到缩宫素产品。
按照本发明优选的方案:
1.合成片段1:boc-cys(acm)-tyr(tbu)-oh
将boc-cys(acm)-oh(1eq.),hosu(1.1eq.),用四氢呋喃溶解,-10℃冷浴10min,dcc(1.1eq.)用少量thf溶解,加入以上溶液中,反应20min后,称h-tyr(tbu)-oh(1.1eq.)和nahco3(1.1eq.)用水溶解,加入以上溶液中。15-25℃反应,hplc监测反应完成后,0.5m盐酸调ph至中性,过滤掉不溶物,浓缩除去thf,0.5m盐酸调ph至2得白色固体,过滤,水洗至中性,真空干燥得片段1。
2.合成片段2:h-ile-gln(trt)-asn(trt)-cys(acm)-pro-ome
(1)合成化合物2.1:fmoc-cys(acm)-pro-ome:
将fmoc-cys(acm)-oh(1eq.),hobt(1.1eq.),用thf和少量dmf溶解,-10℃冷浴10min,dcc(1.1eq.)用少量thf溶解,加入以上溶液中,反应20min后,称h-pro-ome.hcl(1.1eq.)用thf溶解,加入tea(1.1eq.),混匀,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用0.1m盐酸析出固体,过滤,水洗至中性,真空干燥得化合物2.1。
(2)合成化合物2.2:h-cys(acm)-pro-ome:
将干燥好的化合物2.1用适量二乙胺溶解,浓缩至少量,加石油醚析出,过滤,石油醚洗涤,真空干燥得化合物2.2。
(3)合成化合物2.3:fmoc-asn(trt)-cys(acm)-pro-ome:
将fmoc-asn(trt)-oh(1.1eq.),hobt(1.1eq.),用thf和少量dmf溶解,-10℃冷浴10min,dcc(1.1eq.)用少量thf溶解,加入以上溶液中,反应20min后,称化合物2.2(1eq.)用thf溶解,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用0.1m盐酸析出固体,过滤,水洗至中性,真空干燥得化合物2.3。
(4)合成化合物2.4:h-asn(trt)-cys(acm)-pro-ome:
将干燥好的化合物2.3用适量二乙胺溶解,浓缩至少量,加饱和nahco3析出,过滤,水洗至中性,真空干燥,然后用石油醚搅拌洗涤三次,过滤,真空干燥得化合物2.4。
(5)合成化合物2.5:fmoc-gln(trt)-asn(trt)-cys(acm)-pro-ome:
将fmoc-gln(trt)-oh(1.1eq.),hobt(1.1eq.),用thf和少量dmf溶解,-10℃冷浴10min,dcc(1.1eq.)用少量thf溶解,加入以上溶液中,反应20min后,称化合物2.4(1eq.)用thf溶解,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用0.1m盐酸析出固体,过滤,水洗至中性,真空干燥得化合物2.5。
(6)合成化合物2.6:h-gln(trt)-asn(trt)-cys(acm)-pro-ome:
将干燥好的化合物2.5用适量二乙胺溶解,浓缩至少量,加饱和nahco3析出,过滤,水洗至中性,真空干燥,然后用石油醚搅拌洗涤三次,过滤,真空干燥得化合物2.6。
(7)合成化合物2.7:fmoc-ile-gln(trt)-asn(trt)-cys(acm)-pro-ome:
将fmoc-ile-oh(1.1eq.),hobt(1.1eq.),用thf和少量dmf溶解,-10℃冷浴10min,dcc(1.1eq.)用少量thf溶解,加入以上溶液中,反应20min后,称化合物2.6(1eq.)用thf溶解,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用0.1m盐酸析出固体,过滤,水洗至中性,真空干燥得化合物2.7。
(8)合成片段2:h-ile-gln(trt)-asn(trt)-cys(acm)-pro-ome:
将干燥好的化合物2.7用适量二乙胺溶解,浓缩至少量,加饱和nahco3析出,过滤,水洗至中性,真空干燥,然后用石油醚搅拌洗涤三次,过滤,真空干燥得化合物2。
3.合成片段3:h-leu-gly-nh2
称fmoc-leu-oh(1eq.),bop(1eq.)用dmf溶解,加dipea(1.2eq.),5min后,称h-gly-nh2.hcl(1.1eq.)用dmf溶解,加tea(1.1eq.),倒入以上反应液中,tlc(dcm:meoh:acoh=100:6:1)跟踪监测,反应完全后,用0.1mhcl溶液析出,水洗至中性,真空干燥得产物fmoc-ile-gly-nh2.hcl。将干燥的fmoc-ile-gly-nh2.hcl加入适量二乙胺,tlc(dcm:meoh:acoh=100:6:1)跟踪监测,反应完全后,浓缩,石油醚析出,过滤,石油醚洗涤,真空干燥得到片段3。
4.合成化合物4:
称片段1(1.1eq.),hobt(1.1eq.)用thf和少量dmf溶解,-10℃冷浴10min,dcc(1.1eq.)用少量thf溶解,加入以上溶液中,反应20min后,称片段2(1eq.)用thf溶解,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用饱和碳酸氢钠溶液析出固体,过滤,水洗至中性,真空干燥得化合物4。
5.合成化合物5:
化合物4(1eq.)用thf溶解,-10℃冷浴10min,加入2mlioh(5eq.)溶液冰浴反应,hplc检测反应完全后,0.5m盐酸溶液调ph至中性,浓缩,析出白色固体,过滤,水洗,真空干燥得化合物5。
6.合成化合物6:
化合物5(1eq.)、bop(1eq.)用dmf溶解,加入dipea(1.1eq.),5min后,称片段3(1.1eq.)用dmf溶解,投入以上反应液。hplc检测反应完全后,0.1m盐酸溶液析出白色固体,过滤,水洗至中性,真空干燥得化合物5。
7.合成化合物7:
碘(10eq.)用dmf溶解,缓慢加入化合物6(1eq.),hplc检测反应完全后,0.1%硫代硫酸钠溶液析出白色固体,过滤,水洗,真空干燥得化合物7。
8.合成缩宫素粗品:
将化合物7溶于三氟乙酸,10min后,浓缩至少量,加dcm,浓缩至少量,重复三次,加乙酸乙酯冷藏,过夜,过滤,固体真空干燥。
9.缩宫素粗品纯化:
粗肽的预处理:称取0.5g粗肽用10ml0.1mnah2po4溶液溶解,加入乙腈使得乙腈的浓度为15%,然后用0.45μm微孔滤膜过滤。
纯化条件与梯度:
制备柱:dachb-50,富士硅胶
检测波长:220nm,流速:50ml/min
流动相:a0.1mnah2po4溶液,b50%乙腈/a,0-60min:30%b-50%b
收集纯度99%以上的收集液,25℃浓缩,ps聚合物脱盐,浓缩,冻干,得缩宫素纯品,hplc图谱见附图;以欧洲药典标准品为标准物质,按欧洲药典缩宫素含量测定法,本发明所得到的缩宫素含量为98.1%,效价588iu/mg。
本发明的有益效果:
在本发明中,结合使用了boc多肽合成法和fmoc多肽合成法,所有反应均在温和条件下进行,未使用国内外所有液相合成缩宫素的文献报道的氨钠法脱帽反应;首次未使用剧毒试剂或不安全的反应条件进行缩宫素的液相合成,极大降低了缩宫素的合成成本,为工业化生产缩宫素提供了参考。本发明中所有的化学反应均在温和的条件下进行,不涉及剧烈难以控制的反应条件和剧毒的化学试剂,得到了高纯度(99%以上)、高效价(588iu/mg)的缩宫素产品。
附图说明:
图1是片段1:boc-cys(acm)-tyr(tbu)-oh的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,30-50%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图2是片段1高酸裂解样品h-cys(acm)-tyr-oh的esi-ms图;
图3是fmoc-cys(acm)-pro-ome的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,30-90%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图4是h-cys(acm)-pro-ome的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,0-10%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图5是fmoc-asn(trt)-cys(acm)-pro-ome的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,50-90%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图6是h-asn(trt)-cys(acm)-pro-ome的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,30-90%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图7是h-gln(trt)-asn(trt)-cys(acm)-pro-ome的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,50-90%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图8是h-ile-gln(trt)-asn(trt)-cys(acm)-pro-ome(片段2)的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,50-90%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图9是h-ile-gln(trt)-asn(trt)-cys(acm)-pro-ome(片段2)的esi-ms图;
图10是fmoc-leu-gly-nh2的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,60-65%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图11是h-leu-gly-nh2(片段3)的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,0-30%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图12是h-leu-gly-nh2(片段3)的esi-ms图;
图13是化合物4的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,75-80%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图14是化合物5的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,80-90%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图15是化合物6的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,80-85%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图16是化合物7的rp-hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,80-85%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图17是缩宫素粗品的rp-hplc图,分析条件:a:0.1mnah2po4/h2o,b:50%can/h2o,30-60%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长220nm;
图18是缩宫素纯品的rp-hplc图,分析条件:a:0.1mnah2po4/h2o,b:50%can/h2o,30-60%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长220nm;
图19是缩宫素纯品的esi-ms图;
图20是片段3按方案1合成的产物boc-leu-gly-nh2的hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,10-50%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm;
图21是片段3按方案1合成的产物h-leu-gly-nh2的hplc图,分析条件:a:3%acn/h2o,0.1%tfa,b:acn,0-30%b,0-30min,色谱柱:c18,250x4.6mm,流速1ml/min,检测波长210nm。
具体实施方式
在本发明权利要求书和说明书中出现物质的英文缩写对应的中文名称见表1
表1本发明中出现物质的英文缩写对应的中文名称
实施例1:
合成片段1:boc-cys(acm)-tyr(tbu)-oh
将boc-cys(acm)-oh(100mol,29.2g,1eq.),hosu(110mmol,12.6g,1.1eq.),用四氢呋喃200ml溶解,-10℃冷浴10min,dcc(110mmol,22.7g,1.1eq.)用20mlthf溶解,加入以上溶液中,反应20min后,称h-tyr(tbu)-oh(110mmol,26.1g,1.1eq.)和nahco3(110mmol,9.2g,1.1eq.)用150ml水溶解,加入以上溶液中。15-25℃反应,hplc监测反应完成后,0.5m盐酸调ph至中性,过滤掉不溶物,浓缩除去thf,0.5m盐酸调ph至2得白色固体,过滤,水洗至中性,真空干燥得片段1,纯度99.1%,产物47.1g,收率92%。片段1:boc-cys(acm)-tyr(tbu)-ohrp-hplc图谱见说明书附图1,其高酸裂解样品(h-cys(acm)-tyr-ohm/zcalculated.355.4;found356.3[m+h]+)的esi-ms质谱图见附图2。
实施例2:
合成片段2:h-ile-gln(trt)-asn(trt)-cys(acm)-pro-ome
(1)合成化合物2.1:fmoc-cys(acm)-pro-ome:
将fmoc-cys(acm)-oh(100mmol,41.5g,1eq.),hobt(105mmol,14.1g,1.05eq.),用200mlthf和30mldmf溶解,-10℃冷浴10min,dcc(105mmol,21.6g,1.05eq.)用20mlthf溶解,加入以上溶液中,反应20min后,称h-pro-ome.hcl(105mmol,17.4g,1.05eq.)用100mlthf溶解,加入tea(105mmol,14.5ml,1.05eq.),混匀,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用0.1m盐酸析出固体,过滤,水洗至中性,真空干燥得化合物2.1,纯度95.3%,产物50.9g,收率97%(产率均按100mmol计算,下同)。hplc分析图谱见说明书附图3。
(2)合成化合物2.2:h-cys(acm)-pro-ome:
将干燥好的化合物2.1用200ml二乙胺溶解,浓缩至少量,加石油醚析出,过滤,石油醚洗涤,真空干燥得化合物2.2。纯度98.0%,产物28.8g,产率95%。hplc分析图谱见说明书附图4。
(3)合成化合物2.3:fmoc-asn(trt)-cys(acm)-pro-ome:
将fmoc-asn(trt)-oh(1.1eq.,104.4mmol,62.3g),hobt(1.1eq.,104.4mmol,14.1g),用dcm200ml和dmf20ml溶解,-10℃冷浴10min,dcc(1.1eq.,104.4mmol,21.5g)用20mldcm溶解,加入以上溶液中,反应20min后,称化合物2.2(1eq.94.9mmol,28.8g)用50mldmf溶解,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,旋转蒸发仪浓缩,用0.1m盐酸析出固体,过滤,水洗至中性,真空干燥得化合物2.3。纯度99%,产物75g,产率85%。hplc分析图谱见说明书附图5。
(4)合成化合物2.4:h-asn(trt)-cys(acm)-pro-ome:
将干燥好的化合物2.3用200ml二乙胺溶解,浓缩至少量,加饱和nahco3析出,过滤,水洗至中性,真空干燥,然后用石油醚搅拌洗涤三次,过滤,真空干燥得化合物2.4。纯度96.3%,产物55.7g,产率84.4%。hplc分析图谱见说明书附图6。
(5)合成化合物2.5:fmoc-gln(trt)-asn(trt)-cys(acm)-pro-ome:
将fmoc-gln(trt)-oh(1.1eq.,92.8mmol,56.7g),hobt(1.1eq.,92.8mmol,12.5g),用150mlthf和50mldmf溶解,-10℃冷浴10min,dcc(1.1eq.,92.8mmol,19.1g)用20mlthf溶解,加入以上溶液中,反应20min后,称化合物2.4(1eq.,84.4mmol,55.7g)用150mlthf溶解,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用0.1m盐酸析出固体,过滤,水洗至中性,真空干燥得化合物2.5,产物106.4g,产率85%。
(6)合成化合物2.6:h-gln(trt)-asn(trt)-cys(acm)-pro-ome:
将干燥好的化合物2.5用150ml二乙胺溶解,浓缩至少量,加饱和nahco3析出,过滤,水洗至中性,真空干燥,然后用石油醚搅拌洗涤三次,过滤,真空干燥得化合物2.6,纯度98.3%,产物86.5g,产率84%。hplc分析图谱见说明书附图7。
(7)合成化合物2.7:fmoc-ile-gln(trt)-asn(trt)-cys(acm)-pro-ome:
将fmoc-ile-oh(1.1eq.,92.4mmol,32.6g),hobt(1.1eq.,92.4mmol,12.5g),用150mlthf和50mldmf溶解,-10℃冷浴10min,dcc(1.1eq.,92.4mmol,19g)用少20mlthf溶解,加入以上溶液中,反应20min后,称化合物2.6(1eq.,84mmol,86.5g)用150mlthf溶解,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用0.1m盐酸析出固体,过滤,水洗至中性,真空干燥得化合物2.7。纯度90.3%,产物114.4g,产率83.8%。
(8)合成片段2:h-ile-gln(trt)-asn(trt)-cys(acm)-pro-ome:
将干燥好的化合物2.7用150ml二乙胺溶解,浓缩至少量,加饱和nahco3析出,过滤,水洗至中性,真空干燥,然后用石油醚搅拌洗涤三次,过滤,真空干燥得化合物2。纯度94.2%,产物91.5g,产率80.1%。hplc分析图谱见说明书附图8。其高酸裂解样品(h-ile-gln-asn-cys(acm)-pro-omem/zcalculated.658.3;found681.1.3[m+na]+)的esi-ms质谱图见附图9。
实施例3:
按方案2合成片段3:h-leu-gly-nh2
称fmoc-leu-oh(1eq.,100mmol,35.3g),bop(1.01eq.,101mmol,44.7g)用dmf200ml溶解,加dipea(1.2eq.,120mmol,21ml),5min后,称h-gly-nh2.hcl(1.1eq.,110mmol,12.2g)用dmf100ml溶解,加tea(1.1eq.,110mmol,15ml),倒入以上反应液中,tlc(dcm:meoh:acoh=100:6:1)跟踪监测,反应完全后,用0.1mhcl溶液析出,水洗至中性,真空干燥得产物fmoc-leu-gly-nh2.hcl,纯度97%,产物43.7g,产率98%,hplc分析图谱见说明书附图10。
将干燥的fmoc-leu-gly-nh2.hcl加入400ml二乙胺,tlc(dcm:meoh:acoh=100:6:1)跟踪监测,反应完全后,浓缩,石油醚析出,过滤,石油醚洗涤,真空干燥得到片段3,纯度98.4%,产物17.9g,产率95.6%,hplc分析图谱见说明书附图11,(h-leu-gly-nh2m/zcalculated.187.1;found210.0[m+na]+)esi-ms质谱图见附图12。
实施例4:
合成化合物4:
称片段1(1.1eq.,88mmol,45g),hobt(1.1eq.,88mmol,11.9mg)用thf150ml和dmf60ml溶解,-10℃冷浴10min,dcc(1.1eq.,88mmol,18.1mg)用20mlthf溶解,加入以上溶液中,反应20min后,称片段2(1eq.,80mmol,91.5g)用thf100ml溶解,加入以上反应溶液中。15-25℃反应,hplc监测反应完全后,过滤除去不溶物,浓缩,用饱和碳酸氢钠溶液析出固体,过滤,水洗至中性,真空干燥得化合物4。纯度86%,产物115.5g,产率70.6%,rp-hplc分析图谱见说明书附图13。
实施例5:
合成化合物5:
化合物4(1eq.,115.5g)用thf800ml溶解,-10℃冷浴10min,加入1.5mnaoh(5eq.,353mmol)溶液235ml冰浴反应,hplc检测反应完全后,0.5m盐酸溶液调ph至中性,浓缩,析出白色固体,过滤,水洗,真空干燥得化合物5。纯度93%,产物106.2g,产率65.5%,rp-hplc分析图谱见说明书附图14。
实施例6:
合成化合物6:
化合物5(1eq.,65.5mmol,106.2g)、bop(1.05eq.,68.8mmol,30.4g)用dmf150ml溶解,加入dipea(1.1eq.,72mmol,12.5ml),5min后,称片段3(1.1eq.,72mmol,13.4g)用dmf100ml溶解,投入以上反应液。hplc检测反应完全后,0.1m盐酸溶液析出白色固体,过滤,水洗至中性,真空干燥得化合物5。纯度88.6%,产物107.5g,产率60%,rp-hplc分析图谱见说明书附图15。
实施例7:
合成化合物7:
碘(10eq.,600mmol,152g)用dmf1200ml溶解,缓慢加入化合物6(1eq.,60mmol,107.5g),hplc检测反应完全后,0.1%硫代硫酸钠溶液析出白色固体,过滤,水洗,真空干燥得化合物7。纯度95%,产物96.5g,产率58.6%,rp-hplc分析图谱见说明书附图16。
实施例8:
合成缩宫素粗品:
将化合物7溶于三氟乙酸裂解液(tfa:tis:h2o=95:5:5)200ml,5min后,浓缩至少量,加dcm,浓缩至少量,重复三次,加乙酸乙酯冷藏,10h后,过滤,固体真空干燥。得到缩宫素粗品,纯度94.5%,产物称重26.6g,产率26.4%,rp-hplc分析图谱见说明书附图17。
实施例9:
缩宫素粗品纯化:
粗肽的预处理:称取0.5g粗肽用10ml0.1mnah2po4溶液溶解,加入乙腈使得乙腈的浓度为15%,然后用0.45μm微孔滤膜过滤。
纯化条件与梯度:
制备柱:dachb-50,富士硅胶
检测波长:220nm,流速:50ml/min
流动相:a0.1mnah2po4溶液,b50%乙腈/a,0-60min:30%b-50%b
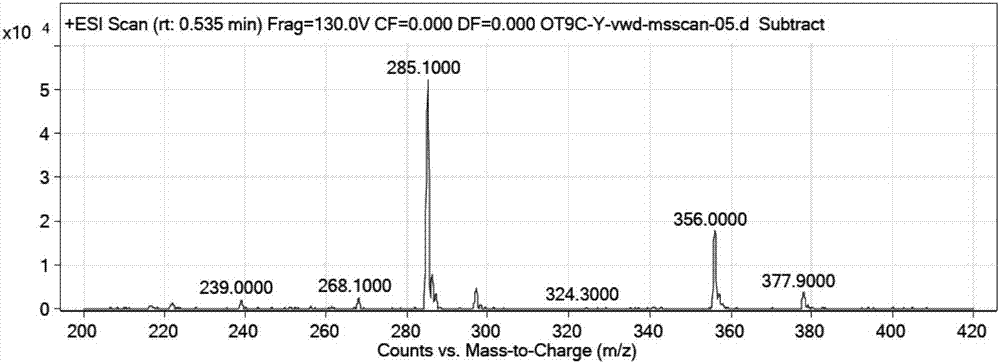
收集纯度99%以上的收集液,25℃浓缩,ps聚合物脱盐,加乙酸,浓缩,冻干,得缩宫素10.6g,hplc图谱见附图18,esi-ms图见附图19(oxytocinm/zcalculated.1006.4;found1007.5[m+h]+);以欧洲药典标准品作为标准物质,按欧洲药典缩宫素含量测定法,除去水分和醋酸,含量为98.2%,效价为588iu/mg。
实施例10
用方案1合成片段3:
称boc-leu-oh(1eq.,100mmol,23.1g)和bop(1.01eq.,101mmol,44.7g),并用用dcm200ml和dmf20ml溶解,加dipea(1.2eq.,120mmol,21ml),5min后,称h-gly-nh2.hcl(1.1eq.,110mmol,12.2g)用dmf100ml溶解,加tea(1.1eq.,110mmol,15ml),倒入以上反应液中,tlc(dcm:meoh:acoh=100:20:1)跟踪监测,反应完全后,用0.5mhcl溶液析出白色稠状物质,ea溶解,萃取,水洗涤3遍,饱和氯化钠洗涤1遍,无水mgso4干燥30min,过滤,浓缩至干,纯度99.1%,hplc分析图谱见附图20。
将上述产物加200ml30%tfa/dcm(三氟乙酸/二氯甲烷)溶液,反应30min,浓缩至干,真空干燥得产物h-leu-gly-nh2。纯度96%,产物25.6g,产率85%。hplc分析图谱见附图21。
- 还没有人留言评论。精彩留言会获得点赞!