多肽融合蛋白GWP在抗立氏立克次体的免疫保护中的应用的制作方法
本发明属于免疫学领域,涉及多肽融合蛋白gwp在抗立氏立克次体的免疫保护中的应用,特别涉及多肽融合蛋白gwp在抗立氏立克次体(rickettsiarickettsii)所致落基山斑点热的免疫保护中的应用。
背景技术:
立氏立克次体(rickettsiarickettsii)是一种严格胞内寄生的革兰氏阴性菌,是落基山斑点热(rockymountainspottedfever,rmsf)的病原体。该菌主要分布在北美洲,其为斑点热群立克次体(spottedfevergrouprickettsia,sfgr)中毒力最强的一个种,被列为生物战剂和潜在的生物恐怖剂。
落基山斑点热是一种严重威胁人类健康的人兽共患自然疫源性疾病。rmsf最早发现在美国西北部的爱达荷州和蒙大拿州,1899年maxey报告了第一例rmsf临床病例。在1906到1909年之间,ricketts首先对该病进行了病原学研究,他证实了安氏革蜱为该病的传播媒介。
rmsf的早期临床表现主要有发热,头痛和肌痛。后期病情严重者可出现血压下降,未接受治疗者可产生肺炎,组织坏死和循环衰竭,并发心和脑后遗症。在暴发型病例可因心跳突然停止而死亡。虽然抗生素治疗对落基山斑点热有效,但由于立氏立克次体能以气溶胶的形式传播,一旦流行难以控制。并且rmsf早期症状缺乏特异性,很难与其他疾病相区别,难以做到早发现早治疗。因此采用有效的疫苗作为预防接种是防止rmsf发生和流行的最有效手段。
二十世纪中期到末期,rmsf疫苗的研制主要集中在灭活疫苗上。1970年美国陆军传染病医学研究所用鸡胚成纤维细胞培养立氏立克次体并通过蔗糖密度梯度离心获得纯化的病原体,将纯化立克次体甲醛灭活后制成疫苗,在1983年进行的人体保护性试验中证明该疫苗可以保护25%的接种者,可减轻患者的发热反应,并能使四环素的治疗效果更快更好。但是该灭活疫苗仅提供有限的保护作用,远没有达到有效疫苗保护标准。另外制备立氏立克次体灭活疫苗通常需要鸡胚或者细胞大量培养立克次体,但是提取纯化立克次体的防护要求高,工艺复杂,成本昂贵,因此难以大量制备和推广使用。
随着对rmsf疫苗研究的不断深入以及蛋白质组学的飞速发展,人们将目光转向了亚单位。研究发现立氏立克次体外膜蛋白a(ompa)、外膜蛋白b(ompb)以及普氏立克次体外膜蛋白b(ompb)免疫产生的抗体可以中和立克次体对小鼠的致死毒性,给予ompa及ompb的单克隆抗体可以保护豚鼠有效抵抗致死剂量的立氏立克次体的感染并交叉保护小鼠抵抗死剂量的康氏立克次体(r.conorii)的感染。这些外膜蛋白尽管有一定的保护作用,但是其免疫保护效果有限,目前难以代替灭活rmsf疫苗。因此,鉴定立氏立克次体的保护性抗原,研发更加安全、有效、持久的亚单位疫苗对预防rmsf具有重大的意义。
技术实现要素:
本发明的目的是提供一种多肽融合蛋白gwp在抗立氏立克次体的免疫保护中的应用。
本发明所提供的多肽融合蛋白gwp,含有如下6个片段:
片段1:氨基酸序列为序列表中序列1的第1-15位;片段2:氨基酸序列为序列表中序列1的第20-34位;片段3:氨基酸序列为序列表中序列1的第39-53位;片段4:氨基酸序列为序列表中序列1的第58-72位;片段5:氨基酸序列为序列表中序列1的第77-91位;片段6:氨基酸序列为序列表中序列1的第96-110位。
进一步,所述多肽融合蛋白gwp,具体为如下(a)或(b):
(a)由序列表中序列1所示的氨基酸序列组成的蛋白质;
(b)由序列表中序列1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由序列1衍生的蛋白质。
编码所述多肽融合蛋白gwp的基因也属于本发明的保护范围。
所述基因中编码所述片段1的dna序列可为如下(a1)-(a3)中任一:
(a1)序列表中序列2的第1-45位所示dna序列;
(a2)在严格条件下能与(a1)限定的dna序列杂交且编码所述片段1的dna序列;
(a3)与(a1)或(a2)限定的dna序列具有90%以上同源性,且编码所述片段1的dna序列;
所述基因中编码所述片段2的dna序列可为如下(b1)-(b3)中任一:
(b1)序列表中序列2的第58-102位所示dna序列;
(b2)在严格条件下能与(b1)限定的dna序列杂交且编码所述片段2的dna序列;
(b3)与(b1)或(b2)限定的dna序列具有90%以上同源性,且编码所述片段2的dna序列;
所述基因中编码所述片段3的dna序列可为如下(c1)-(c3)中任一:
(c1)序列表中序列2的第115-159位所示dna序列;
(c2)在严格条件下能与(c1)限定的dna序列杂交且编码所述片段3的dna序列;
(c3)与(c1)或(c2)限定的dna序列具有90%以上同源性,且编码所述片段3的dna序列;
所述基因中编码所述片段4的dna序列可为如下(d1)-(d3)中任一:
(d1)序列表中序列2的第172-216位所示dna序列;
(d2)在严格条件下能与(d1)限定的dna序列杂交且编码所述片段4的dna序列;
(d3)与(d1)或(d2)限定的dna序列具有90%以上同源性,且编码所述片段4的dna序列;
所述基因中编码所述片段5的dna序列可为如下(e1)-(e3)中任一:
(e1)序列表中序列2的第229-273位所示dna序列;
(e2)在严格条件下能与(e1)限定的dna序列杂交且编码所述片段5的dna序列;
(e3)与(e1)或(e2)限定的dna序列具有90%以上同源性,且编码所述片段5的dna序列;
所述基因中编码所述片段6的dna序列可为如下(f1)-(f3)中任一:
(f1)序列表中序列2的第286-330位所示dna序列;
(f2)在严格条件下能与(f1)限定的dna序列杂交且编码所述片段6的dna序列;
(f3)与(f1)或(f2)限定的dna序列具有90%以上同源性,且编码所述片段6的dna序列。
更加具体的,所述基因为如下1)或2)或3)的dna分子:
1)序列表中序列2所示的dna分子;
2)在严格条件下与1)限定的dna分子杂交且编码所述蛋白质的dna分子;
3)与1)或2)限定的dna序列具有90%以上同源性,且编码所述蛋白质的dna分子。
上述严格条件可为用6×ssc,0.5%sds的溶液,在65℃下杂交,然后用2×ssc,0.1%sds和1×ssc,0.1%sds各洗膜一次。
含有所述基因的重组载体、表达盒、转基因细胞系或重组菌也属于本发明的保护范围。
在本发明的一个实施例中,所述重组载体具体为在pet-32a(+)载体的bamhi和xhoi酶切位点之间插入了序列表的序列2所示的双链dna分子后得到的重组质粒,命名为pet-32a(+)-gwp。
重组载体pet-32a(+)-gwp中,序列2所示的双链dna分子与载体骨架上的his标签形成融合基因,表达融合蛋白,从而可用ni-nta进行纯化。即本发明实施例中的所述多肽融合蛋白gwp具体为重组载体pet-32a(+)-gwp所表达的融合蛋白。
所述蛋白质或所述基因或所述重组载体、表达盒、转基因细胞系或重组菌在如下任一中的应用也属于本发明的保护范围:
(a)制备用于预防和/或治疗由立氏立克次体(rickettsiarickettsii)引起的疾病的产品;
(b)制备用于降低被立氏立克次体(rickettsiarickettsii)感染的动物的脏器组织内立氏立克次体数量的产品;
(c)制备针对立氏立克次体(rickettsiarickettsii)的保护性抗原。
其中,所述保护性抗原是指立氏立克次体能刺激机体发生保护性免疫应答的抗原成分。
另外,活性成分包括所述多肽融合蛋白gwp,且具有如下(a)或(b)所示功能的产品也属于本发明的保护范围:
(a)预防和/或治疗由立氏立克次体(rickettsiarickettsii)引起的疾病;
(b)降低被立氏立克次体(rickettsiarickettsii)感染的动物的脏器组织内立氏立克次体数量。
进一步,所述产品的活性成分可由所述多肽融合蛋白gwp和佐剂组成。
所述佐剂可为弗氏佐剂、氢氧化铝佐剂、明矾佐剂、脂质体佐剂等。
所述弗氏佐剂具体可为弗氏完全佐剂或弗氏不完全佐剂。
在本发明中,所述疾病具体可为落基山斑点热。所述脏器具体可为肺脏、脾脏和/或肝脏。所述产品具体可为疫苗。
本发明的发明人发现立氏立克次体的多肽融合蛋白gwp可以作为一种抗原蛋白,能够刺激机体产生免疫应答对抗立氏立克次体毒株攻击,为具有落基山斑点热疫苗功能的保护性抗原。多肽融合蛋白gwp可通过基因工程制备,用多肽融合蛋白gwp作为疫苗,与菌体蛋白疫苗相比,具有制备方法简单、成本低、产量高、更安全等优点。本发明对于落基山斑点热的防疫和治疗具有重大价值。
附图说明
图1为elispot法筛选阳性th1表位肽。
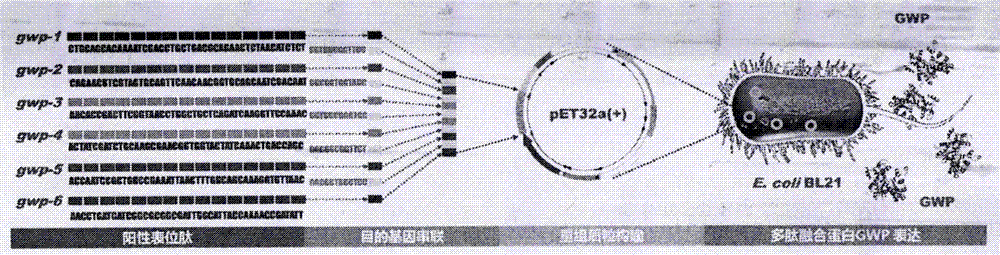
图2为为多肽融合蛋白gwp的组成表位肽、重组质粒构建及诱导表达示意图。
图3为重组质粒的dna电泳检测结果。
图4为目标dna测序结果。
图5为多肽融合蛋白溶液的聚丙烯酰胺凝胶电泳结果。
图6为实时荧光定量pcr检测免疫小鼠肝脏、脾脏、肺脏组织中内立氏立克次体拷贝数评价蛋白抗原gwp的免疫保护效果。其中,a为肝脏结果;b为脾脏结果;c为肺脏结果。实验数据以立氏立克次体ompb基因拷贝数与小鼠actin基因拷贝数之比表示,各组数据以mean+sem表示。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用试剂如无特殊说明,均购自国药集团化学试剂公司。
下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中利用仪器nanodrop1000分光光度计(购自thermoscientific公司)进行蛋白浓度的测定;利用仪器7300realtimepcrsystem(购自appliedbiosystems公司)进行立氏立克次体拷贝数的测定。
载体pet-32a(+):novagen公司产品,产品目录号为69015。
大肠杆菌bl21:novagen公司产品,产品目录号为69450。
c3h/hen小鼠(6-7周龄,雄性):北京维通利华公司产品。
弗氏完全佐剂:sigma公司产品,产品目录号为f-5881。
弗氏不完全佐剂:sigma公司产品,产品目录号为f-5506。
镍-nta琼脂糖凝胶(ni-nta)试剂盒:qiagen公司产品,产品目录号为30230。
dna提取试剂盒:qiagen公司产品,产品目录号为69506。
辣根过氧化物酶标记羊抗鼠igg:中科瑞泰公司产品,产品目录号为zb-2305。
所有限制性内切酶:大连takara公司产品。
实施例中所用的立氏立克次体(rickettsiarickettsii)均为立氏立克次体sheilasmith株(rickettsiarickettsii,sheilasmithstrain),在文献“ellisondw,clarktr,sturdevantde,virtanevak,porcellasf,hackstadtt.genomiccomparisonofvirulentrickettsiarickettsiisheilasmithandavirulentrickettsiarickettsiiiowa.infectimmun.2008feb;76(2):542-50.epub2007nov19.”中已报道,在符合生物安全操作规范的情况下,公众可从申请人处获得,仅可用于重复本发明实验使用。
主要试剂的配制
1、pcr反应用2×mix的配制(1ml):
加去离子水定容至1ml。
2、lb液体培养基的配制(1000ml):
加去离子水定容至1000ml,121℃,15min高压灭菌。
3、lb固体培养基的配制(1000ml):
加去离子水定容至1000ml,121℃,15min高压灭菌。
4、可溶性表达形式目的蛋白纯化所需缓冲液的配制:
(1)可溶性蛋白裂解缓冲液ph8.0(1000ml):
用去离子水溶解并定容到1000ml,naoh调节ph至8.0。
(2)包涵体表达形式目的蛋白纯化所需缓冲液的配制:
①包涵体蛋白裂解缓冲液ph8.0(1000ml):
用去离子水溶解并定容到1000ml,naoh调节ph至8.0。
②包涵体蛋白洗涤缓冲液ph6.3(1000ml):
用去离子水溶解并定容到1000ml,naoh调节ph至6.3。
③包涵体蛋白洗脱缓冲液ph4.5(1000ml):
用去离子水溶解并定容到1000ml,naoh调节ph至4.5。
实施例1、elispot技术筛选阳性表位肽
1、从ncbi数据库中获取adr2(a1g_07050)、ompb(a1g_06030)和ybgf(a1g_01780)保护性抗原的蛋白序列,将蛋白序列输入iedb服务器预测出各自限制型mhcii类分子结合位点。
2、将上述数据库预测出的表位肽通过排序打分,优先选择在各个数据库中得分较高的15肽序列并合成th1表位。
3、将纯化后的立氏立克次体经65℃灭活30分钟,既得立氏立克次体全菌抗原(wca)。按照5×106pfu(空斑形成单位)/只的剂量用wca免疫c3h/hen小鼠10只,另外用pbs免疫c3h/hen小鼠5只用作抗原提呈细胞(apc)的制备。免疫后第15天处死小鼠,解剖取脾,利用cd4+t淋巴细胞分选试剂盒(德国miltenyi公司)分离出致敏的cd4+t淋巴细胞。利用细胞计数器,测定上述分选的t淋巴细胞和apc数目,分别按照2∶1的数目混合后100μl/孔铺板,使得各自终浓度分别为2×105和1×105。实验组按照2μg/孔的量加入步骤2中合成的表位肽,另一组不加入表位肽,仅含有细胞及培养基,用作空白对照组。将96孔elispot板置于含5%co2的37℃细胞培养箱孵育18-24h。孵育结束后,最后通过elispot技术检测上述96孔板中cd4+t淋巴细胞分泌ifn-γ的水平,待斑点达到要求后读板,扫描,计数各孔中斑点的数量。根据si值筛选阳性表位肽。si值表示抗原刺激指数,定义为表位肽刺激组(实验组,含有表位肽、细胞和培养基)斑点数与空白对照组(不加入表位肽,仅有细胞和培养基)斑点数之比,当si>2时则认为阳性。
4、通过上述方法,共筛选出6条阳性表位肽,其si值分别为:ybgf57-71:4.80,ompb152-166:2.29,ompb399-413:11.13,ompb563-577:3.60,ompb698-712:3.85和ompb1411-1425:2.42(图1)。
5、每个thl阳性表位含有15个氨基酸,分别为:
ybgf57-71:lqhkidlltqnsnis
ompb152-166:qnvvvqfnngaaidn
ompb399413:ntdfgnlaaqikvpn
ompb563-577:tidlqanggtiklts
ompb698-712:tnplaeinfgskgvn
ompb1411-1425:nlmigaaigitktdi
实施例2、重组质粒构建及多肽融合蛋白表达
1、将实施例1中所述6个阳性表位以gggs接头相连接组成多肽融合蛋白gwp的氨基酸序列,具体如序列表中序列1所示。将如图2所示的6条表位相对应的基因序列由gggs相对应的基因序列前后连接成完整的基因,具体如序列表的序列2所示(基因命名为gwp),随后送上海生工进行目的基因的合成,合成产物含有“ggatcc+序列2+ctcgag”所示dna片段。
2、用限制性内切酶bamhi和xhoi双酶切步骤1中人工合成的目的基因“ggatcc+序列2+ctcgag”,回收酶切产物。
3、用限制性内切酶bamhi和xhoi双酶切载体pet-32a(+),回收载体骨架。
4、将步骤2所得的酶切产物与步骤3所得的载体骨架进行连接,得到重组质粒。
5、重组质粒经dna电泳发现大小约为6242bp,与预期大小相符(图3)。并进一步对重组质粒进行测序验证(图4)。
重组质粒结构描述如下:在载体pet-32a(+)的bamhi和xhoi酶切位点之间插入了序列表的序列2所示的双链dna分子(所述双链dna分子与载体骨架上的his标签形成融合基因,表达融合蛋白,从而可用ni-nta进行纯化)。将该重组质粒命名为pet-32a(+)-gwp。
6、将重组质粒pet-32a(+)-gwp导入大肠杆菌bl21,得到重组菌。重组菌的验证方法:将菌株接入lb固体培养基平板(含200mg/l氨苄青霉素),挑取单克隆并转接入lb液体培养基,37℃培养并提取质粒进行测序,如果提取的质粒为重组质粒pet-32a(+)-gwp,即为目的重组菌。
7、多肽融合蛋白的表达
将重组菌接入lb液体培养基(含200mg/l氨苄青霉素),37℃、200r/min培养过夜。次日按照1%(体积百分含量)的接种量转接入相同抗生素浓度的lb液体培养基中,在37℃、200r/min条件下培养至od600值≈0.6时,加入iptg诱导剂(0.1mm)后在25℃、200r/min条件下继续进行诱导表达8h,得到发酵液。
8、多肽融合蛋白的纯化
(1)取步骤7的发酵液100ml,5000rpm离心10min,收集菌体沉淀。
(2)用30ml可溶性蛋白裂解缓冲液重悬步骤(1)中得到的菌体,吹打混匀后冰浴条件下进行超声,超声条件为:工作4.5sec,间隔9sec,共超声60min,功率为125w。将超声裂解物以12,000×g离心20min,弃去上清,将10ml包涵体蛋白裂解液加入沉淀部分,并且充分吹打混匀,室温放置过夜。
(3)翌日,将步骤(2)中得到的过夜混合物与2mlni-nta混合,室温200rpm振荡混匀4h,使得目的蛋白(多肽融合蛋白)与ni-nta充分结合,然后将混合物移入纯化柱内,用包涵体蛋白洗涤缓冲液洗涤3次,每次10ml(流速控制为3ml/min)。然后用包涵体蛋白洗脱缓冲液洗脱5次,每次500ul(流速控制为3ml/min),合并收集的洗脱液并测蛋白浓度,得到目的蛋白溶液(多肽融合蛋白溶液)。
9、多肽融合蛋白的鉴定
将多肽融合蛋白溶液进行12%聚丙烯酰胺凝胶电泳,结果见图5。多肽融合蛋白溶液只显示一条约31kda的条带,与预期相符合。
实施例3、多肽融合蛋白gwp的保护性评价
一、小鼠免疫及立氏立克次体拷贝数检测
1、小鼠免疫
(1)分层抽样:将6-7周龄的雄性c3h/hen小鼠20只按照体重分为两大组,每大组小鼠体重接近,然后分别将两大组等量地分配到4个实验组中,每组5只c3h/hen小鼠。
(2)对照组设置:多肽融合蛋白gwp为实验组,pbs组为阴性对照组,全菌蛋白wca(6×106个/只c3h/hen小鼠)组为阳性对照组,表位肽ompb399(即ompb399413:ntdfgnlaaqikvpn)为表位肽对照组。
(3)免疫方案:
其中,cfa表示完全弗氏佐剂;ifa表示不完全弗氏佐剂。每次免疫佐剂和蛋白各100μl。
2、立氏立克次体攻击重组蛋白免疫的c3h小鼠
(1)用立氏立克次体通过腹腔注射感染上述重组蛋白免疫的c3h/hen小鼠,剂量为6×106个/只。
(2)攻毒5天后,将各组小鼠处死,摘取脾脏、肺脏、肝脏。
3、rt-pcr检测各脏器中立氏立克次体拷贝数
(1)将小鼠脏器放入1.5mlep管中,加入700μlpbs后研磨脏器,加入pbs将研磨液总体积补充到1.5ml(由于肺脏体积较小,因此将研磨液总体积定为800μl)。从ep管中吸取100μl研磨液按照组织dna提取试剂盒的说明进行dna提取。
(2)利用rt-pcr检测各脏器中立氏立克次体的载量,进行统计分析,比较和评价各目标蛋白的保护性。
实时荧光定量pcr所用的引物及探针序列如下表1所示:
表1立氏立克次体实时荧光定量探针及引物序列
取立氏立克次体拷贝数分别为1×109、1×108、1×107、1×106、1×105、1×104、1×103的标准品各1μl,以立氏立克次体ompb上下游引物和taqmanmgb探针进行实时荧光定量pcr,得到与脾组织或肝组织或肺组织进行同一批次实时荧光定量pcr的标准曲线方程。该标准曲线方程在脏器中与同批次的小鼠actin拷贝数共用。同时,取1μl各组小鼠脾组织或肝组织或肺组织提取的dna作为模板、以立氏立克次体ompb或小鼠actin上下游引物及各自taqmanmgb探针进行同一批次的实时荧光定量pcr。通过标准曲线将各组小鼠脏器组织的实时荧光定量pcr结果换算为立氏立克次体的拷贝数与小鼠actin内参拷贝数,并计算两者之比。
与脾组织进行同一批次实时荧光定量pcr的标准曲线方程为ct=-3.22×logco+37.13。与肝组织进行同一批次实时荧光定量pcr的标准曲线方程为ct=-3.32×logco+37.99。与肺组织进行同一批次实时荧光定量pcr的标准曲线方程为ct=-3.21×logco+37.89。三个标准曲线方程中,co均代表拷贝数。三个标准曲线方程的r2值均大于98%。
实验结果数据以立克次体拷贝数与小鼠actin内参之比表示(图6),其大小表示立克次体相对量的多少。对定量pcr结果运用sas9.1软件进行单因素多水平方差分析及snk法进行两两之间的比较(相同字母表示之间没有显著性差异)。
肝组织中立氏立克次体拷贝数结果见表2和图6中a。
脾组织中立氏立克次体拷贝数结果见表3和图6中b。
肺组织中立氏立克次体拷贝数结果见表4和图6中c。
表2肝脏组织检测结果
表3脾脏组织检测结果
表4肺脏组织检测结果
统计学分析显示,在肝脏的检测中,多肽融合蛋白gwp组和ompb399组与pbs阴性对照组之间没有显著性差异,wca组与pbs组之间有显著性差异(p=0.0430)。
在脾脏的检测中,多肽融合蛋白gwp组和wca组与pbs阴性对照组之间有显著性差异(p=0.0248),而ompb399组与pbs阴性对照组之间没有显著性差异。
在肺脏的检测中,多肽融合蛋白gwp组和wca组与pbs阴性对照组之间有显著性差异(p=0.0014),而ompb399组与pbs阴性对照组之间没有显著性差异。
与阴性对照组相比,实验组可减少立式立克次体在肝组织、脾组织及肺组织中数量的16.4%、39.7%和75.3%,阳性对照组可减少立克次体菌体在肝组织、脾组织及肺组织中增值的54.0%、70.1%和89.8%,由此可知,肝脏中多肽融合蛋白gwp的免疫保护性占全菌蛋白免疫保护性的比例为:16.4%/54.0%=30.4%;脾脏中多肽融合蛋白gwp的免疫保护性占全菌蛋白免疫保护性的比例为:39.7%/70.1%=56.6%;肺脏中多肽融合蛋白gwp的免疫保护性占全菌蛋白免疫保护性的比例为:75.3%/89.8%=83.9%。由于肺脏是立氏立克次体最主要的靶器官,因此可以认为多肽融合蛋白gwp的免疫保护性可达到全菌蛋白免疫保护性的83.9%以上。
- 还没有人留言评论。精彩留言会获得点赞!