抗心律失常药物的筛选方法及平台与流程
本发明涉及医药领域,尤其涉及抗心律失常药物的筛选方法及平台。
背景技术:
心律失常是心血管疾病中重要的一组疾病,指心律起源部位心搏频率与节律以及冲动传导等任一项异常,既包括节律又包括频率的异常。按照心律失常冲动形成异常可分为1.窦性心律失常①窦性心动过速;②窦性心动过缓;③窦性心律不齐;④窦性停搏。2.异位心律(1)被动性异位心律:①逸博(房性、房室交界区性、室性)。②逸博心律(房性、房室交界区性、室性)。按照心律失常冲动传到异常又可分为:1.生理性干扰及房室分离。2.病理性①窦房传导阻滞;②房内传导阻滞;③房室传导阻滞;④束支或分支阻滞(左、右束支及左束支分支传导阻滞)或室内阻滞。3.房室间传导途径异常预激综合征。心律失常在心血管疾病中,无论是发病率还是致死率均位居前列。探究心律失常发病的机制以及获取毒性和副作用更小的抗心律失常药物是临床医学亟待解决的难题。
vaughanwilliams分类法是抗心律失常药物的常用分类法,此种分类法根据药物作用的电生理特点将药物分为四类。
i类为阻断心肌和心脏传导系统的钠通道,具有膜稳定作用,降低动作电位0相除极上升速率和幅度,减慢传导速度,延长apd和erp。对静息膜电位无影响。根据药物对钠通道阻滞作用的不同,又分为三个亚类,即ia、ib、ic。其中:
(1)ia类适度阻滞钠通道,复活时间常数1~10s,以延长erp最为显著。
(2)ib类轻度阻滞钠通道,复活时间常数<1s,降低自律性。
(3)ic类明显阻滞钠通道,复活时间常数>10s,减慢传导性的作用最强。
ⅱ类为β受体阻滞药,抑制交感神经兴奋所致的起搏电流、钠电流和l-型钙电流增加,表现为减慢4相舒张期除极速率而降低自律性,降低动作电位0相上升速率而减慢传导性。
ⅲ类为延长动作电位时程药,抑制多种钾电流。
ⅳ类为钙通道阻滞药,包括维拉帕米和地尔硫卓等。
心肌细胞又称心肌纤维,有横纹,受植物性神经支配,属于有横纹的不随意肌,具有兴奋收缩的能力。根据心肌细胞的组织学特点、电生理特性以及功能上的区别,可以粗略地分为两大类型,两类心肌细胞分别实现一定的职能,互相配合,完成心脏的整体活动。一类是普通的心肌细胞,包括心房肌和心室肌,含有丰富的肌原纤维,执行收缩功能,故又称为工作细胞。工作细胞不能自动地产生节律性兴奋,即不具有自动节律性;但它具有兴奋性,可以在外来刺激作用下产生兴奋;也具有传导兴奋的能力。另一类是一些特殊分化了的心肌细胞,组成心脏的特殊传导系统;其中主要包括p细胞和浦肯野细胞,它们除了具有兴奋性和传导性之外,还具有自动产生节律性兴奋的能力,故称为自律细胞,它们含肌原纤维甚小或完全缺乏,故收缩功能已基本丧失。
可见,心肌细胞的异常会导致心律失常,心律失常模型常采用体外培养心肌细胞的方式或采用构建动物疾病模型的方式。构建疾病动物模型周期长,不稳定性高,操作困难,用于药物筛选周期长,严重限制了药物筛选的效率。而应用成熟心肌细胞的电泳作为药物筛选的模型,随机性高,可靠性差,没有广泛性。
因此,进一步构建用于筛选抗心律失常的药物的方法,提高稳定性、可靠性十分必要。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供抗心律失常药物的筛选方法及平台。本发明提供的筛选方法通过监测心室肌细胞内钙荧光染料亮度的强弱变化和细胞膜的上下位移判断待测药物的有效性,该方法能够更真实的模拟心律失常,实验结果直观、可靠。
本发明提供的抗心律失常药物的筛选方法为,待测药物作用下,根据心肌细胞心律失常模型的细胞内钙离子浓度和细胞膜的位移,判断待测药物是否具有抗心律失常作用。
本发明通过心室肌细胞的培养,使它们形成的网状的结构,真实的在体外模拟心脏的电信号发生,传导以及心肌细胞的兴奋和收缩耦联。并且,本发明通过检测细胞内钙浓度和细胞的收缩舒张,直接、客观的反映了药物的作用特点和作用机制。本发明提供的方法不再利用动物模型,从而使药物筛选工作的操作更加简单、周期更短且能126够排除多种不确定因素,使结果更加可靠。并且,细胞内该浓度和细胞膜位移的测定使药物作用机制更加明确、直观。
在本发明的实施例中,细胞内钙离子浓度的测定采用的染料为fluo-3am染料;采用的仪器为荧光显微镜。
在本发明的实施例中,荧光显微镜激光源的波长为473nm,检测波长为528nm。
在本发明的实施例中,细胞膜的位移的测定采用扫描离子电导显微镜;所述扫描离子电导显微镜电极电压为6v。
在本发明的实施例中,细胞内钙离子浓度和细胞膜的位移的检测时长为5秒~8秒。
在本发明的实施例中,心肌细胞心律失常模型为:以牛磺胆酸诱导心室肌细胞的心律失常模型。
作为优选,心室肌细胞的为新生大鼠心室肌细胞。
在本发明的实施例中,大鼠为wistar大鼠,雄性,1~2日龄。
作为优选,心室肌细胞的培养方法包括:
步骤1:破碎1~2日龄大鼠心室组织,于tyrode消化液中37℃消化30min,获得细胞悬液;
步骤2:收集细胞,以培养液重悬,然后按接种密度1.8×104~3.4×104细胞/cm2,接种于底面预先铺了fibronectin的培养皿;培养至细胞连接成小的网络,并开始跳动。
作为优选,培养的培养液包括dmem液体培养基、m199液体培养基、马血清和小牛血清。
优选的,dmem液体培养基、m199液体培养基、马血清和小牛血清的体积比为68:17:10:5。
作为优选,培养的条件为37℃,体积分数为5%的co2。
作为优选,tyrode消化液包括:无钙的tyrode溶液、cacl2、bsa、胶原酶和中性蛋白酶ii。
优选的,tyrode消化液中,cacl2的浓度为10μmol/l;bsa的浓度为1mg/ml;胶原酶的浓度为0.6mg/ml;中性蛋白酶ii的浓度为0.03mg/ml。
在本发明的实施例中,心肌细胞心律失常模型的构建方法具体为:以牛磺胆酸与心室肌细胞共同孵育16h;牛磺胆酸的浓度为0.3mmol/l~3mmol/l。
作为优选,在以牛磺胆酸诱导心律失常模型前,以钙荧光染料将心室肌细胞进行染色。
优选的,染色方法包括:
步骤1:以dmso配制染料溶液,其中含有0.2mg/μlpluronicacid、2.5μg/μlfluo-3am;
步骤2:ebss与染料溶液以体积比为200:1混合后,与心室肌细胞混合后,37℃染色30min后,以ebss清洗2次。
本发明以荧光显微镜检测细胞内钙离子浓度,并以扫描离子电导显微镜(sicm)检测细胞由于跳动导致的细胞膜的上下位移。不仅能够能够观察一定时间内细胞内钙离子浓度的变化和细胞膜位移的变化,而且能够测定某一时刻细胞内钙离子浓度和细胞膜位置。
具体的,扫描离子电导显微镜(sicm)检测细胞膜的位移的方法为:将含有心肌细胞心律失常模型的培养皿,置于显微镜,将sicm的z向位移的压电陶瓷在培养皿的支架上,给电极施加6v恒定的电压,在微操作仪的操控下,充满电极液玻璃探针步进接近跳动细胞的细胞膜,当电极接近细胞膜时,电流突然减小,说明电极进入了工作区,继续移动电极接近细胞膜,直到电流比原来减小了20%。在sicm的程序控制下,侧移记录电极,直到记录的细胞膜的上下运动幅度达到显著。
sicm的电极为硼化玻璃电极,外径1.5mm,内径0.86mm,含有导丝。
在本发明的实施例中,判断待测药物具有抗心律失常作用的方法为vaughanwilliams分类法。
在本发明的实施例中,还根据心肌细胞心律失常模型的细胞膜的膜电位、细胞内ph值、细胞内ros值,判断待测药物是否具有抗心律失常作用。
细胞膜的膜电位测定采用激光共聚焦显微镜,通过检测荧光强度的变化检测膜电位的变化,膜电位变化由不规律转向规律。
细胞内ph值的测定采用激光共聚焦显微镜,通过检测荧光染料的荧光强度直接转换成ph度数。调节细胞偏酸性的状态,ph升高。
细胞内ros值的测定采用激光共聚焦显微镜,检测荧光强度检测ros值,纠正显著增多的ros值,使ros值回归到正常范围内;
本发明还提供了一种抗心律失常药物的筛选平台,包括心肌细胞心律失常模型、细胞内钙离子浓度检测仪器和细胞膜的位移检测仪器。
在本发明的实施例中,细胞内钙离子浓度检测仪器为荧光显微镜;所述细胞膜位移监测仪器为扫描离子电导显微镜。
本发明从心肌细胞收缩以及细胞内钙离子浓度的变化的角度揭示了效应细胞在心肌电信号的作用下的真实反应。心肌电的传导,导致电信号经过的细胞发生细胞膜电位的变化,细胞膜上钙离子通道打开,钙离子内流。细胞内大量钙离子,导致了细胞收缩耦联,细胞发生收缩。兴奋收缩耦联是心肌电活动的最重要的表现,因此本发明提供的筛选平台能够更加真实细致地观测心律传导中的核心元素。在实验中,还可以通过收缩以及钙信号的变化,推断出细胞的类型,以及他们对药物的不同反应性。
本发明的筛选方法,操作简单,实验数据确切,实验结果直观可靠。可以同时记录心肌的收缩跳动和细胞内的钙离子浓度。并且,还可以通过测定细胞膜的膜电位,细胞内的ph值,细胞内的ros等参数。因此,在筛选心律失常药物的过程中,除了评价药物本身对细胞电信号传到的作用,可以检测出待筛选的药物是否会影响心肌的收缩,是否会通过影响h泵造成细胞内ph值的变化,是否影响细胞代谢等待选药物本身的药物副作用。而这些是在其他方法和平台上,不易察觉和不能检测的。
附图说明
图1-a示未经牛磺胆酸处理的新生大鼠心室肌细胞的跳动频率;
图1-b示经浓度为0.3mmol/l牛磺胆酸处理的新生大鼠心室肌细胞的跳动频率;
图1-c示经浓度为1mmol/l牛磺胆酸处理的新生大鼠心室肌细胞的跳动频率;
图1-d示经浓度为3mmol/l牛磺胆酸处理的新生大鼠心室肌细胞的跳动频率;
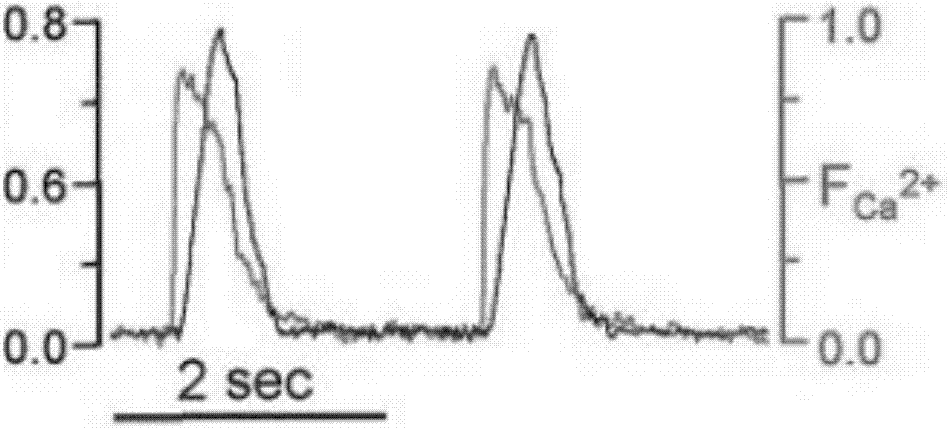
图2-a~图2-c示心肌收缩与细胞内钙离子浓度变化的关系。
具体实施方式
本发明提供了抗心律失常药物的筛选方法及平台,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的材料、仪器皆为普通市售品,皆可通过商业途径获得。
下面结合实施例,进一步阐述本发明:
实施例1心肌细胞心律失常模型的构建
1、新生1~2天的大鼠(wistar)雄性,取心脏,收集心室,切成小块。
2、小块置于tyrode消化液中37℃摇床30min,消化液成分如下:
无钙的tyrode溶液(40毫升)+50μmcacl2(10毫升)+1mg/mlbsa(40毫克)+collagenase(30mg)+proteaseii(1.5mg)。
3、细胞悬浮液经过percoll梯度离心,收集细胞,重悬细胞在培养液中(dmem:m199(4:1),10%的马血清,5%小牛血清),然后按接种密度1.8×104~3.4×104细胞/cm2,接种于底面预先铺了fibronectin的培养皿。
4、细胞生长于培养液,在37℃5%co2的环境下,当细胞连接成小的网络,并开始跳动时,进行钙荧光染料的负载:
称量10毫克pluronicacid,加入50微升dmso,等待pluronicacid完全溶解于dmso中,取出20微升加入含有50微克的fluo-3am中,保存fluo-3am染料在黑暗中。
用ebss溶解fluo-3am染料按200:1的比例,溶液刚好覆盖张在培养皿底面的细胞,放入37度培养箱中,30分钟,移走fluo-3am染料,再用ebss清洗2次,放入ebss溶液,覆盖细胞。
5、分别将含有0mmol/l,0.3mmol/l,1mmol/l,3mmol/l的taurocholate(sigma)(合适浓度的导致心律失常的药物)的培养液孵育经钙荧光染色的细胞16个小时。
实施例2心肌细胞心律失常模型细胞内钙离子浓度、细胞膜位移的测定
1、扫描电导显微镜微电极的拉制
应用硼化玻璃电极,外径1.5mm内径0.86mm,含有导丝
应用sutterp1000拉制仪
拉制程序为:
2、将实施例1制得的由不同浓度taurocholate(牛磺胆酸)诱导的心律失常模型的细胞至于培养皿,置入显微镜上。
3、应用sicm的探针,实时记录心肌细胞的跳动。这里sicm的z向位移的压电陶瓷在培养皿的支架上。给电极施加一个恒定的电压(6v),在微操作仪的操控下,充满电极液玻璃探针步进接近跳动细胞的细胞膜,当电极接近细胞膜时,电流会突然减小,说明电极进入了工作区。继续移动电极接近细胞膜,直到电流比原来减小了20%。
4、在sicm的程序控制下,侧移记录电极,直到记录的细胞膜的上下运动幅度达到显著。
5、用473nm的激光源来作为激活fluo-3,应用photon检测528nm的荧光强度。调节共聚焦的焦点在细胞膜下。
6、应用sicm的程序,同时记录细胞的跳动和细胞内钙离子的变化。其中,结果如图1-a~图1~d、图2-a~图2-c所示。
结果显示,0.3mmol/l的taucholate不会引起心肌收缩幅度的变化,但会引起节律的变化,每4次跳动,有1次延后。而3mm的taucholate不仅引起心肌收缩幅度的大幅减小和不规则,同时引起节律的不规则,甚至心肌颤动。
实施例3药物作用下心肌细胞心律失常模型细胞内钙离子浓度、细胞膜位移的测定
1、将实施例1制得的经染色的细胞,由浓度为1mm的taurocholate(牛磺胆酸)和800nmol/l的地塞米松(常用治疗心律失常药物)共同孵育细胞模型,然后置于显微镜上。
2、应用sicm的探针,实时记录心肌细胞的跳动。这里sicm的z向位移的压电陶瓷在培养皿的支架上。给电极施加一个恒定的电压(6v),在微操作仪的操控下,充满电极液玻璃探针步进接近跳动细胞的细胞膜,当电极接近细胞膜时,电流会突然减小,说明电极进入了工作区。继续移动电极接近细胞膜,直到电流比原来减小了20%。
3、在sicm的程序控制下,侧移记录电极,直到记录的细胞膜的上下运动幅度达到显著。
4、用473nm的激光源来作为激活fluo-3,应用photon检测528nm的荧光强度。调节共聚焦的焦点在细胞膜下。
5、应用sicm的程序,同时记录细胞的跳动和细胞内钙离子的变化。
结果显示,800nm的地塞米松和1mm的taucholate共同孵育细胞,地塞米松防止了节律异常的出现(细胞位移图与图1-a相似)。800nm的地塞米松可以逆转1mm的taucholate引起的心肌节律异常。说明以本发明提供的方法能够检测到抗心律失常药物(地塞米松)发挥药效,其效果与预期相符,且能够从胞内钙离子浓度、心肌细胞膜位移等方面更直观的观测到药物对细胞的作用。说明本发明提供的方法能够用于药物的筛选,且具有准确性。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!