一种构建稳定过表达CXCR4的iPSCs的方法及其应用与流程
本发明属于医药技术领域,具体涉及一种构建稳定过表达cxcr4的ipscs的方法及其应用。
背景技术:
具备多向分化能力的诱导性多能干细胞(inducedpluripotentstemcells,ipscs)是治疗心肌梗死的理想种子细胞,但心梗后局部微环境的变化以及较低细胞移植归巢率限制了其应用。
基质衍生因子(stromalderivedfactor-1,sdf-1)即cxcl12,可在心肌梗死后的心梗区域局部上调,cxcl12通过与其独特受体cxcr4相互作用可促进胚胎干细胞迁移、存活,在胚胎生长发育及器官形成中发挥着极重要作用。
tale(transcriptionactivator-like(tal)effector)靶向基因操作技术是一项崭新的分子生物学工具,是基因功能研究领域的一项重大技术突破。研究人员发现,来自植物病原菌xanthomonas的tal蛋白的核酸结合域的氨基酸序列与其靶位点的核酸序列有恒定的对应关系。基于这一对应关系,利用tal的序列模块构建特异性结合任意dna序列的重组蛋白,可实现操作目标基因的目的。
目前尚无通过talens技术构建稳定过表达cxcr4-ipscs以提高ipscs在治疗心肌梗死方面的研究。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的首要目的在于提供一种构建稳定过表达cxcr4的ipscs的方法。
本发明研究发现,talens技术可稳定构建稳定过表达cxcr4-ipscs,且不改变其分化潜能及其基本形态,体外实验证实可有效提高其细胞归巢率。因此,基于talens技术构建的cxcr4-ipscs可提高干细胞归巢效率。
本发明的另一目的在于提供通过上述构建方法构建得到的稳定过表达cxcr4的ipscs。
本发明的再一目的在于提供上述稳定过表达cxcr4的ipscs的应用。
本发明的目的通过下述技术方案实现:
一种构建稳定过表达cxcr4的ipscs的方法,包括如下步骤:
利用tales技术诱导cxcr4基因启动子区域去甲基化,通过cxcr4慢病毒颗粒转染ipscs,得到稳定过表达cxcr4的ipscs,从而实现靶向基因的过表达。
一种构建稳定过表达cxcr4的ipscs的方法,所述的talens技术:
具体包括如下步骤:
1)cxcr4基因(nm_022205)的启动子区富含cpg甲基化位点,我们已经成功合成了能够识别并定位cxcr4基因启动子区dna序列的tale基因,这两个人工合成基因分别定位cxcr4a:5′-tagacccacactgacttaaaac-3′和cxcr4b:5′-ttcaattttgttgcctggtgca-3′。
2)然后将这两个基因分别同dna去甲基化酶tet1的催化域(catalyticdomain)融合,并在tet1c的末端用t2a技术连接绿色荧光蛋白(gfp),构建cxcr4a-tet1c-gfp和cxcr4b-tet1c-gfp质粒;最后将这两个融合基因分别克隆到慢病毒质粒pcdhcd527a。
3)慢病毒的包装和浓缩:将慢病毒包装质粒和载体质粒cxcr4-tet1c-gfp以1:1的摩尔比例混合,在lipofectamine2000的作用下共转染293ft细胞,置于37℃、体积分数5%co2的培养箱中培养;12h后换液,加入新鲜293ft细胞培养液;72h后观察有强绿色荧光及细胞融合现象时收集培养上清,4℃、4500r/min离心15min,将病毒上清液用0.45μm滤膜过滤以去除细胞碎片,4℃、50000×g高速离心90min;用rnase-freel-dmem悬浮病毒颗粒沉淀,-80℃冻存备用;同法构建只含绿色荧光蛋白的空病毒;
4)cxcr4-tet1c-gfp病毒颗粒稳定感染ipscs:将对数生长期ipscs消化并离心后,以分化培养基重悬成浓度1×106/l细胞悬液,将病毒cxcr4-tet1c-gfp和空病毒以10:1转染诱导性多能干细胞的;每天更换1次培养基;病毒感染24~48h后,更换新鲜培养液;并同时使用氨苄青霉素进行筛选;得到稳定过表达cxcr4的ipscs。
一种稳定过表达cxcr4的ipscs,通过上述方法构建得到。
所述的稳定过表达cxcr4的ipscs在增强细胞迁移特性中的应用。
本实验原理:本申请通过转录激活因子样效应物核酸酶(transcriptionactivator-likeeffectornucleases,talens)技术构建稳定表达cxcr4的诱导性多能干细胞(inducedpluripotentstemcells,ipscs),ipscs在修复急性心肌梗死后心肌上具有巨大临床应用前景,但其细胞移植归巢效率低下及梗死部位恶劣的微环境造成其治疗效果受限,通过生物手段提高干细胞归巢率及治疗效率在预防和治疗心肌损伤相关心血管疾病(如缺血性心脏病、动脉粥样硬化、高血压)等方面有广阔的应用前景。
本发明通过cxcr4慢病毒颗粒转染ipscs实现cxcr4过表达,流式细胞仪技术检验慢病毒颗粒对ipscs凋亡率影响,bsp(bisulfitesequencingpcr)、倒置显微镜、共聚焦显微镜和westernblots证实cxcr4可稳定在细胞表面表达。体外迁移实验证实可显著提高其细胞迁移率。
本发明相对于现有技术,具有如下的优点及效果:
本发明中通过tales技术构建稳定表达cxcr4的ipscs,并通过qpcr、形态学鉴定和bsp证实过表达cxcr4后对ipscs的干性维持基因无影响,且可显著提高体外细胞迁移率。
附图说明
图1是定位cxcr4a和cxcr4b的示意图。
图2是cxcr4b-tet1c-gfp质粒的构建示意图。
图3是慢病毒质粒pcdhcd527a的骨架系统。
图4是ipscs中cxcr4表达情况,其中,a:共聚焦显微镜下cxcr4表达情况(600×);b:倒置显微镜下的ipscs转染前后的形态学改变(40×);c:mrna(cxcr4、oct4、c-myc)表达情况;d:cxcr4蛋白表达情况;e:cxcr4蛋白表达的相对定量(control:对照组,细胞不做任何处理;cxcr4-ipscs:cxcr4过表达的ipscs;且cxcr4代表cxcr4b)。
图5是cxcr4慢病毒颗粒对ipscs凋亡影响;其中,a:流式细胞图;b:凋亡数据分析(control:对照组,细胞不做任何处理;cxcr4-ipscs:cxcr4过表达的ipscs;emptyvectoripscs:空病毒转染组;且cxcr4代表cxcr4b)。
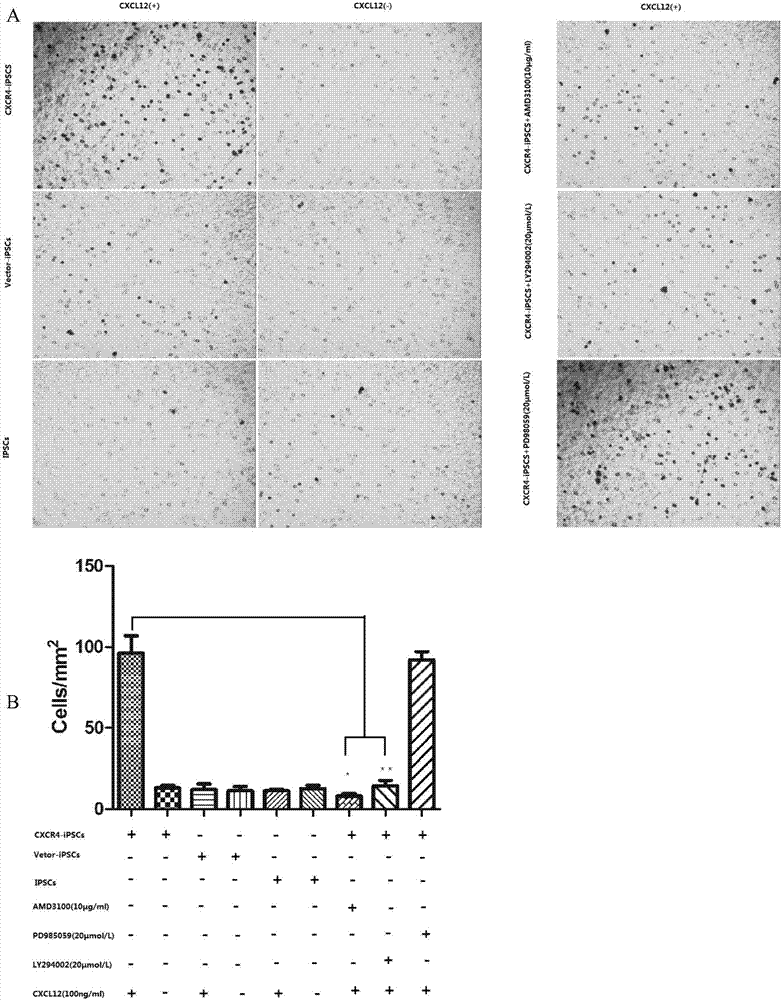
图6是体外细胞迁移实验;其中,a:transwell形态图;b:细胞迁移率柱状图(cxcr4代表cxcr4b)。
图7是cxcr4、oct4、c-myc甲基化状态(cxcr4代表cxcr4b)。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中未注明具体实验条件的实验方法,通常按照常规实验条件或按照制造厂商所建议的实验条件。未注明具体来源的试剂及生物材料,均为市售产品。
实施例1制备ipscs
(1)滋养层(mef)的制备:0.1%(体积分数)的明胶加入t25培养瓶,摇匀覆盖即可,于37℃细胞培养箱静置20min后将其吸除,加入5~6ml预热37℃的mef培养液,与此同时将小鼠胚胎成纤维细胞(mef)(购自上海中科院细胞库)从液氮中快速取出,置于37℃水浴中快速融解并立即用体积分数为75%的酒精擦拭冻存管后拿到超净台内,将冻存管内的细胞悬液转移至含mef培养液的15ml离心管内,以1000rpm离心5min,弃上清液重悬后加入到t25培养瓶中,放置到co2恒温培养箱中,培养24h后得到滋养层即可加入ipscs;
(2)ipscs的培养以及传代:步骤(1)中培养24h后得到的滋养层,4倍显微镜下可见已经均匀铺满t25培养瓶,此时可迅速从液氮中取出ipscs(中科院上海生科院生化细胞所和中科院上海生科院生化细胞所干细胞平台提供)冻存管,复苏过程类似小鼠胚胎成纤维细胞,将复苏的ipscs直接传入mef铺板的t25培养瓶,置于37℃细胞培养箱,每日换液并且观察细胞集落形态的变化。待细胞集落长到合适大小及时传代,pbs(不含钙镁离子)轻轻冲洗一遍后加入0.25%(体积分数)胰酶(含edta)消化,小鼠ipscs培养液终止消化,以1000rpm离心5min,弃上清加培养液吹打制备成单细胞悬液。
实施例2制备cxcr4慢病毒颗粒
一种构建稳定过表达cxcr4的ipscs的方法,所述的talens技术:
基本方法如下:
1)cxcr4基因(nm_022205)的启动子区富含cpg甲基化位点,我们已经成功合成了能够识别并定位cxcr4基因启动子区dna序列的tale基因,这两个人工合成基因分别定位cxcr4a:5′-tagacccacactgacttaaaac-3′和cxcr4b:5′-ttcaattttgttgcctggtgca-3′(如图1所示)。
2)然后将这两个基因分别同dna去甲基化酶tet1的催化域(catalyticdomain)融合,并在tet1c的末端用t2a技术连接绿色荧光蛋白(gfp),构建cxcr4a-tet1c-gfp和cxcr4b-tet1c-gfp质粒(如图2所示,cxcr4代表cxcr4b)。最后将这两个融合基因分别克隆到慢病毒质粒pcdhcd527a(骨架系统见图3所示)。
3)慢病毒的包装和浓缩:将慢病毒包装质粒和载体质粒cxcr4-tet1c-gfp以1:1的摩尔比例混合,在lipofectamine2000的作用下共转染293ft细胞,置于37℃、体积分数5%co2的培养箱中培养。12h后换液,加入新鲜293ft细胞培养液。72h后观察有强绿色荧光及细胞融合现象时收集培养上清,4℃、4500r/min离心15min,将病毒上清液用0.45μm滤膜过滤以去除细胞碎片,4℃、50000×g高速离心90min。用rnase-freel-dmem悬浮病毒颗粒沉淀,-80℃冻存备用。同法构建只含增强型绿色荧光蛋白的空病毒。
4)慢病毒的滴度测定:接种293ft细胞于6孔板,每孔接种2×105个细胞,37℃培养过夜;第2天将慢病毒溶液用无血清dmem(不含抗生素)按1×10-2,1×10-3,1×10-4,1×10-5,1×10-6,1×10-7进行系列稀释,将其分别加入到相应的孔中,加入聚酰胺(polybrene)终浓度至8mg/l,置37℃、体积分数5%co2培养箱培养。12h后全量换液,加入新鲜的293ft细胞培养液。第4天观察荧光表达情况,荧光细胞数随稀释倍数增加而减少,计数出表达荧光的细胞个数,将得到的数值乘以相应的稀释倍数就得到病毒原液的滴度数。
5)cxcr4-tet1c-gfp病毒颗粒稳定感染ipscs:将对数生长期ipscs消化并离心后,以分化培养基重悬成浓度1×106/l细胞悬液,将病毒cxcr4-tet1c-gfp和空病毒以10:1转染诱导性多能干细胞的。每天更换1次培养基。病毒感染24~48h后,更换新鲜培养液。并同时使用氨苄青霉素进行筛选。
所述的分化培养基为含有体积分数分别为1%非必需氨基酸、1%谷氨酰胺、0.25%β-巯基乙醇,15%胎牛血清的dmem。
6)流式细胞仪技术:制备单细胞细胞悬液后,冰预冷的70%的乙醇固定,4℃,1~2小时,细胞重悬,400目的筛网过滤1次,500~1000r/min离心5min,弃去pbs,1mlpi染液染色,4℃避光30min,pi用氩离子激发荧光,激光光波波长为488nm,发射光波波长大于630nm,产生红色荧光分析pi荧光强度的直方图也可分析前散射光对侧散射光的散点图。
cxcr4慢病毒颗粒对ipscs凋亡影响,如图5所示(control:对照组,细胞不做任何处理;cxcr4-ipscs:cxcr4过表达的ipscs;emptyvectoripscs:空病毒转染组;且cxcr4代表cxcr4b);其中,a:流式细胞图;b:凋亡数据分析。结果表明:相比对照组而言,cxcr4慢病毒和空病毒对ipscs凋亡均存在一定的影响,可引起有效的凋亡;但cxcr4慢病毒和空病毒两者间凋亡和增殖无显著差异。
实施例3cxcr4过表达情况
单细胞克隆株在扩增消化离心后进行细胞爬片,pbs缓冲溶液冲洗3次后,小牛血清37℃孵育30min,一抗4℃过夜,二抗37℃孵育30min,dapa染色3~5min,共聚焦显微镜下观察。
单细胞悬液经过pbs缓冲液冲洗后,实时荧光定量pcr(qpcr)技术:各组ipscs经预处理48h后,按trizol操作说明书抽提样品细胞的总rna。紫外分光光度计定量后,取总rna用反转录酶逆转录得到cdna;于pcr仪上进行扩增,反应程序为:95℃首轮变性1min(stage1);95℃变性15s,60℃退火和延伸45s(stage2),40个循环后;95℃15s,60℃15s(stage3,dissociationstage)。为排除样品上样量差异造成的影响,每个基因的ct值都用管家基因gapdh的ct值进行校正。
ipscs中cxcr4表达情况,如图4所示(control:对照组,细胞不做任何处理;cxcr4-ipscs:cxcr4过表达的ipscs;且cxcr4代表cxcr4b);其中,a:共聚焦显微镜下cxcr4表达情况(600×);b:倒置显微镜下的ipscs转染前后的形态学改变(40×);c:mrna(cxcr4、oct4、c-myc)表达情况;d:cxcr4蛋白表达情况;e:cxcr4蛋白表达的相对定量。结果表明:共聚焦显微镜下可见cxcr4可在ipscs上大量表达,且倒置显微镜下无显著形态学改变;qpcr技术结果提示cxcr4mrna水平相比对照组增加了1.8倍(p<0.05),且对分化潜能控制基因oct-4和c-myc的改变无统计学意义(p>0.05)。westernblot结果相比对照组而言提示ipscs经过talens的修饰cxcr4蛋白显著提高6倍(p<0.05)。
实施例4cxcr4对ipscs迁移的影响
1)选用5mm孔径的transwell小室(bectondickinsonlabware,usa);
2)ipscs胰酶消化后重悬,细胞计数板计数;
3)实验分组:
①cxcr4-ipscs组(cxcr4过表达的ipscs);
②ipscs组(ipscs不做任何处理);
③vector-ipscs组(空病毒转染组);
④cxcr4-ipscs+cxcl12组;
⑤ipscs+cxcl12组;
⑥vector-ipscs+cxcl12组;
⑦amd3100+cxcr4-ipscs+cxcl12组;
⑧pd98059+cxcr4-ipscs+cxcl12组组;
⑨ly294002+cxcr4-ipscs+cxcl12组;
选用8mm孔径的transwell小室,上室按实验分组分别加入5×104/孔的细胞,以及cxcr4特异性阻断剂amd3100(10μg/ml)、erk1/2特异阻断剂pd98059(20μmol/l)、akt特异阻断剂ly294002(20μmol/l)预处理1h,下室分别加入含或不含cxcl12(100ng/ml)的无血清培养基;37℃、co2培养箱中孵育4小时,弃培养液,pbs冲洗2次,用棉签刮轻轻刮除聚碳酸酯膜上层的细胞,将transwell小室室温下置于4%多聚甲醛中固定10min,pbs冲洗2-3次,1%结晶紫室温下染色15min;pbs冲洗2~3次,倒置相差显微镜下随机挑选5个视野计数,重复实验三次计数统计。
体外细胞迁移实验;结果如图6所示(cxcr4代表cxcr4b);其中,a:transwell形态图;b:细胞迁移率数据分析。结果表明:transwell下室均未放置100ng/mlcxcl12的ipscs组、cxcr4-ipscs组、vector-ipscs组各组间细胞迁移数的差异无统计学意义(p>0.05)。100ng/mlcxcl12预处理4h后,相比ipscs+cxcl12组的细胞迁移数而言,实验组cxcr4-ipscs+cxcl12组迁移至小室下层的细胞数量具有显著的统计学意义(p<0.05),而vector-ipscs组的迁移细胞数无统计学意义(p>0.05);经过cxcr4受体拮抗剂amd3100和ly294002预处理1h后,相比cxcr4-ipscs+cxcl12组的高效迁amd3100+cxcr4-ipscs+cxcl12组的细胞迁移显著减少(p<0.05),但pd98059对cxcr4-ipscs的迁移无明显的影响(p>0.05)。
实施例5ipscs过表达cxcr4后对分化潜能基因oct-4和c-myc的影响
利用qpcr技术(同上)以及bsp技术证实该方法可使ipscs稳定cxcr4的同时,并不影响分化潜能基因。bsp技术:利用promegawizardgenomicdnapurificationkit(货号cat.#a1125)抽提dna,qiagen公司的epitectbisulfitekit(货号cat.no.59104)亚硫酸氢盐修饰,再进行基因的克隆测序,bsp扩增的甲基化的引物:
bsp-cxcr4:183bp,15cpg,
bsp-cxcr4-f:5′-ggttttggatttatattgatttaaaatata-3′,
bsp-cxcr4-r:5′-ccaaacaacaaaattaaaatttctaac-3′;
bsp-c-myc:232bp,16cpg,
bsp-c-myc-f:5′-tttgttttttgaagggtagggt-3′,
bsp-c-myc-r:5′-aaaacaaaacccctctcactc-3′;
bsp-oct4:232bp,15cpg,
bsp-oct4-f:5′-tggttgagtgggttgtaaggataggt-3′,
bsp-oct4-r:5′-actccaaccctactaacccatcacc-3′。
cxcr4、oct4、c-myc甲基化状态,如图7所示(cxcr4代表cxcr4b)。结果表明:将经过慢病毒颗粒处理筛选以及未处理的ipscs送至广州艾基生物公司测序,可见cxcr4-ipscs上cxcr4的cpg位点有效去甲基化激活cxcr4内源性表达,而对照组以甲基化为主(p<0.05)。oct4和c-myc基因的甲基化和去甲基化无显著的改变(p>0.05),cxcr4的表达量与其去甲基化状态成正相关关系。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>暨南大学
<120>一种构建稳定过表达cxcr4的ipscs的方法及其应用
<130>1
<160>8
<170>patentinversion3.5
<210>1
<211>22
<212>dna
<213>artificialsequence
<220>
<223>cxcr4a
<400>1
tagacccacactgacttaaaac22
<210>2
<211>22
<212>dna
<213>artificialsequence
<220>
<223>cxcr4b
<400>2
ttcaattttgttgcctggtgca22
<210>3
<211>30
<212>dna
<213>artificialsequence
<220>
<223>bsp-cxcr4-f
<400>3
ggttttggatttatattgatttaaaatata30
<210>4
<211>27
<212>dna
<213>artificialsequence
<220>
<223>bsp-cxcr4-r
<400>4
ccaaacaacaaaattaaaatttctaac27
<210>5
<211>22
<212>dna
<213>artificialsequence
<220>
<223>bsp-c-myc-f
<400>5
tttgttttttgaagggtagggt22
<210>6
<211>21
<212>dna
<213>artificialsequence
<220>
<223>bsp-c-myc-r
<400>6
aaaacaaaacccctctcactc21
<210>7
<211>26
<212>dna
<213>artificialsequence
<220>
<223>bsp-oct4-f
<400>7
tggttgagtgggttgtaaggataggt26
<210>8
<211>25
<212>dna
<213>artificialsequence
<220>
<223>bsp-oct4-r
<400>8
actccaaccctactaacccatcacc25
- 还没有人留言评论。精彩留言会获得点赞!