用于定量检测灰霉菌的特异引物及其应用的制作方法
本发明属于病原体检测领域,特别涉及一种用于定量检测灰霉菌的特异引物及其应用。
背景技术:
灰霉菌(botrytiscinerea),又称灰葡萄孢菌,是葡萄孢属中的一类丝状子囊真菌,其寄主范围十分广泛,能够引起200多种双子叶作物和一些观赏花卉感染灰霉病。灰霉菌在空气中广泛存在,其具有多种感染模式,能以菌丝、分生孢子及菌核的形式感染,不仅能够侵染田间作物,同样会给植物的采后阶段造成巨大损失。目前灰霉病防治仍然是一大难题,截止2013年,世界上尚未发现有任何一种植物对灰霉菌产生抗性。
传统的对灰霉菌的检测方法,如生理生化指标鉴定方法,细菌的分离培养鉴定方法等都是依靠表型来鉴定致病菌;这些方法耗时长,灵敏度很低,而且准确度差。
叠氮溴化丙锭(pma)是一种能与dna高度亲和的荧光染料,它能穿过受损细胞膜,在可见光的照射下与dna共价交联,从而达到阻碍受损细胞中的dna进行pcr扩增的作用。有研究报道过pma-qpcr方法结合检测活的病原体含量,但仅限应用于水体中。普通的qpcr方法虽然能够对致病菌进行定量,但不能区分致病菌的死活。有研究表明致病菌在死亡后数天甚至数周内dna都能够保持完整,因此如何区分病原体的死活就成为分子检测手段的巨大挑战。
综上所述,农业生产中迫切需要构建一种重复性好、耗时短、灵敏度高的灰霉菌的分子检测方法,这对于农业生产中预防和控制疾病有着很重要的意义。
技术实现要素:
为了解决现有技术中存在的上述问题,本发明提供了一种用于定量检测灰霉菌的引物及其应用。
本发明的发明人经过大量的研究发现,通过将pma染料与定量pcr结合,使用设计的特异性的引物,可以定量检测作物(例如黄瓜)残体中的活病原体的含量和全部的灰霉菌病原体含量,再经过计算可以得到同一单位质量组织内活的灰霉菌病所占的百分比。因此,该方法的建立可以成为判断在农业生产中针对患病植株进行处理的有效性的一种手段。
本发明的第一个方面提供了一种用于定量检测灰霉菌的引物对,所述引物对含有序列表中seqidno.1和seqidno.2所示的核苷酸序列:
seqidno.1:gcgtaagacggtccatccat
seqidno.2:gcactcggcgatccagataa。
本发明的第二个方面提供了根据本发明的第一个方面的用于定量检测灰霉菌的引物对在定量检测灰霉菌中的应用。
本发明的第三个方面提供了根据本发明的第一个方面的用于定量检测灰霉菌的引物对在制备用于定量检测灰霉菌的试剂盒中的应用。
本发明的第四个方面提供了一种用于定量检测灰霉菌的试剂盒,所述试剂盒含有根据本发明的第一个方面的用于定量检测灰霉菌的引物对。
本发明的第五个方面提供了一种定量检测灰霉菌的方法,所述方法包括:
对待测样品进行pma处理,然后进行提取dna的操作,再以提取的dna为模板,用根据本发明的第一个方面的用于定量检测灰霉菌的引物对进行pma-qpcr扩增;以及,
直接对待测样品进行提取dna的操作,再以待测样品的dna为模板,用根据本发明的第一个方面的用于定量检测灰霉菌的引物对进行qpcr扩增;
根据上述的qpcr扩增和pma-qpcr扩增的结果,计算活的灰霉菌的含量。
优选地,所述根据qpcr扩增和pma-qpcr扩增的结果,计算活的灰霉菌的含量的方法如下:
y1=-3.209*lg(x1)+40.25
y2=-3.209*lg(x2)+40.25
r=x2/x1
其中,
“x1”为qpcr扩增测得的灰霉菌的起始拷贝数;“y1”为qpcr扩增的ct值;
“x2”为pma-qpcr扩增测得的活的灰霉菌的起始拷贝数;“y2”为pma-qpcr扩增的ct值;
“r”为活的灰霉菌占全部灰霉菌的比例。
优选地,所述对待测样品进行pma处理的操作包括:
将pma工作液加入经过粉碎处理的待测样品中,使得pma的终浓度达到5-20μg/ml,优选6-9μg/ml或8-12μg/ml或11-19μg/ml或12-18μg/ml或13-20μg/ml;然后光照处理3-8min,优选4-6min,进一步优选5min。
优选地,所述pma工作液为用20%的dmso配制成的1μg/μl的溶液。
优选地,所述对待测样品进行pma处理的操作在避光和低温的条件下进行,优选在避光和冰上进行。
优选地,所述qpcr扩增和pma-qpcr扩增的程序为:首先95℃3min,然后95℃1min、57℃45s、72℃1min的条件下进行35个循环。
本发明提供的用于定量检测灰霉菌的方法,创造性地将pma染料与实时定量pcr结合,从而可以准确、快速的鉴定灰霉菌并准确对活菌数进行定量。
本发明提供的用于定量检测灰霉菌的特异引物可以高效、准确地扩增出目的片段。
本发明的其他特征和优点将在如下的具体实施方式部分详细描述。
附图说明
图1是本发明实施例1中的pcr反应产物的1%琼脂糖凝胶电泳检测结果图;图中,“m”代表marker,从上到下的条带依次为600bp、500bp、400bp、300bp、200bp和100bp的条带;s1和s2均为样品条带,均在500bp位置处;ck为不含dna的阴性对照。
图2是本发明实施例1中的引物的测试结果。
图3是本发明实施例1的qpcr扩增曲线图;图中,从左到右的六束曲线分别代表5×105、5×104、5×103、5×102、5×101和5×100六个质粒稀释梯度,每束曲线有三条,分别代表每个浓度梯度有三个重复。
图4是本发明实施例1的qpcr扩增的标准曲线图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的实施方式作进一步地详细描述。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
本发明中的灰霉菌(botrytiscinerea)又称灰葡萄孢菌。
本发明的第一个方面提供了一种用于定量检测灰霉菌的引物对,所述引物对含有序列表中seqidno.1和seqidno.2所示的核苷酸序列:
seqidno.1:phmfgcgtaagacggtccatccat
seqidno.2:phmrgcactcggcgatccagataa
本发明的第二个方面涉及本发明的第一个方面提供的用于定量检测灰霉菌的引物对在定量检测灰霉菌中的应用。
本发明的第三个方面涉及本发明的第一个方面提供的用于定量检测灰霉菌的引物对在制备用于定量检测灰霉菌的试剂盒中的应用。
本发明的第四个方面涉及一种用于定量检测灰霉菌的试剂盒,所述试剂盒含有根据本发明的第一个方面提供的用于定量检测灰霉菌的引物对。
本发明的第五个方面涉及一种定量检测灰霉菌的方法,所述方法包括:
对待测样品进行pma(propidiummonoazide,叠氮溴化丙锭)处理,然后进行提取dna的操作,再以提取的dna为模板,用本发明的第一个方面提供的用于定量检测灰霉菌的引物对进行pma-qpcr扩增;以及,
直接对待测样品进行提取dna的操作,再以待测样品的dna为模板,用本发明的第一个方面提供的用于定量检测灰霉菌的引物对进行qpcr扩增;
然后根据上述的qpcr扩增和pma-qpcr扩增的结果,计算活的灰霉菌的含量。
根据本发明的第五个方面,所述待测样品优选为番茄,进一步优选为番茄叶片。
所述对待测样品进行pma处理的操作可以包括:将pma工作液加入经过粉碎处理的待测样品中,使得pma的终浓度达到5-20μg/ml,例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20μg/ml之中的任意一个或者位于任意两个之间的浓度,例如6-9μg/ml、8-12μg/ml、11-19μg/ml、12-18μg/ml和13-20μg/ml之中的任意一个范围。然后光照处理3-8min,优选4-6min,进一步优选5min。对待测样品进行粉碎处理的操作方式可以包括但不限于:将待测样品(例如患病的番茄叶片)迅速放进研钵中用液氮研磨,然后将获得的粉末转移至ep管中,再向ep管内加入pbs缓冲液,涡旋振荡使其混合均匀。所述对待测样品进行pma处理的操作优选在避光和低温的条件下进行,例如可以采用铝箔或者锡箔将上述ep管包住,并在冰上进行操作。其中,所述pma工作液可以为用20%的dmso配制成的1μg/μl的pma工作液,所述pma工作液可以在-20℃避光保存备用。
在本发明的一种具体实施方式中,可以采用如下操作方式来对待测样品进行pma处理:
将待测样品(例如,患病叶片)迅速放进研钵中用液氮研磨,然后将获得的粉末转移至ep管中,按照每50mg粉末加入1ml的pbs的量向ep管内加入pbs缓冲液,涡旋振荡;然后用铝箔纸将ep管包住,再向管内加入20%的pma工作液,使pma的终浓度达到20μg/ml;将加入了pma的ep管放入摇床中,以150r/min的转速震荡5min,再将ep管置于冰上,使用500w氯素灯照射5min,每间隔30s转动ep管,使其照射均匀。pma处理完毕后将ep管在10000rpm下离心5min,尽量去除液体后再对剩下的固体物质进行提取dna的操作。
所述提取dna的操作可以使用ctab法进行,也可以采用市售的dna提取试剂盒进行所述的提取dna的操作来提取待测样品的总dna,例如采用天根生化科技(北京)有限公司的牌号为dp305基因组提取试剂盒提取待测样品的总dna。
所述qpcr扩增和pma-qpcr扩增的程序均可以为:首先95℃3min,然后95℃1min、57℃45s、72℃1min的条件下进行35个循环(即,将95℃1min、57℃45s、72℃1min进行35个循环)。
所述qpcr扩增和pma-qpcr扩增的反应体系均可以为:实时pcr扩增预混缓冲液(不包括模板、引物的预混液,例如,购自天根生化科技(北京)有限公司的牌号为fp206的superrealpremixplus)12.5μl、seqidno.1和seqidno.2的引物各0.75μl(引物浓度均为80-120μmol/l,优选100μmol/l)、dna模板2μl(浓度可以为150-500μg/μl,优选200μg/μl),加水补足至25μl。优选地,为了便于计算活的灰霉菌的含量,所述qpcr扩增和pma-qpcr扩增中使用的dna模板的浓度相同。可以通过测定dna模板的od值的方式来调整qpcr扩增和pma-qpcr扩增中使用的dna模板的浓度,并使二者相同。
根据上述的qpcr扩增和pma-qpcr扩增的结果,计算活的灰霉菌的含量的方法如下:
y1=-3.209*lg(x1)+40.25
y2=-3.209*lg(x2)+40.25
r=x2/x1
其中,
“x1”为qpcr扩增(未经pma处理)测得的灰霉菌的起始拷贝数(即:全部的灰霉菌的数量,包括活的和死的);“y1”为qpcr扩增的ct值;
“x2”为pma-qpcr扩增(经过pma处理)测得的活的灰霉菌的起始拷贝数(即:活的灰霉菌的数量);“y2”为pma-qpcr扩增的ct值;
“r”为活的灰霉菌占全部灰霉菌的比例。
其中,ct值是指每个反应管内的荧光信号到达设定的域值时所经历的循环数,ct值与该模板的起始拷贝数的对数存在线性关系,因此,可以通过ct值计算得到模板的起始拷贝数。
例如,提取基因组时用50mg患病叶片,所以获得的拷贝数为50mg患病叶片中获得的拷贝数,加pma处理的为活的灰霉菌的数量,不加pma处理的为全部灰霉菌的拷贝数,pma处理组与非pma处理组为活的灰霉菌所占的比例。使用这种方法可以用来测定、比较农业上不同杀菌方法的杀菌效率。
以下将通过具体的实施例对本发明进行详细描述。
其中,pma为购自上海开放生物有限公司销售的biotium品牌商品。
实施例1
本实施例用来说明用于定量检测灰霉菌的特异引物对的获得和验证。
取患上灰霉菌病的黄瓜叶片,放入研钵中,加入液氮充分研磨,使用购自天根生化科技(北京)有限公司的牌号为dp305的dna提取试剂盒提取dna,调整dna溶液的浓度至200μg/μl。
使用p729+/p729-引物对,以上述提取的dna为模板,按照如下pcr扩增体系和程序进行pcr扩增:
pcr反应体系:(总体积50μl)
加ddh2o至50μl,混匀,短暂离心。
pcr反应程序:
首先,95℃3min,然后(95℃1min、57℃45s、72℃1min)进行35个循环。
其中,
pcr反应体系中的p729+/p729-引物对如下:
p729+引物:5'-agctcgagagagatctctga-3'
p729-引物:5'-ctgcaatgttctgcgtggaa-3'
对获得的pcr反应产物进行1%琼脂糖凝胶电泳检测,发现可以获得729bp大小的dna条带(结果如图1所示。图1中,“m”代表marker,从上到下的条带依次为600bp、500bp、400bp、300bp、200bp和100bp的条带;s1和s2均为样品条带,均在500bp位置处;ck为不含dna的阴性对照)。
从琼脂糖凝胶中回收纯化s1和s2的729bp位置处的dna片段,经过测序后发现具有序列表中seqidno.3所示的核苷酸序列组成,再经过blast验证发现,其与灰霉菌具有百分之百的同源性。
将从琼脂糖凝胶中回收的729bp大小的dna片段,使用天根生化科技(北京)有限公司的pgm-tfast克隆试剂盒-vt307的载体连接试剂盒连接到puc19载体上,并将载体转化大肠杆菌感受态细胞,经筛选培养后提取大肠杆菌质粒,将质粒测序后证实上述729bp大小的dna片段已经连接到载体上。
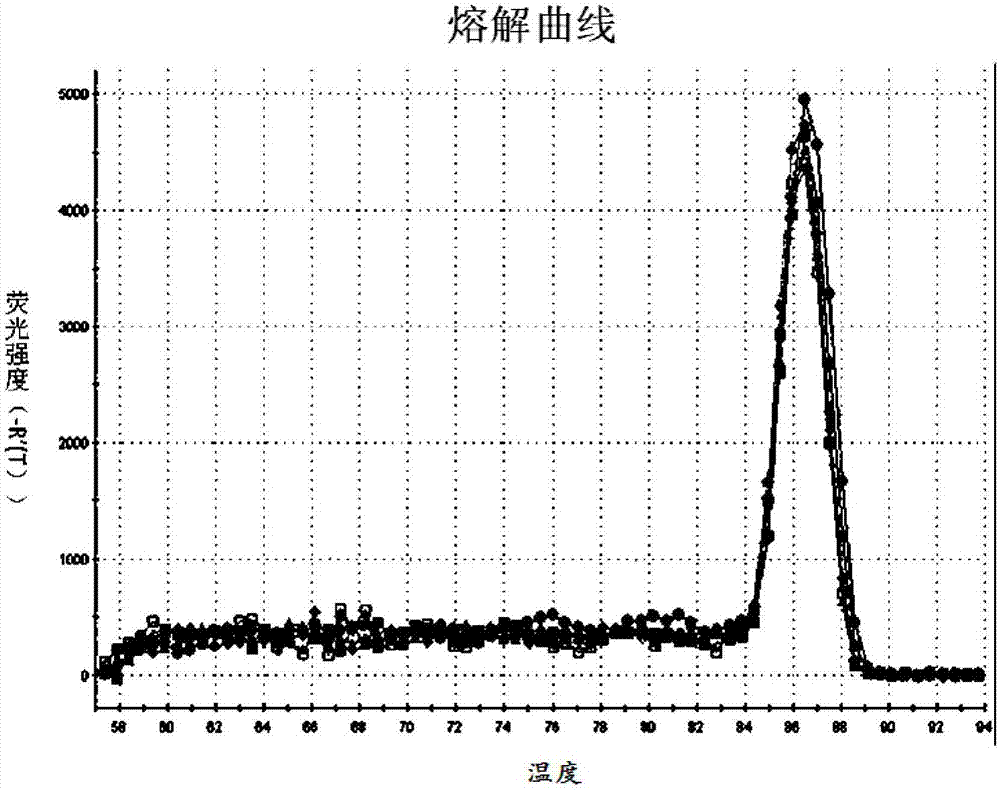
根据上述的729bp大小的dna片段的核苷酸序列组成,设计引物,引物的设计除了遵循一般原则外,还要控制pcr扩增的产物介于70bp-120bp,经测试发现上述seqidno.1和seqidno.2所示的引物对的峰值单一,无引物二聚体和非特异性扩增(结果见图2)。
提取培养后的上述转化的大肠杆菌感受态细胞的质粒,并将质粒稀释5×105、5×104、5×103、5×102、5×101和5×100六个梯度后为分别作为模板,使用上述seqidno.1和seqidno.2所示的引物对进行qpcr扩增,qpcr反应体系和反应程序如下所示:
qpcr反应体系:
qpcr反应程序:首先95℃3min,然后95℃1min、57℃45s、72℃1min的条件下进行35个循环。
上述qpcr反应体系中,seqidno.1引物和seqidno.2引物的浓度均为100μmol/l。
上述qpcr反应体系中,实时pcr扩增预混缓冲液为购自天根生化科技(北京)有限公司的货号为fp206的superrealpremixplus。
qpcr扩增曲线如图3所示,图3中,从左到右的六束曲线分别代表5×105、5×104、5×103、5×102、5×101和5×100六个质粒稀释梯度,每束曲线有三条,分别代表每个浓度梯度有三个重复。由图3可以看出,扩增曲线重复性很好(六个浓度梯度的扩增曲线走势基本一致),说明上述引物和反应体系以及反应程序可以很好地用于灰霉菌的qpcr检测。
标准曲线如图4所示,由图4可以看出,标准曲线的相关性很好,并且上述引物的扩增效率也很好。
综上可见,seqidno.1和seqidno.2所示的引物对可以高效、稳定地用于灰霉菌的dna片段的qpcr扩增,从而可以用于定量检测灰霉菌。
实施例2
本实施例用以说明本发明提供的定量检测灰霉菌的方法。
将感染灰霉菌的番茄叶片用臭氧按照在残体处理机中熏蒸灭菌的方法(这种处理方法可以杀死灰霉菌,随着处理时间的变化,杀死的灰霉菌也会增多),分别处理0分钟、20分钟、30分钟、40分钟和50分钟,收获处理后的叶片后,每个处理均按照如下方式进行处理,以定量检测灰霉菌的含量。
将番茄叶片置于研钵中,加入液氮后充分研磨;取番茄叶片粉末各50mg分别置于ep管中,其中一管按照如下方法进行pma处理,以用于pma-qpcr扩增:
向ep管中加入1ml的pbs,涡旋振荡;然后用铝箔纸将ep管包住,再向管内加入20%的pma工作液(用20%的dmso配制成的1μg/μl的pma溶液),使pma的终浓度达到20μg/ml。将加入了pma的ep管放入摇床中,以150r/min的转速震荡5分钟,再将ep管置于冰上,使用500w氯素灯照射5分钟,每间隔30s转动ep管,使其照射均匀。pma处理完毕后将ep管在10000rpm下离心5分钟,尽量去除液体后再对剩下的固体物质,按照如下方法进行提取dna的操作。
另一管直接进行提取dna的操作,以提取dna用于qpcr反应。
提取dna的操作方法如下:
将80mg的叶片粉末或者经上述pma处理后获得的固体物质使用天根生化科技(北京)有限公司的牌号为dp305的基因组提取试剂盒提取待测样品的总dna。
获得dna后,使用北京科尔德科贸有限公司的牌号为nanodrop2000的超微量分光光度计测量dna溶液的od值,并使用pbs调整使得dna的浓度均为200μg/μl(即od值相同)。
分别以上述提取的dna为模板,以如下qpcr反应程序和体系进行扩增:
qpcr扩增和pma-qpcr扩增的反应体系均为:
qpcr反应程序:首先95℃3min,然后95℃1min、57℃45s、72℃1min的条件下进行35个循环。
上述qpcr反应体系中,seqidno.1引物和seqidno.2引物的浓度均为100μmol/l。
上述qpcr反应体系中,实时pcr扩增预混缓冲液为购自天根生化科技(北京)有限公司的货号为fp206的superrealpremixplus。
根据上述的qpcr扩增和pma-qpcr扩增的结果,按照如下计算公式计算得到活的灰霉菌所占的比例:
y1=-3.209*lg(x1)+40.25
y2=-3.209*lg(x2)+40.25
r=x2/x1
其中,
“x1”为qpcr扩增(未经pma处理)测得的灰霉菌的起始拷贝数(即:全部的灰霉菌的数量,包括活的和死的);“y1”为qpcr扩增的ct值;
“x2”为pma-qpcr扩增(经过pma处理)测得的活的灰霉菌的起始拷贝数(即:活的灰霉菌的数量);“y2”为pma-qpcr扩增的ct值;
“r”为活的灰霉菌占全部灰霉菌的比例。
参数和计算结果见表1。
表1
从表1中可以看出,本实施例提供的方法可以准确、快速的测定活的灰霉菌和全部灰霉菌的起始拷贝数,进而计算得到活的灰霉菌所占的比例,并且随着处理时间的延长,活的灰霉菌所占的比例逐渐降低。
综上所述,本发明的方法可以准确、快速的测定作物中的活的灰霉菌和全部灰霉菌的起始拷贝数,进而计算出活的灰霉菌在作物上的比例。
由技术常识可知,本发明可以通过其它的不脱离其精神实质或必要特征的实施方案来实现。因此,上述公开的实施方案,就各方面而言,都只是举例说明,并不是仅有的。所有在本发明范围内或在等同于本发明的范围内的改变均被本发明包含。
序列表
<110>北京市植物保护站
<120>用于定量检测灰霉菌的特异引物及其应用
<160>3
<210>1
<211>20
<212>dna
<213>人工序列
<220>
<400>1
gcgtaagacggtccatccat20
<210>2
<211>20
<212>dna
<213>人工序列
<220>
<400>2
gcactcggcgatccagataa20
<210>3
<211>718
<212>dna
<213>灰葡萄孢菌
<220>
<400>3
atctctgaaatcaacgtctcgaaatccatcttgaatatttgtggacttgggtatggatac60
aaaaatgcgactgggatcacccgcacctaattcgtcaacgacattagggaggagccttct120
cccttggttactcagcgaccctatatcttcaatcatattgcacaatagcctcgggtcttt180
gattgttttggatataagctgtggtcatcgatggttcacattcaatatacgtttatctcg240
tatttatgttagcccaaaagaattcttctaaagttgtctcgctgttttcgtgattatcac300
ctgggttgttgctatcctttatcagtttagcgttgtggtcgtacgttctaggagctcagc360
ttataatggtgtgcacccattgtatgcaaaggtcggacctgctcacatcgcaatccatgc420
gttattgtacccccatgcccccactcaccaacgacgccaccatgcattatcgaccactac480
ttcaccctcgcacaagcgtaagacggtccatccataccccgtttctcgcaagtttctccc540
gtatcgaagacccctagatttgattttacccttcgcgtggaagatgacctggccgttcgc600
gttgttcaaaacaaggaatcgagtgtgatgtatgcaaagcgctcttatctggatcgccga660
gtgcaacggcatatcacagcaaccgtctgataggtttttccacgcagaacattgcaga718
- 还没有人留言评论。精彩留言会获得点赞!
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用