一株裂殖壶菌菌株、其构建方法及应用与流程
本发明属于生物化工领域,具体涉及利用微生物产油脂的方法,特别涉及一株可发酵共产dha、epa的裂殖壶菌菌株。
背景技术:
epa和dha是对人类生长和发育非常重要的omega-3长链多不饱和脂肪酸,具有降血脂和提高智力等功效,同时它们还可以用于预防和治疗一些疾病,例如高血压、动脉硬化、心血管疾病、老年痴呆、抗炎、抗癌等。这些脂肪酸能通过激活核过氧化物酶体增殖活化受体(ppars)来降低血清中甘油三酯的水平,以此来调节油脂在许多组织中的运输、储存和代谢。人体很难通过自身合成来满足机体对epa和dha的需求,需要从食物中摄取。
目前,主要从深海鱼类中获得所需的epa和dha,但是鱼油的可持续供应受地域和气候,还有鱼类疾病及对鱼类过度捕捞的影响,鱼油的产量和质量不稳定。其次,海洋污染日益严重,鱼类体内污染物质残留严重,如甲基水银等,纯化工艺复杂,成本高。鱼油存在特有的腥味、易于氧化且杂质较多,难以满足食品添加剂行业的需求。因此,寻找一种新的epa和dha来源已经成为单细胞油脂的研究焦点。目前常用的dha生产菌为裂殖壶菌,epa生产菌分别为shewanellasp.和photobacteriumprofundum。
裂殖壶菌是目前dha油脂的主要工业化菌种,其生长速度快,生物量可达到200g/l,油脂占细胞干重比例可达70%,其dha含量占总脂肪酸的42%左右,dpa含量占20%左右,但epa含量低于1%。目前epa的发酵生产一直未实现大规模工业化生产,常用的几种epa生产菌生物量低于裂殖壶菌,如shewanellasp.717发酵结束后生物量才达到6.2g/l;mortierellaalpineatcc32222发酵384h生物量才到20g/l;pythiumsplendensrbb-5生物量最高也仅达到42.5g/l。
目前通过培养基优化和发酵调控等方式来改变裂殖壶菌中不饱和脂肪酸的比例效果有限,尤其是epa的含量更无法调控。对于如何通过其他手段来调控菌体中不饱和脂肪酸的分布和油脂的品质成为亟需解决的问题。
裂殖壶菌通过pks酶合成长链多不饱和脂肪酸,该途径独立于经典的脂肪酸延长去饱和途径,是由一种不依赖于氧、位于细胞质中、由多结构域组成的复合酶——聚酮合酶所催化,聚酮合酶的表达受多个功能结构基因的协同控制,酰基转移酶(at)是其中一个重要的功能域,在多不饱和脂肪酸合成中能够识别并转移acp域的脂肪酰基组,在脂肪酸的富集和聚酮化合物的合成中扮演着重要的角色。
另外,氧和温度对裂殖壶菌的生长及长链多不饱和脂肪酸合成具有重要影响。高氧有利于裂殖壶菌发酵过程中菌体生长,但不利于dha的积累。低温有利于裂殖壶菌胞内多不饱和脂肪酸的积累,但不利于菌体生长。本发明提供了一种改造多不饱和脂肪酸合成的聚酮合酶的研究方法,并且通过功能域的替换获得了脂肪酸比例改善的突变菌株,并通过高转速低温驯化筛选出一株可高产epa和dha两种多不饱和脂肪酸的菌株。
技术实现要素:
本发明的目的在于克服现有技术存在的问题,提供一株可高产epa和dha两种多不饱和脂肪酸的裂殖壶菌菌株。
为实现上述技术目的,本发明采用如下技术方案:
一株裂殖壶菌菌株,其分类命名为裂殖壶菌(schizochytriumsp.)hx-rs,该菌株已于2017年2月20日保藏于中国典型培养物保藏中心,其保藏编号是cctccno:m2017046。
本发明还提供了上述菌株的构建方法,具体包括如下步骤:
(1)以裂殖壶菌(schizochytriumsp.)hx-308为原始菌株,敲除原始菌株基因组中的酰基转移酶域(at),并引入外源菌株的酰基转移酶域(at),构建重组菌株;
所述外源菌株为希瓦氏菌(shewanellasp.)scrc-2738;
(2)将步骤(1)构建的重组菌株在转速180-250rpm,温度18-25℃下驯化,筛选出生长速度快,不饱和脂肪酸含量高的菌株。
本发明所述的酰基转移酶域为具有特定功能的催化域,但其功能尚未完全确认,可以确认的是,其在微生物脂肪酸合成过程中,扮演重要角色。初步判断为其具有识别acp域的脂肪酰基组,并将其转移到胞液中释放为游离脂肪酸或者将其转移给coa变为脂酰coa。预测该催化域还能能嵌合不同的酰基coa(如乙酰coa,丙酰coa,除丙二酰coa),从而合成不同的聚酮化合物。
本发明所述的方法,所述步骤(1)中,敲除原始菌株基因组中的酰基转移酶域(at)的方法为,以酰基转移酶域(at)上下游区域作为同源重组片段,以博莱霉素抗性基因表达框作为筛选标志,对裂殖壶菌基因组中的酰基转移酶域(at)基因进行敲除;
其中,酰基转移酶域(at)上游同源臂核苷酸序列如seqidno:1所示,酰基转移酶域(at)下游同源臂核苷酸序列如seqidno:2所示。
上述步骤(1)中,所述引入外源菌株的酰基转移酶域(at)的方法为,利用酰基转移酶域(at)上下游区域作为同源重组片段,构建含有shew-at基因的表达盒的同源重组片段,shew-at基因的表达盒依次含有泛素启动子、shew-at基因和泛素终止子;shew-at基因的核苷酸序列如seqidno:3所示。
上述步骤(1)中,所述同源重组片段是通过电转的方式导入到裂殖壶菌的;其中,电转参数为0.5-0.8kv,150-200ω,45-55μf。
上述步骤(2)中,重组菌株的驯化方式为:
在含有博莱霉素抗性的平板上进行筛选,然后将筛选的重组菌转接入摇瓶,每24h转接一代,转接30-50代;
其中,平板中博莱霉素的浓度为15-45μg/ml。
本发明还提供了所述菌株hx-rs在二十碳五烯酸epa和二十二碳六烯酸dha联产中的应用,采用本发明所述的菌株可发酵获取含epa和dha的油脂。
本发明中,发明人通过对裂殖壶菌at功能域的敲除发现裂殖壶菌酰基转移酶(at)可以影响脂肪酸种类,获得的at敲除菌株细胞小而脆弱,生长极其缓慢,dpa和dha占总脂肪酸的含量分别由原来的19.87%和49.52%降到12.51%和35.20%。在此基础上,本发明将具有强启动子和外源的酰基转移酶(shew-at)的表达盒替换掉裂殖壶菌基因组上的at,构建得到的菌株经高转速,低温驯化后具有生长速度快和不饱和脂肪酸含量提高的特性,可用于联产dha和epa。
本发明获取的菌株,生理生化稳定,具有稳定的遗传性能。发酵生产含dha和epa的油脂时,生物量达到115.34g/l,产油量达到69.6g/l,epa、dha占总脂肪酸分别可达到为4.68%,51.3%。
附图说明
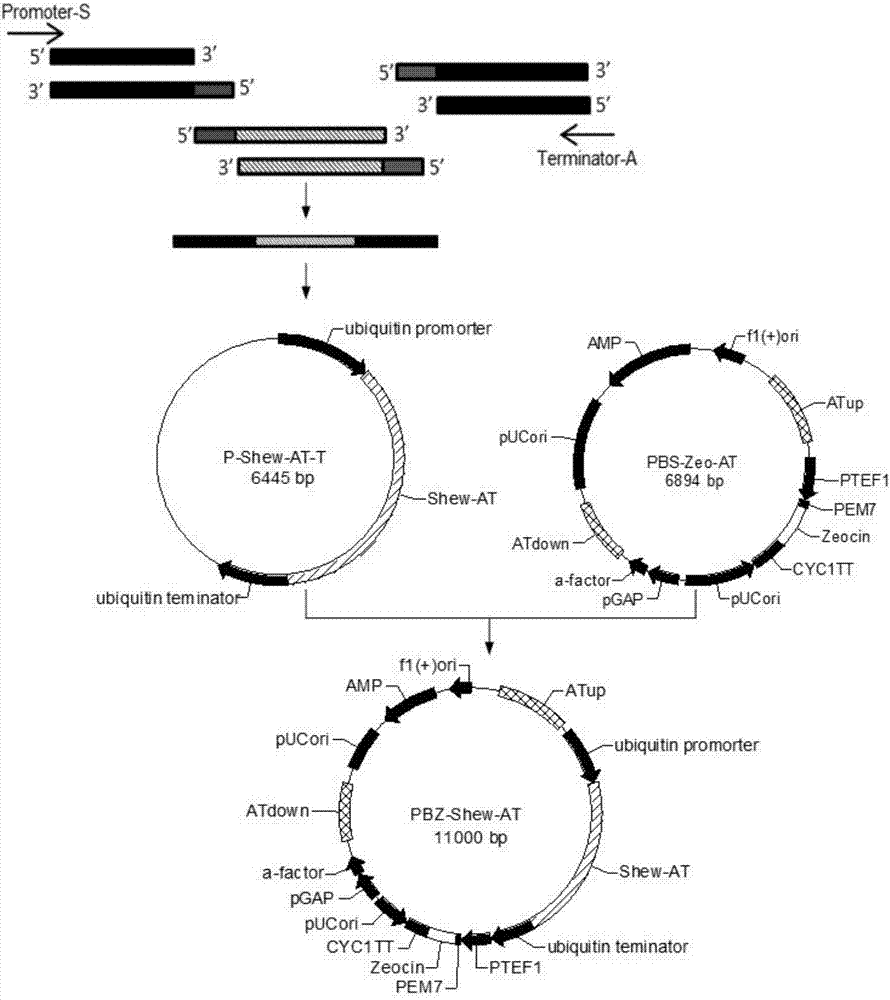
图1是质粒pbs-zeo-at的构建步骤。
图2是质粒pbz-shew-at的构建步骤。
图3是schizochytriumsp.hx-ds及原始菌株生物量变化。
图4是a原始菌株及bschizochytriumsp.hx-rs0培养2天形态图。
图5是schizochytriumsp.hx-rs0及原始菌株生物量变化。
本发明所述的生物材料,其分类命名为裂殖壶菌(schizochytriumsp.)hx-rs,已保藏于中国典型培养物保藏中心(cctcc),其保藏编号为cctccno:m2017046,保藏时间为2017年2月20日,保藏地址为:中国.武汉.武汉大学。
具体实施方式
以下实施例中所采用的培养基如下:
种子培养基:葡萄糖30-60g/l、酵母膏2-4g/l、谷氨酸钠8-15g/l、kh2po42-5g/l、cacl2·2h2o0.5-4g/l、mgcl22-5g/l、nacl10-20g/l、kcl1-4g/l、mgso4·7h2o2-6g/l、fecl30.1-0.5g/l。
发酵培养基:葡萄糖60-120g/l、酵母膏2-6g/l、谷氨酸钠15-20g/l、nacl15-20g/l、mgcl22-5g/l、(nh4)2so42-8g/l、kh2po43-6g/l、kcl1-4g/l、mgso4·7h2o3-5g/l、fecl30.1-0.5g/l。
实施例1本实施例说明本发明的生物材料来源信息
裂殖壶菌(schizochytriumsp.)hx-308,已保藏于中国典型培养物保藏中心(cctcc),其保藏编号为cctccno:m209059。
驯化后的裂殖壶菌基因工程菌schizochytriumsp.hx-rs,该菌株保藏于中国典型培养物保藏中心,其保藏编号是cctccno:m2017046。
载体pbs-zeo:本实验室自主构建。
载体pmd19-t(simple):商业载体,购于takara公司。
实施例2本实施例说明用于at功能域敲除的重组质粒pbs-zeo-at的构建
质粒pbs-zeo-at的构建步骤如图1所示。
1.获取裂殖壶菌at基因上、下游同源臂
(1)获取裂殖壶菌at基因上游同源臂
根据测序获得的at基因序列设计引物atup-s和atup-a扩增裂殖壶菌(schizochytriumsp.hx-308)的上游同源臂,并将其连接到pmd19-t载体上,得到重组质粒pmd19-atup。其中,
atup-s序列:
5’aaggaaaaaagcggccgctgctattccgtgctcctctc3’,
atup-a序列:
5’gctctagagcgccttgggcgtgatgttgag3’。
(2)获取裂殖壶菌at基因下游同源臂
根据获得的裂殖壶菌at序列设计引物atdown-s和atdown-a扩增下游同源臂。并将其连接到pmd19-t载体上,得到重组质粒pmd19-atdown。
atdown-s序列:
5’ccggaattccggtggaacaaggctctggccgt3’;
atdown-a序列:
5’cggggtaccccggacgccaggaacaaggtggg3’。
2.构建质粒pbs-zeo-atup
利用noti和xbai两个限制性内切酶对质粒pmd19-atup和pbs-zeo分别进行双酶切,然后将胶回收的atup片段连接到线性化的pbs-zeo载体上,得到重组质粒pbs-zeo-atup。
3.构建质粒pbs-zeo-at
利用ecori和kpni两个限制性内切酶对质粒pmd19-atdown和pbs-zeo-atup分别进行双酶切,然后将胶回收的atdown片段连接到线性化的pbs-zeo-atup载体上,得到重组质粒pbs-zeo-at。
实施例3本实施例说明酰基转移酶at缺陷型裂殖壶菌菌株产油脂的情况
利用noti和kpni两个限制性内切酶对质粒pbs-zeo-at进行双酶切,然后使用takara胶回收试剂盒纯化含有at上下游同源臂及博莱霉素的片段,通过电击转化到裂殖壶菌中,将转化的菌液涂布在含有得到20μg/ml博莱霉素的平板上,30℃避光培养2天,挑取阳性单菌落摇瓶培养,提取基因组进行pcr验证,并将正确的缺陷菌命名为schizochytriumsp.hx-ds。
将上述获得的工程菌接种到种子培养基中,培养条件为:温度30℃、转速170rpm,分别测定细胞干重,脂肪酸含量。与原始菌种同样条件下参数进行对比。结果见图3,表1。
表1:schizochytriumsp.hx-ds及原始菌株种子脂肪酸分布的差异对比
如图3,表1所示,裂殖壶菌at基因敲除后,细胞生长缓慢,生物量降低,培养14天时生物量仅有原始菌种2天的1/2。dha的产量从49.52%降到35.20%,
本实施例说明了裂殖壶菌的at域的改变可影响菌株脂肪酸种类的事实。
实施例4重组质粒pbz-shew-at的构建
质粒pbz-shew-at的构建步骤如图2所示。
1.泛素启动子、shew-at和泛素终止子的克隆
参照ncbi中泛素启动子,shew-at(shewanellasp.scrc-2738的at基因)和泛素终止子基因序列,由苏州金维智有限公司合成,分别以合成的质粒puc-ubiquitinpromoter,puc-shew-at和puc-ubiquitinterminator为模板,设计如下引物序列以扩增三种基因片段:
promoter-s:5’gctctagagccgttagaacgcgtaatacgactcac3’
promoter-a:5’ccgaggccttcggcgtttgctccacttcgtcttatcctcagtcatgttgg3’
shew-s:5’ccaacatgactgaggataagacgaagtggagcaaacgccgaaggcctcgg3’
shew-a:5’ttagtttagtccgacttggccttggttagacctcaccctgaaggaggtga3’
terminator-s:5’tcacctccttcagggtgaggtctaaccaaggccaagtcggactaaactaa3’
terminator-a:5’cgggatccaccgcgtaatacgactcactatagg3’
2.融合pcr连接泛素启动子、shew-at和泛素终止子,构建载体p-shew-at-t。利用融合pcr反应将dna片段泛素启动子、shew-at和泛素终止子拼接起来,从而获得三基因拼接片段,将获得片段与pmd19-t(simple)载体连接,得到重组质粒p-shew-at-t。
3.构建载体pbz-shew-at
利用xbai和bamhi两个限制性内切酶对质粒p-shew-at-t和pbs-zeo-at分别进行双酶切,然后将胶回收的shew-at基因表达盒片段连接到pbs-zeo-at中at上游同源臂与博莱霉素抗性基因片段之间,构建载体pbz-shew-at。
实施例5shew-at替换型裂殖壶菌菌株的构建
利用noti和kpni两个限制性内切酶对质粒pbz-shew-at进行双酶切,然后使用takara胶回收试剂盒纯化含有shew-at及博莱霉素的目的片段,通过电击转化到裂殖壶菌中,电击转化参数为0.5-0.8kv,150-200ω,45-55μf,将转化的菌液涂布在含有得到20μg/ml博莱霉素的平板上,30℃避光培养2天,挑取阳性单菌落摇瓶培养,提取基因组进行pcr验证,并将正确的替换菌命名为schizochytriumsp.hx-rs0。
将上述获得的工程菌接种到种子培养基中,对其种子性能进行考察,培养条件为:温度30℃、转速170rpm。分别观察细胞形态,测定细胞干重,脂肪酸含量与原始菌株同样条件下参数进行对比。结果见图4,图5,表2。
表2:schizochytriumsp.hx-rs0及原始菌株种子脂肪酸分布(占总脂肪酸含量)的差异对比
结果发现,schizochytriumsp.hx-rs0恢复了生长,培养2天后生物量可以达到31.3g/l,但还是低于原始菌株。细胞形态均一且呈花瓣状明显优于原始菌,且schizochytriumsp.hx-rs0的epa含量达到了3.84%,比原始菌株提高了72.9%。dha含量由原来的35.2%恢复到了47.2%但略低于原始菌株。
实施例6shew-at替换型裂殖壶菌菌株驯化
将实施例5获取的shew-at替换型裂殖壶菌schizochytriumsp.hx-rs0菌株,经高转速、低温进行驯化,在含有博莱霉素抗性的平板上进行筛选,每24h转接一代,转接30-50代;其中,平板中博莱霉素的浓度为15-45μg/ml,筛选转速180-250rpm,温度18-25℃。
以菌株的生物量和dha、epa含量为考核指标,筛选出20株dha、epa含量高的菌株,其中有4株菌生物量和dha、epa含量高于原始菌的10%以上,以其编号依次命名为schizochytriumsp.hx-rs0-4、schizochytriumsp.hx-rs0-6、schizochytriumsp.hx-rs0-12、schizochytriumsp.hx-rs0-16。对驯化后的4株菌进行发酵验证。将获得的4株菌在种子培养基中培养3代,再以10%(v/v)接种量将种子液接入到100ml发酵培养基中,发酵培养条件为:温度30℃、转速170rpm,待培养基中100g/l葡萄糖耗尽终止发酵,分别测定细胞干重,油脂含量以及dha和epa的含量。与原始菌株、未驯化菌株同样条件下发酵参数进行对比。结果见表3:
表3驯化菌株与原始菌株、未驯化菌株发酵结果对比
如表3所示,综合比较,经驯化获得的4株工程菌,schizochytriumsp.hx-rs0-12菌株最突出,生物量,油脂含量,dha和epa的含量均比较高。并将获得的这株菌命名为schizochytriumsp.hx-rs,即为本发明筛选的菌株。
实施例7裂殖壶菌hx-rs5l发酵罐补料发酵
将最终获得的裂殖壶菌schizochytriumsp.hx-rs种子液以10%(v/v)的接种量接入已经灭菌的装有3l发酵培养基的5l发酵罐中,发酵过程中以siliconese-2为消泡剂,于30℃、1vvm的通气比率、170rpm的搅拌转速下发酵培养5天。发酵结束时,原始菌种生物量产油量分别为102.71g/l和52.46g/l;epa、dha占总脂肪酸分别为1.41%,44.9%;epa、dha产量分别达到0.78g/l,24.8g/l。hx-rs菌株的生物量产油量分别达到115.34g/l和69.6g/l;epa、dha占总脂肪酸分别为4.68%;51.3%。epa、dha产量分别达到3.32g/l,36.4g/l。可以看到,与原始菌株相比,油脂含量提高了32.67%,epa,dha含量分别提高了69.9%,14.3%,epa、dha产量分别提高了76.3%,46.8%。
序列表
<110>南京工业大学
<120>一株裂殖壶菌菌株、其构建方法及应用
<130>xb17051003
<160>3
<170>patentinversion3.5
<210>1
<211>704
<212>dna
<213>artificialsequence
<220>
<223>1
<400>1
tgctattccgtgctcctctccgaagccgagggccactacgagcgcgagaaccgcatctcg60
ctcgacgaggaggcgcccaagctcattgtgcttcgcgccgactcccacgaggagatcctt120
ggtcgcctcgacaagatccgcgagcgcttcttgcagcccacgggcgccgccccgcgcgag180
tccgagctcaaggcgcaggcccgccgcatcttcctcgagctcctcggcgagacccttgcc240
caggatgccgcttcttcaggctcgcaaaagcccctcgctctcagcctcgtctccacgccc300
tccaagctccagcgcgaggtcgagctcgcggccaagggtatcccgcgctgcctcaagatg360
cgccgcgattggagctcccctgctggcagccgctacgcgcctgagccgctcgccagcgac420
cgcgtcgccttcatgtacggcgaaggtcgcagcccttactacggcatcacccaagacatt480
caccgcatttggcccgaactccacgaggtcatcaacgaaaagacgaaccgtctctgggcc540
gaaggcgaccgctgggtcatgccgcgcgccagcttcaagtcggagctcgagagccagcag600
caagagtttgatcgcaacatgattgaaatgttccgtcttggaatcctcacctcaattgcc660
ttcaccaatctggcgcgcgacgttctcaacatcacgcccaaggc704
<210>2
<211>690
<212>dna
<213>artificialsequence
<220>
<223>1
<400>2
tggaacaaggctctggccgttgaatttaatgcgctgcgcgaggcctggggcattccacag60
agtgtccccaaggacgagttctggcaaggctacattgtgcgcggcaccaagcaggatatc120
gaggcggccatcgccccggacagcaagtacgtgcgcctcaccatcatcaatgatgccaac180
accgccctcattagcggcaagcccgacgcctgcaaggctgcgatcgcgcgtctcggtggc240
aacattcctgcgcttcccgtgacccagggcatgtgcggccactgccccgaggtgggacct300
tataccaaggatatcgccaagatccatgccaaccttgagttccccgttgtcgacggcctt360
gacctctggaccacaatcaaccagaagcgcctcgtgccacgcgccacgggcgccaaggac420
gaatgggccccttcttcctttggcgagtacgccggccagctctacgagaagcaggctaac480
ttcccccaaatcgtcgagaccatttacaagcaaaactacgacgtctttgtcgaggttggg540
cccaacaaccaccgtagcaccgcagtgcgcaccacgcttggtccccagcgcaaccacctt600
gctggcgccatcgacaagcagaacgaggatgcttggacgaccatcgtcaagcttgtggct660
tcgctcaaggcccaccttgttcctggcgtc690
<210>3
<211>2343
<212>dna
<213>artificialsequence
<220>
<223>1
<400>3
gtggagcaaacgccgaaggcctcggccatgcccctccgtattgcgctcattctcctcccc60
accccgcagtttgaggtcaacagcgtcgatcagtcggtgctcgccagctaccagaccctc120
cagcccgagctcaatgccctcctcaacagcgcgcccacccccgagatgctcagcattacc180
atctcggacgacagcgatgccaattcgttcgagtcgcaactcaacgcggccacgaatgcg240
atcaataacggctacatcgtgaaacttgccacggccacccacgccctcctcatgcttccg300
gcgctcaaggccgcgcagatgcgtatccacccgcatgcccaactcgccgccatgcagcag360
gcgaaaagcacccccatgagccaggtctcgggtgagctcaagctcggcgccaacgccctt420
agcctcgcccagacgaacgccctcagccatgcgctcagccaggccaagcgcaatctcacc480
gacgtctcggtgaacgaatgtttcgagaacctcaagagcgagcagcaattcacggaggtg540
tactcgctcattcagcagcttgcgtcgcgtacccatgtgcgcaaggaggtcaaccagggt600
gtcgaactcggtcccaagcaggccaagtcgcactactggttcagcgagttccatcagaac660
cgcgtcgccgcgatcaactttatcaatggccagcaggcgacgtcgtacgtgctcacgcag720
ggctcgggtcttctcgccgcgaagagcatgcttaatcagcagcgcctcatgttcatcctc780
cccggcaactcgcagcagcaaattacggcgtcgattacgcagcttatgcagcagctcgaa840
cgcctccaggtgacggaggtcaacgaactttcgctcgagtgccagcttgagctcctctcg900
attatgtacgataacctcgtcaacgcggacaagcttacgacccgcgactcgaaacccgcg960
taccaggcggtgatccaagcctcgtcggtgtcggcggccaagcaggaactttcggccctc1020
aacgatgccctcaccgcgctctttgccgagcagaccaacgcgacgagcacgaacaagggt1080
ctcatccagtacaagacccccgccggcagctaccttaccctcacccccctcggctcgaac1140
aacgacaacgcccaggccggtctcgcgttcgtgtaccccggtgtcggcaccgtctatgcg1200
gacatgctcaacgagctccaccagtactttcccgccctttacgcgaagctcgagcgcgag1260
ggcgatctcaaagccatgctccaggccgaagacatctatcacctcgatcccaagcacgcc1320
gcgcaaatgtcgctcggcgatctcgccattgccggcgtcggctcgtcgtacctccttacc1380
cagctcctcacggacgaattcaacatcaaaccgaacttcgccctcggttactcgatgggt1440
gaggcgtcgatgtgggcgtcgctcggtgtctggcagaatccccatgccctcatctcgaaa1500
acccagaccgaccccctctttacctcggcgattagcggcaagctcaccgcggtccgtcag1560
gcctggcagctcgacgatacggccgccgagatccagtggaactcgttcgtggtgcgctcg1620
gaggccgcgcccatcgaggcccttctcaaggactatccccacgcctacctcgcgatcatc1680
cagggcgacacgtgtgtgatcgcgggctgtgaaattcagtgtaaggccctcctcgccgcg1740
ctcggtaaacgcggcatcgcggccaatcgtgtgaccgccatgcacacccagccggccatg1800
caggagcaccagaacgtcatggacttctacctccaacccctcaaggcggagcttccgtcg1860
gagatctcgttcatttcggccgcggaccttacggccaagcaaaccgtgtcggagcaggcc1920
cttagctcgcaggtggtcgcccagtcgattgcggacaccttttgccagacgctcgacttc1980
accgcgctcgtgcaccacgcccaacatcaaggcgcgaagctctttgtggagatcggcgcc2040
gaccgtcagaactgcaccctcatcgacaaaattgtgaaacaggacggcgccagcagcgtc2100
cagcatcagccctgctgtaccgtgcccatgaacgccaagggcagccaggatatcacctcg2160
gtcatcaaggcgcttggtcagctcatctcgcatcaggtcccgctctcggtgcaacccttt2220
atcgacggcctcaagcgcgaactcaccctctgccagcttacctcgcagcagctcgcggcc2280
cacgcgaatgtcgattcgaagttcgagtcgaaccaggatcacctccttcagggtgaggtc2340
taa2343
- 还没有人留言评论。精彩留言会获得点赞!