一种为肺癌提供离体个体化药物测试的方法及培养基与流程
本发明属于细胞生物学与药理学领域,涉及一种为肺癌提供离体个体化药物测试系统的建立及培养基。
背景技术:
肺癌是中国和世界范围内最常见也是死亡率最高的恶性肿瘤,是危害人类健康的头号杀手。肺癌按病理分型可分为非小细胞肺癌(nsclc)和小细胞肺癌(sclc),约占所有肺癌的80%和20%。非小细胞肺癌中,鳞癌约占20%-35%,腺癌约占30%-45%。肺癌确诊时多数患者分期较晚是影响肺癌预后的重要原因,而早期肺癌可以通过多学科综合治疗实现较好的预后,可以得到更好的临床获益。nsclc的肿瘤细胞生长速度及恶性程度均比sclc低,但对放化疗不如sclc敏感。化疗是晚期nsclc综合治疗的重要手段,在肺癌的治疗中占有非常重要的地位,但有效率只有20-40%。肿瘤的多药耐药现象和临床上缺乏个体化治疗是导致化疗失败的重要原因。准确的化疗药物体外敏感性检测是制定个体化治疗方案的前提。因此如何针对性的选择化疗药物,避免无效治疗,降低患者痛苦,提高临床上的疗效日益受到越来越多科研人员和医学工作者的关注与重视。
有文献报道体外药敏的检测结果与临床治疗疗效的总体符合率约为80%,具有较高的敏感度和特异度,表明体外药敏试验与临床治疗敏感性有较好的相关性,且具有操作简易和经济可行等优势。然而体外药敏评价细胞模型也存在建立成功率低、肿瘤间质细胞混杂、无法长期培养等问题。一直以来受限于原代肿瘤细胞体外培养的技术,很难建立来源于肺癌患者的原发肿瘤细胞模型,因为这样的模型不仅需要能够在体外稳定培养,而且能反映出患者体内肿瘤细胞的特性,代表真正原发位点的肿瘤生物学特性,才能作为理想的体外药敏检测模型。从肿瘤的个体化治疗角度而言,只有在体外分离培养原代肿瘤细胞稳定传代后,才能进行更多更广泛的临床前药敏检测,结合临床经验设计药物剂量和药物组合,才能确定最优化的化疗使用方案安排临床治疗。
此外,抗肿瘤药尤其是化疗药引起的肺毒性反应严重影响患者的生存质量,甚至危及生命的化疗限制性毒性。抗肿瘤药相关肺损伤可涉及气道、胸膜、纵膈、肺血管,最常见的肺毒性是间质性肺疾病(ild)。可致肺毒性的代表肿瘤药以博来霉素、甲氨蝶呤、丝裂霉素、马利兰、洛莫司汀为首。其他可能导致ild的肿瘤药:阿糖胞苷、紫杉醇类、环磷酰胺、吉西他滨、伊立替康、奥沙利铂、长春碱、拓扑替康、多柔比星、依托泊苷,靶向药物如贝伐单抗、利妥昔单抗、曲妥珠单抗、厄洛替尼、吉非替尼。因此,增加对肺正常组织细胞的毒性评价显得尤为重要,也是未来的肺癌药敏试验个体化治疗需要优化之处。
综上所述,患者来源的癌细胞和癌旁正常细胞的培养一直以来是世界性的技术难题。如果能建立个体的肺原代上皮细胞和肺原代肿瘤细胞的体外长期培养体系,并利用该体系进行药敏检测,体外预测患者对常用化疗药物的敏感性和评价药物的安全性,将为肺癌精准化疗敏感药物的选择提供参考,尽可能地减轻毒性和副作用负担,最大限度地延长该肺癌患者的生存时间。
技术实现要素:
为了解决现有技术存在的问题,本发明提供一种用于人或哺乳动物原代正常上皮细胞和原代肿瘤细胞培养的培养基及基于该培养基为肺癌提供稳定准确可靠的离体个体化药物测试的方法。
本发明的第一方面,提供一种用于培养人或哺乳动物的原代正常上皮细胞和原代肿瘤细胞的培养基m,所述培养基m成分包括:dmem与ham’sf-12nutrientmix按体积比3:1混合的培养基,同时添加4-6%胎牛血清、1-3nm三碘甲状腺氨酸(triiodothyronine),0.4-0.65%胰岛素-转铁蛋白-硒钠(insulin-transferrin-selenium)、5-20umy-27632、9-11ng/ml表皮生长因子、0.3-0.5μg/ml氢化可的松、0.5-1.5nm霍乱毒素、0.4-0.6μg/ml两性霉素b、35-45μg/ml庆大霉素,激活素a(activina)5-20ng/ml及3ug/ml重组人r-spondin-1。
本发明的第二方面,提供一种短期内快速增殖的肺癌病人肺上皮细胞和肿瘤细胞的原代分离培养和传代培养的方法,包括如下具体步骤:
a、肺癌和癌旁组织样本的取材及其样本储存运输
a1、样本标准:肺癌患者手术样本(适宜手术患者,切除的癌组织及癌旁组织样品至少1×1×1cm3)或活检、穿刺小样本(不适宜手术患者,纤支镜或ct引导经皮穿刺可获得的小样本),涵盖各临床分期;
a2、样本储存运输:洁净室条件下,严格按照无菌操作标准,将手术样本或小样本收集保存于试管中,根据样本量大小添加样本收集液,一般为3-5ml,样本收集液为含2%青/链霉素和100ug/ml制霉菌素的pbs,样本可用于直接分离培养或长期液氮保存;样本直接分离培养时可先放置于4℃冰箱,但保存不宜超过48小时;样本储存于液氮前,需加入覆盖样本体积的冰浴后的pbs缓冲液清洗两次,每次10秒左右,用无菌镊子将清洗干净的样本放入新培养皿中,用眼科剪剪碎至米粒大小,加入1ml样本冻存液,移液器转移保存于细胞冻存管,放入程序降温盒中,-80℃冰箱过夜冷藏,次日可转移至液氮中长期储存,所述样本冻存液为胎牛血清(10099-141,gibco)与二甲基亚砜(dmso,(ch3)2so)溶液按体积比为9:1配制;需要运输的样本在经过-80℃冰箱过夜冷藏后可放入体积合适的泡沫盒,加入足量的运输干冰,密封冰冻运输;
b、对来自于肺癌和癌旁组织样本的肺上皮细胞和肿瘤细胞的原代分离培养:
b1、分离培养前的实验室准备:使超净工作台处于开机状态,并打开紫外灯,工作30-60分钟后,关闭紫外灯,打开调风机调节风量大小,保证工作区内的风速始终处于理想状态后开始实验;准备五个60mm或100mm细胞培养皿(伽马射线消毒灭菌,无热源、无rna酶、无dna酶),标记为①②③④⑤,按照顺序摆放,在②号培养皿加入10ml无水乙醇(分析纯),③、④号培养皿分别加入冰浴的10mlpbs缓冲液;
b2、配制消化液:所述消化液为含0.2mg/ml胶原酶/透明质酸酶混合液的培养基m;
b3、样本直接分离培养:
b3.1、将样本放置①号培养皿,依次在②号培养皿无水乙醇和③、④号培养皿pbs缓冲液清洗,然后分别将肺癌和癌旁组织样本放入⑤号无菌培养皿中,用无菌的眼科剪将组织尽可能剪碎,大小1-2mm3体积为宜,剪碎过程中滴加适量pbs缓冲液维持样本组织活性;
b3.2、在⑤号无菌培养皿中加入含步骤2.2所配制消化液,分别消化剪碎后的肺癌和癌旁组织样本;
b3.3、分别将步骤2.3.2处理后的肺癌和癌旁组织样本低速离心去除上清,速度为1000prm,时长为8分钟;
b3.4、分别将步骤2.3.3处理后的肺癌和癌旁组织样本沉淀室温条件下重悬于2-5ml,浓度为0.25%胰酶/edta中消化;
b3.5、加入于胰酶/edta2倍体积的含10%fbs的dmem培养基终止消化,分别用无菌的一次性塑料枪头反复吹打肺癌和癌旁组织样本,时长为1分钟;
b3.6、分别用70μm细胞筛过滤细胞悬液,收集过滤后的细胞悬液,1000prm低速离心,时长为10分钟去除上清;
b3.7、分别重悬步骤2.3.6中的正常细胞沉淀和肿瘤细胞沉淀于pbs缓冲液中清洗,收集清洗后的细胞悬液,1000prm低速离心,时长为5分钟去除上清;
b3.8、分别重悬步骤b3.7中的正常细胞沉淀和肿瘤细胞沉淀于培养基m中,接种于培养瓶培养,静置培养36-48小时后显微镜观察拍照记录细胞克隆生长情况;
或者,
b3’、当样本为运输样本和液氮储存样本时的分离培养
b3’.1、复苏时需要在40℃医用恒温水箱中快速溶解,经75%医用消毒酒精擦拭后生物传递窗传送至细胞培养室;
b3’.2、取15ml离心管加入适量pbs缓冲溶液,移液器移取溶解后的含样本的冻存液至离心管中,1000rpm低速离心5分钟,小心移去含冻存液的上清,并严格执行收到新鲜组织样本的所有实验操作b3.1-b3.8;
c、建立大量扩增肺癌病人肺原代上皮细胞和肺原代肿瘤细胞的传代培养:
c1、试剂配制:配备dmem培养基、hbss缓冲溶液、0.25%胰蛋白酶/edta、0.02%edta等,用hbss缓冲溶液与0.25%胰蛋白酶/edta配制成0.05%胰蛋白酶/edta(对细胞伤害更低的细胞解离试剂),pbs缓冲溶液与胎牛血清以9:1的体积比配制成10%的消化终止液;
c2、当细胞培养瓶中培养的人肺原代上皮细胞和肺原代肿瘤细胞增殖至70-90%丰度时,用1xpbs缓冲液洗涤细胞两次,再用0.05%胰酶/edta消化单层细胞2-5分钟;
c3、含10%fbs的dmem培养基中和消化反应,1000prm低速离心3-4分钟去除上清;
c4、以1:2,1:3,1:4或1:5比例分别重悬正常细胞沉淀和肿瘤细胞沉淀于培养基m中接种培养,比例的选择只要维持细胞贴壁和正常生长即可。
进一步地,本发明提供了上述建立的肺癌病人肺原代上皮细胞和原代肿瘤细胞的体外培养体系在药物或其联用组敏感性筛选的方法,包括如下具体步骤:
s1、当细胞培养瓶中培养的人肺原代上皮细胞和原代肿瘤细胞处于对数生长期时,用0.05%胰蛋白酶/edta消化3-5分钟,消化终止液终止消化,1000rpm低速离心3-5分钟,分别用培养基m制备成单细胞悬液,通过台盼蓝与细胞悬液1:1混匀细胞计数仪检测细胞数量与活力,每孔100μl细胞悬液接种于96孔板,细胞数为6000-8000个/孔,放入37℃二氧化碳培养箱培养;
s2、次日吸去孔内溶液加药(根据2016年版中国临床肿瘤学会(csco)原发性肺癌诊疗指南,选择其中常用的化疗药物或小分子靶向药物等进行处理),每孔加入200μl含不同浓度药物的培养基;药物浓度梯度可按照实验需求设置,每种药物的每个梯度设置5-6个复孔,同时设置细胞对照组(同体积细胞培养基替代)及空白对照组(同体积pbs缓冲液替代)每组设置6个复孔;
s3、根据实验需求进行一定时间的药物处理,移去板内溶液,每孔加入含有10μlckk-8检测试剂的无血清dmem培养基100μl,包含各实验组、对照组和空白组;
s4、在37℃二氧化碳细胞培养箱继续孵育1-1.5小时,孵育时间跟细胞量的多少相关,具体时间可根据液体颜色变化确定,吸光度最大范围控制在1.0-1.5;
s5、用酶标仪在450nm处测定的吸光度;
s6、所有数据经统计软件graphpadprism6和calcusyn2进行统计学分析和作图,计算单药和其联用组的半数抑制浓度、量效关系方程、回归系数、不同抑制率时的剂量浓度,输出并保存图形和数据。
本发明的第三方面,提供了上述建立的肺癌病人肺原代上皮细胞和原代肿瘤细胞的体外培养的细胞在药物或其联用组敏感性筛选中的应用。
本发明的有益效果体现在:
1、本发明建立了基于培养基m的个体的肺原代上皮细胞和肺原代肿瘤细胞的体外长期培养体系,并利用该体系进行药敏检测,获得了一套完整的技术流程,实现体外同时预测患者对常用化疗药物的敏感性和评价药物的安全性,为肺癌精准化疗敏感药物的选择提供参考,最大程度地减轻毒性和副作用负担,最大限度地延长该肺癌患者的生存时间。
2、本发明建立了个体的肺原代上皮细胞和肺原代肿瘤细胞的体外长期培养体系,可以在细胞水平上再评价已上市药物的药效或探索其新的临床获益率;
3、作为药物研发与测试新系统,通过该系统的开发和应用有可能提高药物进入临床的有效率。
附图说明
图1是建立肺癌个体化治疗-药敏试验检测系统的方法流程图;
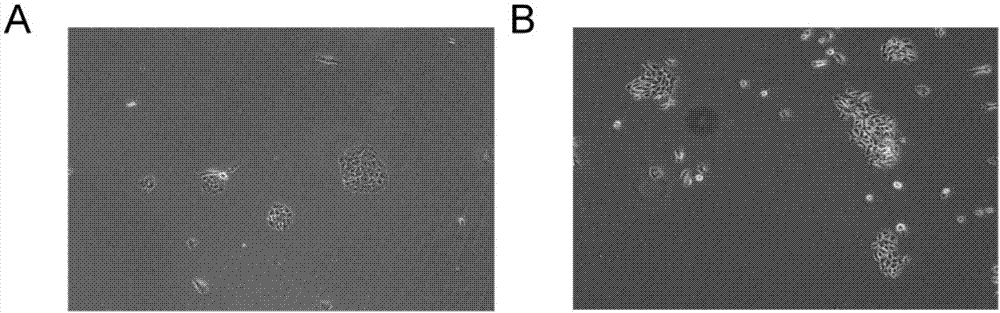
图2是原代分离培养的肺癌病人肺上皮细胞和肺肿瘤细胞形态图,
a为人肺原代上皮细胞生长到第3天的形态图,b为人肺原代肿瘤细胞生长到第3天的形态图;
图3是两周内快速扩增的肺癌病人肺原代上皮细胞和原代肿瘤细胞形态图;
a为人肺原代上皮细胞生长到第9天的形态图,b为人肺原代肿瘤细胞生长到第12天的形态图;
图4是肺癌病人肺原代上皮细胞和肺原代肿瘤细胞的传代培养的周期及获得的细胞数量统计图;
图5是肺癌病人肺原代上皮细胞和肺原代肿瘤细胞的培养体系的药敏检测结果。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
【实施例1】用于分离培养、传代培养人或哺乳动物原代上皮细胞和原代肿瘤细胞的培养基m
其组成成分包括:dmem与ham’sf-12nutrientmix按体积比3:1混合的培养基,同时添加5%胎牛血清、2nmtriiodothyronine,0.5%insulin-transferrin-selenium试剂、10umy-27632、10ng/ml表皮生长因子、0.4μg/ml氢化可的松、1.0nm霍乱毒素、0.5μg/ml两性霉素b、40μg/ml庆大霉素,activina10ng/ml及3μg/ml重组人r-spondin-1。
【实施例2】建立肺癌和癌旁组织样本的取材及其样本储存运输的操作方法
1)在病人和病人监护人知情同意的情况下,本实验所用的肺癌和癌旁组织样本均约为1cm3(立方厘米),取自医院手术切除样本,该患者的临床分期为低分化肺腺癌,无其它治疗。
2)洁净室条件下,严格按照无菌操作标准,将手术样本收集保存于试管中,根据样本量大小添加样本收集液,一般为3-5ml,样本收集液为含2%青/链霉素和100ug/ml制霉菌素的pbs,由于样本量尚可,一分为二同时尝试直接分离培养和长期液氮保存。
3)胎牛血清(10099-141,gibco)与二甲基亚砜(dmso,(ch3)2so)溶液体积比为9:1配制样本冻存液,保证最优冻存和复苏的效果。
4)准备5个60mm无菌细胞培养皿分别标记①②③④⑤,按照顺序摆放,①培养皿放入8ml无水乙醇,②、③培养皿各自放入8mlpbs缓冲液。用无菌镊子取出组织样本放入①培养皿快速清洗,2秒左右。②、③培养皿快速清洗,每次10秒左右,将清洗干净的样本放入④培养皿中,配合眼科剪分成两小份,一份放入⑤培养皿,另一份直接在④培养皿中,剪碎至米粒大小,加入1ml样本冻存液,移液器转移保存于细胞冻存管,放入程序降温盒中,-80℃冰箱过夜冷藏,次日转移至液氮中长期储存(如图1)。
【实施例3】建立短期内快速增殖的肺癌病人肺上皮细胞和肿瘤细胞的原代分离培养的方法,包括如下具体步骤:
1)进行样本直接分离培养前,使超净工作台处于开机状态,并打开紫外灯,工作30分钟后,关闭紫外灯,打开调风机调节风量大小,保证工作区内的风速始终处于理想状态后开始实验;
2)准备5个100mm无菌细胞培养皿分别标记为①②③④⑤,按照顺序摆放,在②号培养皿加入10ml无水乙醇(分析纯,易燃,远离火源),③、④号培养皿分别加入冰浴的10mlpbs缓冲液。
3)消化液的配制:含0.2mg/ml胶原酶/透明质酸酶(07912,stemcell)(终浓度为1x的混合液)的上述培养基m。根据组织的大小,加入10倍于样本体积的消化液的用量。
4)用无菌镊子将另一份新鲜肺癌组织样本放入①号培养皿中,再将组织样本放入②号培养皿中,用无水乙醇快速清洗组织1次,时间为1秒左右。用镊子将样本依次分别放入③、④号培养皿中,用pbs缓冲液清洗组织2次,每次10秒左右。
5)将组织样本放入⑤号培养皿中,用无菌的眼科剪将组织尽可能剪碎,大小1-2mm3体积为宜(剪碎过程中加入适量pbs缓冲液维持样本组织活性)。
6)移取10ml消化液至⑤号培养皿,轻微晃动培养皿使消化液与剪碎的组织微块混匀,37℃恒温二氧化碳培养箱孵育2小时(孵育过程中取出轻微混匀两到三次使组织微块充分得到消化。)
7)将孵育消化后的组织微块收集至15ml离心管中,1000rpm低速离心8分钟,小心吸去上清,加入5ml的0.25%胰酶/edta重悬细胞沉淀,置于二氧化碳培养箱再消化10分钟。(孵育过程中取出轻微混匀两到三次使细胞沉淀充分得到消化。)
8)取出后加入10ml10%fbs的dmem培养基,移液器吹打混匀成细胞悬液,用70μm细胞筛过滤细胞悬液,50ml离心管收集过滤后的细胞悬液,1000rpm低速离心10分钟,小心移去上清。
9)加入5ml的pbs缓冲液,移液器吹打混匀,1000rpm低速离心5分钟,去除上清。
10)细胞培养瓶先添加适量培养基m,将肿瘤细胞沉淀重悬于上述原代肿瘤细胞基础培养基m中,放入37℃恒温二氧化碳培养箱培养48小时后显微镜下观察细胞生长状况。
11)原代分离培养肺癌旁组织样本时,重复以上(2)-(9)操作步骤,细胞培养瓶先添加适量培养基m,将正常细胞沉淀重悬于上述原代上皮细胞基础培养基m中,放入37℃恒温二氧化碳培养箱培养48小时后显微镜下观察细胞生长状况并拍照。
12)显微镜下观察到在原代分离培养肺癌和癌旁组织样本的第3天,可明显观察到肺原代上皮细胞和原代肿瘤细胞的细胞克隆(如图2)。
【实施例4】建立大量扩增肺癌病人肺原代上皮细胞和肺原代肿瘤细胞的传代培养的方法,包括如下具体步骤:
1)配备dmem培养基、hbss缓冲溶液、0.25%胰蛋白酶/edta等,用hbss缓冲溶液与0.25%胰蛋白酶/edta配制成0.05%胰蛋白酶/edta,pbs缓冲溶液与胎牛血清以9:1的体积比配制成10%的消化终止液。
2)显微镜下观察到在肺癌和癌旁组织样本原代分离培养的第12天和第9天,细胞培养瓶中培养的人肺原代上皮细胞和肺原代肿瘤细胞增殖至约90%丰度(如图3)。
3)用1xpbs缓冲液洗涤细胞,再用0.05%胰酶/edta消化单层细胞,消化时长为3分钟。倒置显微镜观察发现约有90%的肺原代肿瘤细胞脱落,加入消化终止液1ml终止消化,移液器吹打混匀并收集细胞悬液转移至15ml的离心管中,依次加入4mlpbs缓冲液清洗培养瓶2次,一并转移至该离心管中,室温1000rpm低速离心4分钟。
4)以1:2比例重悬肿瘤细胞沉淀于培养基m中接种培养,维持细胞贴壁和正常生长。
5)剩余肿瘤细胞沉淀还可重悬于的细胞冻存液中储存于液氮中备用。
6)扩增培养肺原代上皮细胞时,重复以上(3)-(5)操作步骤。
同时绘制传代培养的周期及获得的细胞数量统计图:人肺原代上皮细胞和原代肿瘤细胞在第0天以相同细胞密度同时接种传代培养,细胞密度为4×105个/ml,在第3、7、11天时消化传代并进行细胞计数。(如图4)
【实施例5】建立肺癌病人肺原代上皮细胞和原代肿瘤细胞的体外培养体系在药物或其组合敏感性筛选的的方法,包括如下具体步骤:
1)当细胞培养瓶中培养的人肺原代上皮细胞和原代肿瘤细胞处于对数生长期时,用0.05%胰蛋白酶/edta消化3分钟,消化终止液终止消化,1000rpm低速离心4分钟,分别用培养基m制备成单细胞悬液,取出适量单细胞悬液,台盼蓝与细胞悬液1:1混匀细胞计数仪检测细胞数量与活力,每孔100μl细胞悬液接种于96孔板,细胞数为6000-8000个/孔,放入37℃二氧化碳培养箱培养;
2)次日吸去孔内溶液加药,设置单药组顺铂、紫杉醇、卡铂、吉西他滨和联用组顺铂+紫杉醇、顺铂+吉西他滨、卡铂+紫杉醇处理细胞,每孔加入200μl含不同浓度药物的培养基m。设置合理药物浓度梯度,各个药物实验组的各个梯度均设置6个复孔,同时设置细胞对照组(同体积细胞培养基m替代)及空白对照组(同体积pbs缓冲液替代)每组设置6个复孔。
3)药物统一处理48小时,移去板内溶液,每孔加入含有10μlckk-8检测试剂(ck04,东仁化学)的无血清dmem培养基100μl,包含各药物实验组、对照组和空白组。
4)在37℃二氧化碳细胞培养箱继续孵育1.5小时,酶标仪在450nm处测定的吸光度。
5)所有数据经统计软件graphpadprism6和calcusyn2进行统计学分析和作图,输出并保存图形和数据。
6)结果分析:由实验结果可知,对人肺原代肿瘤细胞药效学为:紫杉醇>顺铂>吉西他滨>卡铂,但同时对人肺原代上皮细胞的杀伤作用也较大。考虑《nccn指南》以铂为主组合化疗的标准方案,尝试药物联用的药敏检测和毒性检测,顺铂+紫杉醇和顺铂+吉西他滨的组合对对人肺原代上皮细胞的杀伤作用较大,对该个体而言卡铂+紫杉醇的组合联用效应较高,且对人肺原代上皮细胞伤害较小,可考虑为临床治疗备选方案。(如图5)
- 还没有人留言评论。精彩留言会获得点赞!