药品中耐胆盐革兰阴性菌能力验证样品及其制备方法与流程
本发明属于微生物学检测方面的质量控制领域,特别涉及一种药品中耐胆盐革兰阴性菌能力验证样品及其制备方法。
背景技术:
药品微生物学检验领域非常特殊。目前,虽然国内外已有认可机构组织药品微生物学能力验证和大规模的制备微生物能力验证样品的先例,但样品均为仅含耐胆盐革兰阴性菌的菌株,没有背景菌存在,与实际样品差异较大,且耐胆盐革兰阴性菌对温度敏感,样品的稳定性很难满足要求,即耐胆盐革兰阴性菌标准样品仍属空白领域。
耐胆盐革兰阴性菌指在胆汁酸中可以存活并繁殖的革兰阴性菌,包括肠杆菌科、假单胞菌属、气单胞菌属。肠杆菌科主要包括大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌、奇异变形杆菌和产气肠杆菌等。如果制备的耐胆盐革兰阴性菌样品中,目标菌群易发生变化(繁殖和死亡等),就会导致样品的保存期短,样品的均匀性和稳定性差。因此,综合考虑细菌的生化特性,选取性质相对稳定的菌群作为目标菌群对保证样品的均匀性和稳定性十分重要。耐胆盐革兰阴性菌样品制备的工艺技术要求比较高,并且样品的均匀性和稳定性与冻干的菌种、冻干的工艺条件、冻干保护剂的使用、再水化的介质等均有密切的关系。
药品中耐胆盐革兰阴性菌指标,直接反映着药品的卫生质量与潜在致病风险。如果药品中耐胆盐革兰阴性菌数超过一定限量,会导致患者直接感染耐胆盐革兰阴性菌,甚至有致命的风险。因此,制备均匀性与稳定性俱佳的耐胆盐革兰阴性菌样品,可以避免耐胆盐革兰阴性菌检验的随意性和不确定性,真实地反映检测实验室的能力。这对提高实验室质量控制水平,保障药品安全,甚至于打破国际贸易壁垒、提高我国药品国际竞争力都具有特殊重要的意义。
技术实现要素:
本发明的目的是克服耐胆盐革兰阴性菌测定样品中总的活的细菌数目在运输、储存和测试等过程中菌落数都可发生变化的问题,提供一种药品中耐胆盐革兰阴性菌能力验证样品,均匀性、稳定性符合能力验证要求,本发明的另一个目的是提供该样品的制备方法,工艺简单,成功率高。
本发明为实现上述目的所采用的技术方案是:药品中耐胆盐革兰阴性菌能力验证样品,其特征是:包括目标菌群与背景菌群,所述目标菌群由大肠埃希菌(e.coil)、肺炎克雷伯菌(klebsiellapnenmoniae)、阴沟肠杆菌(enterobactercloacae)、奇异变形杆菌(proteusmirabilis)、产气肠杆菌(enterobacteraerogenes)和弗氏柠檬酸杆菌(citrobacterfreundii)组成,所述背景菌群由金黄色葡萄球菌(rhodococcusequi)、蜡样芽胞杆菌(bacilluscereus)组成。
所述样品以海藻糖、脱脂奶粉和无菌水为基质,其中海藻糖的体积分数为12%、脱脂奶粉的体积分数为0.5%。
所述样品中目标菌群的目标浓度为102cfu/ml,背景菌群的目标浓度为103cfu/ml。
一种药品中耐胆盐革兰阴性菌能力验证样品的制备方法,其特征是:包括样品添加菌株的选择、冻干保护剂的配制、样品冻干、样品的均匀性和稳定性试验四个步骤,其中样品冻干过程为:菌株复苏传代—增菌—菌悬液配制—冻干和包装—储存,具体过程为:
(1)菌株复苏传代
将标准菌株接种到营养琼脂斜面培养基中,在36±1℃下使其复苏和生长,并对复苏的菌株进行鉴定;
(2)增菌
目标菌群培养至对数生长期末,背景菌群培养至稳定期,从斜面刮取菌落,加到10ml的冻干保护剂中制成相应单一菌种的菌液;
(3)菌悬液配制
将上一过程得到的菌液与冻干保护剂混合,按目标菌群的目标浓度102cfu/ml和背景菌群的目标浓度103cfu/ml配制菌悬液,分别配制6个目标菌的菌悬液和2个背景菌的菌悬液,分别按1:1体积比混合形成目标菌群悬液和背景菌群悬液,再将目标菌群悬液与背景菌群悬液按1:1体积比混合,得到混合菌悬液,置于磁力搅拌器上不断搅拌下分装到样品瓶中,加上瓶塞,但要留有空隙,不要盖实;
(4)冻干和包装
将装有混合菌悬液的样品瓶开盖放入冻干机中,冷冻干燥40~50h,当样品冷冻干燥结束后,直接进行箱内加塞,关闭机器,样品瓶中样品为真空状态;
(5)储存
将样品放置在-18℃条件下避光保存,从全部样品中随机挑选样品进行均匀性和稳定性试验,满足要求后发放给参试实验室进行实验室间比对。
所述冻干保护剂为含有海藻糖和脱脂奶粉的无菌水,其中体积分数分别为:海藻糖12%、脱脂奶粉0.5%。
所述样品的均匀性和稳定性试验按照cnas—gl03《能力验证样品均匀性和稳定性评价指南》进行。
本发明菌种的选择采用大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌、奇异变形杆菌、产气肠杆菌和弗氏柠檬酸杆菌作为耐胆盐革兰阴性菌样品的目标菌群,以金黄色葡萄球菌、蜡样芽胞杆菌作为背景菌群。众所周知,耐胆盐革兰阴性菌指在胆汁酸中可以存活并繁殖的革兰阴性菌,包括肠杆菌科、假单胞菌属、气单胞菌属。耐胆盐革兰阴性菌中的大肠埃希菌非常容易受到环境因素(特别是温度)的影响。相比而言,以肺炎克雷伯菌、阴沟肠杆菌、奇异变形杆菌、产气肠杆菌和弗氏柠檬酸杆菌作为目标菌群,可以最大程度保证测试样品的稳定性,即使在运输及储存中大肠埃希菌的含量发生变化,在统计学意义上也不会影响耐胆盐革兰阴性菌的总量。
本发明的耐胆盐革兰阴性菌能力验证样品具有以下优势特性:活的微生物、数量不发生变化、生化特征不发生变异,从满足特殊运输的条件着手,通过特殊工艺的研究、稳定性和均匀性的研究等形成一套完善的能力验证的样品制备技术,完全适合开展药品中耐胆盐革兰阴性菌(定性)项目的考核,正确评价能力验证结果。
附图说明
图1为本发明工艺流程图。
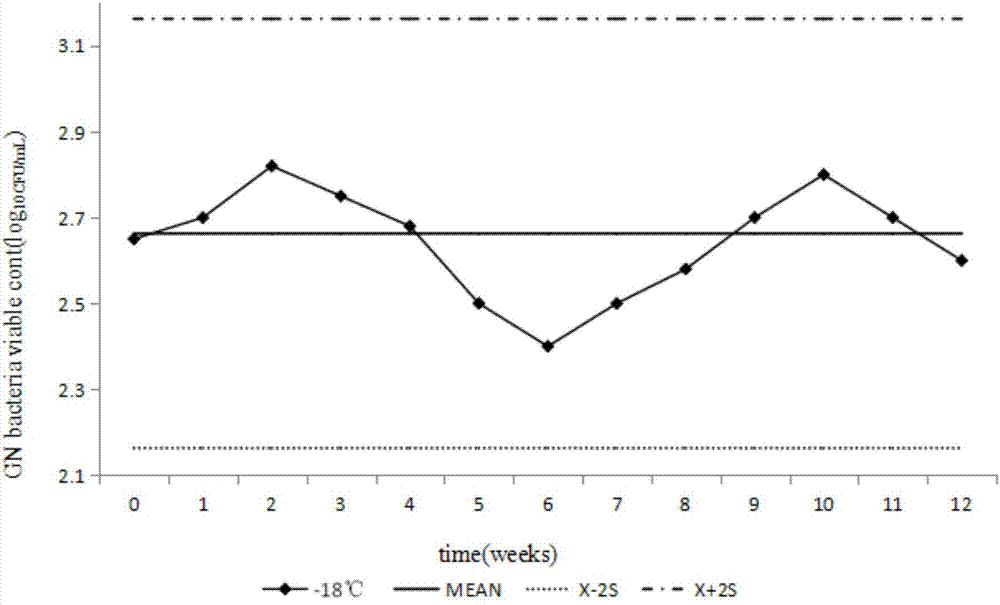
图2为4℃条件下样品耐胆盐革兰阴性菌的稳定性试验结果图。
图3为在不同温度下样品的稳定性试验结果图。
具体实施方式
下面结合附图及具体实施例对本发明作进一步详细描述,但本发明并不局限于具体实施例。
实施例1
药品中耐胆盐革兰阴性菌能力验证样品,包括目标菌群和背景菌群,所述目标菌群由大肠埃希菌(e.coil)、肺炎克雷伯菌(klebsiellapnenmoniae)、阴沟肠杆菌(enterobactercloacae)、奇异变形杆菌(proteusmirabilis)、产气肠杆菌(enterobacteraerogenes)和弗氏柠檬酸杆菌(citrobacterfreundii)组成,所述背景菌群由金黄色葡萄球菌(staphylococcusaureus)、蜡样芽胞杆菌(bacilluscereus)组成。
所述样品以海藻糖、脱脂奶粉和无菌水为基质,其中海藻糖体积分数为12%、脱脂奶粉体积分数为0.5%。
所述样品中目标菌群的目标浓度为102cfu/ml,背景菌群的目标浓度为103cfu/ml。
实施例2
如图1所示,一种实施例1中药品中耐胆盐革兰阴性菌能力验证样品的制备方法,包括样品添加菌株的选择、冻干保护剂的配制、样品冻干、样品的均匀性和稳定性试验四个步骤,具体步骤如下:
1、样品添加菌株的选择
按照目标菌群:大肠埃希菌(e.coil)、肺炎克雷伯菌(klebsiellapnenmoniae)、阴沟肠杆菌(enterobactercloacae)、奇异变形杆菌(proteusmirabilis)、产气肠杆菌(enterobacteraerogenes)和弗氏柠檬酸杆菌(citrobacterfreundii),背景菌群:金黄色葡萄球菌(staphylococcusaureus)、蜡样芽胞杆菌(bacilluscereus)选择标准菌株,所有标准菌株均购于政府指定的机构,并附有菌株证书,保证了菌株的溯源性。
2、冻干保护剂的配制
样品以海藻糖、脱脂奶粉和无菌水为基质(体积分数:海藻糖12%,脱脂奶粉0.5%)配制冻干保护剂。
3、样品冻干
(1)菌株复苏传代
将标准菌株接种到营养琼脂培养基中,在36±1℃下使其复苏和生长,并对复苏的菌株进行鉴定;
(2)增菌
目标菌群培养至对数生长期末,背景菌群培养至稳定期,从斜面刮取菌落,加到10ml的冻干保护剂中制成相应单一菌种的菌液;
(3)菌悬液配制
将上一过程得到的菌液与冻干保护剂混合,按目标菌群的目标浓度102cfu/ml和背景菌群的目标浓度103cfu/ml配制菌悬液。为保证得到的最终样品中含有以上目标浓度的菌株,本实施例中按照目标菌102cfu/ml分别配制6个目标菌的菌悬液,按1:1体积比混合,形成目标菌群悬液;背景菌按103cfu/ml配制2个背景菌的菌悬液,按1:1体积比混合,形成背景菌群悬液;背景菌群悬液与目标菌群悬液按1:1体积比混合,得到混合菌悬液,采用比浊法检查菌株含量;置于磁力搅拌器上不断搅拌下取1.0ml分装到样品瓶(西林瓶)中,加上瓶塞,但要留有空隙,不要盖实;
(4)冻干和包装
将装有混合菌悬液的样品瓶开盖放入冻干机中,冷冻干燥机参数按如下设置:
冷冻速度(coolingrate)0.5℃/min
早期冷冻点(incipientfreezingpoint)-1℃15min
冷冻温度(coolingtemperature)-40℃
共熔点(meltingpointeutectictemperature)-29℃
加热温度(heatingtemperature)20℃120min
启动冷冻干燥机,机器直接进入程序化的冷冻干燥过程,整个冻干过程40h。
当样品冷冻干燥结束后,直接进行箱内加塞;关闭机器。剔除塞子不紧的西林瓶,西林瓶中样品为真空状态;
(5)储存
将样品放置在-18℃条件下避光保存,并对保存的样品进行适当管理和检测,从全部样品中随机挑选样品进行均匀性和稳定性试验,满足要求后发放给参试实验室进行实验室间比对。
4、样品的均匀性和稳定性试验
对样品中目标菌的均匀性和稳定性检查是验证样品制备过程有效性的主要方法。检查样品均匀性和稳定性按照cnas—gl03《能力验证样品均匀性和稳定性评价指南》进行。
所得样品均匀性和稳定性检测方法及结果如下:
分别随机选取12个样品,采用sn/t1896-2007法,在重复条件测试2×12份样品的耐胆盐革兰阴性菌。结果数据用单因素方差分析(anov)进行统计处理,统计步骤及结果如下:
表1方差分析公式
上表中,
表2样品均匀性检测结果
表3样品均匀性试验方差分析结果
结论:在95%置信概率下,与其他因素对测试结果的影响相比,样品的不均匀性是可接受的。
采用两种类型的稳定性试验:一种是在短期贮存温度(4℃)下的稳定性试验,另一种是在高的温度(模拟样品的运输条件)下的稳定性试验,选用三个温度点,分别为20℃、36℃和45℃。定期检测样品,针对不同温度点不同的保存时间测试3个样本,将2×3份样品结果的均值(对数转化后)与均匀性测试结果比较,之间的绝对差值除以测试计划中能力评价用稳健标准差s*,比值小于0.3为原则确定在不同温度条件下符合能力验证样品要求的最长保存时间。稳定性试验结果见图2和图3。
实施例3
本实施例中所述的药品中耐胆盐革兰阴性菌能力验证样品的制备方法的各步骤均与实施例2中相同,不同的技术参数为:菌株培养基选用营养琼脂斜面培养基;菌悬液配制中,目标菌群悬液中各目标菌的浓度按照5×102cfu/ml配制,背景菌群悬液中各背景菌的浓度按照103cfu/ml配制;冻干过程45h。
实施例4
本实施例中所述的药品中耐胆盐革兰阴性菌能力验证样品的制备方法的各步骤均与实施例3中相同,不同的技术参数为:菌悬液配制中,目标菌群悬液中各目标菌的浓度按照4.5×102cfu/ml配制;冻干过程50h。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种检测幽门螺杆菌基因及药物代谢型的Miseq测序方法与流程
- 革兰氏阴性菌阳性血培养分离胶及化学试剂前处理方法与流程
- 一种截短侧耳素的提取方法与流程
- 一种含千金子素的千金子脂肪油‑胆盐混合胶束及其制备方法和应用与流程
- 一种噬菌蛭弧菌冻干粉的制备方法与流程
- 具有表面具备杀菌作用的散热片的热交换器、具有具备杀菌作用的表面的金属构件、利用热交换器的散热片的表面或者金属构件的表面抑制霉菌发生的方法和杀菌方法、以及具有金属构件的电热水器、饮料供应器和饭盒盖与制造工艺
- 作为抗微生物化合物的多黏菌素衍生物的制造方法与工艺
- 吉他霉素的免疫胶体金检测卡及其制备方法与制造工艺
- 一种快速提取革兰氏阳性菌基因组DNA的方法和试剂盒与制造工艺
- 爱格氏菌AUH‑JLD49s及其在3′‑去甲基‑牛蒡苷元转化中的应用的制造方法与工艺