一种天然香料γ‑癸内酯的制备方法与流程
本发明属于材料学及生物发酵工程领域,涉及一种纤维材料,具体来说是一种天然香料γ-癸内酯的制备方法。
背景技术:
γ-癸内酯(gammadecalactone),简称gdl,是一种带有桃香味的内酯类香味物质。它是一个含有五元内酯环的十碳化合物,为无色液体,分子式为c10h18o2,分子量为170.25,微溶于水,易溶于有机溶剂,被广泛用于配制奶油、桃子、柑橘和椰子等型香精中,是香料中需求较大的产品之一。随着γ-癸内酯在香料香精行业的广泛应用,很多香料公司将兴趣投向了这一潜在市场并开始进行研发,使得γ-癸内酯的生物转化生产有了快速发展,天然γ-癸内酯的售价也由20000美元/kg降至1000美元/kg(2014年)。
以蓖麻油酸为底物,利用发酵法制备γ-癸内酯的生产工艺,目前存在的最大问题是:由于蓖麻油酸具有难溶于水的特性,其在水中的分散性较差,这就导致蓖麻油酸分子在水相介质中向酵母细胞内进行转运的过程受到极大限制,酵母与底物接触不充分,致使酵母对底物的利用率降低,最终严重影响γ-癸内酯的生成速率和产量。据目前相关文献及专利报道,为了解决上述发酵过程中存在的问题,一般采用两种方式来解决:(1)向发酵液中添加表面活性剂,以增强底物在水相中的分散性,而表面活性剂的加入虽然有利于底物在水相中的分散,提升底物向细胞内的运输速率,但其不利于细胞的正常生长,甚至高浓度的表面活性剂还会抑制酵母细胞活性,使γ-癸内酯的产量不能得到较大提升;(2)向发酵液中添加高浓度蓖麻油酸进行生物转化。高浓度蓖麻油酸的添加有助于增加水相中底物的有效浓度,一定时期内可提升γ-癸内酯的生成量,但水相中过高浓度的蓖麻油酸对酵母细胞具有较为明显的抑制作用,不利于酵母细胞活性的维持,使最终γ-癸内酯的总产量没有较大提升,同时较大量的底物添加量增加了γ-癸内酯生产的一次性投入成本,不利于产品的工业放大。
因此,建立一种生物毒性低及生物相容性好并且对底物分散性具有积极促进作用的转化体系,用于γ-癸内酯的生物转化,成为目前该产品向产业化发展的必然趋势。
技术实现要素:
针对现有技术中的上述技术问题,本发明提供一种天然香料γ-癸内酯的制备方法,所述的这种γ-癸内酯的制备方法要解决现有技术中的方法制备γ-癸内酯的生成速率和产量低的技术问题。
本发明提供了一种天然香料γ-癸内酯的制备方法,包括如下步骤:
1)一个对改性纤维材料进行处理的步骤,先用粉碎机将改性纤维粉碎,然后利用20、50、80或者120目的筛子对改性纤维进行筛选;
2)一个制备包埋物的步骤,将步骤1)中筛选出的改性纤维与蓖麻油酸按质量比1:0.5-2混合,在30℃-60℃的温度下水浴0.5-1.5h,并持续搅拌,获得包埋物;
3)一个制备转化培养基的步骤,所述的转化培养基由七水硫酸镁、磷酸氢二钾、甘油、l-肉碱和水组成,在所述的转化培养基中,七水硫酸镁的浓度为7-14g/l,磷酸氢二钾的浓度为7-14g/l,甘油的浓度为8-18g/l,l-肉碱的浓度为0.08-0.2g/l,所述的转化培养基的ph为6.0-6.8;
4)一个加入包埋物的步骤,将步骤2)的包埋物按照45-150g/l的量加入到上述步骤(3)的转化培养基中,加入后使得蓖麻油酸的浓度为30-50g/l;
5)一个灭菌的步骤,将上述步骤4)中含有包埋物的转化培养基于115~130℃的温度下湿热灭菌15min;
6)一个接菌的步骤,将高活性酵母粉加入到步骤5)的物料中,菌种接种量为10-20g/l;
7)一个转化培养的步骤,转化培养过程中的摇瓶条件为:转速为200-300r/min,温度为22-33℃,转化50-90h;转化培养过程中的发酵罐条件为:转速为300-600r/min,温度为22-33℃,转化50-90h,通气量3.0-6.0v▪v-1▪m-1,发酵结束后获得γ-癸内酯。
进一步的,所述改性纤维是一种对油脂具有较强吸附能力并对酵母细胞无毒害作用的天然来源纤维。
进一步的,所述改性纤维是经过粉碎后筛选出20-120目范围内的用于包埋蓖麻油酸的改性纤维颗粒。
进一步的,所述的高活性的酵母粉为市售安琪高糖型高活性干酵母。
本发明提供了一种提高底物分散性且进一步提高γ-癸内酯产量的方法,本发明通过将底物蓖麻油酸包埋进入改性纤维,再利用包埋物进行γ-癸内酯生产。所述方法中所采用的包埋物(改性纤维-蓖麻油酸)具有两个优点:(1)提高底物在水中的分散性;(2)对底物具有缓释作用,降低高浓度底物对细胞的抑制作用。
本发明是一种通过将蓖麻油酸与打碎的不同粒径的纤维颗粒混合在一起进行包埋处理,通过酵母生物转化蓖麻油酸制备天然香料γ-癸内酯的方法。改性纤维主要包括纤维素醚类、纤维素酯类和改性纤维素的接枝共聚物。同时纤维表面布满一些纳米级和微米级的小孔,具有很强的吸附能力和简单的脱附能力。本发明所使用的改性纤维(购自上海古阳实业有限公司,型号:gy131)是一种经过改性处理的纤维材料,所以当改性纤维在吸附蓖麻油酸饱和以后,再投入发酵液,一是对底物起到了一定的分散作用,使酵母细胞更有利于吸附到油滴表面;二是改性纤维会对蓖麻油酸具有一种缓释作用,同时也降低了底物对于细胞的抑制作用。
本发明是以一定粒径大小的改性纤维和蓖麻油酸形成的包埋物为底物,利用高活性酵母发酵制备天然γ-癸内酯。实验结果表明,经过改性纤维包埋的实验组γ-癸内酯产量可达8.2g/l,比对照组5.1g/l提高了60.7%。本发明提供的方法相比常规油水两相的发酵体系具有以下优势:(1)有助于提升产物生成速率;(2)缩短发酵周期;(3)能够缓解底物蓖麻油酸对酵母细胞的抑制作用,使细胞活性能够达到较好的状态,从而较大地提高了γ-癸内酯的一次积累量。
本发明与已有技术相比,其技术进步是显著的。本发明能够打破常规的油水两相的发酵体系,提升了产物生成速率,缩短了发酵周期,更重要的是能够缓解底物蓖麻油酸对酵母细胞的抑制作用,从而较大地提高了γ-癸内酯的一次积累量,具有良好的工业应用前景。
附图说明
图1是实施例1和2、5和6、9和10的实施例方法获得的用不同粒径改性纤维包埋底物和对照的产物生成柱状图。
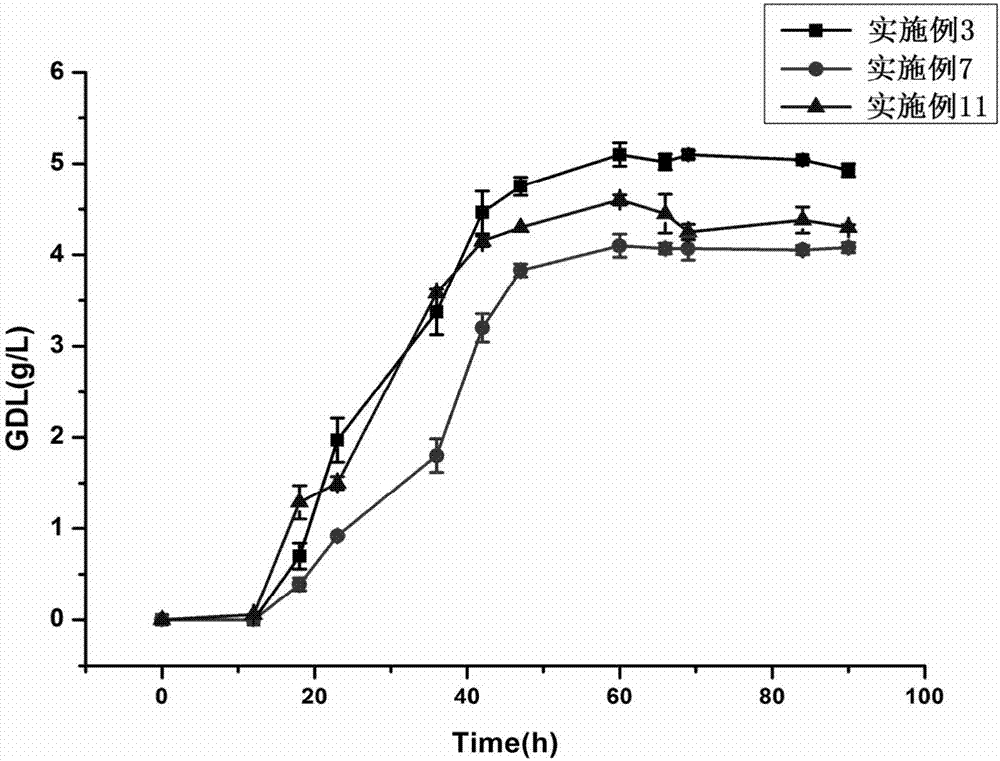
图2是实施例3、7和11的实施例方法获得的不用改性纤维包埋底物的对照的产物生成曲线。
图3是实施例4、8和12的实施例方法获得的用最佳粒径改性纤维包埋底物的产物生成曲线。
图4是实施例3、7和11的实施例方法获得的不用改性纤维包埋底物的对照的底物消耗曲线。
图5是实施例4、8和12的实施例方法获得的用最佳粒径改性纤维包埋底物的底物消耗曲线。
图6是实施例3的实施例方法获得的对照实验转化18h时发酵液中油滴和酵母的显微镜图。
图7是实施例4的实施例方法获得的用最佳粒径改性纤维包埋底物转化18h时发酵液中油滴和酵母的显微镜图。
具体实施方式
实施例1对照实验
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例的技术方案进行清楚、完整地描述。本发明的实施例首先提供一种天然香料γ-癸内酯的制备方法的对照实施例,包括如下步骤:
配制转化培养基:蓖麻油酸40g/l,七水硫酸镁10g/l,磷酸氢二钾10g/l,甘油15g/l,l-肉碱0.12g/l,ph为6.4,将培养基装入250ml摇瓶中,装液量50ml;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉15g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)0.75g,并接入摇瓶中;转化培养:摇瓶放入恒温摇床,转化条件为:转速250r/min,温度28℃,转化时间60h,得到含有γ-癸内酯的发酵液;检测:按摇瓶中发酵液的体积的三倍加入无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为3.5g/l。
实施例2底物包埋对γ-癸内酯转化的影响
改性纤维材料的处理:用粉碎机将改性纤维(购自上海古阳实业有限公司,型号:gy131)粉碎,利用20、50、80、120目的筛子筛选纤维,将<20目的,20-50目的,50-80目的,80-120目的纤维颗粒分别筛选出来;包埋:将筛选出的不同目数的改性纤维与蓖麻油酸按质量比1:1混合,50℃水浴1小时,并持续搅拌;转化培养基配制:七水硫酸镁10g/l,磷酸氢二钾10g/l,甘油15g/l,l-肉碱0.12g/l,ph为6.4,将培养基装入250ml摇瓶中,装液量50ml;包埋物的加入:依据蓖麻油酸40g/l,包埋物加入量为4g;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉15g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)0.75g,并接入摇瓶中;转化培养:摇瓶放入恒温摇床,转化条件为转速250r/min,温度28℃,转化时间60h,得到含有γ-癸内酯的发酵液;检测:按摇瓶中发酵液的体积的三倍加入无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时用80-120目改性纤维包埋底物的摇瓶发酵液中γ-癸内酯的含量最高,为5g/l。
实施例3生物发酵罐转化对照实验
配制转化培养基:蓖麻油酸40g/l,七水硫酸镁10g/l,磷酸氢二钾10g/l,甘油15g/l,l-肉碱0.12g/l,ph为6.4,5l罐装液量3l;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉15g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)45g,并接入发酵罐中;转化培养:搅拌转速400r/min,温度28℃,通气量4.0v▪v-1▪m-1,转化时间90h,得到含有γ-癸内酯的发酵液;检测:取样时将转速调高到600r/min,用移液管取10ml,加入三倍体积的无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为5.1g/l。
实施例4生物发酵罐底物包埋转化实验
选择改性纤维:将实施例2中效果最好的一组选出,选择其对应目数的改性纤维(购自上海古阳实业有限公司,型号:gy131);包埋:将筛选出的改性纤维与蓖麻油酸按质量比1:1混合,50℃水浴1小时,并持续搅拌;转化培养基配制:七水硫酸镁10g/l,磷酸氢二钾10g/l,甘油15g/l,l-肉碱0.12g/l,ph为6.4,5l罐装液量3l;包埋物的加入:依据蓖麻油酸40g/l,包埋物加入量240g;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉15g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)45g,并接入发酵罐中;转化培养:搅拌转速400r/min,温度28℃,通气量4.0v▪v-1▪m-1,转化时间90h,得到含有γ-癸内酯的发酵液;检测:取样时将转速调高到600r/min,用移液管取10ml,加入三倍体积的无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为8.2g/l。
实施例5对照实验
配制转化培养基:蓖麻油酸30g/l,七水硫酸镁7g/l,磷酸氢二钾7g/l,甘油8g/l,l-肉碱0.08g/l,ph为6.0,将培养基装入250ml摇瓶中,装液量50ml;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉10g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)0.5g,并接入摇瓶中;转化培养:摇瓶放入恒温摇床;转化条件为:转速200r/min,温度22℃,转化时间60h,得到含有γ-癸内酯的发酵液;检测:按摇瓶中发酵液的体积的三倍加入无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为2.6g/l。
实施例6底物包埋对γ-癸内酯转化的影响
改性纤维材料的处理:用粉碎机将改性纤维(购自上海古阳实业有限公司,型号:gy131)粉碎,利用20、50、80、120目的筛子筛选纤维,将<20目的,20-50目的,50-80目的,80-120目的分别筛选出来;包埋:将筛选出的不同目数的改性纤维与蓖麻油酸按质量比1:2混合,30℃水浴0.5小时,并持续搅拌;转化培养基配制:七水硫酸镁7g/l,磷酸氢二钾7g/l,甘油8g/l,l-肉碱0.08g/l,ph为6.0,将培养基装入250ml摇瓶中,装液量50ml;包埋物的加入:依据蓖麻油酸30g/l,包埋物加入量为2.25g;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉10g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)0.5g,并接入摇瓶中;转化培养:摇瓶放入恒温摇床,转化条件为转速200r/min,温度22℃,转化时间60h,得到含有γ-癸内酯的发酵液;检测:按摇瓶中发酵液的体积的三倍加入无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时用80-120目改性纤维包埋底物的摇瓶发酵液中γ-癸内酯的含量最高,为3.6g/l。
实施例7生物发酵罐转化对照实验
配制转化培养基:蓖麻油酸30g/l,七水硫酸镁7g/l,磷酸氢二钾7g/l,甘油8g/l,l-肉碱0.08g/l,ph为6.0,5l罐装液量3l;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉10g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)30g,并接入发酵罐中;转化培养:搅拌转速300r/min,温度22℃,通气量3.0v▪v-1▪m-1,转化时间90h,得到含有γ-癸内酯的发酵液;检测:取样时将转速调高到600r/min,用移液管取10ml,加入三倍体积的无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为4.1g/l。
实施例8生物发酵罐底物包埋转化实验
选择改性纤维:将实施例6中效果最好的一组选出,选择其对应目数的改性纤维(购自上海古阳实业有限公司,型号:gy131);包埋:将筛选出的改性纤维与蓖麻油酸按质量比1:2混合,30℃水浴0.5小时,并持续搅拌;转化培养基配制:七水硫酸镁7g/l,磷酸氢二钾7g/l,甘油8g/l,l-肉碱0.08g/l,ph为6.0,5l罐装液量3l;包埋物的加入:依据蓖麻油酸30g/l,包埋物加入量135g;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉10g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)30g,并接入发酵罐中;转化培养:搅拌转速300r/min,温度22℃,通气量3.0v▪v-1▪m-1,转化时间90h,得到含有γ-癸内酯的发酵液;检测:取样时将转速调高到600r/min,用移液管取10ml,加入三倍体积的无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为6.2g/l。
实施例9对照实验
配制转化培养基:蓖麻油酸50g/l,七水硫酸镁14g/l,磷酸氢二钾14g/l,甘油18g/l,l-肉碱0.2g/l,ph为6.8,将培养基装入250ml摇瓶中,装液量50ml;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉30g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)1.5g,并接入摇瓶中;转化培养:摇瓶放入恒温摇床,转化条件为:转速300r/min,温度33℃,转化时间60h,得到含有γ-癸内酯的发酵液;检测:按摇瓶中发酵液的体积的三倍加入无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为3.2g/l。
实施例10底物包埋对γ-癸内酯转化的影响
改性纤维材料的处理:用粉碎机将改性纤维(购自上海古阳实业有限公司,型号:gy131)粉碎,利用20、50、80、120目的筛子筛选纤维,将<20目的,20-50目的,50-80目的,80-120目的分别筛选出来;包埋:将筛选出的不同目数的改性纤维与蓖麻油酸按质量比1:0.5混合,60℃水浴1.5小时,并持续搅拌;转化培养基配制:七水硫酸镁14g/l,磷酸氢二钾14g/l,甘油18g/l,l-肉碱0.2g/l,ph为6.8,将培养基装入250ml摇瓶中,装液量50ml;包埋物的加入:依据蓖麻油酸50g/l,包埋物加入量为7.5g;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉30g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)1.5g,并接入摇瓶中;转化培养:摇瓶放入恒温摇床,转化条件为转速300r/min,温度33℃,转化时间60h,得到含有γ-癸内酯的发酵液;检测:按摇瓶中发酵液的体积的三倍加入无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时用80-120目改性纤维包埋底物的摇瓶发酵液中γ-癸内酯的含量最高,为4.5g/l。
实施例11生物发酵罐转化对照实验
配制转化培养基:蓖麻油酸50g/l,七水硫酸镁14g/l,磷酸氢二钾15g/l,甘油20g/l,l-肉碱0.2g/l,ph为6.8,5l罐装液量3l;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉30g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)90g,并接入发酵罐中;转化培养:搅拌转速600r/min,温度33℃,通气量6.0v▪v-1▪m-1,转化时间90h,得到含有γ-癸内酯的发酵液;检测:取样时用移液管取10ml,加入三倍体积的无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为4.6g/l。
实施例12生物发酵罐底物包埋转化实验
选择改性纤维:将实施例10中效果最好的一组选出,选择其对应目数的改性纤维(购自上海古阳实业有限公司,型号:gy131);包埋:将筛选出的改性纤维与蓖麻油酸按质量比1:0.5混合,60℃水浴1.5小时,并持续搅拌;转化培养基配制:七水硫酸镁14g/l,磷酸氢二钾14g/l,甘油18g/l,l-肉碱0.2g/l,ph为6.8,5l罐装液量3l;包埋物的加入:依据蓖麻油酸50g/l,包埋物加入量450g;灭菌:121℃,湿热灭菌15min;接菌:灭完菌待冷却后,依据酵母粉30g/l,在无菌条件下称取高活性酵母粉(购自安琪酵母股份有限公司,型号:食品级)90g,并接入发酵罐中;转化培养:搅拌转速600r/min,温度33℃,通气量6.0v▪v-1▪m-1,转化时间90h,得到含有γ-癸内酯的发酵液;检测:取样时用移液管取10ml,加入三倍体积的无水乙醇,充分震荡摇匀,取样处理进行气相色谱法检测,得到发酵液中γ-癸内酯的含量。测得60h时发酵液中γ-癸内酯的含量为7.1g/l。
底物、产物检测方法如下:
1、γ-癸内酯的气相色谱检测方法:色谱柱为hp-5,载气为n2,选择恒定流量的进样方式,进样量为0.2ul,进样口和检测器温度分别为250℃和300℃,柱温箱的升温程序为:初始温度120℃保持2min,30℃/min升温到205℃,再4℃/min升温到215℃,再20℃/min升温到280℃,保持5min。
2、蓖麻油酸的高效液相色谱检测方法:色谱柱为c18柱,uvd检测器,检测波长为205nm,柱温为25℃,进样量为2.0ul,流动相及其比例为含0.1%磷酸的水:甲醇=5:95,流速为0.8ml/min。
发酵液镜检方法:
1、发酵液镜检方法:取发酵液,涂于载玻片,盖玻片覆盖时确保无气泡,在显微镜下观察发酵液中细胞和油滴的形态与分布并拍照。
- 还没有人留言评论。精彩留言会获得点赞!