一种利用固有荧光核苷酸超灵敏同时检测多种DNA糖基化酶的方法与流程
本发明涉及dna糖基化酶检测技术领域,具体涉及一种利用固有荧光核苷酸超灵敏同时检测多种dna糖基化酶的方法。
背景技术:
内源性dna损伤是各种内部和环境因素作用的结果,会引起dna突变和复制错误,进一步引发癌症。碱基切除修复(ber)是处理由氧化、烷基化和脱氨基所引起的内源性dna碱基损伤的主要修复途径。ber通路由dna糖基化酶引发,它可以催化损伤/错配碱基的切割,并产生作用于下游ber修复过程的脱嘌呤/脱嘧啶位点。
dna糖基化酶的异常表达与人类疾病密切相关,对dna糖基化酶的准确检测对于了解dna损伤修复过程和临床诊断有重要意义。传统的dna糖基化酶检测方法中,放射性标记的方法灵敏度偏低,而且同位素标记探针会引起放射性污染;凝胶电泳方法灵敏度低,需要样品量大,对操作技巧要求高,不适合定量分析;酶联免疫吸附法和免疫印迹法需要与蛋白结合的特异性抗体,操作步骤繁琐。色谱法定性能力较差,当被分离物极性相差较小时分离效果不好,洗脱时使用溶剂较多,造成溶剂浪费;链霉亲和素顺磁珠捕获技术需要分离步骤,操作程序复杂,无法进行均相检测,并且标记较为昂贵。荧光方法具有安全、简单、灵敏度高的独特优点。然而,荧光方法依赖于用荧光团和猝灭剂进行外部标记,用于均相测定,涉及到复杂的设计且费用高。此外,目前所报道的荧光方法仅能检测到单一类型的dna糖基化酶。事实上,所有的哺乳动物会表达多种dna糖基化酶来维持基因组的稳定,每种dna糖基化酶具有底物特异性。多种dna糖基化酶,如hogg1和udg,都参与ber途径处理内源性dna碱基损伤,而hogg1和udg的异常表达对于分析多种类型的癌症具有深刻的意义。因此,开发同时检测多种dna糖基化酶的方法,能为解释dna损伤修复过程和提高早期临床诊断准确性提供新机会。
技术实现要素:
针对上述现有技术,本发明的目的是提供一种利用固有荧光核苷酸超灵敏同时检测多种dna糖基化酶的方法。
本发明通过2-氨基嘌呤(2-ap)和吡咯-脱氧胞苷(p-dc)作为荧光基团,dna分子作为固有猝灭剂,结合外切酶协助的循环信号放大同时检测多种dna糖基化酶的快速、灵敏的荧光方法,不需要额外的荧光基团和猝灭基团标记,不仅达到实现简单、直观、高灵敏度、检测实际样本的目的,更重要的是实现了多种dna糖基化酶同时检测。
为实现上述目的,本发明采用如下技术方案:
本发明的第一方面,提供一种用于同时检测多种dna糖基化酶的探针组合,包括:双功能dna探针、触发探针1、触发探针2、2-ap信号探针和p-dc信号探针;
所述双功能dna探针的核苷酸序列如seqidno.1所示;
触发探针1的核苷酸序列如seqidno.2所示;
触发探针2的核苷酸序列如seqidno.3所示;
2-ap信号探针的核苷酸序列如seqidno.4所示;
p-dc信号探针的核苷酸序列如seqidno.5所示。
本发明的第二方面,提供上述探针组合在制备同时检测多种dna糖基化酶的试剂盒或芯片中的用途。
本发明的第三方面,提供一种同时检测多种dna糖基化酶的试剂盒,该试剂盒中包含上述的探针组合。
进一步的,本发明的试剂盒中还包括:反应缓冲液、nb.btsi内切酶和lambda核酸外切酶。
优选的,所述反应缓冲液中含有:10×neb缓冲液2、bsa、10×udg反应缓冲液、10×lambda核酸外切酶反应缓冲液。
本发明的第四方面,提供一种同时检测hogg1和udg的方法,步骤如下:
(1)将双功能dna探针、触发探针1和触发探针2在含有nacl、tris-hcl和edta的缓冲液中孵育,孵育后冷却,形成三明治杂交dna底物;
(2)分别将2-ap信号探针和p-dc信号探针在含有mgcl2和tris-hcl的缓冲液中孵育,孵育后冷却,使2-ap信号探针和p-dc信号探针折叠,形成发夹结构;
(3)向反应缓冲液中加入三明治杂交dna底物和待检测样品,孵育,孵育后加入步骤(2)中形成发夹结构的2-ap信号探针和p-dc信号探针,以及nb.btsi内切酶和lambda核酸外切酶,黑暗条件下继续孵育,将孵育后的反应产物分别在365nm和450nm处进行荧光强度检测,分别用于hogg1和udg的定量分析。
步骤(1)中,孵育的温度为95℃,孵育的时间为5min。
优选的,步骤(1)中,所述缓冲液中含有50毫摩尔每升nacl,10毫摩尔每升tris-hcl(ph8.0)和1毫摩尔每升乙二胺四乙酸(edta)。
步骤(2)中,孵育的温度为95℃,孵育的时间为5min。
优选的,步骤(2)中,所述缓冲液中含有1.5毫摩尔每升氯化镁(mgcl2)和10毫摩尔每升tris-hcl(ph8.0)。
步骤(3)中,孵育的温度为37℃,孵育的时间为60min。
步骤(3)中,黑暗条件下孵育的温度为37℃,孵育的时间为60min。
本发明的第五方面,提供上述探针组合或试剂盒在筛选dna糖基化酶抑制剂中的用途。
本发明的有益效果:
(1)本发明通过巧妙地设计双功能探针,可实现对多种dna糖基化酶的同时检测。
迄今为止的文献报道,只能检测单一的糖基化酶。本发明成功设计了一个有一个8-氧代鸟嘌呤和五个尿嘧啶碱基修饰的双功能dna探针,它可以与触发探针1和触发探针2杂交,形成hogg1和udg作用的三明治杂交dna底物,通过以下两个步骤:1)hogg1引发的8-氧代鸟嘌呤切除修复和udg引发的尿嘧啶切除修复,2)lambda核酸外切酶介导的信号探针的循环切割和荧光信号的释放,能够同时检测这两种糖基化酶,并能保证很好的特异性。
(2)不需额外的荧光染料标记。
传统的荧光方法依赖于用荧光团和猝灭剂进行外部标记,涉及到复杂的设计且标记费用高。本发明使用2-ap和p-dc作为荧光基团,dna分子作为固有猝灭剂,由于碱基之间有效的堆积相互作用,2-ap和p-dc在掺入双链dna时表现出弱荧光,但经过nb.btsi内切酶和lambda核酸外切酶切割,释放出游离的2-ap和p-dc分子,使得荧光信号显著增强。与传统的分子信标相比,2-ap和p-dc荧光的猝灭是由于与相邻碱基的更有效的堆叠相互作用,避免了使用较大的有机猝灭剂。另外,2-ap和p-dc可以标记在信号探针的任何位置,在2-ap(365纳米)和p-dc(450纳米)的发射光谱之间没有明显的光谱重叠和串扰。
(3)不需要复杂的dna扩增步骤,即可达到信号放大的目的,且灵敏度高。
传统的dna扩增需要设计模板、引物,加入原料,还需要有热力学循环,这样使得实验复杂,反应时间长,耗费劳动力。本发明设计了lambda核酸外切酶介导的信号探针的循环切割和荧光信号的放大。触发探针与双功能探针分离后,与信号探针结合,通过酶切,释放游离的荧光分子,同时,触发探针又可以与新的信号探针结合,形成了切割-消化-杂交的新循环,实现了触发探针的重复利用和荧光信号的放大,提高了灵敏度。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
图1:2-ap和p-dc的归一化吸收和发射光谱;图中:曲线1为2-ap吸收光谱;曲线2为2-ap发射光谱;曲线3为p-dc吸收光谱;曲线4为p-dc发射光谱。
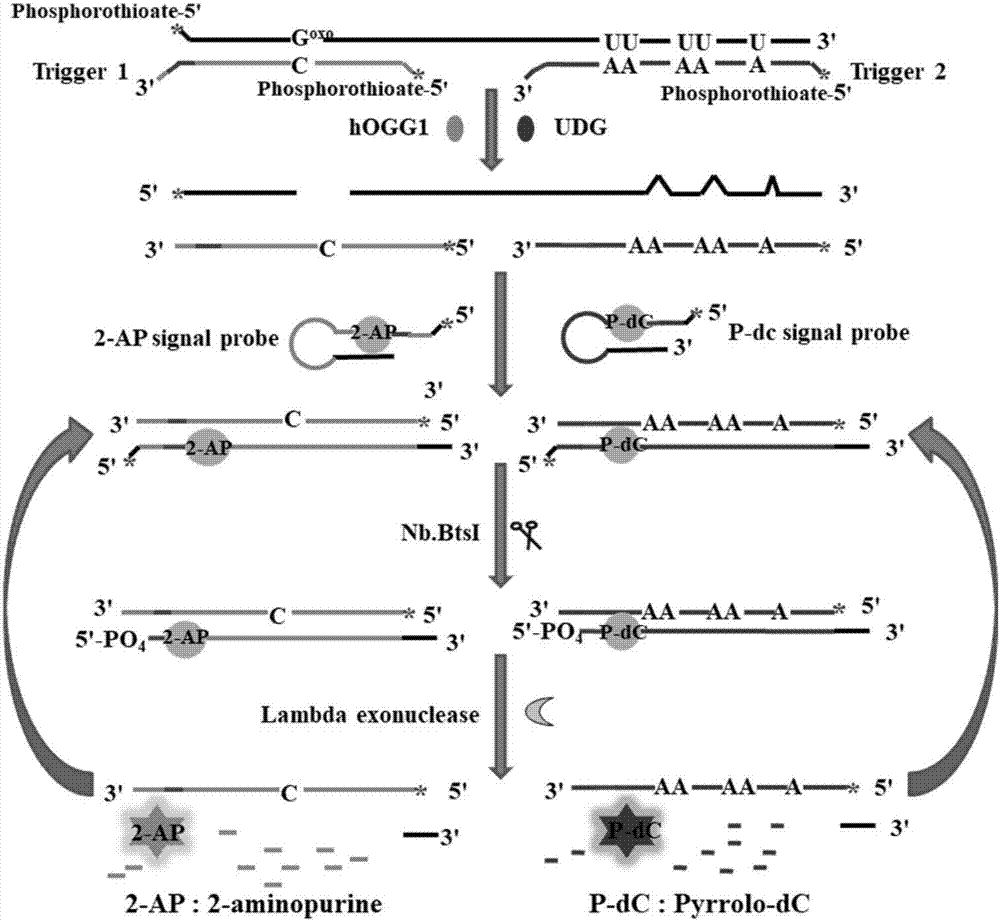
图2:本发明同时检测多种dna糖基化酶的原理图。
图3:(a)存在hogg1(曲线1)和不存在hogg1(曲线2)的情况下2-ap的归一化荧光发射光谱。(b)存在udg(曲线3)和不存在udg(曲线4)的情况下p-dc的归一化荧光发射光谱。(c)存在和不存在hogg1和udg的情况下,2-ap和p-dc的归一化荧光发射光谱。hogg1浓度为32u每毫升,udg浓度为50u每毫升。
图4:(a)不同浓度的hogg1对应的归一化的荧光发射光谱图。(b)365纳米处的归一化荧光强度随hogg1浓度变化的曲线。内置图为365纳米处的归一化荧光强度与hogg1浓度的对数线性图,线性范围从0.005u每毫升至1u每毫升。(c)不同浓度的udg对应的归一化的荧光发射光谱图。(d)450纳米处的归一化荧光强度随udg浓度变化的曲线。内置图为450纳米处的归一化荧光强度与udg浓度的对数线性图,线性范围从0.005u每毫升至5u每毫升。误差棒表示三组实验的标准偏差。
图5:特异性检测。hogg1浓度为32u每毫升,udg浓度为50u每毫升,tdg浓度为100u每毫升。f和f0分别是存在和不存在dna糖基化酶时的荧光信号。误差棒表示三组实验的标准偏差。
图6:动力学分析。(a)对于hogg1,初始速度随着dna底物浓度的变化。(b)对于udg,初始速度随着dna底物浓度的变化。误差棒表示三组实验的标准偏差。
图7:实际样品分析。(a)365纳米处的归一化荧光强度与hela细胞数之间的线性关系。hela细胞数分别为5,10,100,1000,10000个细胞。(b)450纳米处归一化荧光强度与hela细胞数之间的线性关系。细胞数分别为5,10,100,1000,10000个细胞。误差棒表示三组实验的标准偏差。
图8:抑制剂分析。(a)hogg1对于不同浓度5-fu的相对活性的变化。(b)udg对于不同浓度5-fu的相对活性的变化。hogg1浓度为32u每毫升,udg浓度为50u每毫升。误差棒表示三组实验的标准偏差。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,现有技术中荧光方法仅能检测到单一类型的dna糖基化酶。基于此,本发明提出了一种利用固有荧光核苷酸超灵敏同时检测多种dna糖基化酶的方法。
在本申请的一种实施方案中,提供了一种用于同时检测多种dna糖基化酶的探针组合,包括:双功能dna探针、触发探针1、触发探针2、2-ap信号探针和p-dc信号探针;
所述双功能dna探针的核苷酸序列如seqidno.1所示;
触发探针1的核苷酸序列如seqidno.2所示;
触发探针2的核苷酸序列如seqidno.3所示;
2-ap信号探针的核苷酸序列如seqidno.4所示;
p-dc信号探针的核苷酸序列如seqidno.5所示。
具体如下:
*表示硫代磷酸酯修饰。双功能dna探针中加粗的g和u碱基分别表示损伤的鸟嘌呤(8-氧代鸟嘌呤)和尿嘧啶脱氧核糖核苷酸。双功能dna探针的下划线区域和下划线斜体区分别与表示触发探针1和触发探针2的结合序列。触发探针1的下划线加粗区域和触发探针2的下划线斜体加粗区域表示与双功能dna探针的结合序列。2-ap信号探针和p-dc信号探针中的箭头表示nb.btsi内切酶的识别位点。2-ap信号探针和p-dc信号探针的加粗区域表示该发夹探针内的互补区域。
在本申请的另一种实施方案中,提供了一种同时检测hogg1和udg的方法,步骤如下:
(1)将双功能dna探针、触发探针1和触发探针2在含有nacl、tris-hcl和edta的缓冲液中,在95℃下孵育5分钟,然后缓慢冷却到室温以形成三明治杂交dna底物;
(2)分别将2-ap信号探针和p-dc信号探针在含有mgcl2和tris-hcl的缓冲液中,95℃孵育5分钟,然后缓慢冷却至室温使2-ap信号探针和p-dc信号探针折叠形成发夹结构;
(3)向反应缓冲液中加入三明治杂交dna底物和待检测样品,37℃孵育60分钟,孵育后加入步骤(2)中形成发夹结构的2-ap信号探针和p-dc信号探针,以及nb.btsi内切酶和lambda核酸外切酶,黑暗中37℃继续孵育60分钟,将孵育后的反应产物分别在365nm和450nm处进行荧光强度检测,分别用于hogg1和udg的定量分析。
本申请以hogg1和udg作为模型,以2-ap和p-dc作为荧光基团,结合外切酶协助的循环信号放大技术,开发了一种同时检测多种dna糖基化酶的快速、灵敏的荧光方法。dna分子作为固有猝灭剂,由于碱基之间有效的堆积相互作用,一些荧光的核苷酸类似物如2-ap和p-dc在掺入双链dna(dsdna)时表现出弱荧光,但在溶液中游离时荧光显著增强。与传统的分子信标相比,2-ap和p-dc荧光的猝灭是由于与相邻碱基的更有效的堆叠相互作用,避免了使用较大的有机猝灭剂。另外,2-ap和p-dc可以标记在信号探针的任何位置,在2-ap(365纳米)和p-dc(450纳米)的发射光谱之间没有明显的光谱重叠和串扰(图1)。我们设计了一个有一个8-氧代鸟嘌呤和五个尿嘧啶碱基修饰的双功能dna探针,它可以与触发探针杂交,形成hogg1和udg作用的三明治杂交dna底物,从而能够区别hogg1和udg与其他dna糖基化酶。在hogg1和udg存在时,通过循环的lambda外切核酸酶消化来启动信号扩增过程,产生不同的荧光信号,其中2-ap指示hogg1,p-dc指示udg。本方法能够高灵敏度、高选择性的同时检测多种dna糖基化酶,甚至可以在单细胞水平上测定dna糖基化酶。
本申请的检测原理(图2)为:我们设计了一个有一个8-氧代鸟嘌呤和五个尿嘧啶碱基修饰的双功能dna探针,它可以与触发探针1和触发探针2杂交,形成hogg1和udg作用的三明治杂交dna底物。触发探针1和触发探针2都具有包含nb.btsi内切酶的识别位点的3'突出末端。上述探针的5'末端均用硫代磷酸酯修饰以防止lambda核酸外切酶消化。2-ap信号探针和p-dc信号探针是发夹结构,有茎、环两部分,其中2-ap荧光基团和p-dc荧光基团标记在茎中,5'突出末端用硫代磷酸酯修饰。由于碱基的堆积相互作用,2-ap信号探针和p-dc信号探针都显示出弱荧光,但在溶液中游离时荧光显著增强。2-ap信号探针和p-dc信号探针的5'末端含有nb.btsi内切酶的识别位点,当形成双链dna(dsdna)时可被nb.btsi内切酶识别。
此方法包括两个步骤:(1)hogg1引发的8-氧代鸟嘌呤切除修复和udg引发的尿嘧啶切除修复,(2)lambda核酸外切酶介导的信号探针的循环切割和荧光信号的释放。hogg1可以促进从三明治杂交dna底物中的8-氧代鸟嘌呤/胞嘧啶碱基对中去除受损的8-氧代鸟嘌呤,随后水解无碱基位点的3'-磷酸二酯键,导致双功能探针与触发探针1分离并释放触发探针1。释放的触发探针1可以与2-ap信号探针杂交以形成具有nb.btsi内切酶识别位点的新的稳定的双链dna。通过nb.btsi内切酶切割2-ap信号探针,产生可使lambda核酸外切酶切割的位点。通过lambda核酸外切酶消化双链dna释放游离的2-ap分子和触发探针1,触发探针1可以与新的2-ap信号探针杂交,引发切割-消化-杂交的新循环,产生大量游离的2-ap分子,在发射波长365纳米处的荧光强度显著增强。类似地,udg可以切除三明治杂交dna底物的五个尿嘧啶碱基,双链dna变得不稳定,导致双功能探针-触发探针2双链的解离和触发探针2的释放。释放的触发探针2可以与p-dc信号探针杂交并启动切割-消化-杂交的循环,在发射波长450纳米处的荧光强度显着增强。当同时存在hogg1和udg时,可以分别通过hogg1和udg从三明治杂交dna底物中切除一个8-氧代鸟嘌呤和五个尿嘧啶碱基,导致触发探针1和触发探针2的释放。释放的触发探针1和触发探针2可分别与2-ap信号探针和p-dc信号探针杂交,启动信号放大过程,在发射波长365纳米和450纳米处的荧光信号显着增强。在没有hogg1和udg的情况下,既不能切除8-氧代鸟嘌呤碱基,释放触发探针1,也不能切除尿嘧啶碱基,释放触发探针2。结果不会发生切割和消化反应,在2-ap和p-dc对应发射波长处没有荧光增强。
为了验证本发明技术方案的可行性,我们进行了荧光测量。在hogg1存在的情况下,观察到在发射波长365纳米处有明显的2-ap的荧光信号(图3a,曲线1),但是在450纳米的发射波长处没有观察到p-dc的荧光信号。在没有hogg1的情况下,没有观察到明显的2-ap荧光信号(图3a,曲线2)。由此表明,hogg1可以特异性地从8-氧代鸟嘌呤/胞嘧啶碱基对中切除受损的8-氧代鸟嘌呤碱基,并从双功能探针-触发探针1杂交链中释放触发探针1,启动信号放大过程,产生放大的2-ap荧光信号。在udg存在的情况下,观察到在发射波长450纳米处有明显的p-dc的荧光信号(图3b,曲线3),但没有观察到显着的2-ap荧光信号。在没有udg的情况下,没有观察到明显的p-dc信号(图3b,曲线4)。此结果表明udg可以从腺嘌呤/尿嘧啶碱基对中特异性地切除尿嘧啶,并从双功能探针-触发探针2杂交链中释放触发探针2,启动信号放大过程,并产生放大的p-dc荧光信号。值得注意的是,只有当hogg1和udg的共存时可以同时产生明显的2-ap和p-dc荧光信号(图3c,曲线1和曲线3)。这些结果清楚地表明,此实验方法可以用于同时检测多种dna糖基化酶。
为了评估本发明技术方案检测dna糖基化酶的灵敏度,我们在最佳实验条件下测定各种浓度的hogg1和udg。图4a表示的是不同浓度的hogg1对应的归一化的荧光发射光谱图。365纳米处的荧光强度随着的hogg1浓度(从0至40u每毫升)的增加而增强。此外,在hogg1浓度为0.005u每毫升至1u每毫升范围内,荧光强度与浓度呈对数线性相关(图4b的插图)。回归方程为f=0.5012+0.1552log10c,相关系数为0.9909,其中f为归一化荧光强度,c为hogg1的浓度。通过计算空白信号加3倍标准偏差,计算出检测限为0.0035u每毫升。我们所提出的方法的灵敏度与基于纳米金的比色分析(0.7u每毫升)相比,提高了2个数量级;与基于dna酶的比色测定(0.01u每毫升)相比,提高一个数量级;与exoiii辅助等温扩增荧光法(0.001u每毫升)相当。图4c表示的是不同浓度的udg对应的归一化的荧光发射光谱图。发射波长为450纳米处的荧光强度随着udg浓度(从0至50u每毫升)的增加而增强。此外,在udg浓度为0.005u每毫升至5u每毫升范围内,荧光强度与浓度呈对数线性相关(图4d的插图)。回归方程为f=0.602+0.1377log10c,相关系数为0.9902,其中f是归一化荧光强度,c是udg的浓度。计算得出检测限为0.0025u每毫升,与基于g-四倍体发光测定(0.02u每毫升)和无标记的比色法(0.02u每毫升)相比,检测限提高了一个数量级;与滚环扩增介导的dna核酶方法(0.002u每毫升)相当。
为了评估本发明技术方案检测dna糖基化酶的特异性,我们以胸腺嘧啶糖基化酶(tdg)作为干扰酶。tdg是一种单功能酶,可以从鸟嘌呤/胸腺嘧啶错配碱基对中选择性切除胸腺嘧啶。如图5所示,在hogg1和udg存在下,2-ap和p-dc的荧光信号可以同时检测到。只有hogg1存在下,仅观察到明显的2-ap的荧光信号。只有udg存在的情况下,仅观察到p-dc的荧光信号。但是仅有tdg存在时,不能观察到2-ap和p-dc的荧光信号。此结果清楚地表明该检测方法有良好的特异性。
我们进一步应用此方法来测定hogg1和udg的酶动力学参数。我们分别测量了5u每毫升hogg1和10u每毫升udg与不同浓度的三明治杂交dna底物在37℃反应10分钟的初始速度。如图6所示,hogg1(图6a)和udg(图6b)的初始速度均随着三明治杂交dna底物浓度的增加而增加。实验数据拟合为米氏方程v=vmax[s]/(km+[s]),其中vmax是最大初始速度,[s]是三明治杂交dna底物的浓度,km是米氏常数。得到hogg1的最大初速度为0.6184每秒,km为0.01472微摩尔每升,与基于单量子点的传感器所得到的一致(10.7纳摩尔每升)。udg的最大初速度为0.8981每秒,km为0.1641微摩尔每升,与通过荧光测定获得的相一致(0.12±0.02微摩尔每升)。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
实施例1:hogg1和udg的检测
(1)dna储备溶液的制备:将10微摩尔每升的双功能dna探针,10微摩尔每升的触发探针1和10微摩尔每升的触发探针2加入含有50毫摩尔每升氯化钠(nacl),10毫摩尔每升tris-hcl(ph8.0)和1毫摩尔每升乙二胺四乙酸(edta)的缓冲液中,在95℃下孵育5分钟,然后缓慢冷却到室温以形成三明治结构。将10微摩尔每升的2-ap信号探针和10微摩尔每升的p-dc信号探针分别在含有1.5毫摩尔每升氯化镁(mgcl2)和10毫摩尔每升tris-hcl(ph8.0)的缓冲液中,95℃孵育5分钟,然后缓慢冷却至室温使2-ap信号探针和p-dc信号探针折叠形成发夹结构。将获得的dna储备溶液储存在-20℃备用。
(2)hogg1和udg的荧光测定:hogg1和udg的检测包括两个连续的步骤。首先,在20微升含有2微升10×neb缓冲液2,100微克每毫升bsa,2微升10×udg反应缓冲液中加入0.4微升10微摩尔每升的三明治杂交dna底物,加入不同浓度的hogg1和udg,37℃孵育60分钟。然后,将0.8微升10微摩尔每升的2-ap信号探针和p-dc信号探针,3unb.btsi,2ulambda核酸外切酶,3微升10×lambda核酸外切酶反应缓冲液加入反应体系中,加超纯水至总体积30微升,在黑暗中37℃孵育60分钟。用超纯水将30微升反应产物稀释至终体积为60微升。使用日立f-7000荧光分光光度计(日本,东京)测量荧光光谱,记录2-ap和p-dc的光谱。2-ap和p-dc的激发波长分别为310纳米和350纳米,发射波长分别为365纳米和450纳米。发射波长处的荧光强度分别用于hogg1和udg的定量分析。
实施例2:实际样品分析
利用人宫颈癌细胞(hela)进行hogg1和udg的检测。
1.试验方法:
(1)细胞培养和细胞提取物的制备:将人宫颈癌细胞系(hela)放入含有10%胎牛血清(fbs)和1%青霉素-链霉素的dulbecco改良的eagle培养基(dmem),在37℃,含5%co2的潮湿气氛中培养。细胞数由countstar细胞计数器计数。使用核提取试剂盒(activemotif)根据说明书进行细胞提取物的提取。
(2)按实施例1的方法对细胞提取物中的hogg1和udg进行检测。
2.试验结果:
对于hogg1,归一化的荧光强度随着hela细胞数量增加而增加,在5至10000个细胞的范围内呈线性相关(图7a)。回归方程为f=0.3803+0.1473log10n,相关系数为0.9855,其中f为归一化荧光强度,n为hela细胞数。通过计算空白信号加3倍标准偏差,得出检测限为4个细胞,与基于单个量子点的方法相当(5个细胞)。对于udg,归一化荧光强度与细胞数在5至10000个细胞呈线性相关(图7b)。回归方程为f=0.2760+0.1724log10n,相关系数为0.9931,其中f为归一化荧光强度,n为hela细胞数。计算出检测限为3个细胞,这与酶介导的等温扩增荧光方法相当(3个细胞)。此结果清楚地表明,该方法可用于在实际样品中定量检测多种dna糖基化酶,具有进一步应用于临床诊断的巨大潜力。
实施例3:dna糖基化酶抑制剂分析
我们选择5-氟尿嘧啶(5-fu)作为抑制剂进行研究。一些化学药物如5-fu和庆大霉素可与dna糖基化酶相互作用并影响其活性。其中5-fu是最广泛用于治疗各种肿瘤的化疗药物。
将不同浓度的5-氟尿嘧啶(5-fu)与三明治杂交dna底物在25℃孵育15分钟,然后加入hogg1和udg,37℃孵育60分钟。随后的反应过程和荧光测量遵循上述步骤。根据公式:
来计算dna糖基化酶的相对活性(ra)。其中f0是不存在hogg1或udg的荧光强度,ft是存在32u每毫升hogg1或50u每毫升udg时的荧光强度,而fi是在hogg1和5-fu存在下或在udg和5-fu存在下的荧光强度。从ra曲线和5-fu浓度可得到ic50值。
我们用ic50值评估5-fu对hogg1和udg的抑制作用。ic50值是酶活性降低50%时所需的抑制剂浓度。如图8a所示,随着5-fu浓度的增加,hogg1的相对活性降低。根据hogg1相对活性与5-fu浓度关系图,计算得ic50为4.9667毫摩尔每升。如图8b所示,udg的相对活性随着5-fu浓度的增加而降低。计算出ic50为4.6304毫摩尔每升,此结果与基于四倍体的分子信标测定获得的ic50值(5毫摩尔每升)一致。此结果清楚地表明本方法可用于筛选hogg1和udg的抑制剂。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
sequencelisting
<110>山东师范大学
<120>一种利用固有荧光核苷酸超灵敏同时检测多种dna糖基化酶的方法
<130>2017
<160>5
<170>patentinversion3.5
<210>1
<211>44
<212>dna
<213>人工序列
<400>1
ttatgcaacggacaacaagttttttttatgccuuacuuagcutc44
<210>2
<211>25
<212>dna
<213>人工序列
<400>2
atcttgttgtccgttgcagtgagtt25
<210>3
<211>25
<212>dna
<213>人工序列
<400>3
tggaagctaagtaaggcagtgtata25
<210>4
<211>34
<212>dna
<213>人工序列
<400>4
aaaactcactgcaacggacaacaatccgttgcag34
<210>5
<211>34
<212>dna
<213>人工序列
<400>5
aatatacactgccttacttagcttagtaaggcag34
- 还没有人留言评论。精彩留言会获得点赞!