肿瘤抑制因子p16的抗原多肽和其应用的制作方法
本发明属于生物免疫学技术领域,是一种肿瘤抑制因子p16的抗原多肽和其应用以及和含有肿瘤抑制因子p16的抗原多肽的用于检测血样品中p16自身抗体水平的试剂盒。
背景技术:
大量研究表明,血清或血浆中的肿瘤相关抗原能够诱导机体产生自身抗体,在恶性肿瘤恶变的前3-5年,患者血中可出现高浓度的肿瘤相关抗原自身抗体。这说明,既可以利用抗体检测肿瘤抗原,也可以利用肿瘤抗原检测自身抗体,但是利用肿瘤自身抗体检测肿瘤的特异性和敏感性均比利用肿瘤抗原检测肿瘤要高的多。原因是很多肿瘤相关抗原不仅在肿瘤患者体内存在,在正常人体内也存在,导致近年来的临床报道抗体检测方法敏感度低,特异性差,假阴性比率可高达50%以上。其主要原因是由于每一种肿瘤相关抗原自身抗体在患者中的阳性检测率平均在10%左右。因此,检测血中肿瘤相关抗原自身抗体具有预测肿瘤发病风险和早期诊断肿瘤的重要价值,是肿瘤临床诊断领域的重点发展方向之一。
在正常人体内自身抗体含量很低检测不到或根本不存在,若体内自身抗体水平明显增高,则表明体内存在异常免疫情况,表明体内相关抗原水平发生波动,预示疾病的存在或原有疾病加重。
p16为细胞周期依赖激酶(cdk)抑制蛋白的基因家族中发现的突变率最高的基因,又称多种肿瘤抑癌基因1(mts1)。p16蛋白的功能是g1周期中与cyclind1竞争性结合cdk4并特异性抑制cdk4阻止细胞尤其是带有损伤dna的细胞进入s期,对细胞周期直接起反向调节作用,从而控制细胞分裂。当p16基因发生缺失、突变、转录和表达异常时,p16蛋白的合成障碍则引起细胞增殖的失控,使细胞无限制生长、分裂并向癌变转化。说明p16作为一种细胞周期调节蛋白,其表达异常和功能丧失都能引起肿瘤的恶性进展和不良预后。通过测定细胞中p16蛋白的含量可判断肿瘤的侵袭转移及估计患者的预后。
虽然自身抗体对肿瘤的诊断和预后是一种极有前途的生物标志物,对于肿瘤的早期诊断、改善患者预后和降低死亡率方面有重要的意义。但是,自身抗体作为肿瘤诊断标志物还存在很多问题:①检测阳性率低,②研究队列的样本量小,③敏感性不足,④检测成本较高。这些不足制约了自身抗体作为常用生物标志物的应用。
另外,目前以重组蛋白为抗原,要经过载体构建、转染、表达、筛选、纯化等繁琐的过程,蛋白空间结构复杂,抗原表位不易暴露,抗原抗体结合的特异性差。同时,elisa法的高灵敏性对纯化技术的稳定性要求极高,成本昂贵。
技术实现要素:
本发明的目的在于克服现有技术的上述不足,提供一种肿瘤抑制因子p16的抗原多肽和含有肿瘤抑制因子p16的抗原多肽的用于检测血样品中p16自身抗体水平的试剂盒,以解决现有将自身抗体作为肿瘤诊断标志物的方法存在的灵敏度和特异性不高,且成本高的不足。
为了实现上述发明目的,本发明一方面,提供了一种肿瘤抑制因子p16的抗原多肽。所述肿瘤抑制因子p16的抗原多肽的多肽活性片段为下列至少一种氨基酸序列:
(1)seqidno:1所示的氨基酸序列:dwlatpaardpveevr
(2)seqidno:1所示的氨基酸序列经缺失、插入或替换所获得的具有相同功能的氨基酸序列。
本发明另一方面,提供了本发明肿瘤抑制因子p16的抗原多肽的一种应用方法。所述肿瘤抑制因子p16的抗原多肽在制备检测血样品中p16自身抗体水平的试剂盒中的应用。
本发明又一方面,提供了用于检测血样品中p16自身抗体水平的试剂盒。所述试剂盒包括本发明抗原多肽。
与现有技术相比,本发明肿瘤抑制因子p16的抗原多肽由于含有seqidno:1所示序列的氨基酸序列的多肽活性片段,其具有的特定抗原决定簇,从而提高了本发明抗原多肽与待测样本中所含的肿瘤抑制因子p16的自身抗体之间的特异结合率,同时降低了检测肿瘤抑制因子p16的自身抗体的成本。
本发明用于检测血样品中p16自身抗体水平的试剂盒由于含有本发明肿瘤抑制因子p16的抗原多肽,因此,赋予本发明试剂盒能够快速检测样品中肿瘤抑制因子p16的自身抗体的含量,并提高了检查的灵敏度高和检测效率,从而能够准确预测早期肿瘤的危险性,并为肿瘤新药研究提供可靠数据,同时降低了预测早期肿瘤的经济成本。
附图说明
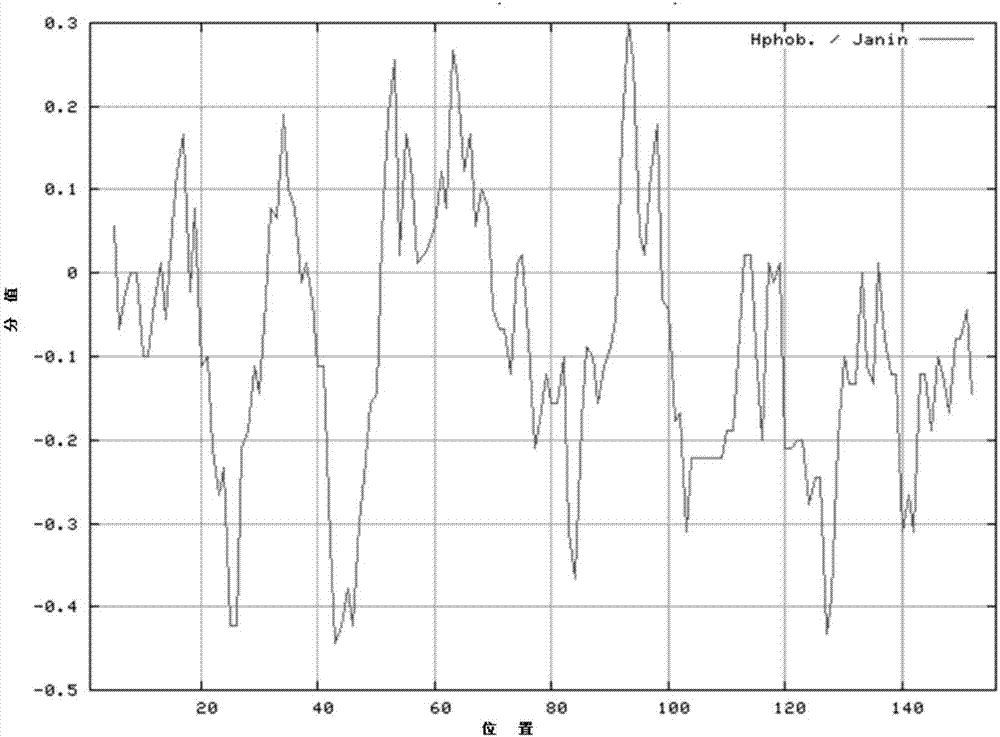
图1是本发明实施例肿瘤抑制因子p16的抗原多肽的疏水性分析图;
图2是本发明实施例肿瘤抑制因子p16的抗原多肽的表面可及性分析图;
图3是本发明实施例肿瘤抑制因子p16的抗原多肽的弹性区域分析图;
图4是本发明实施例sbi特异性结合曲线图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例和附图,对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下文所述的相关术语解释:
多肽:α-氨基酸以肽键连接在一起而形成的化合物,它也是蛋白质水解的中间产物。
抗体(antibody):是一种由浆细胞(效应b细胞)分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等的大型y形蛋白质。
抗原(antigen,缩写ag):任何可诱发免疫反应的物质。
抗原-抗体反应(antigen-antibodyreaction):是抗原和对应抗体在一定条件下特异结合形成可逆性抗原-抗体复合物的过程。
抗原决定簇:它可以是由连续序列(蛋白质一级结构)组成或由不连续的蛋白质三维结构组成,决定抗原性的特殊化学基团,又称抗原表位。
大量研究表明,血清或血浆中的肿瘤相关抗原能够诱导机体产生自身抗体,在恶性肿瘤恶变的前3-5年,患者血中可出现高浓度的肿瘤相关抗原自身抗体。而且利用肿瘤自身抗体检测肿瘤的特异性和敏感性均比利用肿瘤抗原检测肿瘤要高的多。因此,本发明实施例以细胞周期依赖激酶(cdk)抑制蛋白基因p16的自身抗体作为肿瘤标志物,并依据抗原-抗体反应的结合实际上只发生在抗原决定簇(抗原表位)和抗体的抗原结合位点之间实现两者在空间结构和空间构型上完全互补特性,本发明实施例提供了下文的含有特异序列的肿瘤抑制因子p16的抗原多肽和相应的试剂盒。
(一)肿瘤抑制因子p16的抗原多肽
一方面,本发明实施例提供了一种基于特异性免疫应答肿瘤抑制因子p16蛋白的抗原多肽。所述肿瘤抑制因子p16的抗原多肽的多肽活性片段为下列至少一种氨基酸序列:
(1)seqidno:1所示的氨基酸序列:dwlatpaardpveevr;
(2)seqidno:1所示的氨基酸序列经缺失、插入或替换所获得的具有相同功能的氨基酸序列。
上述含有seqidno:1所示氨基酸序列的肿瘤抑制因子p16的抗原多肽由于含有特定的抗原决定簇,使得其能够与肿瘤抑制因子p16自身抗体抗原结合位点发生特异识别和结合,从而提高了上述抗原多肽与待测样本中所含的肿瘤抑制因子p16的自身抗体之间的特异反应,并提高两者的特异结合率。这样,将用其与待测样本如血样本中的肿瘤抑制因子p16的自身抗体特异识别和结合后,能够间接检测出待测样本中肿瘤抑制因子p16的自身抗体的含量水平,通过对自身抗体的含量水平判断,从而间接判断待测样本来源体的肿瘤发病风险和进展。例如在正常人体内肿瘤抑制因子p16的自身抗体含量很低检测不到或根本不存在,若体内肿瘤抑制因子p16的自身抗体水平明显增高,则表明体内存在异常免疫情况,表明体内相关抗原水平发生波动,预示疾病的存在或原有疾病加重。其中,肿瘤抑制因子p16的自身抗体可以是抗肿瘤抑制因子p16的特异性自身igg抗体。一实施例中,可以利用上述肿瘤抑制因子p16的抗原多肽采用酶联免疫法对待测样本如血液样本中肿瘤抑制因子p16的自身抗体的含量检测,具体采用酶联免疫法检测方法如下文所述。
另外,上述肿瘤抑制因子p16的抗原多肽所含的seqidno:1所示氨基酸序列为简单的线性多肽氨基酸序列,其相对于现有重组蛋白的抗原而言,其获得的成本显著降低,而且与肿瘤抑制因子p16的自身抗体的特异性强。其中,设计上述含有seqidno:1所示氨基酸序列的肿瘤抑制因子p16的抗原多肽是按照如下线性多肽原则设计:
(1)尽可能是在蛋白表面;(2)保证抗原片段序列不形成α-helix;(3)n端和c端的肽段比中间的肽段更好;(4)避免蛋白内部重复或接近重复段的序列;(5)避免同源性太强的肽段;(6)交联可以交联在n,c两端,选择依据就是交联在对产生抗体不太重要的一端;(7)序列中不能有太多的脯氨酸(pro),但有1~2个pro有好处,可以使肽链结构相对稳定一些,对产生特异性抗体有益。
进一步地,设计上述含有seqidno:1所示氨基酸序列的肿瘤抑制因子p16的抗原多肽的抗原设计选择为:利用生物信息学数据库资料和在线工具对蛋白的结构进行分析,预测蛋白的ph值、疏水性、柔性、表面可及性、抗原性等相关参数。遵循线性多肽设计原则和方法,设计了如seqidno:1氨基酸序列。其中p16抗原蛋白(cyclin-dependentkinase4inhibitora[p16-ink4a])的序列如下seqidno:2所示,其中加框部分为上述肿瘤抑制因子p16的抗原多肽以及在p16抗原蛋白中的位置):
上述seqidno:1和seqidno:2序列中的每一个大写字母均是对应一个相应简称的氨基酸。
在上文各实施例的基础上,本领域技术人员可以理解的是,还可以对上文所述的肿瘤抑制因子p16的抗原多肽进行化学修饰,以便增加肿瘤抑制因子p16的抗原多肽的抗原性和有助于多肽的包被处理。
上述抗原多肽可通过化学合成得到,也可以通过基因工程技术得到,此技术为行业内所熟悉。本领域技术人员可以理解的是,可以有效地通过常规合成方法,合成上述肿瘤抑制因子p16的抗原多肽,从而代替重组表达的生物合成方式。
因此,上文肿瘤抑制因子p16的抗原多肽由于含有seqidno:1所示序列的氨基酸序列的多肽活性片段,其具有的特定抗原决定簇,从而提高了与待测样本中所含的肿瘤抑制因子p16的自身抗体之间的特异结合率。而且优选采用化学合成方法合成上文肿瘤抑制因子p16的抗原多肽,有效避免了采用基因工程技术要经过载体构建、转染、表达、筛选、纯化等繁琐的过程,获得蛋白空间结构复杂、抗原表位不易暴露、抗原抗体结合的特异性差的不足,有效降低了检测肿瘤抑制因子p16的自身抗体的成本。
(二)肿瘤抑制因子p16的抗原多肽的应用
另一方面,本发明实施例提供了上文肿瘤抑制因子p16的抗原多肽在制备检测血样品中p16自身抗体水平的试剂盒中的应用。由于上文肿瘤抑制因子p16的抗原多肽其具有特定抗原决定簇,从而提高了与待测样本中所含的肿瘤抑制因子p16的自身抗体之间的特异结合率。因此,应用上文肿瘤抑制因子p16的抗原多肽可以检测胃癌、肝癌、宫颈癌等含有p16基因异常表达的癌症患者血液中相应的特异性自身抗体。通过检测体内自身抗体含量变化情况,可以间接监控体内相关抗原水平发生波动,预示疾病的存在或原有疾病加重,如判断肿瘤的侵袭转移及估计患者的预后。因此,在具体实施例中,该检测血样品为血浆或血清。
为此,在本发明实施例的第三方面,本发明提供了一种用于检测血样品中p16自身抗体水平的试剂盒。所述试剂盒至少包括上文所述的肿瘤抑制因子p16的抗原多肽。
在一实施例中,上述试剂盒所含的肿瘤抑制因子p16的抗原多肽可以是溶剂的形式存在,也可以直接被包被在酶标板上。其中,肿瘤抑制因子p16的抗原多肽包被在酶标板上的方法可以是本领域常规的包被处理方法。
在进一步实施例中,上述试剂盒还可以包括抗原包被缓冲液、参比抗原、pbst洗涤缓冲液、样品稀释分析液、二抗标准液、终止缓冲液、底物显色液中的至少一种。
在具体实施例中,上述试剂盒所含的包被缓冲液只要是能够保证抗原多肽活性的均可,具体可以是下文中表1的包被缓冲液。该包被缓冲液可以用来包被上文肿瘤抑制因子p16的抗原多肽。
上述试剂盒所含的参比抗原可以为gag。
上述试剂盒所含的pbst洗涤缓冲液可以是酶联免疫法中常用的pbst洗涤缓冲液。具体可以是下文中表4的pbst洗涤缓冲液,其可以用来洗涤酶标板等。因此,在一实施例中,上述试剂盒还可以包含酶标板,如96孔酶标板。
上述试剂盒所含的样品稀释分析液可以是酶联免疫法中常用的样品稀释分析液。具体可以是下文中表5的样品稀释分析液,其可以用来稀释待测样本、肿瘤抑制因子p16的抗原多肽和二抗等。
上述试剂盒所含的二抗标准液中的二抗为羊抗人igg和羊抗人iga,具体可以是以hrp-lgg或hrp-iga的形式存在。
上述试剂盒所含的底物显色液的显色剂可以为3,3',5,5'-四甲基联苯胺。当然还可以是酶联免疫法中其他显色剂。
因此,上述用于检测血样品中p16自身抗体水平的试剂盒由于含有上文肿瘤抑制因子p16的抗原多肽,因此,赋予上述试剂盒能够快速检测样品中肿瘤抑制因子p16的自身抗体的含量,并提高了检查的灵敏度高和检测效率,从而能够准确预测早期肿瘤的危险性,并为肿瘤新药研究提供可靠数据,并降低成本。同时,通过在上述试剂盒中配置抗原包被缓冲液、参比抗原、pbst洗涤缓冲液、样品稀释分析液、二抗标准液、终止缓冲液、底物显色液中的至少一种。以提高上述试剂盒的使用方便,避免件检测过程中需要额外的准备其他试剂,提高了检查效率,同时保证了检测样品中肿瘤抑制因子p16的自身抗体的含量的稳定性和准确性。
利用上文肿瘤抑制因子p16的抗原多肽或者上文用于检测血样品中p16自身抗体水平的试剂盒采用elisa法自身抗体检测的实验方法如下:
(1)实验设计(对照):96孔酶标板,每个血浆样本设人抗原多肽双复孔,对照参比抗原(gag)双复孔和阴性对照双复孔(nc)。gag抗原与人类蛋白质组无同源性,减小非特异性结合反应的干扰;
(2)固相包被:抗原用包被缓冲液包被于96孔酶标板,每孔100μl,抗原多肽包被浓度1.0~5.0μg/ml,gag包被浓度为10μg/ml,4℃过夜;
(3)血浆样本(一抗):采用洗液(0.01mtris-hcl,ph8.8)清洗每孔3遍,利用分析液将血浆1:200稀释,每孔100μl,25℃孵育2h;
(4)酶标抗体(二抗):洗液(0.01mtris-hcl,ph8.8)清洗每孔3遍,利用分析液稀释辣根过氧化物酶标记的羊抗人igg或辣根过氧化物酶标记的羊抗人iga,每孔加100μl,25℃孵育2h;
(5)显色:洗液(0.01mtris-hcl,ph8.8)清洗每孔3遍,利用3,3',5,5'-四甲基联苯胺(tmb)为过氧化物酶的底物,每孔加100μl,室温避光20~30min。
(6)检测:每孔加50μl10%hci为反应终止液,10min内使用酶标仪检测od值,检测波长为450nm,参考波长为630nm。
其中,上述采用elisa法自身抗体检测的质控如下:
各样本设双复孔,取平均od值。od值离散度判定:离散度=od1-od2/od1+od2,离散度≤0.1,为有效结果;离散度>0.1,为无效结果。取100份健康人血清等体积混合作为质控血qc,代表人群的普遍情况,每板均设2个qc血浆孔,以qc血浆孔的od值变异水平判定结果的稳定性,批间变异cv=所有批次qc孔sd/所有批次qc孔od均值<10%。批内变异cv=每日各板qc孔sd/每日各板qc孔均值<5%。
上述采用elisa法自身抗体检测方法步骤(6)获得的检测数据分析:
采用spss19.0forwindows进行统计学分析。采用特异结合指数(specificbindingindex,sbi)来判定p16抗原多肽与血浆自身抗体的结合程度,sbi=p16od值-ncod/gagod值-ncod,nc为各样本的阴性对照。以健康人sbi平均值+2sd判为阳性,判定灵敏度和特异度;进行秩和(z)检验,检验一类错误水准为a=0.05。
现以具体的肿瘤抑制因子p16的抗原多肽和含有肿瘤抑制因子p16的抗原多肽的试剂盒为例,对本发明做进一步详细说明。
实施例1
本实施例1提供了一种肿瘤抑制因子p16的抗原多肽,所述肿瘤抑制因子p16的抗原多肽含有seqidno:1所示的氨基酸序列。当然,seqidno:1所示的氨基酸序列经缺失、插入或替换所获得的具有相同功能的氨基酸序列也在本实施例公开的范围。
本实施例1提供的肿瘤抑制因子p16的抗原多肽的合成方法如下:
一、通过多肽1的氨基酸序列合成编码多肽1的基因序列,在多肽1的基因序列前后分别增加his-tag标签,并在编码多肽1基因序列和his-tag标签之间插入消化酶酶切位点。
二、dh5α质粒扩增载体转化:
1.将插入多肽1基因序列的细菌37℃活化过夜;
2.以1:100的比例吸取过夜菌液(250μl)加入25mllb液体培养基中,37℃,200r/min振荡培养2-3h至od600达到0.5左右;
3.将25ml菌液移至预冷的50mlep管中,在冰上放置30min,使培养基冷却到0℃;
4.于4℃,4000rpm离心10min,回收细胞;
5.倒出培养基,将管倒置于吸水纸上1min;
6.每50ml菌液用10ml预冷的0.1mol/l的cacl2,重悬每份沉淀,冰浴30min;
7.于4℃,以4000rpm离心10min,回收细胞;
8.倒出培养液,将管倒置于吸水纸上1min;
9.每50ml初始培养物用2ml用冰预冷的0.1mol/l的cacl2(含15%甘油)重悬每份细胞沉淀;
10.取50μl大肠杆菌感受态细胞,加入4μl质粒冰浴30min后,42℃热激90s,马上放回冰上,冰浴2min:加400μllb培养基,于37℃摇床慢摇振荡培养45-60min;取50-100μl涂在含有氨苄青霉素的lb固体培养基上,37℃倒置培养过夜;
三、质粒抽提:
1.挑取lb固体培养基上生长的单菌落,接种于20mllb(含amp100ug/ml)液体培养基中,37℃、250rmp振荡培养过夜(约12-14hr);
2.取1.5ml培养液倒入1.5mlep管中,12000rmp离心1-2min。弃上清,将离心管倒置于吸水纸上几分钟,使液体尽可能流尽;
3.菌体沉淀重悬浮于100μl溶液ⅰ中,需剧烈振荡,室温下放置5-10min;
4.加入新配制的溶液ⅱ200μl,盖紧管口,快速温和颠倒ep管数次,以混匀内容物,冰浴5min,使细胞膜裂解;
5.加入150μl预冷的溶液ⅲ,盖紧管口,将管温和颠倒数次混匀,见白色絮状沉淀,可在冰上放置5min。离心12000rmp,10min;
6.上清液移入干净ep管中,加入450μl的苯酚/氯仿/异戊醇,振荡混匀,12000rmp离心10min;
7.小心移出上清于一新微量离心管中,加入2倍体积预冷的无水乙醇,混匀,室温放置2-5min,离心12000rmp,10min;
8.弃上清,将管口敞开倒置于卫生纸上使所有液体流出,加入1ml70%乙醇洗沉淀一次,离心12000rmp,5min;
9.吸除上清液,将管倒置于卫生纸上使液体流尽,室温干燥;
10.将沉淀溶于20μlte缓冲液(ph8.0,含20μg/mlrnasea4μl,37℃水浴30min以降解rna分子,储于-20℃冰箱中;
四、bl21质粒表达载体转化:
1.感受态细胞使用前在冰中融化;
2.融化后,轻柔混合均匀,取100μl移入ep管中;
3.加入目的蛋白表达用质粒(10ng以下);
4.冰中放置30min;
5.于42℃放置45s;
6.立即移入冰中放置1-2min;
7.加入37℃预温的soc培养基900μl;
8.于37℃振荡培养1h(160-225rpm);
9.将适量培养液涂布在含有抗生素的lb平板上;
10.于37℃过夜培养;
11.取50μl大肠杆菌感受态细胞,加入4μl质粒冰浴30min后,42℃热激90s,马上放回冰上,冰浴2min:加400μllb培养基,于37℃摇床慢摇振荡培养45-60min;取50-100μl涂在含有氨苄青霉素的lb固体培养基上,37℃倒置培养过夜;
五、bl21裂解:
1.挑取lb固体培养基上生长的单菌落,接种于20mllb(含amp100ug/ml)液体培养基中,37℃、250rmp振荡培养过夜(约12-14hr);
2.收集培养液,4℃7000-8000g离心10min,收集沉淀的菌体;
3.取1-2g菌体加10ml破碎缓冲液在冰上混合45min;
4.把混合菌体在冰水中用超声探头破碎20s种,破碎四次,中间间隔要保持2min冷却破碎液,控制ph为7-8;
5.破碎液4℃12000g离心10min;
6.破碎离心的上清加2m咪唑溶液0.12ml使终浓度为20mm,样品的总体积为10ml;
六、多肽1分离与提纯
1.平衡缓冲液:ph7.4的50mm磷酸缓冲液含0.5mnacl,含20mm咪唑;
2.洗脱缓冲液:ph7.4的50mm磷酸缓冲液含0.5mnacl,含500mm咪唑;
3.取1ml镍琼脂糖凝胶ff预装柱,用10ml平衡缓冲液平衡,然后取破碎上清10ml样品以0.5ml/min上样,然后2ml/管分管收集;
4.用15ml平衡缓冲液洗去未吸附的样品,流速1-2ml/min,2ml/管收集;
5.用5ml洗脱缓冲液洗去未吸附的样品,流速1-2ml/min,2ml/管收集;
6.再用5ml平衡缓冲液平衡柱子,灌满20%乙醇,封闭,以备下次使用;
7.收集的部分用紫外分光光度法测定蛋白的浓度,再取有蛋白的部分电泳检测纯度。
对本实施例1提供的肿瘤抑制因子p16的抗原多肽相关性能如ph值、疏水性、柔性、表面可及性、抗原性等相关性能进行分析,,其分析结果如图1-4所示。其中,
肿瘤抑制因子p16的抗原多肽的疏水性分析结果如图1所示,肿瘤抑制因子p16的抗原多肽的表面可及性分析结果如图2所示,肿瘤抑制因子p16的抗原多肽的弹性区域分析结果如图3所示。因此,本实施例提供的肿瘤抑制因子p16的抗原多肽具有如图1-3的疏水性、柔性、表面可及性等相关性能,遵循线性多肽设计原则和方法。
实施例2
本实施例提供了实施例1中肿瘤抑制因子p16的抗原多肽(简称p16抗原多肽)与血清及血浆igg结合的方法,所述方法如下:
用96孔酶标板对p16多肽抗原包被,设置浓度梯度为1.0μg~5.0μg/ml,设置双复孔,一抗用qc结合,最后酶标仪检测得到sbi特异性结合曲线。
其中,所述sbi结合曲线图如图4所示。由图4可知,p16浓度1.0~4.0μg/ml时,随着浓度的增大,sbi值逐渐下降;当p16抗原多肽浓度4.0~4.5μg/ml时,随着浓度的增大,sbi值逐渐上升。此sbi结合曲线表明,当p16抗原多肽为1.0μg/ml的较低浓度时,96孔酶标板的板底没有被铺满,导致非特异性反应高,所以此时sbi值偏高,为假阳性结果;随着p16抗原多肽浓度增高,抗原逐渐铺满整个板底,其阻断作用显现,非特异性反应逐渐减小,到4.0μg/ml时非特异性反应最低,此时p16抗原多肽与igg抗体的特异性结合开始出现,并随着抗原浓度的增高逐渐增强,趋于平稳。此sbi结合曲线充分体现了p16抗原多肽与血浆中自身igg抗体的特异性结合反应过程。
实施例3
本实施例3提供含有实施例1中肿瘤抑制因子p16的抗原多肽的用于检测血样品中p16自身抗体水平的试剂盒。
1.本实施例提供的用于检测血样品中p16自身抗体水平的试剂盒包含下文表1-8所述的试剂:
表1.抗原包被缓冲液
表2.工作抗原
表3.参比抗原
表4.0.1mpbst洗涤缓冲液(1000ml体积)
表5.样品稀释分析液
表6.二抗标准液
表7.终止缓冲液
表8.底物显色液
2.本实施例用于检测血样品中p16自身抗体水平的试剂盒的操作方法如下:
(1)包被:工作抗原及参比抗原包被液稀释至工作浓度,包被于酶标板,4℃过夜;
(2)加血浆样本(一抗):洗涤缓冲液清洗酶标板3遍,分析液以1∶200将血浆稀释至合适浓度,每孔加入100μl,25℃或室温孵育2h;
(3)加酶标抗体(二抗):洗涤缓冲液清洗3遍,利用分析液稀释二抗标准液igg,每孔加200μl,25℃/室温孵育2h;
(4)显色:洗涤缓冲液清洗3遍,每孔加100μl底物显色液,室温避光20~30min。
(5)检测:每孔加50μlhcl终止液,10min内检测od,波长为450nm,参考波长为630nm。
实施例4
实施例3提供的试剂盒在肝癌、胃癌患者的p16自身igg抗体检测中的临床应用。
1.样本收集:
健康组样本:健康组188例,平均年龄为50.07±10.36岁,其中男112例,女76例;
肝癌组样本:肝癌组113例,平均年龄为51.5±9.2岁,其中男67例,女46例。健康组与肝癌组在性别、年龄匹配,具有可比性(p>0.05);
胃癌组样本:胃癌组122例,平均年龄为49.62±7.46岁,其中男69例,女53例。健康组与食管癌组在性别、年龄匹配,具有可比性(p>0.05)。
2.检测方法如实施例3中第2节所述的操作方法;
3.检测结果:
由表10可知,肝癌肿瘤患者血浆中p16抗原多肽检测igg抗体灵敏度为39.3%特异度为90.2%。通过对比分析,肝癌患者血浆中与p16抗原多肽结合的igg抗体阳性率明显高于健康组(z=-3.68,p<0.001)。
胃癌肿瘤患者血浆中p16抗原多肽检测igg抗体灵敏度为42.7%,特异度为89.8%。通过对比分析,肝癌患者血浆中与p16抗原多肽结合的igg抗体阳性率同样明显高于健康组(z=-4.34,p<0.001)。
以上数据充分表明,利用本发明所设计的抗原多肽检测得到的肝癌患者自身抗体igg水平与正常健康组比较有显著性统计学差异。通过检测肿瘤患者血清及血浆中自身抗体含量,可开发相应的快速检测试剂盒,提前诊断早期肿瘤的危险性。
表10.胃癌与肝癌患者中p16自身igg抗体检测及对比分析
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>深圳市华中生物药械有限公司
<120>肿瘤抑制因子p16的抗原多肽和其应用
<160>2
<170>patentinversion3.5
<210>1
<211>16
<212>prt
<213>人工合成
<400>1
asptrpleualathrproalaalaargaspprovalglugluvalarg16
<210>2
<211>156
<212>prt
<213>p16的抗原多肽序列
<400>2
metgluproalaalaglysersermetgluproseralaasptrpleu16
alathrproalaalaargaspprovalglugluvalargalaleuleu32
glualaglyalaleuproasnalaproasnsertyrglyargargpro48
ileglnvalmetmetmetglyseralaargvalalagluleuleuleu64
leuhisglyalagluproasncysalaaspproalathrleuthrarg80
provalhisaspalaalaarggluglypheleuaspthrleuvalval96
leuhisargalaglyalaargleuaspvalargaspalatrpglyarg112
leuprovalaspleualaglugluleuglyhisargaspvalalaarg128
tyrleuargalaalaalaglyglythrargglyserasnhisalaarg144
ileaspalaalagluglyproseraspileproasp156
- 还没有人留言评论。精彩留言会获得点赞!