一种双泵补料法及基于双泵补料法的重组大肠杆菌发酵方法与流程
本发明涉及微生物发酵技术领域,特别涉及一种双泵补料法及基于双泵补料法的重组大肠杆菌发酵方法。
背景技术:
利用基因重组技术构建的生物工程菌的发酵工艺不同于传统的发酵工艺。就其选用的生物材料而言,前者含有带外源基因的重组载体,而后者是单一的微生物细胞;从发酵工艺考虑,生物工程菌发酵生产的目的是希望能获得大量的外源基因产物,尽可能减少宿主细胞本身蛋白的污染。而外源基因的高水平表达,不仅涉及宿主、载体和克隆基因三者之间的相互关系,而且与其所处的环境条件息息相关,因此仅按传统的发酵工艺生产生物制品是远远不够的,需要对影响外源基因表达的因素进行分析,探索出一套适于外源基因高效表达的发酵工艺。
基因工程菌发酵问题中最重要的两个问题是菌体的高密度发酵和诱导条件的确定。菌株的高密度生长将导致供氧不足和培养基中大量乙酸的产生,这将极大的影响菌体的生长;另外,菌体密度的高低与外源蛋白表达量之间并没有直接相关性,它们之间的结合点就是诱导条件的确定。
重组大肠杆菌在发酵过程中存在葡萄糖流加速率与溶氧控制相关联的问题。如果葡萄糖流加过快,则会导致溶氧水平过低,使发酵处于厌氧状态,目标产物产量降低;如果葡萄糖流加过慢,则会导致溶氧水平过高,菌体处于饥饿状态,自溶现象增加,影响目标产物的产生。目前大肠杆菌发酵的补料方法为单泵补料法,即将溶氧与补料相关联,如果溶氧高于设定值,补料自动开启;溶氧低于设定值,补料自动关闭。该方法在运行过程中存在溶氧波动范围大,上限与下限相差60%的问题,严重影响发酵水平的提高。
技术实现要素:
有鉴于此,本发明提供了一种双泵补料法,及利用双泵补料法对重组大肠杆菌进行发酵方法,解决了大肠杆菌发酵过程中溶氧波动范围大,发酵水平低的技术问题。
为了解决上述技术问题,本发明的技术方案如下:
本发明提供了一种双泵补料法,所述双泵补料法为采用恒速补料泵和溶氧关联泵对发酵液进行补料的方法,首先打开恒速补料泵,将恒速补料泵流加葡萄糖的速度调整至小于发酵液中葡萄糖的消耗速度,再打开溶氧关联泵,设置关联溶氧值;当发酵液的溶氧值高于所述溶氧关联泵的设定值时,溶氧关联泵开启进行补料,当发酵液的溶氧值低于所述溶氧关联泵设定值时,溶氧关联泵关闭。
其中,所述双泵补料法用于重组大肠杆菌发酵液加入诱导剂之后的发酵过程中。
本发明还提供了一种基于所述双泵补料法的重组大肠杆菌发酵方法,包括以下步骤:
(1)将重组大肠杆菌种子液接种至含有发酵培养基的发酵罐中进行发酵;
(2)发酵过程中控制发酵液的溶氧、ph及补料,使发酵液的od值增长;
(3)当发酵液的od600值增长至38~42时,加入诱导剂进行低温诱导,采用上述双泵补料法继续进行发酵,当发酵液的od600停止增长时,结束发酵。
其中,所述步骤(2)的具体步骤为:通过调节发酵罐的搅拌转速和空气流量将发酵液的溶氧控制在50%以上;当发酵液的ph开始下降时,用氨水调节发酵液的ph在6.5~7.5;当发酵液的溶氧上升时,将补料与溶氧关联,设定溶氧关联值为20%,补加葡萄糖进行发酵。
优选的,上述步骤(2)中,所述搅拌转速为100~200rpm,所述空气在发酵罐中的通气比1:1~1.5。
优选的,步骤(3)中,加入诱导剂后,调节发酵液的ph为7.0~7.5进行发酵。
优选的,步骤(3)中,所述低温诱导具体为,将发酵液降温,当温度降到30℃以下时,加入诱导剂。
更优选的,所述诱导剂为iptg,所述iptg在发酵液中的终浓度为1~2mm。
优选的,所述双泵补料法中,恒速补料泵流加葡萄糖的速度为5~20ml/h/l。
优选的,所述双泵补料法中,设置溶氧关联泵的关联溶氧值为20~40%。
现有技术相比,本发明具有以下优点:
本发明的双泵补料法采用恒速补料泵和溶氧关联泵对大肠杆菌发酵液进行补料,使溶氧波动范围大幅度降低,菌体处于饥饿状态的时间大幅度减少。恒速补料泵采用较低的补料速度用来维持菌体基本生长,在发酵过程中处于一直开启的状态,保证发酵液中大肠杆菌的基本碳源供给,使菌体始终有葡萄糖可以利用。溶氧关联泵将溶氧与补料相关联,当发酵液的溶氧值高于设定值时,溶氧关联泵自动开启进行补料,当发酵液的溶氧值低于设定值时,溶氧关联泵自动关闭,给菌体提供了相对充足的葡萄糖,并且在关联溶氧的状态下,流加葡萄糖的数量不会过量太多,使菌体处于饱和而不过量的状态。原来采用单泵补料工艺溶氧波动范围大,溶氧上下限相差60%,采用本发明的双泵补料法,溶氧波动范围缩小至10%,溶氧保持相对稳定。采用本发明的双泵补料法对重组大肠杆菌进行发酵,能够使大幅度提高大肠杆菌的发酵水平。发酵结束时,发酵液的od值达到160左右,发酵液中重组大肠杆菌表达的水解酶酶活达到180u/ml,大大提高了大肠杆菌的发酵水平。
附图说明
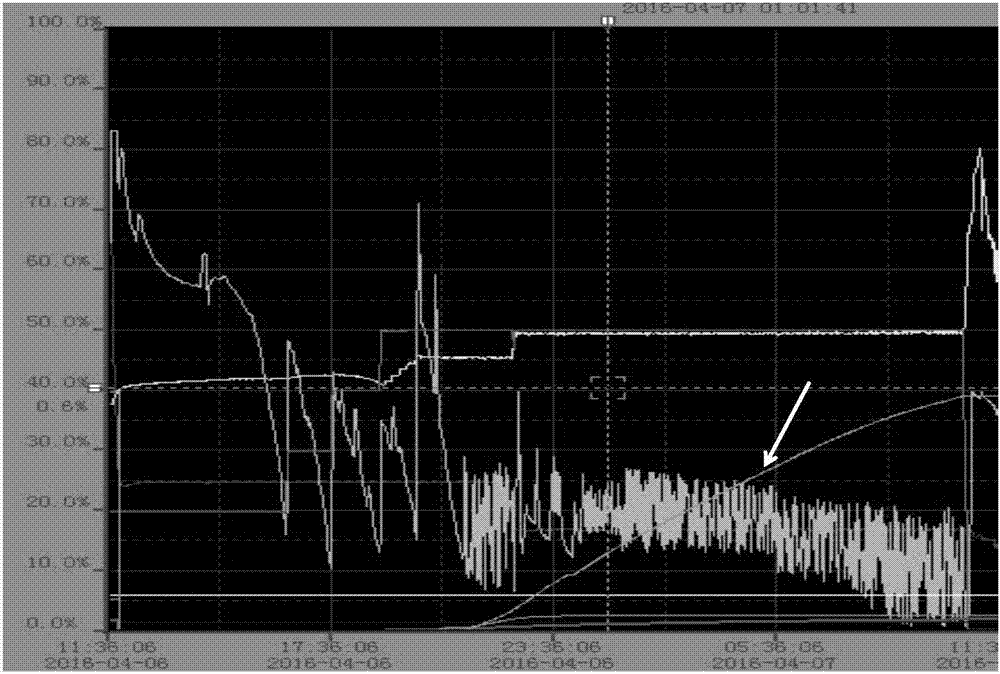
图1为采用单泵补料法发酵液的溶氧波动情况;
图2为采用双泵补料法发酵液的溶氧波动情况。
具体实施方式
本发明为了解决在重组大肠杆菌发酵过程中,溶氧波动范围大,影响发酵水平的问题,提供了一种双泵补料法,该方法采用恒速补料泵和溶氧关联泵对重组大肠杆菌发酵液进行补料,具体为,首先打开恒速补料泵,将恒速补料泵流加葡萄糖的速度调整至小于发酵液中葡萄糖的消耗速度,再打开溶氧关联泵,设置关联溶氧值;当发酵液的溶氧值高于所述溶氧关联泵的设定值时,溶氧关联泵开启进行补料,当发酵液的溶氧值低于所述溶氧关联泵设定值时,溶氧关联泵关闭。
双泵补料法中,恒速补料泵一直处于开启状态,保证了重组大肠杆菌对碳源的基本供给,不会出现葡萄糖补料过量的状态,避免由于葡萄糖的过量出现溶氧水平过低,使发酵处于厌氧状态的情形。本领域技术人员可以根据发酵液中重组大肠杆菌对葡萄糖的消耗速度,设定恒速补料泵流加葡萄糖的速度。在本发明具体实施例中,优选恒速补料泵流加葡萄糖的速度为5~20ml/h/l,更优选为8~12ml/h/l。
开启恒速补料泵后,当恒速补料泵稳定时,打开溶氧关联泵。溶氧关联泵是将泵的开关与溶氧关联起来,设置关联溶氧值。当发酵液的溶氧值高于所述溶氧关联泵的设定值时,溶氧关联泵开启进行补料,当发酵液的溶氧值低于所述溶氧关联泵设定值时,溶氧关联泵关闭。本领域技术人员可以根据重组大肠杆菌在发酵过程中所需的溶氧值,设定溶氧关联泵的关联溶氧值。在本发明中,关联溶氧值优选设定在20~40%,更优选为20%。观察溶氧曲线,根据溶氧曲线调整关联补料泵的开启时间,将发酵液的溶氧曲线调整至浮动于20%为止,上下浮动5%。
通过恒速补料泵和溶氧关联泵的结合,使流加的葡萄糖量更加接近于重组大肠杆菌所需的碳源量,既不会出现葡萄糖的缺乏,又不会导致葡萄糖的过量添加,从而使发酵液中的溶氧波动范围大大减小,从单泵法的溶氧波动范围在60%,降低至10%以内。
本发明的双泵补料法优选应用于重组大肠杆菌发酵液加入诱导剂之后的发酵过程中。
本发明还提供了采用上述双泵补料法对重组大肠杆菌进行发酵的方法,包括以下步骤:
(1)将重组大肠杆菌种子液接种至含有发酵培养基的发酵罐中进行发酵;
(2)发酵过程中控制发酵液的溶氧、ph及补料,使发酵液的od值增长;
(3)当发酵液的od600值增长至38~42时,加入诱导剂进行低温诱导,采用双泵补料法继续进行发酵,当发酵液的od600停止增长时,结束发酵。
本发明对重组大肠杆菌的来源没有特殊限制,本领域中的现有重组大肠杆菌或采用常规方法将目的基因导入大肠杆菌的重组大肠杆菌都在本发明的保护范围之内。在本发明具体实施例中,采用的重组大肠杆菌为lkgh-0712(bl21pet30a-xf2),其发酵产物为内酯二醇水解酶。
本发明中,重组大肠杆菌的种子液为保存的重组大肠杆菌在lb培养基中进行培养的培养液,其中,lb培养基中含有氨苄青霉素,其浓度优选为100~800ug/ml,进一步优选为500ug/ml。本发明中,重组大肠杆菌以菌液的形式接种在lb培养基中,接种量优选为1~5%,更优选为1~3%。重组大肠杆菌在lb培养基中的培养温度为37℃,优选为摇床培养,培养时间优选为3~4h。待菌液的od600长至2.5±0.5时,作为重组大肠杆菌的种子液。
本发明对重组大肠杆菌的发酵培养基没有特殊限定,可以采用本领域中适合于大肠杆菌发酵的常规培养基进行发酵,也可以采用改进的发酵培养基对重组大肠杆菌进行发酵。本发明中,优选采用以下重组大肠杆菌发酵培养基配方:10l发酵培养基中含有:十二水和磷酸氢二钠100~200g,磷酸二氢钾50~150g,氯化铵100~200g,硫酸钠15~50g,七水合硫酸镁5~20g,蛋白胨10~200g,酵母粉20~100g,甘油10~200g,消泡剂2~10ml,三氯化铁0.1~1.5g。其中,消泡剂为聚醚类或有机硅类消泡剂。本发明对发酵培养基的配制方式没有特殊限定,采用本领域技术人员熟知的配制方式即可。
在种子液接种之前,优选进行消罐处理。将配制好的上述发酵培养基倒入发酵罐,在121℃下灭菌30min。降温后控制发酵罐温度为37℃,通空气通气比为1:1,转速200rpm,稳定15~30min后标定溶氧为100%。测定发酵培养基的ph为6.0±0.1。如果发酵培养基ph需要调节,优选用氨水调节调节ph至上述范围内。
消罐后,将重组大肠杆菌种子液接种至发酵罐中。本发明对种子液接种的方式没有特殊限定,可以采用本领域熟知的接种方法进行接种。本发明中,种子液的接种量优选为0.5~5%,进一步优选为1~2%。本发明的发酵罐中,优选在发酵液中加入氨苄青霉素,所述氨苄青霉素在发酵液中的终浓度为100~800mg/l,进一步优选为500mg/l。
接种后,控制发酵液的溶氧、ph及补料等因素,使发酵液中的大肠杆菌进行繁殖,发酵液的od值增长。
发酵前期,控制发酵罐的转速和空气流量,在温度为35~38℃下进行发酵。发酵前期,发酵罐的转速优选为100~200rpm,更优选为200rpm;通气比优选为1:0.5~1.5,更优选为1:1,其中进口空气压力为0.08mpa。发酵前期不控制发酵液的ph,重组大肠杆菌处于快速繁殖的时期。随着发酵的进行,发酵液的od600快速增长,调整搅拌转速及空气流量,使发酵液的溶氧控制在50%以上。
当发酵液的ph开始下降时,此时发酵液od值在6~10之间。用氨水调节发酵液的ph在6.5~7.5,中和发酵过程中大肠杆菌产生的乙酸等副产物。
待发酵液的溶氧突然上升时,固定此时发酵罐的转速及通气量,开始补加葡萄糖。此时,优选发酵罐的转速为500~600rpm,通气量为1:0.5~1.5l/min。本发明中,补加的葡萄糖浓度优选为50~70%w/v。葡萄糖优选在灭菌后补加到发酵罐中。本发明对葡萄糖灭菌的方式没有特殊限定,优选采用115℃灭菌20min的灭菌方式。本发明对葡萄糖的补加方式没有特殊限定,采用本领域中的常规补料方式即可。具体的,在此阶段的发酵时,优选采用单泵法进行葡萄糖的补料。即将补料与溶氧相关联,设置关联溶氧值为20~40%,当发酵液的溶氧值高于设定值时,进行葡萄糖的补料;当发酵液的溶氧值低于设定值时,补料关闭。
本发明对此阶段的补料方式并不限制与单泵补料法,也可以采用本发明的双泵补料法。此阶段的单泵补料法和双泵补料法对发酵效果并无明显区别,基于操作上的简易性,本发明优选在此阶段采用单泵补料法。
定时检测发酵液的od600,检测发酵液中重组大肠杆菌的生长情况。当发酵液的od600值增长至38~42时,进行诱导表达。
本发明采用低温诱导的方式进行诱导表达。将发酵罐进行降温,优选设置发酵罐的降温值为20~25℃。当发酵液的温度降至30℃以下时,向发酵液中加入诱导剂进行诱导。本发明对诱导剂的种类没有特殊限定,可以采用本领域技术人员所熟知的诱导剂。本发明中,优选诱导剂为iptg。加入的诱导剂在发酵液中的终浓度优选为1~5mm,本领域技术人员可以根据发酵罐的大小设置诱导剂的加入量。
加入诱导剂后,调整发酵液的ph为7.0~7.5,采用双泵补料法进行发酵。
首先打开恒速补料泵,将恒速补料泵流加葡萄糖的速度调整至小于发酵液中葡萄糖的消耗速度。本发明中,优选恒速补料泵的补料速度为5~20ml/h/l,更优选为8~12ml/h/l。待恒速补料泵稳定时,打开溶氧关联泵,设置关联溶氧值为20~40%。观察溶氧曲线,根据溶氧曲线调整关联补料泵的开启时间。当发酵液的溶氧值高于设定值时,溶氧关联泵开启进行补料,当发酵液的溶氧值低于设定值时,溶氧关联泵关闭。通过双泵补料法调整至发酵液溶氧曲线浮动于设定值为止,发酵液溶氧浮动较小,上下浮动5%。
通常诱导10~12h后,菌液od600停止增长,结束发酵。发酵结束时,发酵液的od600长至150~190。
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例对本发明进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
以下实施例中,所采用的重组大肠杆菌为lkgh-0712(bl21pet30a-xf2)。
实施例1
接种:从保藏甘油管中取出菌液以1%接种量接入含有150mllb培养基(含氨苄青霉素500ug/ml)的摇瓶中,37℃摇床培养4h,待培养液od600长至2.5时,开始移种进罐。
按照以下配方配制10l发酵培养基:十二水和磷酸氢二钠200g,磷酸二氢钾150g,氯化铵200g,硫酸钠50g,七水合硫酸镁20g,蛋白胨200g,酵母粉100g,甘油200g,聚醚型消泡剂10ml,三氯化铁1.5g。
消罐:将配制好的发酵培养基倒入发酵罐,121℃灭菌30min;降温后控制发酵温度为37℃,通空气通气比为1:1,转速200rpm,稳定20min后标定溶氧为100%;用氨水调节发酵培养基ph为6.0±0.1。
进罐:将长好的种子液火焰接种进罐,接种量1%,并加入1ml氨苄青霉素,使氨苄青霉素在发酵液中的终浓度为500mg/l。
发酵控制:发酵前期发酵罐参数:200rpm,37℃,通气比1:1(进口空气压力0.08mpa),不控制发酵液的ph。随着发酵液od600增长,调整发酵罐搅拌转速及空气流量,使发酵液的溶氧控制在50%以上。ph开始下降时,向发酵液中补氨水,用0.5h将发酵液ph调至6.5;待发酵液溶氧突然上升时,固定此时发酵罐的转速及通气量(500rpm,10l/min)开始补加60%w/v的灭菌葡萄糖。将补料泵的电子开关与溶氧值设定为关联,设置关联溶氧值为20%,控制发酵液的溶氧值在10~50%。
诱导表达:定时取样检测发酵液od600,待发酵液od600长至40时,将发酵罐温度设定为25℃开始降温。当温度降到30℃以下时加入iptg6ml(终浓度1mm),开始诱导,并将发酵液ph调整为7.0,采用双泵法继续发酵。
首先打开恒速补料泵,设置恒速补料泵的流加葡萄糖的速度为10ml/h/l,待恒速补料泵稳定后,打开溶氧关联泵,设置关联溶氧值为20%,观察溶氧曲线,根据溶氧曲线调整关联泵的开启时间,调整至溶氧曲线浮动于20%为止,上下浮动5%。
诱导12h后,发酵液液od600停止增长,此时发酵液的od600为160,发酵液中的酶活为180u/ml。
实施例2
接种、消罐、进罐同实施例1。
发酵控制:发酵前期发酵罐参数:150rpm,37℃,通气比1:0.5(进口空气压力0.08mpa),不控制发酵液的ph。随着发酵液od600增长,调整发酵罐搅拌转速及空气流量,使发酵液的溶氧控制在50%以上。ph开始下降时,向发酵液中补氨水,用0.5h将发酵液ph调至6.5;待发酵液溶氧突然上升时,固定此时发酵罐的转速及通气量(500rpm,10l/min)开始补加60%w/v的灭菌葡萄糖。将补料泵的电子开关与溶氧值设定为关联,设置关联溶氧值为25%,控制发酵液的溶氧值在10~50%。
诱导表达:定时取样检测发酵液od600,待发酵液od600长至42时,将发酵罐温度设定为25℃开始降温。当温度降到30℃以下时加入iptg6ml(终浓度1mm),开始诱导,并将发酵液ph调整为7.0,采用双泵法继续发酵。
首先打开恒速补料泵,设置恒速补料泵的流加葡萄糖的速度为8ml/h/l,待恒速补料泵稳定后,打开溶氧关联泵,设置关联溶氧值为25%,观察溶氧曲线,根据溶氧曲线调整关联泵的开启时间,调整至溶氧曲线浮动于25%为止,上下浮动5%。
诱导12h后,发酵液液od600停止增长,此时发酵液的od600为180,发酵液中的酶活为185u/ml。
对比例1
接种、消罐、进罐、发酵控制同实施例1。
在诱导表达阶段采用单泵发酵法进行发酵。
具体为:将发酵罐的补料与溶氧相关联,设置关联溶氧值为20%。当发酵液的溶氧值高于20%时,补料开启进行补料;当发酵液的溶氧值低于20%时,补料关闭。经过检测,发酵液的溶氧值波动范围为0~60%,上限与下限相差60%左右。
诱导12h后,发酵液液od600停止增长,此时发酵液的od600为130,发酵液中的酶活为120u/ml。
表1单泵法和双泵法发酵重组大肠杆菌的效果分析
由表1可以看出,采用双泵法对重组大肠杆菌发酵,发酵过程中糖耗和氨水用量都有一定程度的提高,说明双泵法相对于单泵法更有利于重组大肠杆菌的生长繁殖。发酵结束时,双泵法的发酵液od600能够达到160±10,高于单泵法。发酵后,双泵法的发酵液中,水解酶的酶活达到180±10u/ml,提高了重组大肠杆菌发酵生产水解酶的产量。
本发明中的酶活定义为:35℃、ph9.5下,1min催化开环的洛伐他丁水解生成1μg莫那克林酸所需的酶量,定义为一个酶活单位(u)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!