一种诱导菌剂及应用其缓解反刍动物瘤胃酸中毒的方法与流程
本发明属于应用微生物技术领域,具体涉及一种m.elsdeniilc1诱导菌剂及应用其缓解反刍动物瘤胃酸中毒的方法。
背景技术:
现代集约化反刍动物养殖过程中,为了追求高生产性能,通常过量使用谷物饲料作为反刍动物的饲粮。富含大量谷物的饲粮饲喂反刍动物一定程度上显著地提高了其生产性能,但由于反刍动物瘤胃生理的特殊性,过量的谷物饲粮容易导致瘤胃微生物发酵失衡,具体表现为:乳酸等有机酸的大量产生与瘤胃微生物及瘤胃上皮的吸收失衡,有机酸在瘤胃中累积,引起瘤胃ph值降低,诱导酸中毒的发生。反刍动物瘤胃酸中毒能够诱发蹄叶炎、瘤胃上皮脱落、拉稀等临床症状,如不能够及时的发现并有针对性地治疗,将会直接影响反刍动物的生产、繁殖及使用周期,造成直接经济损失。
现有缓解瘤胃酸中毒的方法主要分为缓冲法盐和微生物菌剂法。缓冲盐法主要指的是通过饲喂小苏打等弱碱性类缓冲盐,从而达到提高瘤胃ph的目的,短期内具有明显的效果,但是并不能从本质上缓解酸中毒,因为并没有起到减少有机酸的量或改变瘤胃有机酸组成模式的作用;微生物菌剂法主要指饲喂埃氏巨型球菌(megasphaeraelsdenii)等乳酸利用菌,从而达到调节瘤胃发酵模式,减少瘤胃乳酸累积,提高瘤胃ph,最终缓解瘤胃酸中毒的目的。但目前问题在于,目前市场上菌剂因为适应性差等原因造成使用效果不佳。为此开发高适应性m.elsdenii菌剂以缓解瘤胃酸中毒十分必要。
技术实现要素:
本发明的目的是通过对m.elsdeniilc1菌株进行低营养富集诱导,提高其适应性及乳酸分解能力,达到利用其缓解高淀粉饲粮诱导瘤胃酸中毒的目的,具体为一种高适应性m.elsdenii诱导及应用其缓解瘤胃酸中毒的方法。
本发明涉及的涉及菌株为atcc标准菌株,菌株号为:atcc25940,获取网址为:https://www.atcc.org/products/all/25940.aspx
实现本发明目的的技术方案是:
一种m.elsdeniilc1诱导菌剂,所述菌剂的制备过程为:在厌氧工作站进行种子培养后,取出种子培养液,向高营养诱导培养基中直接接种种子培养液进行高营养富集诱导,后接种至中营养诱导培养基进行中营养富集诱导,最后接种至低营养诱导培养基进行低营养富集诱导,得到m.elsdeniilc1诱导菌剂;诱导过程中诱导罐密闭且无需通入其他气体,以乳酸为发酵底物,进行底物不同乳酸浓度的梯度诱导,诱导全过程保持厌氧。
进一步地,所述种子培养过程为:取出冻存的m.elsdeniilc1菌株种子细菌液,以1%的接种量接种种子培养基,36~39℃厌氧培养,所述培养时间为8到10小时,待到种子培养基浑浊度od值为0.38~0.42时,取出种子培养液接种到新的种子培养基中继续培养,所述培养时间为8到10小时,再次待到培养液浑浊度od值为0.38~0.42时,取出种子培养液进行高营养富集诱导。
更进一步地,所述种子培养基是以水为溶质,向其中加入质量比为1.0%胰蛋白胨,0.5%酵母提取物,0.5%牛肉提取物,0.5%葡萄糖,0.05%半胱氨酸盐酸盐,0.4%na2hpo4,5.0%无菌脱纤维马血,0.002%d,l-乳酸,0.0005%刃天青。将配置的种子培养基液高温105到110℃灭菌除氧后密封冷却,调节ph为6.8到7.0。
进一步地,所述高营养诱导培养基是以水为溶质,向其中加入质量比为0.1%胰蛋白胨,0.1%酵母提取物,0.06%半胱氨酸盐酸,0.09%k2hpo4,0.09%kh2po4,0.18%nacl,0.024%cacl·2h2o,0.083%mgso4·7h2o,0.18%(nh3)2so4,3.0%胎牛血清,0.3%葡萄糖及0.36%d,l-乳酸。将配置的发酵产酸培养基液在105到110℃高温灭菌10分钟除氧后密封冷却,调节ph为6.7到7.0。
进一步地,所述中营养诱导培养基是以水为溶质,向其中加入质量比为0.1%胰蛋白胨,0.1%酵母提取物,0.06%半胱氨酸盐酸,0.09%k2hpo4,0.09%kh2po4,0.18%nacl,0.024%cacl·2h2o,0.083%mgso4·7h2o,0.18%(nh3)2so4及0.18%d,l-乳酸。将配置的发酵产酸培养基液在105到110℃高温灭菌10分钟除氧后密封冷却,调节ph为6.7到7.0。
进一步地,所述低营养诱导培养基是以水为溶质,向其中加入质量比为0.1%胰蛋白胨,0.1%酵母提取物,0.06%半胱氨酸盐酸,0.09%k2hpo4,0.09%kh2po4,0.18%nacl,0.024%cacl·2h2o,0.083%mgso4·7h2o,0.18%(nh3)2so4及0.09%d,l-乳酸。将配置的发酵产酸培养基液在105到110℃高温灭菌10分钟除氧后密封冷却,调节ph为6.7到7.0。
进一步地,所述高营养富集诱导是将种子培养液以0.3%到1%的量接种到高营养诱导培养基,诱导水浴温度控制为37℃到39℃,无需通入特殊气体,设置培养液搅拌速度为100到200rpm,诱导生长18到24小时后取菌液接种至一新高营养诱导培养基,如此往复3到4次后,取出诱导菌液进行中营养富集诱导。
进一步地,所述中营养富集诱导是将高营养诱导菌液以0.5%到1%的量接种到中营养诱导培养基,诱导水浴温度控制为37℃到39℃,无需通入特殊气体,设置培养液搅拌速度为100到200rpm,诱导生长20到26小时后取菌液接种至一新中营养诱导培养基,如此往复3到4次后,取出诱导菌液进行低营养富集诱导。
进一步地,所述低营养富集诱导是将中营养诱导菌液以1%到2%的量接种到低营养诱导培养基,诱导水浴温度控制为37℃到39℃,无需通入特殊气体,设置培养液搅拌速度为100到200rpm,诱导生长24到30小时后取菌液接种至一新中营养诱导培养基,如此往复5到7次后,得到m.elsdeniilc1诱导菌剂。
本发明还提供一种应用上述m.elsdeniilc1诱导菌剂缓解瘤胃酸中毒的方法。
具体包括以下步骤:
取出m.elsdeniilc1诱导菌剂进行瘤胃灌注,选择8只成年干奶期萨能奶山羊,采用自身对照试验设计,设置对照期、酸中毒诱导期及m.elsdenii菌液灌注期共3期试验。于每日08:00和20:00对时饲喂。对照期饲喂含20%破碎玉米及80%燕麦草的tmr饲粮。诱导期饲喂含50%破碎玉米及50%燕麦草的tmr饲粮。灌注期饲粮同诱导期,并于饲喂前通过瘤胃瘘管灌注200ml低营养富集菌液(灌注过程15s内完成)。对照期连续饲喂9d后于第10天采集样品。诱导期设置为10天。其中,前3天饲粮破碎玉米比例从20%提升至50%,随后连续饲喂7天,于第7天采集样品。灌注期设置为10天并于第10天采集样品。采样时间设置为08:00起(第一次采样为饲喂前)每隔1.5h通过瘤胃瘘管采集瘤胃腹囊瘤胃液5ml用以测定ph,每隔3.0h通过瘤胃瘘管采集瘤胃腹囊瘤胃液20ml用以测定瘤胃液相关指标。
本发明的有益效果在于提供了一种利用m.elsdeniilc1菌株诱导产生高适应性及乳酸分解能力,从而缓解瘤胃酸中毒的方法。从菌株的种子培养到诱导全程保持厌氧,步骤简单,操作方便,诱导过程中不需要进行特殊气体的补充,以乳酸为唯一碳源,节约了生产成本并能够获得较高适应性及乳酸分解能力的m.elsdeniilc1菌株,瘤胃灌注酸中毒反刍动物,缓解瘤胃酸中毒,具有重大的生产实践应用价值及经济效益。
附图说明
图1瘤胃灌注低营养富集m.elsdenii菌液对瘤胃液ph变化的影响(●对照期,■sara期,▲灌菌期)。
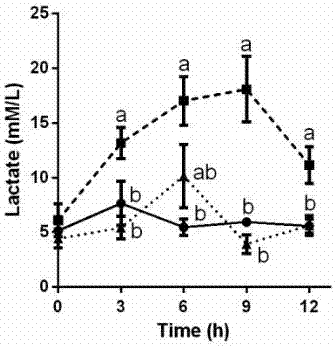
图2瘤胃灌注低营养富集m.elsdenii菌液对瘤胃液乳酸浓度的影响(●对照期,■sara期,▲灌菌期)。
图3瘤胃灌注低营养富集m.elsdenii菌液对瘤胃液lps浓度的影响(●对照期,■sara期,▲灌菌期)。
具体实施方式
本实施例说明利用m.elsdeniilc1菌株进行低营养诱导富集,瘤胃瘘管灌注高淀粉饲粮饲喂下的酸中毒山羊。
实施例1:制备种子培养基
种子培养基:以水为溶质,向其中加入质量比为1.0%胰蛋白胨,0.5%酵母提取物,0.5%牛肉提取物,0.5%葡萄糖,0.05%半胱氨酸盐酸盐,0.4%na2hpo4,5.0%无菌脱纤维马血,0.002%d,l-乳酸,0.0005%刃天青。将配置的种子培养基液高温110℃灭菌除氧后密封冷却,调节ph为7.0。
实施例2:制备高营养富集诱导培养基
高营养富集诱导培养基:以水为溶质,向其中加入质量比为0.1%胰蛋白胨,0.1%酵母提取物,0.06%半胱氨酸盐酸,0.09%k2hpo4,0.09%kh2po4,0.18%nacl,0.024%cacl·2h2o,0.083%mgso4·7h2o,0.18%(nh3)2so4,3.0%胎牛血清,0.3%葡萄糖及0.36%d,l-乳酸。将配置的发酵产酸培养基液在110℃高温灭菌10分钟除氧后密封冷却,调节ph为7.0。
实施例3:制备中营养富集诱导培养基
中营养富集诱导培养基:以水为溶质,向其中加入质量比为0.1%胰蛋白胨,0.1%酵母提取物,0.06%半胱氨酸盐酸,0.09%k2hpo4,0.09%kh2po4,0.18%nacl,0.024%cacl·2h2o,0.083%mgso4·7h2o,0.18%(nh3)2so4及0.18%d,l-乳酸。将配置的发酵产酸培养基液在110℃高温灭菌10分钟除氧后密封冷却,调节ph为7.0。
实施例4:制备低营养富集诱导培养基
低营养富集诱导培养基:以水为溶质,向其中加入质量比为0.1%胰蛋白胨,0.1%酵母提取物,0.06%半胱氨酸盐酸,0.09%k2hpo4,0.09%kh2po4,0.18%nacl,0.024%cacl·2h2o,0.083%mgso4·7h2o,0.18%(nh3)2so4及0.09%d,l-乳酸。将配置的发酵产酸培养基在110℃高温灭菌10分钟除氧后密封冷却,调节ph为7.0。
实施例5:
一种m.elsdeniilc1诱导菌剂,所述菌剂的制备过程为:
1)种子培养:培养过程为将冻存的的m.elsdeniilc1菌株接种到种子培养基中,36℃培养8小时后,待到种子培养基浑浊度od达到0.38时,移取1ml接种到10ml新的种子培养基中,继续培养10小时,待到种子培养基浑浊度od达到0.42时,取出种子培养液进行诱导富集。
2)诱导富集步骤为:首先向高营养培养基中接种1%上述种子培养液(处于对数生长期,od为0.42)。培养15h后吸取2ml培养液接种于一新高营养培养基中(实施例2培养基),如此反复3次;取最后一次高营养富集菌液2ml接种于一中营养培养基(实施例3培养基)中,培养20h后吸取2ml培养液接种于一新中营养培养基中,如此反复3次;取最后一次中营养富集菌液2ml接种于一低营养培养基(实施例4的培养基)中,培养24h后吸取2ml培养液接种于一新低营养培养基中,如此反复5次并将最后一次菌液保留,得到m.elsdeniilc1诱导菌剂,用于瘤胃灌注。整个富集培养过程在恒温震荡摇床中进行,温度设置为37℃,震荡转速为160rpm/min。
实施例6
灌注试验设计:选择8只成年干奶期萨能奶山羊,采用自身对照试验设计,设置对照期、酸中毒诱导期及m.elsdenii菌液灌注期共3期试验。于每日08:00和20:00对时饲喂。对照期饲喂含20%破碎玉米及80%燕麦草的tmr饲粮。诱导期饲喂含50%破碎玉米及50%燕麦草的tmr饲粮。灌注期饲粮同诱导期,并于饲喂前通过瘤胃瘘管灌注200ml低营养富集菌液(灌注过程15s内完成)。对照期连续饲喂9d后于第10天采集样品。诱导期设置为10天。其中,前3天饲粮破碎玉米比例从20%提升至50%,随后连续饲喂7天,于第7天采集样品。灌注期设置为10天并于第10天采集样品。采样时间设置为08:00起(第一次采样为饲喂前)每隔1.5h通过瘤胃瘘管采集瘤胃腹囊瘤胃液5ml用以测定ph,每隔3.0h通过瘤胃瘘管采集瘤胃腹囊瘤胃液20ml用以测定瘤胃液相关指标(采集过程30s内完成)。
指标测定方法及结果:利用ph计(sevenexcellence,inlabroutinepro-ismmeter,mettler-toledo,瑞士)测定瘤胃液ph值,根据各时间点ph变化绘制ph变化曲线。结果表明,相较高淀粉饲粮诱导的酸中毒组,灌注低营养富集诱导m.elsdenii菌液显著提高了瘤胃液ph(图1)。
取1ml瘤胃液,10000rpm/min室温离心5min后吸取上清液,浓盐酸滴定ph至2.5,后用0.22um水相滤膜过滤,保留滤过液用以测定有机酸。通过高效液相色谱(hplc,lc-15c,shimadzu,日本)测定瘤胃液有机酸含量。选用有机酸色谱柱(pn.062902,thermo,美国),检测选择紫外检测器(uv210nm),柱箱温度设置为30℃,流动相(100mm/lna2so4,甲磺酸校正ph至2.65)流速为0.6ml/min。结果表明,相较高淀粉饲粮诱导的酸中毒组,灌注低营养富集诱导m.elsdenii菌液显著降低了瘤胃液乳酸浓度(图2)。
取1ml瘤胃液随即室温10000rpm/min离心5min,收集上清液,后用去内毒素水梯度稀释样品10000倍,用于测定瘤胃液内毒素(lps)含量。测定选用显色基质鲎试剂盒(pn.ce80545,厦门鲎试剂),测定步骤参照说明书进行。结果表明,相较高淀粉饲粮诱导的酸中毒组,灌注低营养富集诱导m.elsdenii菌液显著降低瘤胃液游离lps浓度(图3)。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于热诱导的肾神经调制的方法和系统的制作方法
- 用于实现血管内热诱导肾神经调节的设备、系统以及方法
- 诱导缓解维持剂的制作方法
- 一种环磷腺苷冻干制剂及其制备方法
- As<sub>2</sub>O<sub>3</sub>联合TSA在制备诱导白血病HL60细胞由部分分化向终末分化转变的药物中的应用的制作方法
- As<sub>2</sub>O<sub>3</sub>联合TSA在制备诱导白血病HL60细胞由部分分化向凋亡转变的药物中的应用的制作方法
- 用于药物诱导型肾病和肝病的预防或治疗组合物的制作方法
- 一种药物组合物及其应用的制作方法
- 用于预防和/或治疗抗癌剂诱导的外周神经病的乙酰基-l-肉碱的制作方法
- 治疗急性白血病的中成药及其制备工艺的制作方法