一种与肝癌发生发展相关的非编码基因的应用的制作方法
本发明属于生物医药领域,涉及一种与肝癌发生发展相关的非编码基因的应用,具体的所述非编码基因为ensg00000259153。
背景技术:
肝细胞癌(hepatocellularcarcinoma,hcc)是世界范围内最常见的人类癌症之一。我国每年新发及死亡hcc病例约占全世界病例的一半以上。在我国,hcc患者中约80%是乙型肝炎病毒(hepatitisbvirus,hbv)携带者。尽管医疗水平不断提高,hbv相关hcc患者的5年生存率仍然很低。发现和鉴定肝癌的致病基因,研究其与肝癌发生和发展之间的关系,不仅有助于阐明肝癌形成的机制,而且对于肝癌新的预防、诊断、治疗措施的研发都具有极为重要的意义。
长链非编码rna(longnon-codingrna,lncrna)是指长度超过200个核苷酸的非编码rna。与其它的非编码rna(如microrna)相比,lncrna具有更长的序列与更复杂的二级结构和三级结构。众多已有研究表明,lncrna不仅在细胞周期、凋亡和分化等基本的细胞生物学过程中发挥调控功能,在癌症等疾病的发生发展过程中也发挥着重要作用。在癌症中,lncrna的转录水平异常往往可以标志着疾病的进展程度,甚至可以用来预测个体的患病风险。
技术实现要素:
为了弥补现有技术的不足,本发明的目的之一,提供一种诊断肝癌的产品,所述产品可以通过检测基因的表达水平判断患者是否患有肝癌或者患肝癌的风险。
本发明的目的之二,提供一种治疗肝癌的药物组合物或手段。通过改变基因标志物的表达从而治疗肝癌。
本发明的目的之三,提供一种筛选预防或治疗肝癌潜在物质的手段,通过检测所述物质对基因标志物的表达水平的改变来判断该物质是否为潜在物质。
为了实现上述目的,本发明采用如下技术方案:
本发明提供了检测ensg00000259153表达水平的试剂在制备诊断肝癌的产品中的应用。其中,ensg00000259153基因在肝癌患者中表达上调。
进一步,所述试剂包括:通过rt-pcr、实时定量pcr、原位杂交、芯片或高通量测序平台检测样本中ensg00000259153基因的表达水平以诊断肝癌用试剂。所述“样本”包括细胞、组织、脏器、体液(血液、淋巴液等)、消化液、咳痰、肺胞支气管清洗液、尿、粪便等。优选的,所述样本为组织、血液。在本发明的具体实施方式中,所述样本为组织。
进一步,所述用实时定量pcr诊断肝癌的试剂至少包括一对特异性扩增ensg00000259153基因的引物,在本发明的具体实施例中所述引物序列如seqidno.2和seqidno.3所示。
本发明提供了一种诊断早期肝癌的产品,所述产品包括检测ensg00000259153表达水平的试剂,所述产品包括芯片、核酸膜条或试剂盒;
进一步,所述试剂包括特异性识别ensg00000259153的探针,或特异性扩增ensg00000259153的引物。
本发明中基因检测试剂盒或基因芯片可用于检测包括ensg00000259153基因在内的多个基因(例如,与肝癌相关的多个基因)的表达水平,将肝癌的多个标志物同时进行检测,可大大提高肝癌诊断的准确率。
本发明提供了一种ensg00000259153基因的用途,用于筛选预防或治疗肝癌潜在物质。
进一步,用于筛选预防或治疗肝癌潜在物质的步骤包括:
用候选物质处理表达或含有ensg00000259153基因的体系;和
检测所述体系中ensg00000259153基因的表达;
其中,若所述候选物质可降低ensg00000259153基因的表达水平(优选显著降低,如低20%以上,较佳的低50%以上;更佳的低80%以上),则表明该候选物质是预防或治疗肝癌的潜在物质。所述体系选自:细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系。
所述候选物质包括(但不限于):针对ensg00000259153基因或其上游或下游基因设计的干扰分子、核酸抑制物、小分子化合物等。
本发明提供了一种ensg00000259153基因的用途,用于制备治疗肝癌的药物组合物。
进一步,所述药物组合物包括ensg00000259153基因的抑制剂。
本发明提供了一种治疗肝癌的药物组合物,所述药物组合物包括ensg00000259153基因的抑制剂。所述抑制剂选自:以ensg00000259153或其转录本为靶序列、且能够抑制ensg00000259153基因表达或基因转录的干扰分子,包括:shrna(小发夹rna)、小干扰rna(sirna)、dsrna、微小rna、反义核酸,或能表达或形成所述shrna、小干扰rna、dsrna、微小rna、反义核酸的构建物。优选的,所述的抑制剂为sirna。
在筛选有效的sirna序列时,本发明人通过大量的比对分析,从而找出最佳的有效片段。通过设计合成了多种sirna序列,并将它们分别通过转染试剂转染至肝癌细胞系进行验证,选出干扰效果最佳的sirna,进一步地在细胞水平实验,结果证明该sirna能有效的抑制细胞中ensg00000259153基因的表达水平,以及肝癌细胞的增殖。
进一步,所述药物组合物还包括与所述抑制剂相配伍的其他药类以及药学上可接受的载体和/或辅料。其中,药学上可接受的载体和/或辅料包括(但不限于)如缓冲剂、乳化剂、悬浮剂、稳定剂、防腐剂、生理食盐等。作为缓冲剂,能够使用磷酸盐、甘氨酸,山梨酸,山梨酸钟,饱和植物脂肪酸的部分甘油酯混合物,水,盐或电解质例如硫酸钾、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐,胶态二氧化硅,三硅酸镁,聚乙烯吡咯烷酮,基于纤维素的物质,聚乙二醇,羧甲基纤维素钠,聚丙烯酸酯,蜡,聚乙烯-聚氧丙烯嵌段共聚物,聚乙二醇和羊毛脂等。作为乳化剂,能够使用阿拉伯树胶、海藻酸钠、西黄芪胶等。作为悬浮剂,能够使用单硬脂酸甘油、单硬脂酸铝、甲基纤维素、羧甲基纤维素、羟甲基纤维素、月桂基硫酸钠等。作为稳定剂,能够使用丙二醇、二亚乙基亚硫酸盐、抗坏血酸等。作为防腐剂,能够使用叠氮化钠、苯扎氯铵、对羟苯甲酸、氯丁醇等。
本发明的药物组合物还可以包括离子交换剂如矾土,硬脂酸铝,卵磷脂,半乳化药物递送系统(sedds)例如dα-生育酚聚乙二醇1000琥珀酸盐,在药物剂型中使用的表面活性剂例如吐温或其它类似聚合递送基质,血清蛋白例如人血清白蛋白,也可以使用环糊精例如α-环糊精、β-环糊精、和γ-环糊精,或化学修饰的衍生物例如是羟基烷基环糊精,包括2-和3-羟基丙基-β-环糊精、或其它增溶衍生物来促进本发明化合物的递送。本发明所述携带基因的载体是本领域已知的各种载体,如市售的载体、包括质粒、粘粒、噬菌体、病毒等。
本发明的药物组合物还包括药学上可接受的赋形剂、填充剂、凝结剂与调和剂,如含水乳糖或无水乳糖、淀粉、葡萄糖、蔗糖、甘露醇、山梨醇、硅酸、微晶纤维素、羟甲基纤维素钠、淀粉甘醇酸钠及其衍生物等。
本发明的药物组合物还包含界面活性剂、乳化剂、扩散剂、消泡剂、涂层材料等。任何药学上或医学上可接受的界面活性剂、乳化剂、扩散剂、消泡剂等皆可被使用。
本发明所述药物组合物可口服给药、非胃肠道给药、通过吸入喷雾给药、局部给药、直肠给药、鼻给药、颊给药、阴道给药或通过植入的贮药装置给药。优选口服给药或注射给药。本发明药物组合物可含有任何常用的无毒可药用载体、辅料或赋形剂。在某些情况下,药用酸、碱或缓冲剂可用来调节制剂的ph以提高所配制的化合物或其给药剂型的稳定性。本文所用术语非胃肠道包括皮下、皮内、静脉内、肌内、关节内、动脉内、滑膜内、胸骨内、鞠内、损伤部位内、和颅内注射或输注技术。只要能达到目标组织,本发明所述药物组合物可以通过任何途径给予受体。
本发明药物组合物可以以任何口服剂型的形式口服给药,包括但不限于胶囊、片剂、乳剂和水悬浮液、分散剂和溶液。对于口服片剂,常用载体包括乳糖和玉米淀粉。一般还加入润滑剂例如硬脂酸镁。为了以胶囊形式口服给药,适用的稀释剂包括乳糖和无水玉米淀粉。当口服施用水悬浮液和/或乳液时,可将活性组分悬浮或溶解在油相中,并与乳化剂和/或悬浮剂合并。如果需要的话,可加入一些甜味剂和/或矫味剂和/或着色剂。适当时,可将用于口服给药的剂量单位制剂包微囊。例如,通过在聚合物、蜡等中将颗粒物质包衣或包埋,也可制备所述制剂已延长或维持释放。本发明的药物组合物可以用于下调内源性的ensg00000259153的过表达,通过降低ensg00000259153基因的表达,从而治疗因ensg00000259153表达上调引起的肝癌。
本发明的药物组合物可进一步包含一种或多种抗癌剂。在具体的实施方案中,药物组合物包含至少一种抑制ensg00000259153基因表达的化合物和至少一种化疗剂。用于本发明的化疗剂,包括但不限于:微管激活剂、烷化剂、抗赘生抗代谢物、铂类化合物、dna-烷化剂,抗肿瘤抗生素剂,抗代谢剂,微管蛋白稳定剂,微管蛋白去稳定剂,激素拮抗剂,拓扑异构酶抑制剂,蛋白激酶抑制剂,hmg-coa抑制剂,cdk抑制剂,细胞周期蛋白抑制剂,胱天蛋白酶抑制剂,金属蛋白酶抑制剂,反义核酸,三链螺旋dna,核酸适体,和分子修饰的病毒、细菌和外毒素试剂。
本发明的药物还可与其他治疗肝癌的药物联用,其他治疗性化合物可以与主要的活性成分同时给药,甚至在同一组合物中同时给药。还可以以单独的组合物或与主要的活性成分不同的剂量形式单独给予其它治疗性化合物。主要成分的部分剂量可以与其它治疗性化合物同时给药,而其它剂量可以单独给药。在治疗过程中,可以根据症状的严重程度、复发的频率和治疗方案的生理应答,调整本发明药物组合物的剂量。
在本发明中,术语“生物标记物”是其在组织或细胞中的表达水平与正常或健康细胞或组织的表达水平相比发生改变的任何基因。
本领域技术人员将认识到,本发明的实用性并不局限于对本发明的标志物基因的任何特定变体的基因表达进行定量。作为非限制性的实例,标志物基因可具有seqidno.1指定的核苷酸序列。
本发明可以利用本领域内已知的任何方法测定基因表达。本领域技术人员应当理解,测定基因表达的手段不是本发明的重要方面。可以在转录水平上检测生物标志物的表达水平。
在本发明中,术语“芯片”包括:固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述的寡核苷酸探针特异性地对应于ensg00000259153所示的部分或全部序列。术语“核酸膜条”包括基底和固定于所述基底上的寡核苷酸探针,所述基底可以是任何适于固定寡核苷酸探针的基底,例如尼龙膜、硝酸纤维素膜、聚丙烯膜、玻璃片、硅胶晶片、微缩磁珠等。
具体地,可根据本发明所述的lncrna,设计出适合的探针,固定在固相载体上,形成“寡核苷酸阵列”。所述的“寡核苷酸阵列”是指具有可寻址位置(即以区别性的,可访问的地址为特征的位置)的阵列,每个可寻址位置均含有一个与其相连的特征性寡核苷酸。根据需要,可将寡核苷酸阵列分成多个亚阵。
所述固相载体包括塑料制品、微颗粒、膜载体等。所述塑料制品可通过非共价或物理吸附机制与抗体或蛋白抗原相结合,最常用的塑料制品为聚苯乙烯制成的小试管、小珠和微量反应板;所述微颗粒是由高分子单体聚合成的微球或颗粒,其直径多为微米,由于带有能与蛋白质结合的功能团,易与抗体(抗原)形成化学偶联,结合容量大;所述膜载体包括硝酸纤维素膜、玻璃纤维素膜及尼龙膜等微孔滤膜。
术语“试剂盒”可用于检测ensg00000259153的表达水平,包括(但不限于)可检测ensg00000259153表达水平的芯片、核酸膜条以及pcr引物。在本发明的具体实施方式中,所述引物具有seqidno.2~3所示的序列。所述试剂盒中还可包括样本核酸的提取试剂、pcr反应试剂、对照液等。此外,所述试剂盒还包括使用说明书和/或芯片图像分析软件。
术语“探针”指能与另一分子的特定序列或亚序列或其它部分结合的分子。除非另有指出,术语“探针”通常指能通过互补碱基配对与另一多核苷酸(往往称为“靶多核苷酸”)结合的多核苷酸探针。根据杂交条件的严谨性,探针能和与该探针缺乏完全序列互补性的靶多核苷酸结合。探针可作直接或间接的标记,其范围包括引物。杂交方式,包括,但不限于:溶液相、固相、混合相或原位杂交测定法。
所述探针具有与靶点基因的特定的碱基序列互补的碱基序列。这里,所谓“互补”,只要是杂交即可,可以不是完全互补。这些多核苷酸通常相对于该特定的碱基序列具有80%以上、优选90%以上、更优选95%以上、特别优选100%的同源性。这些探针可以是dna,也可以是rna,另外,可以为在其一部分或全部中核苷酸通过pna(polyamidenucleicacid,肽核酸)、lna(注册商标,lockednucleicacid,bridgednucleicacid,交联化核酸)、ena(注册商标,2′-o,4′-c-ethylene-bridgednucleicacids)、gna(glycerolnucleicacid,甘油核酸)、tna(threosenucleicacid,苏糖核酸)等人工核酸置换得到的多核苷酸。
在本发明中,针对ensg00000259153基因的寡核苷酸探针可以是dna、rna、dna-rna嵌合体、pna或其它衍生物。所述探针的长度没有限制,只要完成特异性杂交、与目的核苷酸序列特异性结合,任何长度都可以。所述探针的长度可短至25、20、15、13或10个碱基长度。同样,所述探针的长度可长至60、80、100、150、300个碱基对或更长,甚至整个基因。由于不同的探针长度对杂交效率、信号特异性有不同的影响,所述探针的长度通常至少是14个碱基对,最长一般不超过30个碱基对,与目的核苷酸序列互补的长度以15-25个碱基对最佳。所述探针自身互补序列最好少于4个碱基对,以免影响杂交效率。
本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。在本发明中,是本领域已知的各种载体,如市售的载体、包括质粒、粘粒、噬菌体、病毒等。表达载体向宿主细胞中的导入可以使用电穿孔法、磷酸钙法、脂质体法、deae葡聚糖法、显微注射、病毒感染、脂质体转染、与细胞膜透过性肽的结合等周知的方法。
本发明的药物组合物可以按药剂学上有效的量进行给药,本发明的用语“药剂学上有效的量”指的是以可适用于医学治疗或预防的合理的受惠/危险比率足以治疗或预防疾病的量,可根据包括疾病的严重程度、药物的活性、患者的年龄、体重、健康、性别、患者对药物的敏感度、所使用的本发明组合物的给药时间、给药途径及排出比率、治疗时间、与所使用的本发明的组合物配合或同时使用的药物的要素及其它医学领域中公知的要素来决定有效用量水平。本发明的药物组合物可作为单独的治疗剂进行给药,或是与其它治疗剂并用地进行给药,可以与以往的治疗剂依次地或同时地进行给药。此外,可单次或多次地进行给药。重要的是,需要对上述要素均加以考虑,并且以无副作用的最少的量可取得最大效果的量进行给药。
统计学分析
在本发明的具体实施方式中,实验都是按照至少重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用spss18.0统计软件来进行统计分析的,两者之间的差异采用t检验,认为当p<0.05时具有统计学意义。
附图说明
图1是利用qpcr检测ensg00000259153在肝癌患者中的表达情况图;
图2是利用tcga数据库交叉验证ensg00000259153在肝癌患者中的差异表达图;图3是ensg00000259153在肝癌患者中的roc曲线图;
图4是利用qpcr检测ensg00000259153在肝癌细胞中的表达情况图;
图5是检测转染sirna对肝癌细胞中ensg00000259153的表达影响图;
图6是利用cck8检测ensg00000259153对细胞增殖的影响图;
图7是检测ensg00000259153对细胞的克隆形成集落的影响图;
图8是检测ensg00000259153对肝癌细胞凋亡的影响图;
图9是transwell小室检测ensg00000259153基因对肝癌细胞迁移和侵袭的影响图;其中,图a是ensg00000259153基因对肝癌细胞迁移的影响图,图b是ensg00000259153基因对肝癌细胞迁移的影响图。
具体的实施方式
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1筛选与肝癌相关的基因标志物
1、样品收集
各收集10例肝癌患者的癌组织以及癌旁组织,患者均知情同意,上述所有标本的取得均通过组织伦理委员会的同意。
2、rna样品的制备
利用qiagen的组织rna提取试剂盒进行组织rna的提取,按说明书的具体步骤进行操作。
3、逆转录和标记
用lowrnainputlinearamplificationkit将mrna逆转录成cdna,同时用cy3分别标记实验组和对照组。
4、杂交
基因芯片采用康城生物-humanlncrnaarray,按芯片使用说明书的步骤进行杂交。
5、数据处理
杂交后芯片用agilent扫描仪扫描,分辨率为5μm,扫描仪自动以100%和10%pmt各扫描1次,2次结果agilent软件自动合并。扫描图像数据采用featureextraction进行处理分析,得到的原始数据应用bioconductor程序包进行后续数据处理。最后ratio值为实验组和对照组。差异基因筛选标准:fdr<0.01,abs(log2fc)>1.5。
6、结果
与癌旁组织相比,ensg00000259153基因在肝癌组织中的表达水平显著高于癌旁组织。
实施例2qpcr测序验证ensg00000259153基因的差异表达
1、对ensg00000259153基因差异表达进行大样本qpcr验证。按照实施例1中的样本收集方式肝癌组织和癌旁组织样本各60例。
2、rna提取步骤同实施例1。
3、逆转录:
采用25μl反应体系,每个样品取1μg总rna作为模板rna,在pcr管中分别加入以下组分:depc水,5×逆转录缓冲液,10mmdntp,0.1mmdtt,30μmoligodt,200u/μlm-mlv,模板rna。42℃孵育1h,72℃10min,短暂离心。
(3)qpcr扩增检验
根据ensg00000259153基因和管家基因的gapdh的序列设计引物,引物序列由上海生工合成。其中,ensg00000259153基因的引物序列如seqidno.2~3所示,管家基因gapdh的引物序列如seqidno.4~5所示。
配制25μl反应体系:sybrgreen聚合酶链式反应体系12.5μl,正反向引物(5μm)各1μl,模板cdna2.0μl,无酶水8.5μl。各项操作均于冰上进行。
扩增程序为:95℃60s,(95℃15s,60℃15s,72℃45s)×35个循环。
以sybrgreen作为荧光标记物,在lightcycler荧光实时定量pcr仪上进行pcr反应,通过融解曲线分析和电泳确定目的条带,δδct法进行相对定量。
3、结果
结果如图1所示,与癌旁组织相比,ensg00000259153基因在肝癌组织中表达上调,差异具有统计学意义(p<0.05),同rna-sep结果一致。
实施例3分析ensg00000259153在tcga数据库中的表达情况
1、数据收集
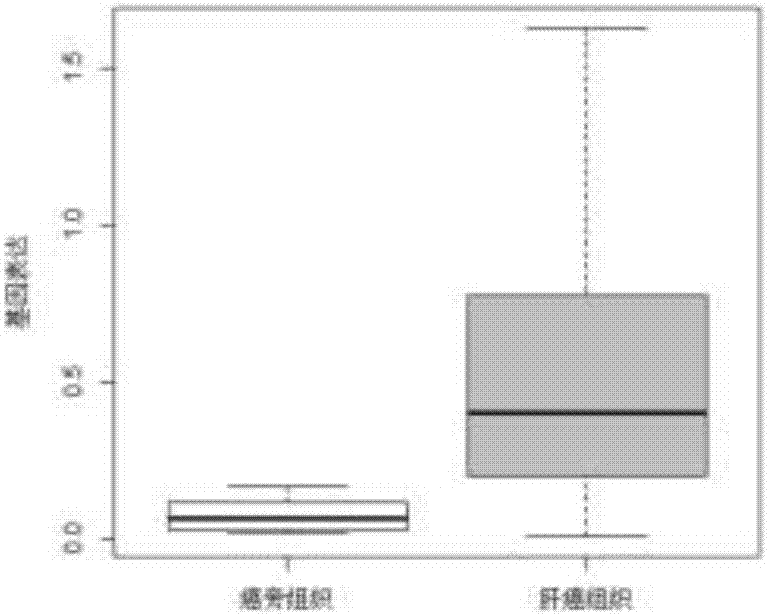
从tcga数据库中收集200例肝癌组织和50例癌旁组织的lncrna表达谱数据,分析ensg00000259153在肝癌组织和癌旁组织中的表达水平;绘制箱线图。
2、roc曲线分析
使用r语言中的proc包分析ensg00000259153的受试者工作特征,计算二项精确置信空间,绘制roc曲线。
3、结果
ensg00000259153的表达水平如图2所示,相比对照组,ensg00000259153在肝癌组织中表达显著上调。
ensg00000259153的roc曲线如图3所示,ensg00000259153的auc值高达0.909,说明ensg00000259153应用于肝癌的诊断具有较高的准确性和敏感性。
实施例4ensg00000259153基因在肝癌细胞系中的差异表达
1、细胞培养
人肝癌细胞株hepg2、huh7和正常肝细胞系hl-7702,以含10%胎牛血清和1%p/s的培养基dmem在37℃、5%co2、相对湿度为90%的培养箱中培养。2-3天换液1次,使用0.25%含edta的胰蛋白酶常规消化传代。
2、rna的提取
1)胰酶消化贴壁细胞,吹打获得的细胞经离心、重悬、清洗后,以含10%fbs的dmem培养基重悬;
2)将重悬的细胞转移至6孔板,添加培养基至2ml/孔,轻摇6孔板使细胞均匀重悬;
3)细胞贴壁生长48h,去培养基;
4)以1mltrizol试剂裂解细胞,反复吹打6孔板壁,尽量使细胞完全裂解;
5)转移细胞裂解液至1.5mldepc处理过的ep管中,置于冰上。加入0.2m1氯仿,剩余操作步骤同组织中rna提取过程。
3、逆转录
具体步骤同实施例2.
4、结果
结果如图4所示,与正常肝细胞系相比,ensg00000259153基因在肝癌细胞hepg2、huh7中表达均上调,差异具有统计学意义(p<0.05),同rna-sep结果一致。
实施例5ensg00000259153基因的沉默
1、细胞培养
人肝癌细胞株hepg2,以含10%胎牛血清和1%p/s的培养基dmem在37℃、5%co2、相对湿度为90%的培养箱中培养。2-3天换液1次,使用0.25%含edta的胰蛋白酶常规消化传代。
2、sirna设计
针对ensg00000259153基因设计sirna序列,其中,sirna1序列如seqidno.6~7所示;sirna2序列如seqidno.8~9所示;sirna3序列如seqidno.10~11所示,阴性对照sirna序列(sirna-nc)如seqidno.12~13所示。
将细胞按2×105/孔接种到六孔细胞培养板中,在37℃、5%co2培养箱中细胞培养24h;在无双抗、含10%fbs的dmem培养基中,转染按照脂质体转染试剂2000(购自于invitrogen公司)的说明书转染。
实验分为空白对照组(hepg2)、阴性对照组(sirna-nc)和实验组(20nm)(sirna1、sirna2、sirna3),其中阴性对照组sirna与ensg00000259153基因的序列无同源性,浓度为20nm/孔,同时分别进行转染。
3、qpcr检测ensg00000259153基因的表达水平
3.1细胞总rna的提取
具体步骤同实施例4。
3.2逆转录步骤同实施例2。
3.3qpcr扩增步骤同实施例2。
4、结果
结果如图5显示,相比hepg2、转染空载sirna-nc、sirna1、sirna3组,sirna2组能够显著降低ensg00000259153的表达,差异具有统计学意义(p<0.05)。
实施例6cck8检测细胞增殖实验
1、细胞培养与转染步骤同实施例4
2、cck8检测细胞增殖
1)将对数增殖期的hepg2细胞接种于96孔板,每孔2×103个细胞;
2)实验分三组,分别是空白对照组、转染sirna-nc组和转染sirna1,每组设6个复孔;
3)分别在转染0h、24h、48h、72h后加入10μl/孔cck8试剂;
4)2h后使用酶标仪检测a450的吸光值。
3、结果
图6所示的结果显示:空白对照组同空载组无明显差异,而转染sirna2组的细胞生长速度明显低对照组的细胞生长速度,差异具有统计学意义(p<0.05),上述结果表明ensg00000259153的表达能够促进肝癌细胞的生长。
实施例7软琼脂克隆形成实验
1、用0.25%胰蛋白酶消化处于对数生长期的细胞,轻轻吹打使之成为单细胞悬液,离心收集细胞沉淀。
2、用含20%胎牛血清的dmem完全培养基重悬,适当稀释后计数,调整细胞浓度为5×103个/ml。
3、制备两个浓度分别为1.2%和0.7%的低溶点琼脂糖液,高压灭菌后,维持在40℃水浴中。
4、1.2%的琼脂糖和2×dmem培养基1:1混合,加入2×抗生素和20%的小牛血清,取3ml混合液注入直径6cm平皿中放置5min冷却凝固,作为底层琼脂置于co2温箱中备用。
5、在无菌试管中1:1混合0.7%的琼脂糖和2×dmem培养基,再向管中加入0.2ml浓度为5×103个/ml的稳定感染细胞悬液,充分混匀,注入上述平皿中,逐渐形成双琼脂层,每个实验组重复4个样本。
6、待上层琼脂凝固后,置入37℃5%co2温箱中培养,每3天加培养基1.5ml。7、培养14天后取出培养皿,用1ml浓度为0.005%的龙胆紫染色90min。把平皿放置在倒置显微镜下观察,每组细胞随机选取10个低倍视野,镜下技术形成的细胞克隆数。
8、结果
结果如图7所示,与对照组相比,转染sirna2组的细胞克隆集落形成数显著降低。
实施例8ensg00000259153基因对肝癌细胞凋亡的影响
使用流式细胞仪检测ensg00000259153基因对细胞凋亡的影响。
1、细胞培养步骤同实施例4。
2、细胞转染步骤同实施例5。
3、步骤
1)将3m110×上样缓冲液用27ml蒸馏水稀释。
2)收集细胞样本并用预冷的pbs清洗。
3)将细胞加入lml1×上样缓冲液,300g离心10min,吸出缓冲液。
4)再次加入lml1×上样缓冲液,将细胞悬液中细胞浓度调整为1×106个/ml。
5)将细胞悬液取出100μ1,加入ep管中。
6)将5μl的annexinvfitc加入ep管中,混匀ep管中的液体,在室温下避光孵育10min。
7)向ep管中加入5μ1pi染液,在室温下避光5min。
8)在ep管中加入500μl的pbs溶液,轻轻混匀,1h内上流式细胞仪进行检测。
4、结果:
结果如图8所示,实验组与对照组相比,细胞凋亡率升高(p<0.05),该结果说明,ensg00000259153的表达抑制肝癌细胞的凋亡。
实施例9细胞迁移及侵袭实验
1、transwell小室制备
无菌条件下matrigel冰浴融化,用pbs进行20倍稀释,以50μl/孔的体积铺在transwell小室的聚碳酸酯膜上。37℃放置4h,待matrigel胶聚合成凝胶后取出,轻轻吸出上层析出液。每孔中加入50μl的含bsa的无血清培养液对基底膜进行水化处理,37℃放置30min。
2、配置细胞悬液
细胞撤血清饥饿处理12-24h,对细胞进行消化处理,终止消化后进行离心,去除上层培养液。用pbs对沉淀细胞进行清洗,加入含有bsa的无血清培养基对其进行重悬。调整细胞的密度至5×l05个/ml。
3、细胞接种
取细胞悬液200μ1(迁移实验为100μ1,侵袭实验为200μ1)加入到transwell小室中。在24孔板下室加入500μ1含fbs的1640培养基。把细胞放入细胞培养箱中培养24h。
4、染色
细胞在培养结束后使用dapi染色。把小室细胞先用pbs漂洗2遍,放入dapi工作液中室温染色5-20min。用pbs漂洗2遍,放入荧光显微镜下观察并计数。
5、结果
结果如图9所示,在肝癌细胞转染干扰rna之后,与对照组相比,实验组的迁移及侵袭能力均有明显下降,结果说明ensg00000259153能够促进肝癌细胞的迁移及侵袭。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
sequencelisting
<110>北京泱深生物信息技术有限公司
<120>一种与肝癌发生发展相关的非编码基因的应用
<160>13
<170>patentinversion3.5
<210>1
<211>629
<212>dna
<213>人源
<400>1
cagaaaggcaagagaccaccttactgagcttcaaactggggctgggaacgctgccatgaa60
ttgggcttggtctgtctgaagggagccaccttttcgacaatccttagacttcttttgcct120
gttggaattacaccttggatcgtggcgaagtctatagaggtcagattaagaagaaccaaa180
gcagaataaacgtagaacccgatgctgagttcacgagtgaggacgacctcttcctatatg240
ctttgctataccctgcgttttgaacattaaggacgagataggaggcccataatgtttctt300
cttgctttaatcctgtcgtggcaacgttgacttccacctggttgcagagtgagcccatgg360
gacagccctctgaaattatactgcttacaaccatgctgagtctgcaaggacttcgtccaa420
gcctttccgtccaggacctcaaacagatccaatcacaagaagagagatttcaggaaagag480
aaaattattcctatcatcggggtttttgaagaacatgaaatgactgggaaaataatcatg540
ttaagtggaaaaaaaaaagaaatctatctgttgtaattttcaaataatttttaaataaat600
ttgaaaaattaagagaactatatatataa629
<210>2
<211>18
<212>dna
<213>人工序列
<400>2
aacattaaggacgagata18
<210>3
<211>18
<212>dna
<213>人工序列
<400>3
atggttgtaagcagtata18
<210>4
<211>22
<212>dna
<213>人工序列
<400>4
ccgggaaactgtggcgtgatgg22
<210>5
<211>25
<212>dna
<213>人工序列
<400>5
aggtggaggagtgggtgtcgctgtt25
<210>6
<211>21
<212>rna
<213>人工序列
<400>6
uaaucugaccucuauagacuu21
<210>7
<211>21
<212>rna
<213>人工序列
<400>7
gucuauagaggucagauuaag21
<210>8
<211>21
<212>rna
<213>人工序列
<400>8
uugugauuggaucuguuugag21
<210>9
<211>21
<212>rna
<213>人工序列
<400>9
caaacagauccaaucacaaga21
<210>10
<211>21
<212>rna
<213>人工序列
<400>10
aggaauaauuuucucuuuccu21
<210>11
<211>21
<212>rna
<213>人工序列
<400>11
gaaagagaaaauuauuccuau21
<210>12
<211>19
<212>rna
<213>人工序列
<400>12
uucuccgaacgugucacgu19
<210>13
<211>19
<212>rna
<213>人工序列
<400>13
acgugacacguucggagaa19
- 还没有人留言评论。精彩留言会获得点赞!