抑制多重耐药菌的化合物、其制备方法及应用与流程
本发明涉及药物化学技术领域,尤其涉及一类抑制多重耐药菌的化合物、其制备方法及应用。
背景技术:
由于世界范围的抗生素的大规模使用和滥用,各种“多重耐药细菌”不断出现,对人类的健康提出了严峻的挑战,已经成为全球公共健康最大的威胁之一。然而,抗生素新药的研发进展非常缓慢,尤其缺乏具有全新抗菌机理的抗生素新药,在过去的30年内没有一种具有新的抗菌机理的抗菌药物出现在市场上,人类即将面临没有抗生素可用的重大危机。
抗菌肽是宿主防御体系中天然免疫的一个重要组成部分,它广泛分布于自然界中。抗菌肽是由12~80个氨基酸组成的阳离子肽,含有大约50%的非极性氨基酸残基,具有两亲性特征。抗菌肽是通过静电作用吸附在细菌细胞膜上,使得细胞磷脂膜结构发生改变,渗透性增强,在细胞膜上形成孔洞,引起胞内物质泄漏,从而杀死细菌。由于其独特的抗菌机制,显示出抗菌谱广、不易产生耐药性、特异性强等优点,有望成为具有巨大发展潜力的新型抗菌药物。
目前抗菌肽的数量多,种类繁杂,结构也复杂多变。但是天然抗菌肽在生物体中含量极低,提取工艺繁杂,而化学合成抗菌肽的成本较高。另外,许多抗菌肽对宿主细胞的毒副作用大,且容易造成红细胞溶血。抗菌肽存在于水溶液时,其分子结构易被破坏,影响其生物活性。微生物直接表达抗菌肽时存在产量低、纯化困难的难题,这些因素成为制约抗菌肽进入实际应用的最大障碍。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一类抑制多重耐药菌的化合物、其制备方法及应用,其为柔性结构,对革兰氏阳性菌和革兰氏阴性菌均有好的抗菌效果。
本发明提供了一类抑制多重耐药菌的化合物,具有式ⅰ所示结构,或其药学上可接受的盐:
其中,a、g、e独立的选自c或n。
d为nh、o或s。
r1为h、c1~c5的烷基,c1~c5的烷氧基或c1~c5烷基取代的羟基。
n为1~7的整数;在本发明的某些具体实施例中,其为2、3、4、5或6。
m为c2~c12的烷基、含氧烷基、含氮烷基或含硫烷基;优选的,m选自以下任一结构:
q选自以下任一结构:
其中,x、y各自取1~12的正整数。
在本发明的某些具体实施例中,所述化合物具有以下任一结构:
本发明中,上述结构式中的弯线
上述药学上可接受的盐优选为盐酸盐、醋酸盐、硫酸盐、碳酸盐、磷酸盐、氢溴酸盐、氢碘酸盐、酒石酸盐、柠檬酸盐、天冬氨酸盐和谷氨酸盐等中的任意一种或多种。
本发明还提供了上述化合物的制备方法,包括以下步骤:
a)将化合物1和化合物2在水体系中进行反应,得到化合物3;
b)将化合物4和化合物5,在碱的作用下进行反应,得到化合物6;
c)将化合物6和化合物3,在碱的作用下进行反应,得到化合物7;
其中,a、g、e独立的选自c或n;
d'为nh2、oh或sh;
d为nh、o或s;
r1为h、c1~c5的烷基,c1~c5的烷氧基或c1~c5烷基取代的羟基;
n为1~7的整数;
m为c2~c12的烷基、含氧烷基、含氮烷基或含硫烷基;
q为cl。
上述步骤a)和b)没有先后顺序之分。
所述步骤a)中,所述反应的温度优选为30~70℃。
所述步骤b)中,反应的温度优选为0~5℃。本发明对反应中添加的碱并无特殊限定,可以为本领域技术人员熟知的碱性化合物,本发明优选为碳酸钠、碳酸氢钠、碳酸氢钾、三乙胺、n,n-二异丙基乙胺。所述反应的溶剂优选为乙腈、丙酮、四氢呋喃等。
所述步骤c)中,反应的温度优选为50~90℃。本发明对反应中添加的碱并无特殊限定,可以为本领域技术人员熟知的碱性化合物,本发明优选为碳酸钠、碳酸氢钠、碳酸氢钾、三乙胺、n,n-二异丙基乙胺。所述反应的溶剂优选为水/乙腈、水/丙酮、水/四氢呋喃等混合溶剂。
当q不为cl,而是选自以下任一时:
其中,x、y各自取1~12的正整数。
所述制备方法还包括:
对化合物4、6或7中,a、g之间的c原子连接的cl原子进行取代反应的步骤。
即所述方法的反应路线如下:
具体包括如下步骤:
a)将化合物1和化合物2在水体系中反应,得到化合物3;
b)将化合物4溶于合适溶剂中,在碱的作用下,与化合物5发生反应,得到化合物6';
c)化合物6'与kq在混合溶剂中反应,得到化合物7';
d)碱的作用下,化合物3与化合物7'在混合溶剂中反应,得到化合物8'。
或者反应路线如下:
具体包括如下步骤:
a)将化合物1和化合物2在水体系中反应,得到化合物3;
b)将化合物9与kq在混合溶剂中反应,得到化合物10;
c)将化合物10溶于合适溶剂中,在碱作用下,与化合物11发生反应,得到化合物12;
d)碱的作用下,化合物3与化合物12在混合溶剂中反应,得到化合物13。
或者反应路线如下:
具体包括如下步骤:
a)将化合物1和化合物2在水体系中反应,得到化合物3;
b)在碱作用下,化合物14与化合物15在混合溶剂中反应,得到化合物16;
c)化合物16与kq在合适溶剂中反应,得到化合物17;
d)碱的作用下,化合物3与化合物17在混合溶剂中反应,得到化合物18。
上述各步骤的反应条件同上,在此不再赘述。
本发明还提供了上述化合物的另外一种制备方法,包括以下步骤:
a)将化合物1和化合物2在水体系中进行反应,得到化合物3;
b)将化合物4和化合物3,在碱的作用下进行反应,得到化合物8;
c)将化合物8和化合物5,在碱的作用下进行反应,得到化合物7;
其中,a、g、e独立的选自c或n;
d'为nh2、oh或sh;
d为nh、o或s;
r1为h、c1~c5的烷基,c1~c5的烷氧基或c1~c5烷基取代的羟基;
n为1~7的整数;
m为c2~c12的烷基、含氧烷基、含氮烷基或含硫烷基;
q为cl。
上述各步骤的反应条件同上,在此不再赘述。
当q不为cl,而是选自以下任一时:
其中,x、y各自取1~12的正整数。
所述制备方法还包括:
对化合物4、6或7中,a、g之间的c原子连接的cl原子进行取代反应的步骤。
即反应路线如下:
具体包括以下步骤:
a)将化合物1和化合物2在水体系中反应,得到化合物3;
b)将化合物19与kq在混合溶剂中反应,得到化合物20;
c)在碱的作用下,化合物3与化合物20在混合溶剂中反应,得到化合物22;
d)将化合物22溶于合适溶剂中,在碱作用下,与化合物21发生反应,得到化合物23。
或者反应路线如下:
具体包括以下步骤:
a)将化合物1和化合物2在水体系中反应,得到化合物3;
b)化合物3与化合物24在混合溶剂中反应,得到化合物25;
c)化合物25与kq在合适溶剂中反应,得到化合物26;
d)在碱作用下,化合物26与27在混合溶剂中反应得到化合物28。
或者反应路线如下:
具体包括以下步骤:
a)将化合物1和化合物2在水体系中反应,得到化合物3;
b)化合物3与化合物29在混合溶剂中反应,得到化合物30;
c)在碱作用下,化合物30与31在混合溶剂中反应得到化合物32;
d)化合物32与kq在合适溶剂中反应,得到化合物33。
上述kq,可以根据q的不同,而自行选择,在本发明的某些具体实施例中:
当q为
当q为
当q为
当q为
当q为
当q为
当q为
当q为咪唑基时,kq为咪唑。
所述取代反应的温度是本领域技术人员所公知的,优选温度为0~100℃。所述反应的溶剂为本领域技术人员所公知的,优选为水/乙腈、水/丙酮、水/四氢呋喃、水/二氧六环等混合溶剂。
本发明还提供了上述化合物或上述制备方法制备的化合物在制备抗菌剂中的应用。
所述抗菌剂优选为抗革兰氏阳性菌和/或革兰氏阴性菌,在本发明的某些具体实施例中,所述抗菌为抗金黄色葡萄球菌、耐药性金黄色葡萄球菌、屎肠球菌、耐药性屎肠球菌、大肠杆菌和铜绿假单胞菌中的任意一种或几种。
上述应用可以为日化领域,作为抗菌添加剂,由于此类小分子合成方法简单,成本低,抗菌效果好,可以作为抗菌添加剂用于各类卫生护理用品,有效阻断多重耐药细菌的传播,从而预防多重耐药细菌导致的感染性疾病。
或应用于畜牧业中,作为抗生素添加于兽药中。
本发明还提供了一种抗菌剂,包括上述化合物或上述制备方法制备的化合物。
本发明还提供了一种抗菌添加剂,包括上述化合物或上述制备方法制备的化合物,应用于日常化学用品中。
本发明还提供了一种兽药,包括上述化合物或上述制备方法制备的化合物,作为抗生素应用于畜牧业中。
与现有技术相比,本发明提供了一类抑制多重耐药菌的化合物,具有式ⅰ所示结构,或其药学上可接受的盐。本发明打破抗菌肽及其模拟物刚性的分子结构,提供了一类柔性非肽类抗菌肽模拟物,对革兰氏阳性菌和革兰氏阴性菌均有好的抗菌效果。具有高抗菌活性、低溶血活性和低毒性,水溶性和稳定性优良,原料廉价易得,合成路线短且成本低、合成条件易于控制等优势,从而为设计抗菌药物提供了一种新的思路,为应对全球性的多重耐药细菌问题作出贡献。
附图说明
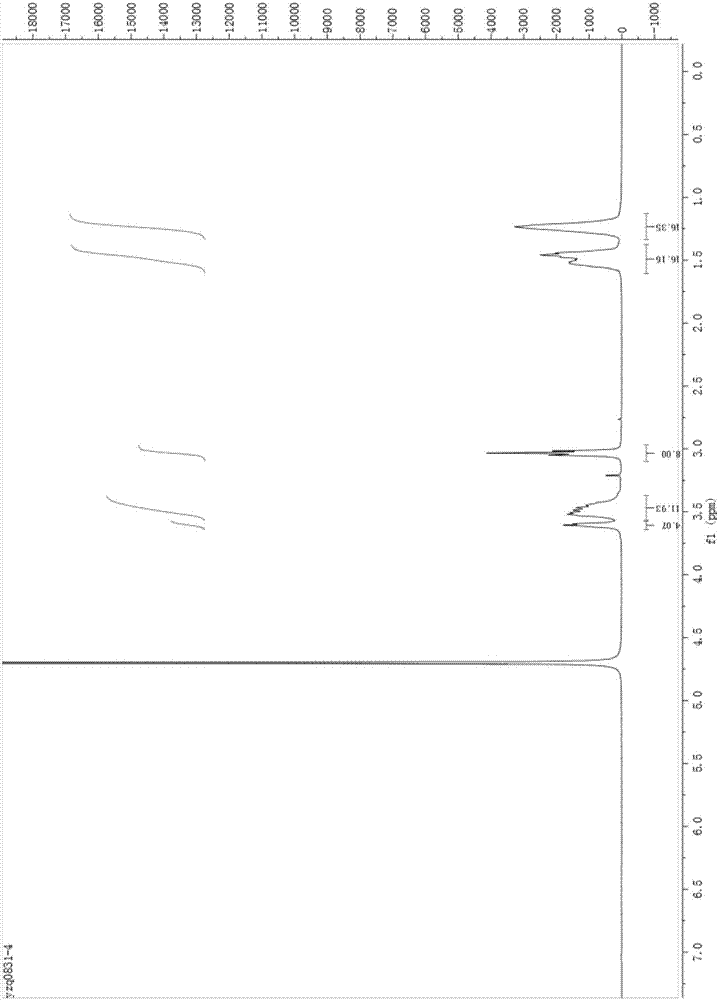
图1为本发明实施例1制备的d6e1n3的核磁共振氢谱图;
图2为本发明实施例1制备的d6e1n3对常见革兰氏阳性菌和格兰氏阴性菌的抗菌效果;
图3为本发明实施例1制备的d6e1n3对细胞的杀死效果。
具体实施方式
为了进一步说明本发明,下面结合实施例对本发明提供的抑制多重耐药菌的化合物、其制备方法及应用进行详细描述。
以下核磁共振谱(nmr)用brukeravance-400型核磁共振仪记录,化学位移δ的单位为ppm。高分辨质谱图用watersq–tofpermier型质谱仪记录。极性较大化合物的分离提纯用全自动制备色谱仪(iscocombiflashrf+)。柱层析用硅胶(200~300目)为青岛海洋化工分厂生产,薄层层析硅胶板(hsgf254型)为烟台江友硅胶开发有限公司生产。所用溶剂为分析纯试剂。
实施例1化合物d6e1n3的制备(参照以下反应式)
步骤a:双六甲基三胺(1.0804g,5mmol,1eq)和o-甲基异脲硫酸盐(1.4825g,12.5mmol,2.4eq)溶解在h2o(7ml)中,50℃反应6h,反应完毕。放置于4℃冰箱,析出白色固体,过滤,依次用冰水、乙醇洗涤,干燥即得到化合物n,n-二(己基胍基)二甲胺(dig6)。
步骤b:三聚氯氰(2.05g,11mmol,2eq)溶于乙腈(25ml)中,冷却至0℃,2,2'-氧双(乙胺)(0.56ml,5.4mmol,1eq)和nahco3(1.83g,22mmol,4eq)依次加入上述溶液中,0℃反应2h,反应完毕。减压旋蒸溶剂,用ch2cl2溶解,过滤掉不溶物,滤液用无水硫酸镁干燥,蒸除溶剂,得到化合物2,2'-氧双(乙胺)基-4,4',6,6'-四氯-1,1',3,3',5,5'-双三嗪(ecl2)。
步骤c、d:化合物ecl2(210mg,0.53mmol,1eq)溶于乙腈(5ml)中,在冰水浴加入nan3(70mg,1.08mmol,2eq),室温搅拌1h,然后加热至35℃搅拌1h,用高效液相色谱跟踪,原料已经转化完全。向上述反应液中加入溶解了n,n-二(己基胍基)二甲胺(440mg,1.1mmol,2.1eq))和nahco3(180mg,2.2mmol,4eq)的水溶液,75℃反应3h,反应完毕。浓缩,用全自动制备色谱仪分离,减压蒸除溶剂,经冻干获得化合物d6e1n3。
将实施例1制备得到的化合物进行核磁共振氢谱、核磁共振碳谱和高分辨率质谱表征,氢谱图如图1所示,其数据如下:
1hnmr(400mhz,d2o):δ3.65-3.57(m,4h),3.54-3.37(m,12h),3.03(m,8h),1.60-1.38(m,16h),133-1.13(m,16h)。
13cnmr(100mhz,d2o):δ166.13,160.51,159.86,156.67,67.90,48.28,41.06,40.39,27.79,27.02,26.60,25.76,25.57。
hrms-esim/z(%):mfc38h74n28omw938.6600.[m+3h]3+calcdfor313.8940,found:313.8948.[m+2h]2+calcdfor470.3373,found:470.3378。
实施例2化合物d3e1n3的制备
除了3,3'-二氨基二丙基胺代替双六甲基三胺以外,其余与实施例1相同。
1hnmr(400mhz,d2o):δ3.60(m,12h),3.53(m,4h),3.12(m,8h),1.83(m,8h)。
13cnmr(100mhz,d2o):δ161.50,159.92,156.63,155.28,68.20,45.49,45.30,40.49,39.75,39.59,26.07,25.76。
hrms-esim/z(%):mfc26h50n28omw770.4722.[m+3h]3+calcdfor257.8314,found:257.8320.[m+2h]2+calcdfor386.2434,found:386.2438。
实施例3化合物d6e1nh2的制备
除了nh4oh代替nan3以外,其余与实施例1相同。
实施例4化合物d6e2n3的制备
除了二乙二醇代替2,2'-氧双(乙胺)以外,其余与实施例1相同。
实施例5化合物d6e1scn的制备(参照以下反应式)
步骤a、b与制备化合物d6e1n3中的步骤a、b相同。
步骤c、d:化合物ecl2(210mg,0.53mmol,1eq)溶解在乙腈(5ml)中,依次加入n,n-二(己基胍基)二甲胺(435mg,1.07mmol,2eq))和nahco3(180mg,2.2mmol,4eq)的水溶液,室温搅拌1h,然后加热至40℃搅拌2h,用高效液相色谱跟踪,原料已经转化完全。向上述反应液中加入kscn(124mg,1.26mmol,2.4eq)85℃反应5h,反应完毕。浓缩,用全自动制备色谱仪分离,减压蒸除溶剂,经冻干获得化合物d6e1scn。
1hnmr(400mhz):δ3.51(m,4h),3.30(m,12h),3.10(m,2h),2.96(m,8h),1.38(m,16h),1.16(m,16h)。
13cnmr(100mhz):δ161.50,159.92,156.63,155.28,68.20,45.49,45.30,40.49,39.75,39.59,26.07,25.76。
hrms-esim/z(%):mfc40h74n24os2mw970.5919.[m+4h]4+calcdfor243.6552,found:243.6570.[m+3h]3+calcdfor324.5379,found:324.5397.[m+2h]2+calcdfor486.3032,found:486.3051。
实施例6化合物d3e1n3的制备
除了3,3'-二氨基二丙基胺代替双六甲基三胺以外,其余与实施例5相同。
实施例7柔性非肽类抗菌肽模拟物的抑菌实验
下述实施例中的病原菌来自美国microbiologics公司的atcc标准菌株,其中,金黄色葡萄球菌(25923)、耐药性金黄色葡萄球菌(baa-44)、屎肠球菌(35667)、耐药性屎肠球菌(baa-2320)、大肠杆菌(25922)、铜绿假单胞菌(baa-2110)。
最小抑菌浓度(minimalinhibitoryconcentration,mic)为检测不到细菌生长的孔和与之相邻的有细菌生长孔样品浓度之和的平均值作为样品最小抑菌浓度。采用二倍稀释法测定柔性非肽类抗菌肽模拟的抗菌活性,每组实验设立3组平行实验,具体方法如下:
细菌接种于tsa固体培养基上,37℃培养箱中倒置培养。待菌落长出后,用接种环挑取单克隆菌落转接到tsb液体培养基中,37℃培养箱震荡培养至对数生长期。在酶标仪上检测菌落od600,根据1od600=1×109cfu/ml将菌落用液体tsb培养基稀释至106cfu/ml。
柔性抗菌肽模拟物预先配置成1.0mg/mlpbs溶液,抑菌实验的浓度梯度设置为:0.125、0.25、0.5、1.0、2.0、4.0、8.0、16.0μg/ml。在无菌培养管中预先分别加入1.0mltsb液体培养基,然后每个培养管中依次对应加入0.25、0.5、1.0、2.0、4.0、8.0、16.0、32.0μl柔性抗菌肽模拟物溶液和1.0ml已稀释好的菌液,混匀后于37℃缓慢震荡培养16小时,用96孔板测定600nm处的光吸收值,并计算结果。结果如表1和表2所示。
表1柔性抗菌肽模拟物对金黄色葡萄球菌和耐药性金黄色葡萄球菌的最低抑菌浓度
表2柔性抗菌肽模拟物d6e1n3对细菌的最低抑菌浓度
注:linozolid,ceftadime,vacomycin和polymyxinb作为对照药物。
由检测结果可知,柔性抗菌肽模拟物d6e1n3对所常见的革兰氏阳性细菌和革兰氏阴性细菌显示出极强的杀死作用(尤其是针对革兰氏阳性细菌),比如对金黄色葡萄球菌、耐药性金黄色葡萄球菌、屎肠球菌和耐药性屎肠球菌的μic值分别为0.1μg/ml、0.2μg/ml、0.4μg/ml和0.4μg/ml,结果如图2所示。
实施例8柔性非肽类抗菌肽模拟物d6e1n3的细胞毒性实验
ic50为抑制50%细胞生长的浓度。选取293t细胞和a594细胞采用mtt方法进行细胞毒性实验,具体方法如下:
常规培养293t细胞,采用dmem培养基加入10%的血清,37℃培养至对数期,胰酶消化,进行细胞计数,用dmem培养基稀释至1×105/ml,铺96孔板,细胞密度为1×104/孔,37℃培养12h。
a594细胞接种的方法相同。
将柔性非肽类抗菌肽模拟物用pbs配制成5mg/ml的母液,然后按照二倍稀释法配制2倍浓度的柔性非肽类抗菌肽模拟物液(pbs配制),浓度分别为10、20、40、80、160、320μg/ml,将配好的柔性非肽类抗菌肽模拟物液100μl加入到96孔板的小孔内,使与细胞作用的柔性非肽类抗菌肽模拟物浓度为5、10、20、40、80、160μg/ml,对照组为pbs,本实验每个浓度的样品重复6孔,至少3次完全独立实验。
将96孔板放置在37℃的培养箱内培养12h,然后将样品孔中的液体用移液枪吸出,再加入预热好的无色dmem培养基100μl,将预先配制好的5mg/mlmtt母液取出,每孔加入10μl,37℃避光处理4h,吸去上清液,加入150μldmso溶解,37℃震荡20min至显色,酶标仪495nm波长下测定吸光度,细胞存活率=实验组/对照组,计算ic50值。结果如图3和表3所示。
表3柔性抗菌肽模拟物d6e1n3对细胞的毒性
注:a549是腺癌人类肺泡基底上皮细胞,属于癌细胞系;293t是人源胚胎肾细胞,属于正常细胞系。
实施例9柔性非肽类抗菌肽模拟物的溶血活性测定
利用柔性非肽类抗菌肽模拟物对红细胞的溶血性来评价对正常哺乳动物细胞的杀伤作用。
采集新鲜的人血液,通过离心分析新鲜血液中的红细胞,用0.9%的生理盐水洗三次后用0.9%的生理盐水重悬,将红细胞分装到96孔板中(100μl/孔),加入100μl不同浓度的柔性非肽类抗菌肽模拟物溶液,另外部分孔作为100%溶血和0%的实验对照组分别加入100ml0.1%的tritonx-100和0.9%的生理盐水。轻微震荡后于37℃水浴温育1h,离心后,取上清液至新的96孔板中,使用酶标仪测定od540值。溶血活性的计算公式如下:
溶血活性=[(od实验组-od生理盐水)/(odtritonx100-od生理盐水)]×100%
最后计算得到柔性抗菌肽模拟物d6e1n3对人体红细胞的ec50为100μg/ml。
以上试验表明,柔性非肽类抗菌肽模拟物d6e1n3即使在100μg/ml的高浓度下也不会引起人血发生溶血现象,表明上述柔性非肽类抗菌肽模拟物具有作为药物前体开发和利用的价值。
实施例10柔性非肽类抗菌肽模拟的小鼠毒性实验
选取昆明小鼠作为研究对象,采取灌胃法(intragastricinjection)给药方式。
将灌胃针连接在注射器上,吸入一定量的药液。用左手固定小鼠,使其头颈部充分伸直,右手拿起连有小鼠灌胃针的注射器,将针头小心自口角插入口腔,顺着上颚部插入咽部,顺咽后壁轻轻往下推,灌胃针会顺着食管滑入小鼠的胃内,用右手食指将针栓慢慢往下压,将注射器中的药液灌入小鼠的胃中。
操作时应避免灌胃针插入气管。插入时遇有阻力应抽出再试,如错插入气管注药时可立即死亡。
最终确定,通过灌胃给药的半致死剂量ld50>300mg/kg,属于低毒的范围。
由上述实施例可知,本发明提供的柔性非肽类抗菌肽模拟物具有优良的抗菌效果以及低溶血活性和低毒性。
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!