一种OsGA3ox1基因在水稻雄性不育株系创制中的应用的制作方法
本发明属于水稻育种
技术领域:
,涉及水稻赤霉素合成基因osga3ox1的一种全新的应用和一种相关的新型水稻不育株系的创制方法,具体涉及osga3ox1基因在水稻雄性不育株系创制中的应用、应用osga3ox1基因创制水稻雄性不育株系的方法以及通过此种方法创制的水稻雄性不育株系的育性恢复方法。
背景技术:
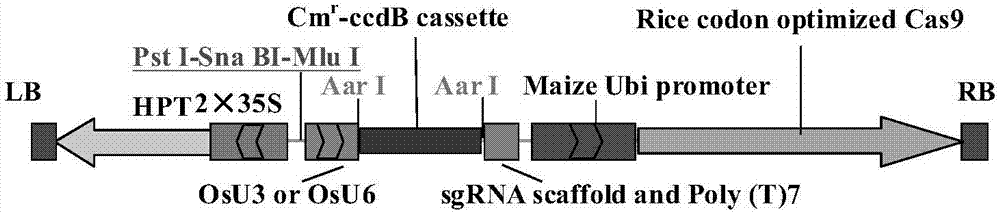
:获得不育系是水稻中进行杂种优势利用的基础。目前水稻生产中应用的不育系主要为细胞质(质核互作)雄性不育系和光温敏核不育系。相关制种也相应分为″三系″及″两系″制种。″三系″系统由于受恢保关系限制存在配组不自由的问题,并且由于育性恢复非简单地受单基因控制,又增加了恢复系或保持系培育的难度,因此,″三系″育种年限较长,效率低下,而″两系″不育系也存在育性转换临界温度受遗传背景影响较大、难以预测的问题,而且由于极端天气的影响,″两系″制种面临较高风险。虽然能克服上述缺点的利用核隐性不育基因的spt技术已初步应用于水稻生产,但这种方法存在必须依赖专门昂贵设备的问题,而且技术较为复杂,不易为普通育种者掌握。因此,生产中急需培育过程简单且育性稳定的新型不育系。通过基因工程干预某种生化代谢,使得某种育性维持必须的代谢物缺乏,从而造成不育,而且此种不育材料的育性可通过外源施加缺乏的代谢物而恢复,这可能是不育系获得的一种全新途径,国内外已有一些研究者进行了有益尝试[baehk,kangh-g,kimg-j,etal.transgenicriceplantscarryingrnainterferenceconstructsofaos(alleneoxidesynthase)genesshowseveremalesterility.plantbreeding,2010,129:647-651;huangs,cernyre,qiy,etal.transgenicstudiesontheinvolvementofcytokininandgibberellininmaledevelopment.plantphysiol,2003,131(3):1270-1282;engelket,hirschej,roitscht.anther-specificcarbohydratesupplyandrestorationofmetabolicallyengineeredmalesterility.jexpbot,2010,61(10):2693-2706;goetzm,godtde,guivarc′ha,etal.inductionofmalesterilityinplantsbymetabolicengineeringofthecarbohydratesupply.procnatlacadsciusa,2001,98(11):6522-6527;vandermeerim,stamme,vantunenaj,etal.antisenseinhibitionofflavonoidbiosynthesisinpetuniaanthersresultsinmalesterility.plantcell,1992,4(3):253-262;yistrab,busscherj,frankenj,etal.flavonolsandfertilizationinpetuniahybrida:localizationandmodeofactionduringpollentubegrowth.plantj,1994,6:201-212;ribaritsa,mamunan,lis,etal.combinationofreversiblemalesterilityanddoubledhaploidproductionbytargetedinactivationofcytoplasmicglutaminesynthetaseindevelopinganthersandpollen.plantbiotechnolj,2007,5(4):483-494;albertsen,m.c.,etal.1999,inductionofmalesterilityinplantsbyexpressionofhighlevelsofavidin.unitedstates,pioneerhi-bredinternational,inc.,desmoines,iowa.us5962769;sinhar,raiammv.rnaisilencingofthreehomologuesofs-adenosylmethioninedecarboxylasegeneintapetaltissueoftomatoresultsinmalesterility.plantmolbiol,2013,82(1-2):169-180]。当前,基因工程法制备代谢缺陷型不育材料仍然存在育性不彻底、成本较高或引起其他其他农艺性状严重劣变等问题,生产中未见相关成果的实际应用。在水稻中,通过寻找更为优良的代谢缺陷型雄性不育材料不失为一条寻找新型不育系以克服水稻现有不育系缺点的重要途径。基因编辑技术的迅猛发展使得现在可以非常便捷地创制某种代谢基因功能缺失突变体,从而创制代谢缺陷型不育系。基因编辑技术主要包含锌脂蛋白核酸酶(zfn)、类转录因子效应蛋白核酸酶(talen)及crispr系统[gaj,t.,etal.zfn,talen,andcrispr/cas-basedmethodsforgenomeengineering.trendsbiotechnol,2013,31(7):397-405]。crispr/cas9是目前使用最为广泛且最为高效的基因编辑系统,与先前的zfn及talen技术相比,过程更便捷,成本更低。crispr/cas9系统由两部分组成,其中一个组分是cas9蛋白(一种核酸酶),另一个组分是引导cas9蛋白至目的特异靶位点的sgrna(singleguiderna),欲敲除某个基因时,只需设计sgrna上针对靶基因的特异的20bp碱基序列(称为引导序列,guidesequece)即可。crispr/cas9系统作用时,sgrna引导cas9蛋白至与sgrna上的引导序列相匹配的基因组目标序列并在特定位点创造双链断裂,细胞在修复双链断裂时采用非同源末端连接(nhej)或同源重组(hr)方式而引入突变,从而完成基因编辑。目前crispr/cas9系统已经在水稻中成功应用。技术实现要素:本发明针对现有质核互作雄性不育系、光温敏不育系及spt核隐性不育系在水稻杂种生产应用中的不足,提供了一种新型的水稻雄性不育系系统及生产方法。研究发现植物中一些内源激素为正常育性所必须,因此本申请的发明人猜想水稻中某些植物激素代谢基因突变体可能成为理想的代谢缺陷型雄性不育材料。通过文献查询及生物信息学分析,筛选,本案发明者认为水稻植株中赤霉素合成基因osga3ox1功能缺失突变后有可能成为理想的代谢缺陷型突变体。此种猜想基于如下信息:1)水稻赤霉素合成途径中只存在ga3ox的两种同工酶基因,osga3ox1和osga3ox2,osga3ox2功能缺失突变引起严重矮杆[sakamoto,t.,etal.anoverviewofgibberellinmetabolismenzymegenesandtheirrelatedmutantsinrice.plantphysiol,2004,134(4):1642-1653],但可结实,暗示osga3ox1对于维持正常育性发挥主要作用;2)osga3ox1在花粉发育中后期大量表达,其他部位则几乎不表达[itoh,h.,etal.cloningandfunctionalanalysisoftwogibberellin3beta-hydroxylasegenesthataredifferentlyexpressedduringthegrowthofrice.procnatlacadsciusa,2001,98(15):8909-8914和hirano,k.,etal.comprehensivetranscriptomeanalysisofphytohormonebiosynthesisandsignalinggenesinmicrospore/pollenandtapetumofrice.plantcellphysiol,2008,49(10):1429-1450],更暗示了其对于育性维持的重要性,也暗示了其对于营养器官发育并不是必须的;3)水稻赤霉素合成突变体造成的矮杆表型一般可以通过外源添加赤霉素而恢复,提示了osga3ox1基因功能缺失突变亦可以通过类似方法添加外源赤霉素而恢复其表型。基于以上了解,本申请的发明人通过基因敲除技术获得了一种败育彻底、简单易行、成本较低且不带来其他农艺性状严重劣变的水稻不育系的生产方法,此种不育系为通过定点敲除水稻赤霉素合成基因osga3ox1而创制,具体地,本发明的内容包括一种水稻osga3ox1基因在水稻雄性不育创制中的应用、一种通过敲除水稻osga3ox1基因创制水稻雄性不育株系的方法以及对此种不育株系进行育性恢复以进行自身繁育的方法。除非另外指明,否则本发明的实施将采用本领域常规的分子生物学、细胞生物学、杂交育种、杂种优势利用以及农业领域技术。除非另外指明,否则本申请中所用的术语具有本领域技术人员通常所理解的含义。本发明的目的是通过以下技术方案实现的:第一方面,本发明提供了一种水稻赤霉素合成基因osga3ox1的应用,所述的osga3ox1基因编码的多肽氨基酸序列如seqidno.1所示,或为与seqidno.1所示序列存在90%以上序列相似性的序列。本发明第一方面所述的应用具体是,用于水稻雄性不育株系的创制。进一步地,所述的水稻雄性不育株系的创制为通过构建水稻osga3ox1基因突变体株以实现。进一步地,所述的osga3ox1基因突变体株为与正常水稻相比基因组中一个或两个osga3ox1等位基因所编码的多肽功能丧失或受抑制的水稻植株,并且植株中花粉50%以上是败育的。第二方面,本发明提供了一种应用osga3ox1基因创制水稻雄性不育株系的方法。本发明中,所述的osga3ox1基因的核苷酸序列如seqidno.2所示,或为与seqidno.2所示序列存在90%以上序列相似性的序列。本发明中,所述的创制水稻雄性不育株系的方法是通过利用crisprr/cas9系统对普通水稻中的osga3ox1基因进行定点敲除实现的。进一步地,所述的crispr/cas9系统为crispr/cas9基因敲除载体。进一步地,所述的crispr/cas9基因敲除载体优选基于载体pcambia1390的crisprr/cas9基因敲除载体。在一具体实施例中,crispr/cas9基因敲除载体为pcubi1390cas9-u3,所采用的sgrna引导序列(guidesequence)为seqidno.3所示的序列或与此序列存在1至3个碱基差异的序列。在一具体实施例中,crispr/cas9基因敲除载体为pcubi1390cas9-u6,所采用的sgrna引导序列为seqidno.4所示的序列或与此序列存在1至3个碱基差异的序列。本发明所述的创制水稻雄性不育株系的方法中,通过利用crisprr/cas9基因敲除载体对普通水稻中的osga3ox1基因进行定点敲除获得水稻雄性不育株系的方法包括步骤:1)利用公开软件crispr-p或其他工具设计sgrna引导序列,本发明采用如seqidno.3(用于第一种方法)或seqidno.4(用于第二种方法)所示的sgrna引导序列;2)根据设计的sgrna引导序列及载体构建要求,合成末端四个碱基外其余碱基反向互补的寡脱氧核糖核酸sgg3x1u3-f(ggcacatctgcttcgggtaccgg)和sgg3x1u3-r(aaacccggtacccgaagcagatg)(用于第一种方法),以及sgg3x1u6-f(cttgactcgtcgatgagagctct)和sgg3x1u6-r(aaacagagctctcatcgacgagt)(用于第二种方法);3)分别把反向互补寡脱氧核糖核酸退火成双链寡核酸;4)酶切、连接和转化,分别把所得的双链寡核酸连接到crispr/cas9载体;5)测序,选取正确克隆,扩大繁殖提取质粒,其中,测序前先挑单克隆,以如下引物对单克隆进行测序,osu3-f(ggcatgcatggatcttggaggaat)(检测克隆正确性,启动子为osu3时用),osu6-f(ttgagcgattacaggcgaaagtg)(检测克隆正确性,启动子为osu6时用),35s-f(tgacgcacaatcccactatccttc)(35s正向引物,检测载体完整性),cas9-r-1(tcgagcctgcgggacttagag)(cas95′端引物,检测载体完整性),c126(tcgtgaagaagaccgaggtt)(cas93′端引物,检测载体完整性);6)转化农杆菌;7)转化水稻愈伤组织,获得t0代转化子;8)对t0代转化子中osga3ox1基因的靶位点进行测序检测,具体为,提取转化子dna,分别利用g3x1u3-f(tcgcgctgccggcggacgac)和g3x1u3-r(gcggatggcagggggagggaaggt),以及g3x1u6-f(tcgatccgccattgcttgcat)和g3x1u6-r(ccgagcgccttgaagaacatgg)组成的引物对对转化子osga3ox1基因组dna中seqidno.3和seqidno.4所在位点序列进行扩增,将扩增片段克隆至t载体,转化大肠杆菌,挑单克隆测序,每个片段至少测10个单克隆以上,至少获得5个阳性克隆;9)判定突变情况,具体为,将测序结果与野生型序列进行比对,分析,结果存在四种可能,无突变,纯合突变、杂合突变或双等位基因突变;10)观察突变转化子表型,判定osga3ox1基因敲除情况,具体为,观察t0代osga3ox1基因突变转化子表型,包含花粉i2-ki染色情况,散粉情况,结实情况以及除育性之外的其他农艺性状是否受影响;根据花粉i2-ki染色判定osga3ox1基因是否敲除,若一转化子中一半左右花粉i2-ki染色较正常花粉浅(称为染败),则该突变转化子中有一个等位基因完成osga3ox1基因敲除,若几乎全部花粉染色都比正常花粉浅,则两个osga3ox1等位基因都完成敲除,若染色与野生型无异,则突变并不影响基因功能;11)按照10)确定的等位基因敲除类型选择赤霉素喷施方案实施喷施,获得水稻雄性不育株系,具体为,若转化子中仅有一个osga3ox1等位基因被敲除,即突变是杂合的,则突变株在t0代是可育(此处可育指可结实)的,直接收获种子,种植获得t1植株,由于osga3ox1是在花粉后期表达的基因,其控制的不育性状为配子体雄性不育,因而此种突变体不可能通过自然自交得到纯合的不育株(这也可能是目前国内外水稻突变体库中没有发现osga3ox1功能缺失突变体的原因),因此,t1代在osga3ox1基因位点只有两种基因型,杂合可育株和野生型可育株,呈1∶1分离,在下一代分离群体中通过标记选择杂合株或通过花粉染色选出杂合株,让其自交繁殖,如此往复,突变体得以保存,通过在孕穗期到扬花期分3-5次喷施含10-60mg/lga3的水溶液于杂合植株穗部,从获得的自交种中鉴定突变基因纯合且不含转基因成分的不育植株,以后均通过相同方法喷施ga3水溶液以繁殖此种纯合不育株,扩大繁殖,即得用于生产的雄性不育株系;若转化子中两个osga3ox1等位基因均被敲除,则t0代即不育,可通过在孕穗期到扬花期分3~5次喷施含10-60mg/lga3的水溶液于植株穗部繁殖此种不育株,t0植株上获得的种子应该是分离的,在后代可通过分子标记筛选获得去除转基因成分且osga3ox1突变基因纯合的单株,继续对这些单株喷施ga3水溶液,收获种子,种植,如此往复,突变体得以扩大繁殖,即得用于生产的雄性不育株系,或替代地,以t0代转化子作母本与野生型父本杂交,获得突变基因杂合的f1代植株,此后按照前述仅一个等位基因发生敲除的情况所采用的方法进行处理,亦可得到用于生产的雄性不育株系。第三方面,本发明提供了通过本申请第二方面的方法创制的水稻雄性不育株系的育性恢复方法,所述的育性恢复方法为向水稻雄性不育株系植株穗部喷施赤霉素类物质的水溶液。本发明的水稻雄性不育株系育性恢复方法的一些实施方式中,赤霉素类物质优选为ga3。本发明的水稻雄性不育株系育性恢复方法的一些实施方式中,赤霉素类物质喷施的时期是在水稻孕穗期至扬花期。本发明的水稻雄性不育株系育性恢复方法的一些实施方式中,赤霉素类物质喷施的时间选自早上6-9点或下午4-6点。本发明的水稻雄性不育株系育性恢复方法的一些实施方式中,赤霉素类物质喷施的次数为2~8次或优选3~5次,所述喷施的赤霉素类物质的浓度为5~90mg/l或优选10~60mg/l或更优选20~40mg/l中的一种。本发明的水稻雄性不育株系育性恢复方法的一些实施方式中,赤霉素喷施用量为5-25g每667m2;本发明的水稻雄性不育株系育性恢复方法的一些实施方式中,赤霉素溶液包含0.03%表面活性剂。本发明的水稻雄性不育株系的育性恢复方法的一些实施方式中,赤霉素溶液包含0.002%表面活性剂。本发明的水稻雄性不育株系的育性恢复方法的一实施例中,赤霉素溶液包含0.01%吐温-20。第四方面,本发明提供了通过本发明第二方面的方法获得的水稻不育株系在水稻杂种生产中的应用。杂种生产时,将稳定的osga3ox1基因敲除不育材料作为母本种植,依据父母本生育期差异错期播种,其他等同常规杂种生产方法。有益效果与现有技术相比,本发明的优点在于提供了一种赤霉素合成基因osga3ox1全新的应用,为杂种生产提供了一种新型的两用不育系系统,此种不育系可通过外源喷施赤霉素而得以自身繁殖,育性不受环境条件影响,克服了以往光温敏两用不育系受极端天气影响而制种风险高的缺点。附图说明图1:crispr/cas9载体pcubi1390cas9-u3和pcubi1390cas9-u6的t-dna区结构示意图,两个载体的差别仅在于驱动sgrna表达的启动子前者为osu3,后者为osu6;图中各符号示意为,lb、rb,t-dna左、右边界,hpt,抗潮霉素选择标记,2×35s,串联的35s启动子,cmr-ccdbcassette,抗氯霉素基因及自杀基因表达盒,sgrnascaffoldandpoly(t)7,sgrna骨架及终止子,maizeubipromoter,玉米ubi基因启动子,ricecodonoptimizedcas9,水稻密码子优化的cas9基因,aari,供引导序列克隆的酶切位点,psti-snabi-mlui,三个单一限制性内切酶识别位点,图中省略了hpt和cas9基因各自表达所需的终止子camv3′utr和nospolyasignal。图2:通过crispr/cas9定点敲除获得的osga3ox1基因突变植株的靶序列突变情况;其中,wt-u6表示seqidno.4对应的野生型osga3ox1基因的位点(在正义链上)附近的序列(展示了正义链),wt-u3表示seqidno.3对应的野生型osga3ox1基因的位点(在负义链上)附近的序列(展示了正义链),a1-6,a4-2,a4-3,a5-2和a6-5为测序时不同样品的编号并以此代表不同的突变类型。图3:为图2中展示序列所对应的测序峰图,为对突变体中靶序列测序所获得,(+)表示测序时测到的是靶序列的正义链,(-)表示测序时测到的是靶序列的负义链,中括号内数字范围表示测序峰图中此数字范围内的碱基对应于图2中的对应序列。图4:一个osga3ox1基因双等位基因突变体(右侧)t0植株及其野生型(左侧)的结实情况,野生型正常结实,突变体结实率为零。图5:一个osga3ox1基因双等位基因突变体t0植株作为母本与野生型进行杂交可以正常结实(即雌蕊功能正常)的情况,箭头指示了一部分结实的种子。图6:一个osga3ox1基因双等位基因突变体(右侧)t0植株其颖花(小穗)形态结构与野生型(左侧)并不存在明显差异,且雄蕊中存在黄色花药。图7:一个osga3ox1基因双等位基因突变体(右侧)t0植株的花粉与野生型(左侧)相比,其i2-ki染色较浅,因而败育类型为染败具体实施方式下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。下列实施例中末注明具体条件的实验方法,通常按照常规条件,例如书籍《分子克隆实验指南(第3版)》(j.萨姆布鲁克,d.w.拉塞尔著;黄培堂等译;科学出版社,2008)中所述的条件,或按照制造试剂或设备厂商所建议的条件。实施例1、一种通过定点敲除赤霉素合成基因osga3ox1以创制水稻雄性不育株系的方法通过如下步骤完成osga3ox1基因的敲除及获得雄性不育株:1)设计sgrna引导序列利用在线工具crispr-p(http://cbi.hzau.edu.cn/crispr/),按照开发者提供的方法,设计针对osga3ox1基因的sgrna引导序列,从软件提供的结果中依据序列特异性及序列所在位置选择合适的引导序列,本实施例所选的sgrna引导序列为seqidno.3和seqidno.4所示的序列。2)依据引导序列及载体要求合成用于克隆的寡核酸本实施例采用基于载体pcambia1390(由非盈利机构cambia构建,载体序列及图谱见http://www.cambia.org/daisy/cambia/585.html)的crispr/cas9载体pcubi1390cas9-u3和pcubi1390cas9-u6(两个载体的t-dna区结构如附图1所示),均为本申请发明者自己构建。依据载体构建要求,对于引导序列采用seqidno.3的情况,合成除末端四个碱基外其余碱基反向互补的寡脱氧核糖核酸sgg3x1u3-f(ggcacatctgcttcgggtaccgg)和sgg3x1u3-r(aaacccggtacccgaagcagatg),而对于靶序列采用seqidno.4的情况,合成寡脱氧核糖核酸sgg3x1u6-f(cttgactcgtcgatgagagctct)和sgg3x1u6-r(aaacagagctctcatcgacgagt)。3)退火寡核酸形成接头用1倍te缓冲液溶解寡核酸,终浓度为100pmol/μl,将互补的寡核酸各取等量混合后加入2%体积的5mnacl(此方法中退火体系各组分及终浓度约为:10mmtris-cl,1mmedta,100mmnacl,两种互补寡核酸各自50pmol/μl),混匀,于pcr仪(杭州晶格t960)中95度2分钟,自然冷却至室温,接头即制成,把接头稀释50倍成1pmol/μl备用。4)酶切和回收用限制性内切酶aari(生产商thermoscientific;货号er1581)酶切crispr/cas9载体pcubi1390cas9-u3或pcubi1390cas9-u6。酶切体系:质粒5μg,aari酶3u,10xaari缓冲液4μl,50xoligonucleotide(0.025mm;酶生产商提供)0.8μl,补水至40μl;酶切条件:37度温育10小时;回收载体质粒dna:直接乙醇沉淀回收,具体地,在酶切体系中加入4μl3mnacl,再加入2倍体积乙醇,-20度低温保持30min,12000g/min离心10min,弃掉上清,再用70%乙醇洗涤2遍,待样品干燥后用50μl水溶解质粒dna。5)连接连接反应体系为:t4连接酶缓冲液1μl,乙醇沉淀回收的载体100ng左右,接头1pmol,t4连接酶(生产商neb,货号m0202s)1μl,ddh2o补足至10μl总体积;连接反应条件为:16℃连接2h。6)转化大肠杆菌:把10μl全部连接产物全部接入100μl商业化的大肠杆菌dh5α化学感受态细胞(生产商北京鼎国昌盛生物技术有限责任公司;货号mcc001),转化方法依据生产商提供的方法,用含卡那霉素的平板筛选阳性克隆。7)测序挑单克隆,以如下引物对单克隆进行测序,选取正确克隆,扩大繁殖提取质粒。测序引物为:osu3-f(ggcatgcatggatcttggaggaat)(检测克隆正确性,启动子为u3时用);osu6-f(ttgagcgattacaggcgaaagtg)(检测克隆正确性,启动子为u6时用);35s-f(tgacgcacaatcccactatccttc)(35s正向引物,检测载体完整性);cas9-r-1(tcgagcctgcgggacttagag)(cas95′端引物,检测载体完整性);c126(tcgtgaagaagaccgaggtt)(cas93′端引物,检测载体完整性)。8)转化农杆菌用常规的反复冻融法将正确克隆质粒转化至常规cacl2法制备的eha105农杆菌化学感受态细胞中中,具体地,农杆菌感受态细胞的制备及转化包含如下步骤:a)取-70℃保存的eha105于合50μg/ml利福平板划线,28℃培养。b)挑取单菌落接种于5mlyep液体培养基中,220rpm28℃振荡培养12-16hr。c)取2ml菌液转接于100mlym液体培养基中,28℃220rpm振荡培养至od600=0.5。d)转入无菌离心管,5000rpm离心5min,去上清液。e)加入10ml预冷的0.1m的cacl2溶液,轻轻悬浮细胞,冰上放置20min,4℃5000rpm离心5min,去上清。f)加入4ml预冷的含15%甘油的0.1m的cacl2溶液,轻轻悬浮。g)农杆菌悬浮液分装于无菌1.5ml离心管中,每管200μl冻存于-70℃。h)双元载体转化农杆菌eha105取1μg左右的质粒dna加入到200μleha105感受态细胞中,混匀后,冰浴30min,液氮放置5min,再在37℃水浴5min,接着冰浴2min,加入800μlyep液体培养基28℃、175rpm摇培3h,后涂在含50μg/ml卡那霉素的yep平板上,28℃培养到形成单菌落。9)转化愈伤组织利用农杆菌转化法转化水稻品种kasalath的愈伤组织(方法参考toki等的方法[tokis,haran,onok,etal.earlyinfectionofscutellumtissuewithagrobacteriumallowshigh-speedtransformationofrice.plantj,2006,47(6):969-976]。10)对转化子中osga3ox1基因的靶位点进行检测;提取转化子dna(本实施例中为秧苗期叶片,实施者可以选择任何时期的组织作为dna提取材料),利用引物g3x1u3-f(tcgcgctgccggcggacgac)和g3x1u3-r(gcggatggcagggggagggaaggt),以及g3x1u6-f(tcgatccgccattgcttgcat)和g3x1u6-r(ccgagcgccttgaagaacatgg)组成的引物对对转化子osga3ox1基因dna中seqidno.3和seqidno.4所在位点序列进行扩增,将获得的pcr产物目标片段克隆至pmd-18-t载体(厂商takara,货号6011),转化大肠杆菌,挑取单克隆测序,测10个单克隆以上,保证获得5个以上阳性克隆。11)突变判定将测序结果与野生型序列进行比对,分析,结果存在四种可能,无突变(野生型),纯合突变、杂合突变或双等位基因突变。本实施例中,获得的转化子t0发生突变的株系其基因基因组dna序列突变情况如表1及附图2、附图3所示,进而导致的蛋白质序列变化如表2所示。表1转化子中osga3ox1基因靶位点突变情况及结实情况表2转化子中基因突变对蛋白质序列及功能的影响核酸突变类型氨基酸序列的改变1说明可能后果a1-6y146fs移码功能失活a4-2r192_a193delinss保守序列的缺失/插入功能失活a4-3a194_e195delinsgragsd保守序列的缺失/插入功能失活a5-2r192fs移码功能失活a6-5l194fs移码功能失活1此栏中的氨基酸序列突变表示方法参考dendunnen等的文章[j.t.dendunnenands.e.antonarakisnomenclatureforthedescriptionofsequencevariations,humgenet,2001,109(1):121-124及网页http://www.hgmd.cf.ac.uk/docs/mut_nom.html的描述]12)观察和繁殖突变体,获得雄性不育系观察突变体表型,包含结实情况,花粉i2-ki染色情况,散粉情况,以及除育性之外的其他农艺性状是否受影响。本实施例中,发明者发现,在同样种植条件野生型材料能正常结实的情况下,获得的osga3ox1基因发生突变的转化子中,2个双等位基因突变体及1个纯合突变体均未能正常结实(其中株系a4的情况如附图4所示),说明突变类型a4-2、a4-3及a6-5都是蛋白功能丧失的突变类型,而2个杂合突变体能够正常结实,与预期表型相符。利用株系a4进一步观察发现,突变体雌蕊可接受野生型花粉而结实(如附图5所示),而且突变体花器官形态与野生型相比并无显著差异,其雄蕊中还含有花药(如附图6所示),花粉i2-ki染色显示,突变体中花粉染色较野生型浅(如附图7所示),为染败型败育。因此,本案发明者证明了osga3ox1基因敲除可导致雄性不育,而且证明此种不育突变体可作为杂种母本而利用。通过在穗子刚抽出时喷施1次30mg/lga3获得了10%左右的结实率(穗子套袋隔离外来花粉,排除串粉的可能),说明osga3ox1基因敲除突变体可通过外源施加赤霉素而恢复育性,且进一步提示了osga3ox1基因敲除突变体在未施加外源赤霉素时可作为不育系使用,而需要繁种时通过施加赤霉素恢复育性即可,因而可作为一种新的两用不育系系统而利用。一个osga3ox1基因双等位基因突变体(右侧)t0植株及其野生型(左侧)的结实情况,野生型正常结实,突变体结实率为零如图4所示。一个osga3ox1基因双等位基因突变体t0植株作为母本与野生型进行杂交可以正常结实(即雌蕊功能正常)的情况如图5所示。一个osga3ox1基因双等位基因突变体(右侧)t0植株其颖花(小穗)形态结构与野生型(左侧)并不存在明显差异,且雄蕊中存在黄色花药如图6所示。一个osga3ox1基因双等位基因突变体(右侧)t0植株的花粉与野生型(左侧)相比,其i2-ki染色较浅,因而败育类型为染败如图7所示。本实施例结果表明,本申请人通过创制osga3ox1基因双等位基因突变体成功获得了水稻雄性不育株系,并证明此种不育株系可以通过喷施赤霉素而恢复以及可作为不育母本进行杂交种制种。实施例2、osga3ox1基因敲除突变体的育性恢复在水稻抽穗期可通过上午8点用含赤霉素类物质ga3的溶液喷施水稻穗部而恢复育性,浓度可在45mg/l赤霉素,喷施4次,每667m2用量18g内,赤霉素溶液应该包含一定量表面活性剂如0.01%吐温-20,以增强药剂在叶片表面的粘附,利用kasalath为背景时,使用浓度约30mg/l的ga3在穗子刚抽出时喷施。实施例3、osga3ox1基因敲除突变体的育性恢复在水稻抽穗期可通过下午5点用含赤霉素类物质ga3的溶液喷施水稻穗部而恢复育性,浓度可在60mg/l赤霉素,喷施1次,每667m2用量30g内,赤霉素溶液应该包含一定量表面活性剂如0.03%吐温-20,以增强药剂在叶片表面的粘附。实施例4osga3ox1基因敲除突变体的育性恢复在水稻抽穗期可通过上午9点用合赤霉素类物质ga3的溶液喷施水稻穗部而恢复育性,浓度可在10mg/l赤霉素,喷施5次,每667m2用量5g内,赤霉素溶液应该包含一定量表面活性剂如0.002%吐温-20,以增强药剂在叶片表面的粘附。实施例5、osga3ox1基因敲除突变不育系在杂种生产中的利用杂种生产时,将稳定的osga3ox1基因突变不育材料作为母本种植,依据父母本生育期差异错期播种,其他等同常规杂种生产方法。需要特别指出,杂种生产利用osga3ox1基因突变不育材料做杂交母本时,绝对不能用赤霉素类物质调节花期或用以增加制种产量,因为如此操作将导致母本自交结实而使制种失败。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1