一种偶氮苯接枝富勒烯纳米杂化化合物以及制备方法与流程
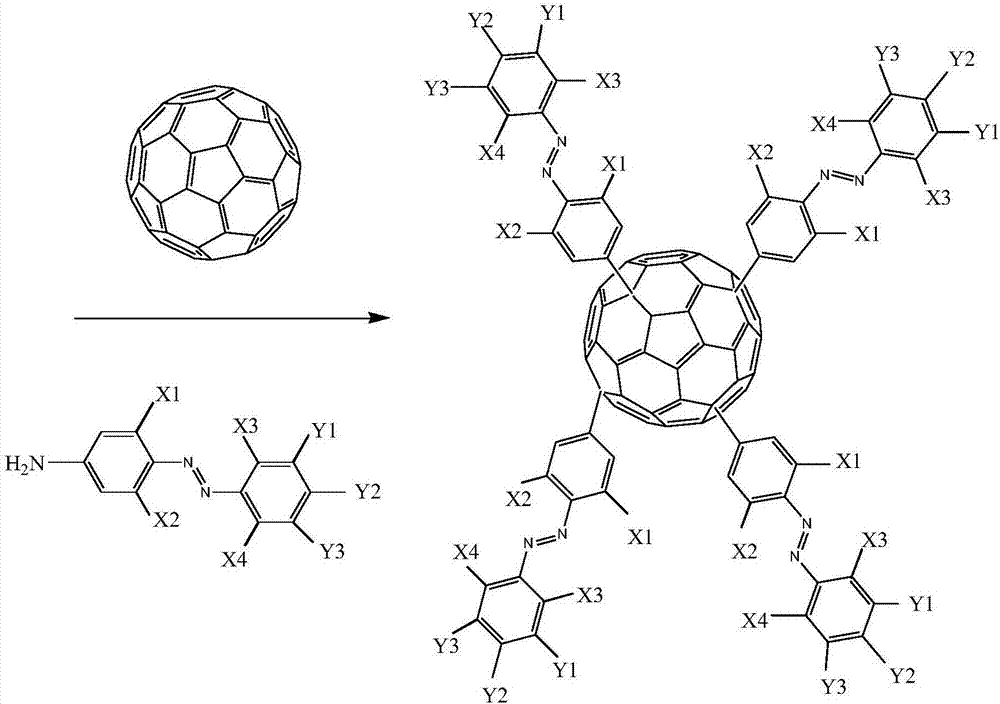
本发明涉及能源材料技术领域,尤其是涉及一种偶氮苯接枝富勒烯纳米杂化化合物以及制备方法。
背景技术:
随着全球经济的发展,能源危机日趋严重。研究、开发和利用清洁、可再生的太阳能已经成为当今社会解决能源危机的重要途径。
偶氮苯(azobenzenes)是一类二氮烯衍生物,中间含有一个偶氮基团(-n=n-),两边的氢原子分别被两个苯环所取代,具有反式(trans)和顺式(cis)两种构型。偶氮苯体系的光致异构特性是由分子内的-n=n-基团在光、热等外界条件作用下进行顺反异构化所引起的。采用不同波长的光束对偶氮基团进行光照,可使其可逆的在顺式和反式两种异构体间进行转变。偶氮苯类分子的可逆光致异构化反应具有存储太阳能的潜力,但传统的偶氮苯分子存在单分子能量密度低和回复半衰期短等问题,限制了其在光储热领域的应用。
1985年,curl等人首次发现富勒烯c60,1991年huffman等人找到了一种可以宏量制备c60的方法,由此展开了富勒烯的研究热潮,包括富勒烯c28、c32、c60、c70、c80等。富勒烯具有独特的笼状结构,其中六元环结构中亲电的c=c键可以与自由基进行加成反应。富勒烯结构稳定,并且具有较好的催化性、光学性、超导性及热稳定性。
现有技术中,偶氮苯与富勒烯纳米复合材料存在接枝率低、能量密度低、稳定性差的技术缺陷,限制了其在光储能领域的实际应用。因此,研发出一种接枝率高、能量密度高、回复半衰期长的偶氮苯接枝富勒烯纳米杂化材料成为本领域技术人员亟待解决的问题。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种偶氮苯接枝富勒烯纳米杂化材料,本发明制备得到的偶氮苯接枝富勒烯纳米杂化材料接枝率高,能量密度高、回复半衰期长。
本发明提供了一种如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物:
其中,fc为富勒烯cm,m为富勒烯的碳原子数,m=50~120;n=1~8;
x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;
y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种。
优选的,所述m为60~90;n=1~6。
优选的,所述x独立的选自h、甲基、乙基、甲氧基、乙氧基、卤原子中的一种或几种;
y独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c5的烷基中的一种或几种。
本发明提供了一种如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物的制备方法,包括:
a)将富勒烯进行预处理,得到修饰后的富勒烯;
将式(ii)结构的偶氮苯重氮化,得到重氮盐;
b)将重氮盐和修饰后的富勒烯反应,得到如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物;
其中,x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;
y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种。
优选的,步骤a)所述富勒烯进行预处理为酸化或采用表面活性剂修饰。
优选的,所述酸化的酸为v(浓h2so4):v(浓hno3)=(5~1):1;所述表面活性剂选自十二烷基三甲基溴化铵、十二烷基苯磺酸钠、十二烷基硫酸钠和十二烷基磺酸钠中的一种或几种。
优选的,步骤b)所述重氮盐和修饰后的富勒烯的摩尔比为(10~60):1。
优选的,步骤b)所述反应具体为:0~5℃反应2~4h,升温至25~35℃反应12~48h。
优选的,步骤b)所述重氮化具体为:将式(ii)结构的偶氮苯在0~5℃冰浴中反应1~2h得到重氮盐。
本发明提供了一种光热燃料,由包括上述技术方案所述的化合物或上述技术方案所述的制备方法制备得到的化合物制备得到。
与现有技术相比,本发明提供了一种如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物:其中,fc为富勒烯cm,m为富勒烯的碳原子数,m=50~120;n=1~8;x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种。本发明由一端含有氨基的多取代偶氮苯分子接枝于富勒烯表面形成偶氮苯接枝富勒烯纳米杂化化合物,此化合物具有热稳定性好,接枝率高的特点;同时通过增强分子间相互作用,提高了能量密度和回复半衰期。
附图说明
图1为本发明提供的偶氮苯接枝富勒烯纳米杂化材料的合成原理图;
图2为本发明实施例中富勒烯c60的ft-ir光谱图;
图3为4-氨基-2,6-二甲基-4’-羧基偶氮苯的ft-ir光谱图;
图4为4-氨基-2,6-二甲基-4’-羧基偶氮苯接枝在富勒烯c60上的杂化材料的ft-ir光谱图。
具体实施方式
本发明提供了一种如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物:
其中,fc为富勒烯cm,m为富勒烯的碳原子数,m=50~120;n=1~8;
x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;
y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种。
在本发明中,fc为富勒烯,本发明对于所述富勒烯不进行限定,本领域技术人员熟知的富勒烯。富勒烯的结构为cm,其中m为富勒烯的碳原子数,m=50~120;优选的,m=60~90。
其中n为接枝上的偶氮苯的分子的个数,n=1~8;优选的,n=1~6。
其中,x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;x1、x2、x3、x4优选独立的选自h、甲基、乙基、甲氧基、乙氧基、卤原子中的一种或几种;所述卤原子优选为氟、氯、溴或碘。即为x1、x2、x3、x4为苯环上的取代基,可以相同或不同。
y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种;优选的,y独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c5的烷基中的一种或几种;最优选的,y独立的选自h、羟基、羧基、磺酸基、硝基和酰胺基中的一种或几种。即为y1、y2、y3为苯环上的取代基,可以相同或不同。
本发明提供了一种如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物:其中,fc为富勒烯cm,m为富勒烯的碳原子数,m=50~120;n=1~8;x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种。本发明由一端含有氨基的多取代偶氮苯分子接枝于富勒烯表面形成偶氮苯接枝富勒烯纳米杂化化合物,此化合物具有热稳定性好,接枝率高的特点;同时通过增强分子间相互作用,提高了能量密度和回复半衰期。
本发明提供了一种如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物的制备方法,包括:
a)将富勒烯进行预处理,得到修饰后的富勒烯;
将式(ii)结构的偶氮苯重氮化,得到重氮盐;
b)将重氮盐和修饰后的富勒烯反应,得到如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物;
其中,x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;
y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种。
本发明首先将将富勒烯进行预处理,得到修饰后的富勒烯。
本发明所述富勒烯进行预处理为酸化或采用表面活性剂修饰。
本发明对富勒烯进行酸化的具体方式不进行限定,本领域技术人员熟知即可;优选具体为:称取适量的富勒烯加入到混酸v(浓h2so4):v(浓hno3)=(5~1):1溶液中,室温超声分散2~4h,洗涤离心。
其中,所述酸化的酸优选为v(浓h2so4):v(浓hno3)=(5~1):1;更优选为v(浓h2so4):v(浓hno3)=(4~1):1;最优选为v(浓h2so4):v(浓hno3)=(4~2):1。
酸化后优选为洗涤至中性;本发明对于所述洗涤的具体方式不进行限定,本领域技术人员熟知的即可。
本发明对富勒烯采用表面活性剂修饰的具体方式不进行限定,本领域技术人员熟知的即可;优选具体为:称取适量的富勒烯加入到质量分数为0.1%~2%的表面活性剂水溶液中,室温超声分散2~4h形成溶液。
本发明所述表面活性剂优选选自十二烷基三甲基溴化铵、十二烷基苯磺酸钠、十二烷基硫酸钠和十二烷基磺酸钠中的一种或几种;更优选为十二烷基苯磺酸钠、十二烷基硫酸钠和十二烷基磺酸钠中的一种或几种;最优选为十二烷基硫酸钠或十二烷基磺酸钠。
本发明所述表面活性剂的质量浓度优选为0.1%~2%;更优选为0.5%~1.5%。
将式(ii)结构的偶氮苯重氮化,得到重氮盐。
其中,x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;x1、x2、x3、x4优选独立的选自h、甲基、乙基、甲氧基、乙氧基、卤原子中的一种或几种;所述卤原子优选为氟、氯、溴或碘。即为x1、x2、x3、x4为苯环上的取代基,可以相同或不同。
y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种;优选的,y独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c5的烷基中的一种或几种;最优选的,y独立的选自h、羟基、羧基、磺酸基、硝基和酰胺基中的一种或几种。即为y1、y2、y3为苯环上的取代基,可以相同或不同。
本发明所述重氮化优选具体为采用亚硝酸钠和盐酸或硫酸对式(ii)结构的偶氮苯重氮化。
其中所述盐酸或硫酸的浓度优选为0.3~0.7mol/l;更优选为0.5~0.6mol/l。
所述重氮化的条件优选具体为:将式(ii)结构的偶氮苯在0~5℃冰浴中反应1~2h得到重氮盐。更优选为将式(ii)结构的偶氮苯在0~4℃冰浴中反应1~1.5h得到重氮盐。
得到修饰后的富勒烯和重氮盐后,将重氮盐和修饰后的富勒烯反应,得到如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物。
其中,所述重氮盐和修饰后的富勒烯的摩尔比优选为(10~60):1;更优选为(15~55):1;最优选为(20~50):1。
所述反应优选具体为:0~5℃反应2~4h,升温至25~35℃反应12~48h;更优选具体为:0~4℃冰浴中反应2~3h,升温至25~35℃反应12~36h。
反应后,优选将产物过滤,用溶剂清洗,直到滤液经uv-vis光谱检测没有偶氮苯分子的特征吸收峰;而后真空干燥得到产物。
其中所述溶剂优选为去离子水、丙酮和dmf中的一种或几种;所述真空干燥的温度优选为30~50℃;更优选为35~40℃。所述真空干燥的时间优选为20~30h;优选为20~24h。
本发明提供的偶氮苯接枝富勒烯纳米杂化化合物的合成原理图如图1所示,本发明实施例中富勒烯c60的ft-ir光谱图如图2所示。
本发明提供了一种光热燃料,由包括上述技术方案所述的化合物或上述技术方案所述的制备方法制备得到的化合物制备得到。
本发明所述化合物在光热燃料中用作光能转化和储存材料。
本发明还提供了上述技术方案所述的化合物或上述技术方案所述的合成方法制备得到的化合物在制备光热燃料中的应用。
本发明提供了本发明提供了一种如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物的制备方法,包括:a)将富勒烯进行预处理,得到修饰后的富勒烯;将式(ii)结构的偶氮苯重氮化,得到重氮盐;b)将重氮盐和修饰后的富勒烯反应,得到如式(i)所示的偶氮苯接枝富勒烯纳米杂化化合物;其中,x1、x2、x3、x4独立的选自h、c1~c3的烷基、c1~c3的烷氧基和卤原子中的一种或几种;y1、y2、y3独立的选自h、羟基、羧基、磺酸基、硝基、酰胺基和c1~c8的烷基中的一种或几种。本发明先通过预处理,将富勒烯变为水溶性易分散物质,而后将一端含有氨基的多取代偶氮苯分子接枝于富勒烯表面形成偶氮苯接枝富勒烯纳米杂化化合物。本发明无需在有机溶剂中即可反应且接枝率高。同时得到的化合物热稳定好、能量密度高、回复半衰期长。
为了进一步说明本发明,以下结合实施例对本发明提供的偶氮苯接枝富勒烯纳米杂化化合物进行详细描述。
实施例1
称取1.3450g的4-氨基-2,6-二甲基-4’-羧基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去离子水中。搅拌均匀后再慢慢加入盛有50mlhci(0.5mol/l)溶液的烧杯中,置于冰浴中反应1h得到重氮盐溶液。然后缓慢滴入120ml经过酸化的c60(1mg/ml)溶液中,继续在冰浴中反应2h,然后升至室温反应12h。将产物进行过滤,并用去离子水、丙酮和dmf反复清洗,直到滤液经uv-vis光谱检测没有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到产物azo-1-c60。此产物能量密度相比azo分子提高约70%~170%,回复半衰期提高3~5个数量级,同时在30~50次重复光储能/释热过程中保持优异的循环稳定性。。
实施例2
称取1.2050g的4-氨基-2,6-二甲基-4’-羟基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去离子水中。搅拌均匀后再慢慢加入盛有50mlhci(0.5mol/l)溶液的烧杯中,置于冰浴中反应1h得到重氮盐溶液。然后缓慢滴入120ml经过十二烷基硫酸钠修饰的c60(1mg/ml)溶液中,继续在冰浴中反应2h,然后升至室温反应24h。将产物进行过滤,并用去离子水、丙酮和dmf反复清洗,直到滤液经uv-vis光谱检测没有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到产物azo-2-c60。此产物能量密度相比azo分子提高约60%~140%,回复半衰期提高3~4个数量级,同时在30~50次重复光储能/释热过程中保持优异的循环稳定性。
实施例3
称取1.5250g的4-氨基-2,6-二甲基-4’-磺酸基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去离子水中。搅拌均匀后再慢慢加入盛有50mlhci(0.5mol/l)溶液的烧杯中,置于冰浴中反应1h得到重氮盐溶液。然后缓慢滴入120ml经过酸化的c70(1mg/ml)溶液中,继续在冰浴中反应3h,然后升至室温反应36h。将产物进行过滤,并用去离子水、丙酮和dmf反复清洗,直到滤液经uv-vis光谱检测没有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到产物azo-3-c70。此产物能量密度相比azo分子提高约60%~130%,回复半衰期提高3~4个数量级,同时在30~50次重复光储能/释热过程中保持优异的循环稳定性。
实施例4
称取1.5050g的4-氨基-2,6-二甲氧基-4’-羧基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去离子水中。搅拌均匀后再慢慢加入盛有50mlhci(0.5mol/l)溶液的烧杯中,置于冰浴中反应1h得到重氮盐溶液。然后缓慢滴入120ml经过十二烷基硫酸钠修饰的c70(1mg/ml)溶液中,继续在冰浴中反应2h,然后升至室温反应12h。将产物进行过滤,并用去离子水、丙酮和dmf反复清洗,直到滤液经uv-vis光谱检测没有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到产物azo-4-c70。此产物能量密度相比azo分子提高约70%~150%,回复半衰期提高3~5个数量级,同时在30~50次重复光储能/释热过程中保持优异的循环稳定性。
实施例5
称取1.5650g的4-氨基-2,6-二甲基-3’,5’-二羧基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去离子水中。搅拌均匀后再慢慢加入盛有50mlhci(0.5mol/l)溶液的烧杯中,置于冰浴中反应1h得到重氮盐溶液。然后缓慢滴入120ml经过酸化的c90(1mg/ml)溶液中,继续在冰浴中反应2h,然后升至室温反应24h。将产物进行过滤,并用去离子水、丙酮和dmf反复清洗,直到滤液经uv-vis光谱检测没有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到产物azo-5-c90。此产物能量密度相比azo分子提高约90%~220%,回复半衰期提高3~5个数量级,同时在30~50次重复光储能/释热过程中保持优异的循环稳定性。
实施例6
称取1.6450g的4-氨基-2,6-二甲氧基-2’,6’-二甲基偶氮苯,0.2000g的naoh,0.3450g的nano2溶入60ml的去离子水中。搅拌均匀后再慢慢加入盛有50mlhci(0.5mol/l)溶液的烧杯中,置于冰浴中反应1h得到重氮盐溶液。然后缓慢滴入120ml经过十二烷基磺酸钠修饰的c90(1mg/ml)溶液中,继续在冰浴中反应3h,然后升至室温反应36h。将产物进行过滤,并用去离子水、丙酮和dmf反复清洗,直到滤液经uv-vis光谱检测没有偶氮苯分子的特征吸收峰,35℃真空干燥24h得到产物azo-6-c90。此产物能量密度相比azo分子提高约50%~130%,回复半衰期提高2~4个数量级,同时在30~50次重复光储能/释热过程中保持优异的循环稳定性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!