培养基及其用途与诱导多能干细胞向间充质干细胞转化的方法与流程
本发明涉及干细胞及基因工程技术领域,尤其涉及培养基及其用途与间充质干细胞的制备方法。
背景技术:
随着组织工程及临床移植医学的兴起,种子细胞的研究越来越受关注。间充质干细胞(msc,mesenchymalstemcells)是一类存在于多种组织(如骨髓、脐带血和脐带组织、胎盘组织、脂肪组织等)的多能干细胞。其具有高度增殖、自我更新的能力,且具有多向分化的潜能。可在不同诱导条件下分化为软骨、骨、骨骼肌、肌腱、脂肪、真皮、神经及肾实质的细胞等。因此,间充质干细胞常被作为种子细胞。
间充质干细胞的临床研究已经在许多国家开展,美国批准了60余项临床试验,随着间充质干细胞及其相关技术的日益成熟,我国也批准了多项临床试验,走入了间充质干细胞核心技术研发的舞台。目前,临床试验证实,mscs抑制可用于组织修复及治疗间充质组织遗传缺陷性疾病,例如:血液系统疾病,心血管疾病,肝硬化,神经系统疾病,膝关节半月板部分切除损伤修复,自身免疫性疾病等。间充质干细胞的特性决定其具有良好的临床应用前景。
目前,间充质干细胞的主要来源是骨髓和脐带组织,骨髓间充质干细胞随着年龄的老化,干细胞数目显著降低、增殖分化能力大幅度衰退,制备过程不容易质控,移植给异体可能引起免疫反应且对人体伤害较大。脐带间充质干细胞虽免疫性较低但是脐带血的保存比较昂贵。而其他组织来源的干细胞的数量则非常的稀少,分离和培养也十分的困难。因此,进一步研究间充质干细胞的制备方法仍是目前该领域研究的热点。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供培养基及其用途与间充质干细胞的制备方法。本发明提供的培养基能够将尿液细胞重新编程为ips细胞,再将ips细胞诱导为拟胚体然后定向分化为间充质干细胞。
本发明提供的间充质干细胞诱导培养基包括基础培养基和:
一些实施例中,间充质干细胞诱导培养基由基础培养基和以下组分组成:
fbs是胎牛血清;bfgf为碱性成纤维细胞生长因子;scf为干细胞因子。本发明中,在基础培养基中添加fbs、l-谷氨酰胺、胰岛素、bfgf和scf,该培养基能够诱导ips细胞向间充质干细胞转化。所述基础培养基为dmem培养基。
本发明还提供了一种诱导ips细胞转化为间充质干细胞的方法,将ips细胞以mtesr培养基培养至融合度为60%~80%时,更换培养基为间充质干细胞诱导培养基,诱导5~7天获得间充质干细胞。
一些实施例中,诱导条件为37℃,饱和湿度,5%co2。所述诱导在以明胶包被的培养板中进行。所述培养过程中每天更换新鲜培养基。
实验表明,以该方法诱导ips细胞,5~7d细胞发生形变。
一种由尿液细胞制备间充质干细胞的方法,包括以下步骤:
将转录调控因子oct4、sox2、nanog、klf4和lin28导入尿液细胞,培养获得ips细胞;
将ips细胞以mtesr培养基培养至融合度为60%~80%时,更换培养基为间充质干细胞诱导培养基,诱导5~7天获得间充质干细胞。
一些实施例中,诱导条件为37℃,饱和湿度,5%co2。所述诱导在以明胶包被的培养板中进行。所述培养过程中每天更换新鲜培养基。
本发明中,获得间充质干细胞后还包括增殖、传代的步骤,所述增殖、传代采用间充质干细胞培养基;
所述间充质干细胞培养基包括基础培养基和:
一些实施例中,间充质干细胞由基础培养基和以下组分组成:
hgf是肝细胞生长因子、pdgf为血小板衍生因子,tgf-β为转化生长因子-β。本发明将fbs、egf、hgf、bfgf、pdgf和tgf-β添加入基础培养基,所得培养基能够用于间充质干细胞的培养。所述基础培养基为dmem培养基。
本发明中,尿液细胞的制备方法为:离心尿液,沉淀经灭菌后,以含有primocin的regm培养基培养,获得尿液细胞。
本发明中,尿液细胞的具体制备方法为:
步骤1:在含有青霉素/链霉素双抗的容器中收集尿液,400g离心10min,沉淀以含有青霉素/链霉素的pbs(每95mlpbs加入5ml青霉素/链霉素)清洗一次后,转移至经0.1%明胶包被的培养板;
步骤2:含有primocin的regm培养基(每2mlregm培养基添加3μlprimocin)培养,培养条件为37℃,饱和湿度,5%co2;待细胞贴壁后,吸去培养基,用pbs洗一遍,再进行换液处理;当尿液细胞融合度达到80%,进行传代培养。
所述转录调控因子oct4、sox2、nanog、klf4和lin28导入尿液细胞后,细胞以regm与mef的混合培养基(体积比1:1)在用明胶包被后的培养板上进行培养;导入转录调控因子后第2天,将培养基更换为ips培养基mtesr,每天更换新鲜培养基,使克隆继续增殖;导入转录调控因子后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用明胶包被的培养板,培养基mtesr培养获得诱导多能干细胞(ips细胞)。
ips细胞用0.03%-0.3%胶原酶iv将细胞消化成单个细胞后,再诱导形成间充质干细胞。
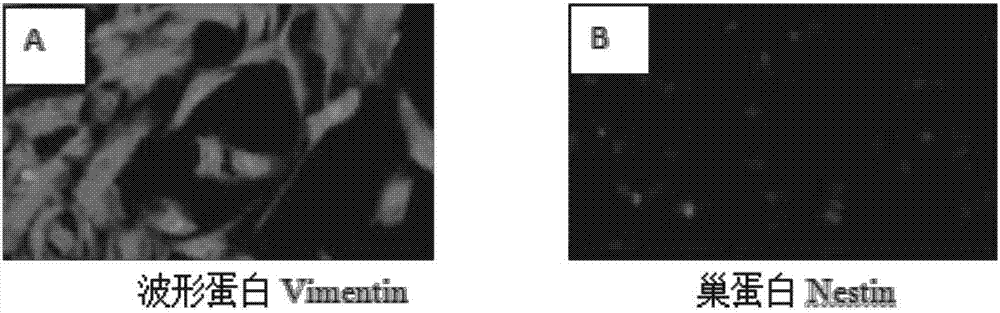
rt-pcr检测间充质干细胞中基因表达情况,naong和oct-4在间充质干细胞中的表达量几乎不表达,说明诱导的间充质干细胞丧失了多能干性基因的表达,间充质干细胞属于中胚层msx-1是中胚层基因在间充质干细胞中的表达量显著增高,符合间充质干细胞的特征。免疫荧光检测制得的间充质干细胞,结果显示波型蛋白表达为阳性而巢蛋白表达为阴性,这与间充质干细胞表达中胚层标vimentin,而不表达外胚层标志nestin的结果相符合。
本发明提供了培养基以及使用该培养基诱导尿液细胞成为间充质干细胞的方法,尿液细胞来源广泛,不受伦理限制,采用本发明提供的方法,尿液细胞形成ips细胞后经诱导形成间充质干细胞。全部诱导能够在12~15天内完成,所获得的细胞经检测符合间充质干细胞的特性,数量较大,活率较高。
附图说明
图1示实施例1制备间充质干细胞的表面标记抗原检测情况;
图2示实施例1制备间充质干细胞的免疫荧光检测情况。
具体实施方式
本发明提供了培养基及其用途与间充质干细胞的制备方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的试材皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
1、培养基的制备
ips诱导培养基(配置培养基a):regm与mef培养基按体积比的比例混合。
间充质干细胞诱导培养基(配置培养基b):450mldmem基础培养基、50mlfbs、80pm胰岛素、5mml-谷氨酰胺、85ug/lbfgf、15ug/lscf、3×10-8mol/l地塞米松。
间充质干细胞培养基(配置培养基c):450mldmem基础培养基、50mlfbs、10ng/mlhegf、10ng/mlbfgf、3ng/mlhgf、5ng/mlpdgf、5ng/mltgf-β。
2、尿液细胞的获取
1)收集杯每个加2ml青霉素/链霉素双抗。
2)收集尿液,如不立刻进行后续操作,则将尿液存储于4℃冰箱并于当天完成后续操作。
3)每份尿液准备六孔板1孔,将此孔用0.1%明胶包被20min以上,使用前吸去孔内液体。
4)把尿液倒到合适数量的50ml离心管里,离心400g,10min。
5)吸去上清,每管留下约1-5ml,混合到一个离心管内。
6)加入含有青霉素/链霉素的pbs(pbs95ml加入5ml青霉素/链霉素混匀)约10-30ml。轻轻混匀。
7)离心400g,10min。
8)吸去上清至剩余0.5-1ml液体。
9)把剩余的液体加入包被好的孔中,加入2mlregm培养基加入3μlprimocin。
10)将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后(7天),吸去培养基,用pbs洗一遍,再进行换液处理。
11)当尿液细胞融合度达到80%,则可进行传代培养。
3、尿液细胞重编程为ips细胞
1)将表达转录调控因子oct4、sox2、nanog、klf4和lin28或其它转录因子的各种组合共同导入尿细胞,将细胞分至预先用matrigel包被的6孔板中,用培养液a培养;
2)转染后第2天,将培养基更换为ips培养基mtesr,每天更换新鲜培养基;使克隆继续增殖
3)转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,培养基mtesr培养获得诱导多能干细胞。
4、ips诱导间充质干细胞
1)将制备好的ips细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,mtesr培养基进行培养。
2)待六孔板中的ips细胞融合度达到70%时,pbs清洗将ips培养基清除干净,加入培养液b进行诱导培养,每天更换培养液。
3)培养5-7d细胞发生形变,更换培养液c进行培养。
实施例2
1、培养基的制备
ips诱导培养基(配置培养基a):regm与mef培养基按体积比的比例混合。
间充质干细胞诱导培养基(配置培养基b):450mldmem基础培养基、50mlfbs、1pm胰岛素、1mml-谷氨酰胺、50ug/lbfgf、5ug/lscf、2×10-8mol/l地塞米松。
间充质干细胞培养基(配置培养基c):450mldmem基础培养基、50mlfbs、1ng/mlhegf、1ng/mlbfgf、1ng/mlhgf、、2ng/mlpdgf、1ng/mltgf-β。
2、尿液细胞的获取
1)收集杯每个加2ml青霉素/链霉素双抗。
2)收集尿液,如不立刻进行后续操作,则将尿液存储于4℃冰箱并于当天完成后续操作。
3)每份尿液准备六孔板1孔,将此孔用0.1%明胶包被20min以上,使用前吸去孔内液体。
4)把尿液倒到合适数量的50ml离心管里,离心400g,10min。
5)吸去上清,每管留下约1-5ml,混合到一个离心管内。
6)加入含有青霉素/链霉素的pbs(pbs95ml加入5ml青霉素/链霉素混匀)约10-30ml。轻轻混匀。
7)离心400g,10min。
8)吸去上清至剩余0.5-1ml液体。
9)把剩余的液体加入包被好的孔中,加入2mlregm培养基加入3μlprimocin。
10)将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后(7天),吸去培养基,用pbs洗一遍,再进行换液处理。
11)当尿液细胞融合度达到80%,则可进行传代培养。
3、尿液细胞重编程为ips细胞
1)将表达转录调控因子oct4、sox2、nanog、klf4和lin28或其它转录因子的各种组合共同导入尿细胞,将细胞分至预先用matrigel包被的6孔板中,用培养液a培养;
2)转染后第2天,将培养基更换为ips培养基mtesr,每天更换新鲜培养基;使克隆继续增殖
3)转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,培养基mtesr培养获得诱导多能干细胞。
4、ips诱导间充质干细胞
1)将制备好的ips细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,mtesr培养基进行培养。
2)待六孔板中的ips细胞融合度达到70%时,pbs清洗将ips培养基清除干净,加入培养液b进行诱导培养,每天更换培养液。
3)培养5-7d细胞发生形变,更换培养液c进行培养。
实施例3
1、培养基的制备
ips诱导培养基(配置培养基a):regm与mef培养基按体积比的比例混合。
间充质干细胞诱导培养基(配置培养基b):450mldmem基础培养基、50mlfbs、160pm胰岛素、10mml-谷氨酰胺、200ug/lbfgf、50ug/lscf、5×10-8mol/l地塞米松。
间充质干细胞培养基(配置培养基c):450mldmem基础培养基、50mlfbs、100ng/mlhegf、100ng/mlbfgf、50ng/mlhgf、、20ng/mlpdgf、25ng/mltgf-β。
2、尿液细胞的获取
1)收集杯每个加2ml青霉素/链霉素双抗。
2)收集尿液,如不立刻进行后续操作,则将尿液存储于4℃冰箱并于当天完成后续操作。
3)每份尿液准备六孔板1孔,将此孔用0.1%明胶包被20min以上,使用前吸去孔内液体。
4)把尿液倒到合适数量的50ml离心管里,离心400g,10min。
5)吸去上清,每管留下约1-5ml,混合到一个离心管内。
6)加入含有青霉素/链霉素的pbs(pbs95ml加入5ml青霉素/链霉素混匀)约10-30ml。轻轻混匀。
7)离心400g,10min。
8)吸去上清至剩余0.5-1ml液体。
9)把剩余的液体加入包被好的孔中,加入2mlregm培养基加入3μlprimocin。
10)将培养皿放置于37℃培养箱内培养,待尿液细胞贴壁后(7天),吸去培养基,用pbs洗一遍,再进行换液处理。
11)当尿液细胞融合度达到80%,则可进行传代培养。
3、尿液细胞重编程为ips细胞
1)将表达转录调控因子oct4、sox2、nanog、klf4和lin28或其它转录因子的各种组合共同导入尿细胞,将细胞分至预先用matrigel包被的6孔板中,用培养液a培养;
2)转染后第2天,将培养基更换为ips培养基mtesr,每天更换新鲜培养基;使克隆继续增殖
3)转染后第7天,镜下观察形态与人胚胎干细胞相近的挑取单克隆,并接种于用matrigel包被的12孔板中,培养基mtesr培养获得诱导多能干细胞。
4、ips诱导间充质干细胞
1)将制备好的ips细胞,0.25%的胰酶进行消化,收集细胞按1:3的比例接种至matrigel包被好六孔板中,mtesr培养基进行培养。
2)待六孔板中的ips细胞融合度达到70%时,pbs清洗将ips培养基清除干净,加入培养液b进行诱导培养,每天更换培养液。
3)培养5-7d细胞发生形变,更换培养液c进行培养。
实施例4
对实施例1~3制得的间充质干细胞进行检测:
1、流式细胞术表面抗原检测
实验步骤
①将各实施例备好的间充质干细胞待其融合度达到80%时,0.25%胰酶消化间充质干细胞并收集细胞,使其细胞数为2×105个/每例样本;
②细胞胞重悬于1mldpbs中洗涤2次,200g,离心5min;
每管样本加入1ml70%预冷的酒精重悬固定2h;
③离心弃去固定液,加入200μl鼠源cd29、cd44、cd73、cd90、cd105、cd34、cd45一抗抗体(稀释度为1:100)常温下孵育30min;
④1mlpbs洗涤后,分别与fitc标记二抗(稀释度为1:200)常温避光孵育1h;
⑤pbs洗两次后,弃去,根据细胞量加入适量的pbs重悬细胞,利用流式细胞仪检测。
通过流式细胞仪分析显示,在实施例1~3制得的间充质干细胞中cd29、cd44、cd73、cd90、cd105表达为阳性,而cd34、cd45表达为阴性,符合间充质干细胞表面标记物的表达结果。图2示对实施例1制得间充质干细胞表面标记抗原的检测结果。实施例2~3制得干细胞的检测结果与此相似。
2、免疫荧光检测间充质干细胞
①0.25%胰酶消化成纤维细胞,以1×105的接种量接种于放有细胞爬片的6孔板中,待其贴壁,4%的多聚甲醛固定2h,pbs洗三遍;
②加200μl的一抗稀释液(pbs+10%血清+0.3%tritonx-100)常温封闭1-2h;
③弃去一抗稀释液,分别加入200μl鼠源vimentin和nestin一抗抗体(稀释浓度为1:100),4℃孵育过夜,pbs冲洗三次3次,每次5min;
④分别加200μl羊抗鼠二抗(1:400),常温避光反应1h,dapi复染,10%的甘油封片,荧光显微镜下观察。结果见图2。
结果表明,实施例1~3制得的间充质干细胞中,波型蛋白表达为阳性而巢蛋白表达为阴性,这与间充质干细胞表达中胚层标vimentin,而不表达外胚层标志nestin的结果相符合。其中,对实施例1制得间充质干细胞的检测结果如图1。实施例2~3制得干细胞的检测结果与此相似。
3、细胞活力检测
采用mtt法对各实施例制得细胞的活率进行检测,结果表明,实施例1~3制得间充质干细胞的活力依次为95%、65%、55%,其中实施例1制得的干细胞的活力显著高于实施例2~3(p<0.05)
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!