一种特异性敲减人BRCC3基因慢病毒的构建及在肺癌中的应用的制作方法
本发明属于分子生物学及肿瘤学领域,具体涉及一种乳腺癌易感基因复合物亚基基因brcc3及2个稳定敲减brcc3基因重组质粒的构建及其在肺癌中的应用。
背景技术:
恶性肿瘤是严重危害人民生活和健康的重大疾病之一,是全球第二大致死性疾病。其中,肺癌是全球癌性死亡的首要原因,也是导致我国城乡居民死亡的罪魁祸首,其发病率和死亡率仍在不断上升。肺癌起病隐匿,早期不易发现,确诊时多属晚期,手术、化疗、放疗仍是治疗肺癌的主要方法,但是,即使根治性手术也不能避免全身转移,化疗、放疗杀伤作用没有针对性,且长期放化疗会损伤机体的免疫系统及各器官组织的功能,甚至诱发新的癌变。因此,迫切需要找到新的方法和思路来解决这一难题。
随着分子生物学及免疫组学的不断发展,人们把越来越多的目光投到以基因和蛋白为基础的靶向治疗上。靶向治疗是在细胞分子水平上,针对致癌位点(肿瘤细胞内部的蛋白分子、基因片段),来设计相应的治疗药物,药物进入体内特异地与致癌位点结合,使肿瘤细胞死亡,而不会波及肿瘤周围的正常组织细胞,所以分子靶向治疗又被称为"生物导弹"。由此可知,在分子靶向治疗中,寻找合适的治疗靶点至关重要。
brcc3是乳腺癌易感基因复合物亚基3,是2003年从brcc复合物中发现的一种含锌jamm/mpn+类去泛素化酶,由316个氨基酸组成,分子量约为36kda。既往对brcc3的研究主要集中于其在正常生理过程中的作用,如调控细胞周期检查点、dna损伤修复、细胞有丝分裂等多种细胞活动,在血管生成、心肌缺血再灌注、心肌凋亡等过程中发挥重要作用。近年来,有研究发现,brcc3在乳腺癌、鼻咽癌中高表达,可作为预后标志物,促进肿瘤细胞增殖,参与放疗耐受和化疗耐药,可作为肿瘤生物治疗潜在靶点,但其具体机制及在肺癌中的作用仍未阐明。
技术实现要素:
本发明的目的在于针对brcc3基因在肿瘤中的研究现状及其可作为潜在治疗靶点的应用前景,提供一种能特异性敲减brcc3基因的shrna序列及慢病毒的制备方法,并进一步验证该慢病毒对肺癌细胞的作用。
本发明的目的通过以下技术方案实现:
step1,通过pcr合成能特异性敲减人brcc3基因的shrna序列;
step2,构建能特异性干扰brcc3基因的重组质粒;
step3,包装能特异性干扰brcc3基因的慢病毒;
step4,筛选验证step3中的能够特异性干扰brcc3基因的慢病毒;
step5,观察step3中能够特异性干扰brcc3基因的慢病毒对肺癌细胞生物学功能的影响。
进一步的,步骤step1中,包含如下步骤:
(1):利用ncbi(https://www.ncbi.nlm.nih.gov/gene)数据库,获得人brcc3基因的转录本及编码(cds)区信息。
(2):针对人brcc3基因的编码区,设计2个能特异性敲减人brcc3基因的核苷酸序列。
(3)根据gv248载体及step2中设计的shrna序列,选择合适的限制性内切酶(agei和ecori),分别于靶序列的5’端和3’端加上agei、ecori限制性内切酶位点,化学合成该shrna序列(单链引物)。
进一步的,所述的gv248载体,可以替换成其他作为构建干扰慢性病毒的载体,如psh-h1-gfp,psh-u6-gfp,plent-u6-puro,pav-h1-gfp等。挑选此类作为构建干扰慢病毒的载体的方法在于:1.能够稳定、高效沉默/干扰目的基因;2.能高效感染细胞;3.带有绿色荧光标记,便于观察;4.带有嘌呤霉素抗性,必要时便于筛选稳定细胞株。
(4):将上一步中合成的单链引物粉末溶于退火缓冲液中,90℃水浴15min,待其自然冷却至室温,形成双链dna。
(5)载体酶切:根据限制性内切酶说明书,配制50l酶切反应体系,将其置于37℃酶切过夜。
(6):用dna纯化试剂盒对上述载体酶切产物进行纯化。
进一步的,步骤step2中,包含如下步骤:
(1):用t4dna连接酶将step1(4)中的双链dna与酶切纯化后的载体进行连接,16℃连接过夜。
(2):重组质粒的转化:将10l连接反应液加入150l感受态细胞中,轻微混匀,冰上放置30min后,42℃水浴90s,冰水孵育2min。加入1mllb培养基,置于37℃摇床振荡(100rpm)培养1h。4000rpm离心2min,去上清,加入150l含有氨苄青霉素的lb培养基,轻微混匀,将其均匀涂布于含有氨苄青霉素的细菌培养平板上,37℃倒置培养15h。(3):挑选单克隆菌落,置于1ml含有氨苄青霉素的lb培养基中,37℃摇床振荡(230rpm)培养7h,取1l菌液用能特异扩增brcc3基因的引物进行pcr反应。并用1%琼脂糖凝胶电泳鉴定pcr产物。
进一步的,步骤step3中,包含如下步骤:
(1):取部分上一步中鉴定出的阳性菌液进行测序,将测序结果与step1中所设计的shrna序列进行比对,若序列一致,则该菌液即为正确克隆的菌液。
(2):提取质粒:将测序正确的菌液接种于15ml含氨苄青霉素的lb培养基中,于37℃摇床振荡(230rpm)培养过夜,用天根质粒小提中量试剂盒,按照试剂盒说明书进行质粒抽提。
(3):扩大培养携带phelper1.0和phelper2.0质粒的菌液,用天根质粒小提中量试剂盒进行质粒抽提。
进一步的,如上步骤中除了可以使用phelper1.0和phelper2.0,还可以使用pspax2和pmd2g等。
(4):将5×106个处于对数生长期的293t细胞接种于10cm培养皿中,37℃、5%co2培养箱中培养24小时。
进一步的,因为293t细胞适宜的包膜和高表达反转录酶,能提高慢病毒的滴度,故此处用来包装产生慢病毒。
(5):将培基更换为无血清培养基。设计实验组和对照组:向一无菌ep管中分别加入20ggv248质粒、15gphelper1.0质粒、10gphelper2.0质粒和相应体积的lip2000,混合均匀,室温孵育20min。其中,实验组中的gv248质粒为已经连接上shrna序列的gv248质粒,对照组为未连接上shrna序列的gv248质粒。
(6):将上述质粒混合液缓慢加入293t细胞中,混匀,于37℃、5%co2培养箱中培养,6h后更换为含有10%胎牛血清的培养基,于37℃、5%co2培养箱中继续培养48h。
(7):收集转染48h后的293t细胞上清液,于4℃、4000g离心10min,除去细胞碎片,收集病毒颗粒。
进一步的,步骤step4中,包含以下两种方法:
验证步骤step3中慢病毒的方法,其特征在于直接利用westernblot验证brcc3蛋白的表达,内参蛋白为α-tubulin。
验证步骤step3中慢病毒的方法,其特征在于采用实施荧光定量pcr。
1.进一步的,步骤step5中,检测step3中慢病毒对肺癌细胞生物学功能的影响及具体方法,包括:
(1)细胞增殖活性检测(mts法):将103个生长状态良好细胞接种于96孔板,每孔加入150ul培养基,置于5%co237℃培养箱中培养1天后,每孔加mts溶液(5mg/ml)30ul,继续孵育2小时;选择490nm波长测定各孔的吸光度,连续检测7天。
(2)克隆形成实验:将200个生长状态良好细胞接种于6孔板,置于5%co2、37℃培养箱中培养14天后终止培养。pbs洗涤2次后加甲醇固定15分钟,加适量苏木素染色液染10~30分钟,流水冲洗后扫描拍照。肉眼直接计数克隆或在显微镜(低倍镜)计数大于10个细胞的克隆数,计算克隆形成率。克隆形成率=克隆数/接种数×100%
(3)流式细胞周期检测:将处于对数生长期的2×106个细胞于70%的乙醇中固定、漂洗,离心收集细胞,0.2m柠檬酸/柠檬酸钠高渗处理30分钟,1×pbs洗2次,0.1%triton(pbs配制)洗1次,再用500μg/mlpi和0.1%rnaasea,室温避光孵育30分钟,流式细胞仪检测分析。
本发明的有益效果如下:
1.本发明构建的重组质粒(菌液)可批量扩增,大量包装慢病毒,满足多个分子生物学研究。
2.用该慢病毒感染两株人肺癌细胞系,westernblot检测发现,两株人肺癌细胞系中brcc3蛋白表达均降低,结果表明本发明所构建的两个慢病毒均能明显抑制内源性brcc3的表达。
3.mts法检测细胞增殖表明,与转染对照慢病毒相比,转染本发明中的两个慢病毒可以抑制肺癌细胞的增殖能力。
4.平板克隆形成实验表明,与转染对照慢病毒相比,转染本发明中的两个慢病毒均能抑制肺癌细胞的克隆形成能力。
5.流式细胞术检测肺癌细胞周期表明,与转染对照慢病毒相比,转染本发明中的两个慢病毒均能抑制肺癌细胞的细胞周期进程,使其阻滞于g1期。
附图说明
图1为构建敲减brcc3基因重组质粒的gv248载体结构图;
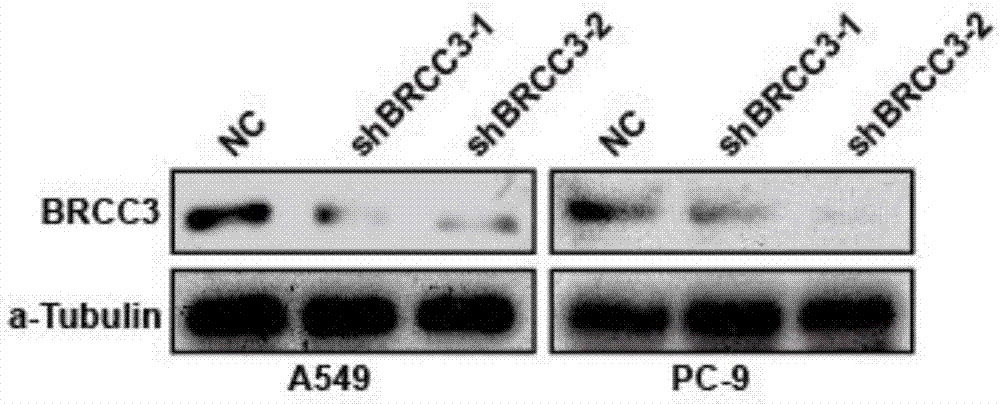
图2为两种慢病毒对肺癌细胞中brcc3蛋白的抑制情况鉴定;
图3为两种慢病毒对肺癌细胞增殖能力的抑制情况;
图4为两种慢病毒对肺癌细胞克隆形成能力的抑制情况;
图5为两种慢病毒对肺癌细胞细胞周期的阻滞情况。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
具体实施方式1:
构建能特异性干扰人brcc3基因的重组质粒及慢病毒的包装,本发明的具体实施过程为:
1.一种能特异性干扰brcc3基因的重组质粒的构建方法,包括以下步骤:
step1:利用ncbi(https://www.ncbi.nlm.nih.gov/gene)数据库,获得人brcc3基因的转录本及编码(cds)区信息(转录本1:nm_024332.3,cds区为109-1059,具体序列见序列表)。
step2:针对人brcc3基因的cds区,设计2个能特异性敲减人brcc3基因的shrna序列。
step3:根据gv248载体及step2中设计的shrna序列,选择合适的限制性内切酶(agei和ecori),分别于靶序列的5’端和3’端加上agei、ecori限制性内切酶位点,化学合成该shrna序列(单链引物)。
如图1所示,为gv248载体结构图,从图1可以看出本发明设计的2个特异性敲减人brcc3基因shrna序列所连接的位置,为mcs区域。
step4:将step3中合成的单链引物粉末溶于退火缓冲液中,90℃水浴15min,待其自然冷却至室温,形成双链dna。
step5:载体酶切:根据限制性内切酶说明书,配制50μl酶切反应体系,将其置于37℃酶切过夜。
step6:用dna纯化试剂盒对上述载体酶切产物进行纯化。
step7:用t4dna连接酶将(4)中的双链dna与酶切纯化后的载体进行连接,16℃连接过夜。
step8:重组质粒的转化:将10μl连接反应液加入150μl感受态细胞中,轻微混匀,冰上放置30min后,42℃水浴90s,冰水孵育2min。加入1mllb培养基,置于37℃摇床振荡(100rpm)培养1h。4000rpm离心2min,去上清,加入150μl含有氨苄青霉素的lb培养基,轻微混匀,将其均匀涂布于含有氨苄青霉素的细菌培养平板上,37℃倒置培养15h。
step9:挑选单克隆菌落,置于1ml含有氨苄青霉素的lb培养基中,37℃摇床振荡(230rpm)培养7h,取1μl菌液用能特异扩增brcc3基因的引物进行pcr反应。并用1%琼脂糖凝胶电泳鉴定pcr产物。
step10:取部分step9中鉴定出的阳性菌液进行测序,将测序结果与step2中所设计的shrna序列进行比对,若序列一致,则该菌液即为正确克隆的菌液。
step11:提取质粒:将测序正确的菌液接种于15ml含氨苄青霉素的lb培养基中,于37℃摇床振荡(230rpm)培养过夜,用天根质粒小提中量试剂盒,按照试剂盒说明书进行质粒抽提。
2.包装能特异性干扰brcc3基因的慢病毒的方法,包括以下步骤:
step1:扩大培养携带phelper1.0和phelper2.0质粒的菌液,用天根质粒小提中量试剂盒进行质粒抽提。
step2:将5×106个处于对数生长期的293t细胞接种于10cm培养皿中,37℃、5%co2培养箱中培养24小时。
step3:将培基更换为无血清培养基。向一无菌ep管中分别加入20μggv248质粒、15μgphelper1.0质粒、10μgphelper2.0质粒和相应体积的lip2000,混合均匀,室温孵育20min。
step4:将上述质粒混合液缓慢加入293t细胞中,混匀,于37℃、5%co2培养箱中培养,6h后更换为含有10%胎牛血清的培养基,于37℃、5%co2培养箱中继续培养48h。
step5:收集转染48h后的293t细胞上清液,于4℃、4000g离心10min,除去细胞碎片,收集病毒颗粒。
具体实施方式2:
稳定干扰brcc3基因的人肺癌细胞系的构建,包括以下步骤:
step1:复苏a549和pc-9人肺癌细胞,用含10%的胎牛血清的rpmi-1640培养基于37℃、5%co2的细胞培养箱中培养细胞。
step2:将处于对数生长期的a549和pc-9细胞接种于24孔培养板中(104个/孔),8小时后进行慢病毒感染。
step3:弃step2中孔内培养基,每孔加入100ul含10%的胎牛血清的rpmi-1640培养基。
step4:取1.5mlep管,分别向管中加入400ulopti-men无血清培养基、1ul5mg/mlpolybrene促感染剂、200ul慢病毒颗粒,轻柔混匀。
step5:将step4中的慢病毒混合液加入step3的孔内,轻柔摇匀,于37℃、5%co2的细胞培养箱中培养,10小时后更换新鲜培养基,逐渐扩大培养。
step6:用ripa细胞裂解液(按100:1加入蛋白酶抑制剂)裂解处于对数生长期的细胞提取总蛋白,用bca法测蛋白浓度并于95℃水浴10min变性蛋白。
step7:利用westernblot验证brcc3蛋白的表达,内参蛋白为α-tubulin。
如图2所示,为westernblot验证稳定干扰人brcc3基因的肺癌细胞系构建情况,从图2可以看出,与阴性对照慢病毒比较,本发明设计包装的2个慢病毒均使brcc3蛋白表达降低,说明本发明设计的2个shrna序列均能明显抑制人brcc3基因的表达,本发明构建的2个质粒均能抑制人brcc3基因的表达,本发明包装的2个慢病毒均能稳定干扰brcc3基因表达,本发明构建的2株稳定干扰brcc3基因的人肺癌细胞系构建成功,可用于后续研究。
具体实施方式3:
稳定干扰brcc3对肺癌细胞生物学功能的影响,包括以下方法及步骤:
(1)细胞增殖活性检测(mts法):将103个生长状态良好细胞接种于96孔板,每孔加入150ul培养基,置于5%co237℃培养箱中培养1天后,每孔加mts溶液(5mg/ml)30ul,继续孵育2小时;选择490nm波长测定各孔的吸光度,连续检测7天。
如图3所示,为稳定干扰人brcc3基因后肺癌细胞增殖能力的变化,从图3可以看出,与阴性对照组细胞比较,稳定干扰brcc3基因后,a549和pc-9肺癌细胞增殖能力明显减慢,说明本发明包装的两个慢病毒,抑制brcc3基因后,均能抑制肺癌细胞的增殖能力。
(2)克隆形成实验:将200个生长状态良好细胞接种于6孔板,置于5%co2、37℃培养箱中培养14天后终止培养。pbs洗涤2次后加甲醇固定15分钟,加适量苏木素染色液染10~30分钟,流水冲洗后扫描拍照。肉眼直接计数克隆或在显微镜(低倍镜)计数大于10个细胞的克隆数,计算克隆形成率。克隆形成率=克隆数/接种数×100%
如图4所示,为稳定干扰人brcc3基因后肺癌细胞克隆形成能力的变化,从图4可以看出,与阴性对照组细胞比较,稳定干扰brcc3基因后,a549和pc-9肺癌细胞形成的克隆数明显减少,说明本发明包装的两个慢病毒,抑制brcc3基因后,均能抑制肺癌细胞的克隆形成能力。
(3)流式细胞周期检测:将处于对数生长期的2×106个细胞于70%的乙醇中固定、漂洗,离心收集细胞,0.2m柠檬酸/柠檬酸钠高渗处理30分钟,1×pbs洗2次,0.1%triton(pbs配制)洗1次,再用500μg/mlpi和0.1%rnaasea,室温避光孵育30分钟,流式细胞仪检测分析。
如图5所示,为稳定干扰人brcc3基因后肺癌细胞周期的变化,从图5可以看出,与阴性对照组细胞比较,稳定干扰brcc3基因后,a549和pc-9肺癌细胞处于g1期细胞比例增加,说明本发明包装的两个慢病毒,抑制brcc3基因后,均能使肺癌细胞的细胞周期阻滞于g1期。
以上所述实施例,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
第一个序列表:人brcc3基因(cds区为109-1059)
aggcctgggcggagcgcacagcgctgggcgctggggaggctgcgccgcagcacccggttg
gtcaggaccaagtgggcccgaggcggacgtgagaagggtcgggccaagatggcggtgcag
gtggtgcaggcggtgcaggcggttcatctcgagtctgacgctttcctcgtttgtctcaac
cacgctctgagcacagagaaggaggaagtaatggggctgtgcataggggagttgaacgat
gatacaaggagtgactccaaatttgcatatactggaactgaaatgcgcacagttgctgaa
aaggttgatgccgtcagaattgttcacattcattctgtcatcatcttacgacgttctgat
aagaggaaggaccgagtagaaatttctccagagcagctgtctgcagcttcaacagaggca
gagaggttggctgaactgacaggccgccccatgagagttgtgggctggtatcattcccat
cctcatataactgtttggccttcacatgttgatgttcgcacacaagccatgtaccagatg
atggatcaaggctttgtaggacttattttttcctgtttcatagaagataagaacacaaag
actggccgggtactctacacttgcttccaatccatacaggcccaaaagagttcagagtcc
cttcatggtccacgagacttctggagctccagccagcacatctccattgagggccagaag
gaagaggaaaggtatgagagaatcgaaatcccaatccatattgtacctcatgtcactatc
gggaaagtgtgccttgaatcagcagtagagctgcccaagatcctgtgccaggaggagcag
gatgcgtataggaggatccacagccttacacatctggactcagtaaccaagatccataat
ggctcagtgtttaccaagaatctgtgcagtcagatgtcggcagtcagcgggcctctccta
cagtggttggaggacagactggagcaaaaccaacagcatttgcaggaattacaacaagaa
aaggaagagcttatgcaagaactttcttctctagaataaatcaggagacaaaatggggaa
agatgaaaatatccagtgtaaagttacttaagctaaatcaatttcaaagaagaaaaactt
ggaggactcattttacctgacttcaagacttactataaagctatagtaatcaagatagat
ggtattggcagaggaacagacacatacgtcaatggaacagatgagagaacccagaaataa
acccatataaatatgctcagctgattttgaaaaagtgaaaaagcaattcaatggaggaag
aatagcctttctgacaaattatgctagagcaattagacacccatggcgaggagaaaaaag
aacctctacttaaacctcacatcttatataaaatttaactcaaaatgtataacggactta
aatgtgatacataaaactagataactttgaaaaaagccacaggagaaaaatcttcaggat
cttgggctaggtgacaagttcttggactttgccccgaaagcacatccataaaagacaaaa
tctgatatattggacttcttcaaaatttaaaaacttgtgatttaagaagaggaaaagata
agctacagattgagatgaatttgcaaaccatatatctgatcaatttggaatatataaagt
gtactaaaaactcaactgaagtcaggcatggtagctcatgcttgtaatctcaccactttg
ggaggccaagatgggaggagtgcttgaggttaggcgttccagaccagcctgggcaacata
gtgagactcttgtctctacaaaaagtttttttaaaaaattaactgggcaccatgacacac
accagtagtcccagctactagggaggcaggaggatcacttgagcccaggagtttgaggct
gcggtgagctgtgatcacaccaccacactccaacctgtgtaacagagtgaggcctcatct
caaaaaaaaaaaaaggccacaaaactcaacaataaaaacaaacagtccaattagaaaatg
ggcaaaagacatgaatagatgtttcactgaagaggatctatagatggcaagtaagcatat
gaaaagctgttaaactccataagtcatcagggaatgcaaattgaaaccacagcgaggcta
tgacttacttatctcaatggctaaagaaaaaatagtgaaaataccaaatactgatgagga
tacaaactggatattttatacattgctgacaggaatgtaaaatggtacagccactctggg
aaagagtttatgaatttcttatcaagttaaacataattttttaatcaagttaaacataag
acccagcagttgtgctcctggacattcattccagagaaatgaaaacctatattgtacttg
tactcaaatattcataggagctttatttgtaatagccccaaactggaaacaacccagatg
tcctacaacaggtacatggttaaacaaaccatccataacttggaatactgctctggaatg
aaaaggaactaactgttgatacaagaacttggttgtacctcaggggtattatggtgaaca
aaaaaaaaaccagtctcaaatggtcacatactgtatgatcgcatttatataacattcttg
aggtgacaaaattattgaaatgaagaacagattaatggttgccagggatagggactggag
ggggtgtggggtatgtatgactataaagggatgacgcaaggagttcctttgtgctgatgg
aacagttctatatgattatgatgattacgatgttgattataacatttgattatgaggtta
agcacatgagtctttacctgtgctgaagttgtatggacctacatacacacaaatgaatgc
atgtaaaatctggtgatactgaataaagtctgtggtctagatagcagtaaaaaaaaaaaa
aaaaaaaaaaaa
第二个序列表:特异性敲减人brcc3基因的shrna序列表
rnai-1-f:ccgggccgtcagaattgttcacattctcgagaatgtgaacaattctgacggctttttg
rnai-1-r:aattcaaaaagccgtcagaattgttcacattctcgagaatgtgaacaattctgacggc
第三个序列表:特异性敲减人brcc3基因的shrna序列表
rnai-2-f:ccgggagcacagagaaggaggaagtctcgagacttcctccttctctgtgctctttttg
rnai-2-r:aattcaaaaagagcacagagaaggaggaagtctcgagacttcctccttctctgtgctc
- 还没有人留言评论。精彩留言会获得点赞!
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 毛酸浆的分子特异性标记引物及鉴别方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 脯氨酸特异性蛋白酶基因及其应用
- 一种泰国库蠓的特异基因及其分子鉴定方法
- 一种美丽库蠓特异基因及其分子鉴定方法
- 一种特异于禽类原始生殖细胞的基因转移系统及方法
- CRISPR-Cas9特异性敲除猪SALL1基因的方法及用于特异性靶向SALL1基因的sgRNA的制作方法
- CRISPR-Cas9特异性敲除猪CMAH基因的方法及用于特异性靶向CMAH基因的sgRNA的制作方法
- CRISPR-Cas9特异性敲除猪SLA-2基因的方法及用于特异性靶向SLA-2基因的sgRNA的制作方法
- 一种安宁铗蠓的特异基因及其分子鉴定方法
- CRISPR-Cas9特异性敲除猪GGTA1基因的方法及用于特异性靶向GGTA1基因的sgRNA的制作方法
- 一种蓝腹库蠓的特异基因及其分子鉴定方法
- 扬子鳄抗病毒潜力检测的ⅰ类mhc基因的特异性引物及分型方法
- 一种检测水稻粒宽等位基因的特异性PCR分子标记和方法与流程
- 丝状真菌中多个基因拷贝的同时位点特异性整合的制造方法与工艺
- 一种特异性敲减人BRCC3基因慢病毒的构建及在肺癌中的应用的制造方法与工艺
- 烟粉虱MED隐种高温耐受相关基因特异性探针及其应用的制造方法与工艺
- CRISPR/SaCas9特异性敲除人CXCR4基因的方法与流程
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 用于检测烟草对tmv抗性的n基因特异性引物对、检测方法及试剂盒的制作方法