具有高抗原呈递的DC细胞和抗原特异性T细胞及其制备方法和应用与流程
本发明涉及生物技术领域,特别是涉及一种具有高抗原呈递的dc细胞和抗原特异性t细胞及其制备方法和应用。
背景技术:
近年来,自体免疫细胞治疗肿瘤成为继手术、放疗、化疗后最有前景的肿瘤治疗方法。dc细胞(dendriticcell,树突状细胞)是人体已知的最重要的抗原呈递细胞,在介导肿瘤抗原特异性细胞免疫及肿瘤免疫应答方面所起的作用成为人们研究之热点。dc细胞介导的肿瘤特异性抗原呈递及t细胞免疫应答,既是肿瘤发病早期机体对抗肿瘤的有效手段,也是肿瘤发生免疫逃逸的重要机制。
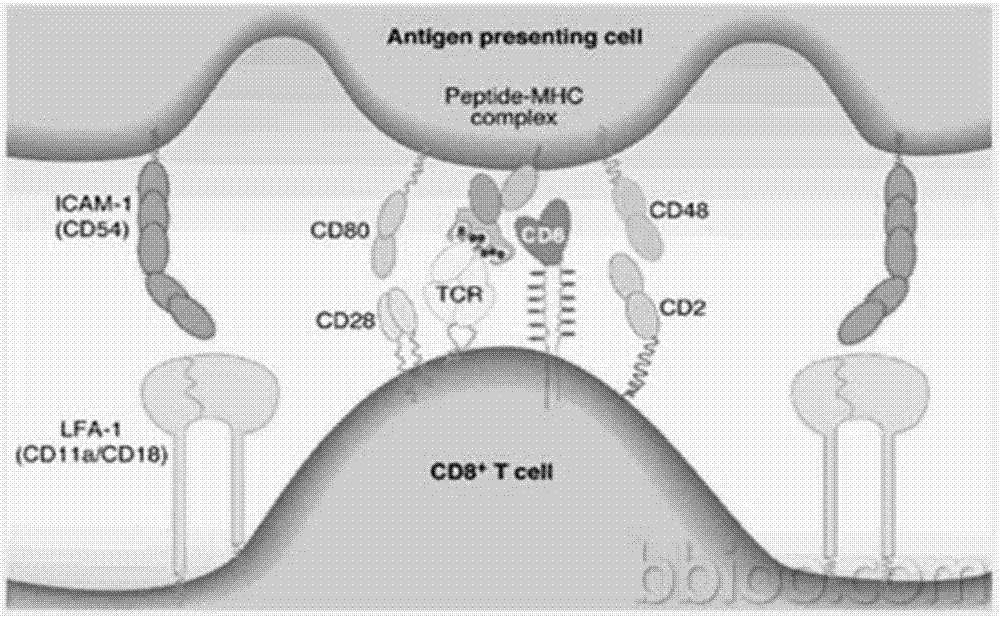
在体内dc细胞与t细胞(thymus-dependentlymphocyte,胸腺依赖性淋巴细胞)进行抗原传递的过程中有一个关键的步骤:形成免疫突触(immunologicsynapse,is)结构。免疫突触的结构请参阅图1,具体形成过程如下:大量t细胞游走于淋巴结等淋巴器官,当t细胞遇到dc细胞时其运动速度减低并被dc细胞捕获,接受外源信号后t细胞发生极化反应,t细胞产生伪足,并形成适合分子信号传递的三维空间结构。细胞质内以微管组织中心(microtubuleorganizationcenter,mtoc)移动到靠近dc细胞的一侧边缘为基本特征的一系列细胞器重组变化发生,其表面粘附分子通过受体-配体相互作用得以紧密接触dc细胞,形成了一个临时性结构,该结构以tcr-mhc-抗原肽三元结构为簇状中心,周围环形分布着粘附分子,该结构即为免疫突触(immunologicsynapse,is)结构。
然而,目前体外培养的dc细胞-t细胞之间存在抗原呈递效率不高,t细胞特异性免疫应答效果不理想等缺陷。
技术实现要素:
基于此,有必要提供一种能够制备抗原呈递效率高的具有高抗原呈递的dc细胞的制备方法以及一种能够提高t细胞特异性免疫应答效果的抗原特异性t细胞的制备方法。
一种具有高抗原呈递的dc细胞的制备方法,包括以下步骤:
提供dc细胞;
在所述dc细胞上负载抗原;以及
向所述dc细胞内导入基因表达沉默剂,所述基因表达沉默剂用于沉默tao-1蛋白磷酸激酶基因的表达,得到所述具有高抗原呈递的dc细胞。
在一个实施方式中,所述基因表达沉默剂为所述tao-1蛋白磷酸激酶的shrna。
在一个实施方式中,所述tao-1蛋白磷酸激酶的shrna的正义链的碱基序列如seqidno.1所示,所述tao-1蛋白磷酸激酶的shrna的反义链的碱基序列如seqidno.2所示。
一种具有高抗原呈递的dc细胞,所述具有高抗原呈递的dc细胞通过上述具有高抗原呈递的dc细胞的制备方法制备得到。
一种抗原特异性t细胞的制备方法,包括以下步骤:
提供dc细胞;
在所述dc细胞上负载抗原;
向所述dc细胞内导入基因表达沉默剂,所述基因表达沉默剂用于沉默tao-1蛋白磷酸激酶基因的表达,得到具有高抗原呈递的dc细胞;
将t细胞与所述具有高抗原呈递的dc细胞混合,并置于含有四环素的培养基中共同培养;以及
收集共同培养后的所述t细胞,得到所述抗原特异性t细胞。
在一个实施方式中,所述含有四环素的培养基中,所述四环素的终浓度为0.5mg/ml~5mg/ml。
在一个实施方式中,所述含有四环素的培养基中还含有终浓度为10ng/ml~1000ng/ml的gm-csf、终浓度为0.1ng/ml~100ng/ml的il-4和体积分数为0.1%~20%的血浆。
在一个实施方式中,所述将t细胞与所述具有高抗原呈递的dc细胞混合,并置于含有四环素的培养基中共同培养的操作中,所述t细胞与所述具有高抗原呈递的dc细胞的个数比为1~20:1,所述共同培养的时间为1天~15天。
一种抗原特异性t细胞,所述抗原特异性t细胞通过上述抗原特异性t细胞的制备方法制备得到。
上述高抗原呈递的dc细胞的制备方法制备得到的具有高抗原呈递的dc细胞或上述的抗原特异性t细胞的制备方法制备得到的抗原特异性t细胞在制备抗肿瘤的药物中的应用。
上述具有高抗原呈递的dc细胞的制备方法,通过在dc细胞上负载抗原,并向dc细胞内导入基因表达沉默剂得到具有高抗原呈递的dc细胞。该具有高抗原呈递的dc细胞与t细胞在四环素的条件下,四环素能够调控dc细胞内的基因表达沉默剂的开关,使得dc细胞和t细胞相互接触并形成免疫突触结构的过程中抑制dc细胞内具有负调控作用的tao-1蛋白磷酸激酶的基因表达,增加免疫突触形成的时间和强度,提高形成的免疫突触的稳定性。而一旦dc细胞与t细胞抗原呈递结束,即可去掉四环素,恢复dc细胞内tao-1蛋白磷酸激酶的表达,保证了dc细胞在非抗原呈递阶段的正常生理功能不受影响。结果表明,上述具有高抗原呈递的dc细胞能够在四环素的作用下刺激t细胞,使t细胞分化程度高,形成的抗原特异性t细胞cd3和hla-dr双阳性的t细胞比例高,dc细胞-t细胞之间的抗原呈递效率高。
附图说明
图1为一实施方式dc细胞与t细胞进行抗原传递形成免疫突触的示意图;
图2为一实施方式的制备具有高抗原呈递的dc细胞的流程图;
图3为一实施方式的制备抗原特异性t细胞的流程图;
图4为实施例1中构建的plko-tet-on/tao-1-shrna慢病毒表达质粒经过xhoi单酶切后得到的产物的琼脂糖凝胶电泳图;
图5为实施例2制备的四组t细胞cd3+及hla-dr+的流式检测对比图;
图6为实施例2制备的四组t细胞对正常细胞系mcf-10a以及乳腺癌mcf-7细胞的杀伤效率的流式检测对比图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例及附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
请参阅图2,一实施方式的具有高抗原呈递的dc细胞的制备方法,包括以下步骤s110~s130。
s110、提供dc细胞。
具体地,dc细胞为生物内正常的dc细胞,可以通过提取外周血中的细胞获得,也可以是传代培养dc细胞株获得。
本实施方式中,dc细胞为人源dc细胞。
具体地,dc细胞通过以下制备方法获得:抽取健康志愿者的外周血,肝素抗凝,用淋巴细胞分离液分离外周血的单个核细胞。然后重悬单个核细胞,培养1h~4h后,洗涤并收集贴壁的细胞,得到dc细胞。
具体地,收集的dc细胞置于含有gm-csf(granulocyte-macrophagecolonystimulatingfactor,粒细胞-巨噬细胞集落刺激因子)、il-4(白细胞介素4)和血浆的培养基中培养。具体地,培养基中gm-csf的终浓度为10ng/ml~1000ng/ml,培养基中il-4的终浓度为0.1ng/ml~100ng/ml,培养基中血浆的体积分数为0.1%~20%,促进dc细胞的生长。
s120、在s110中的dc细胞上负载抗原。
具体地,可以根据需要,在dc细胞上负载不同的抗原。当负载有抗原的dc细胞与t细胞相互接触时,抗原能够刺激t细胞形成免疫突触结构。
本实施方式中,dc细胞上负载的抗原为乳腺癌抗原。
具体地,向培养的dc细胞中加入一定量的抗原,置于培养箱中培养1~2天,使得dc细胞上负载抗原。
具体地,负载抗原时,dc细胞与抗原的比例约为106个细胞:1ml抗原。
s130、向s120中得到的dc细胞内导入基因表达沉默剂,该基因表达沉默剂用于沉默tao-1蛋白磷酸激酶基因的表达,得到具有高抗原呈递的dc细胞。
发明人发现,在免疫突触(is)形成过程中细胞骨架的动态变化及调控是实现其生理功能的重要基础。它不仅为is的形成提供三维空间构型的基础,还将众多信号分子带到这一区域内,同时为抗原呈递及细胞信号传递提供保障。is形成需要较长时间,体外实验观察t细胞需要与dc细胞紧密结合数小时以上才能够形成免疫突触结构。免疫突触形成的这一特点需要维持支持其3d结构的细胞骨架维持较长的时间不发生解聚。这是保障后续抗原交换、细胞激活信号传递、t细胞激活等一系列细胞生物学行为发生的重要前提和基础。因此,免疫细胞调控is部位细胞骨架的信号分子及其调控机制就成为理解整个is生理功能的关键。
而tao-1蛋白磷酸激酶(thousand-and-oneaminoacids)是sterile-20家族的成员之一,在所有真核细胞中高保留表达。它们的共同特征是都拥有一个丝氨酸/苏氨酸激酶结构域。tao家族蛋白的一个重要功能是激活mapk(mitogen-activatedproteinkinase)细胞信号传到通路,以蛋白磷酸化和去磷酸化的方式调控细胞生长因子,从而调控细胞的增殖和分裂。此外,tao-1蛋白磷酸激酶还可以在微管延长端到达细胞边缘过渡增长时诱发微管的去稳定性,同时可以通过调控rhogtpase(rhogtp酶)在细胞表面的位置从而动态的调控细胞极化过程。发明人猜测tao-1在细胞骨架相互作用的动态调控中扮演着重要角色,tao-1在dc细胞和t细胞相互接触,形成免疫突触结构的过程中发挥着关键的负调控作用。因此通过向dc细胞内导入基因表达沉默剂,在dc细胞和t细胞相互接触形成免疫突触结构的过程沉默t细胞内的tao-1蛋白磷酸激酶的基因表达,控制细胞接触部位微管和细胞骨架的稳定性,从而控制免疫突触形成的时间和强度,提高形成的免疫突触的稳定性。
在一个实施方式中,基因表达沉默剂为tao-1蛋白磷酸激酶的shrna。将tao-1蛋白磷酸激酶的shrna导入进入dc细胞中,shrna与tao-1蛋白磷酸激酶的mrna互补结合序列特异性地实现靶mrna降解。通过基因敲除的方法对dc细胞中的tao-1蛋白磷酸激酶表达基因进行沉默,从而提高dc细胞和t细胞相互接触形成免疫突触的稳定性。
具体地,tao-1蛋白磷酸激酶的shrna的正义链的碱基序列如seqidno.1所示,tao-1蛋白磷酸激酶的shrna的反义链的碱基序列如seqidno.2所示。上述碱基序列的tao-1蛋白磷酸激酶的shrna特异性好,对目的基因沉默效果稳定。
在一个实施方式中,基因表达沉默剂负载在慢病毒中,通过慢病毒转染进入t细胞内,并在转染过程中加入聚凝胺(polybrane),促进慢病毒的转染。具体地,加入的聚凝胺的终浓度为1μg/ml~100μg/ml。
具体地,将tao-1蛋白磷酸激酶的shrna连接到经agei和ecor1双酶切后慢病毒载体plko-tet-on中,得到重组plko-tet-o载体。经酶切鉴定正确后,将其与慢病毒包装质粒plp1、plp2、plp/vsvg共转染293t细胞,制备出plko-tet-on/tao-1-shrna慢病毒,然后将plko-tet-on/tao-1-shrna慢病毒转染进入dc细胞内。
具体地,plko-tet-on/tao-1-shrna慢病毒转染dc细胞时,病毒滴度moi=10~100。
通过将基因表达沉默剂负载在慢病毒中并转染到dc细胞内,转染效率高,转染效果好。
上述方法制备的具有高抗原呈递的dc细胞内具有沉默tao-1蛋白磷酸激酶基因表达的基因表达沉默剂。该具有高抗原呈递的dc细胞在四环素的条件下与t细胞接触时,能够抑制dc细胞内具有负调控作用的tao-1蛋白磷酸激酶的基因表达,提高dc细胞与t细胞形成的免疫突触的稳定性,增加免疫突触形成的时间和强度,提高抗原呈递效率,刺激t细胞分化的更成熟、更具抗原特异性。
实验结果表明,经上述具有高抗原呈递的dc细胞刺激的t细胞分化更加成熟,t细胞中cd3和hla-dr双阳性的t细胞数量占总t细胞数量的60%以上。dc细胞与t细胞表面形成的表面突触更加稳定,dc细胞-t细胞之间的抗原呈递的效率高,t细胞的免疫应答效果好。
此外,本文还提供一实施方式的具有高抗原呈递的dc细胞及其在制备抗肿瘤的药物中的应用。
具体地,上述具有高抗原呈递的dc细胞可以是应用于预防肿瘤的疫苗,也可以是应用于治疗已经确诊为肿瘤甚至癌症的药物。
进一步地,上述具有高抗原呈递的dc细胞为用于制备抗乳腺癌的药物。
实验结果表明,上述具有高抗原呈递的dc细胞能够刺激t细胞分化更加成熟,增强t细胞对乳腺癌特异性的高效杀伤作用,而对正常的乳腺细胞的杀伤作用很小。因此,该具有高抗原呈递的dc细胞有望应用在抗肿瘤的药物中,为肿瘤治疗提供一种思路。
请参阅图3,一实施方式的抗原特异性t细胞的制备方法,包括步骤s110~s150。
其中,步骤s110~s130请参见上文制备具有高抗原呈递的dc细胞的描述,在此不作赘述。
s140、将t细胞与s130中得到的具有高抗原呈递的dc细胞混合,并置于含有四环素的培养基中共同培养。
四环素能够调控dc细胞内的基因表达沉默剂的开关,实验结果表明,只有在四环素存在的情况下,tao-1蛋白磷酸激酶基因表达沉默。而一旦dc细胞与t细胞抗原呈递结束,即可去掉四环素,恢复dc细胞内tao-1蛋白磷酸激酶的表达,保证了dc细胞在非抗原呈递阶段的正常生理功能不受影响。
在一个实施方式中,含四环素的培养基中,四环素的终浓度为0.5mg/ml~5mg/ml。例如0.8mg/ml、1mg/ml、2mg/ml或4mg/ml等等。四环素的浓度适宜,调控dc细胞内的基因表达沉默剂,在dc细胞和t细胞相互接触并形成免疫突触结构的过程中,抑制tao-1蛋白磷酸激酶的基因表达。
在一个实施方式中,含有四环素的培养基的基础培养基为无血清培养基,例如alys-505培养基。培养基中还含有gm-csf、il-4和血浆,gm-csf的终浓度为10ng/ml~1000ng/ml,il-4的终浓度为0.1ng/ml~100ng/ml,血浆的体积分数为0.1%~20%。
本实施方式中,含有四环素的培养基的基础培养基为alys-505培养基,培养基中含有四环素、有gm-csf、il-4和血浆,四环素的终浓度为1mg/ml,gm-csf的终浓度为100ng/ml,il-4的终浓度为10ng/ml,血浆的体积分数为10%。
具体地,血浆与提取dc细胞的外周血为同源的。培养基中加入gm-csf、il-4和血浆能够促进dc细胞的生长、增强dc细胞的抗原呈递能力。
在一个实施方式中,将具有高抗原呈递的dc与t细胞与混合,并置于含有四环素的培养基中共同培养的操作中,t细胞与具有高抗原呈递的dc的个数比为1~20:1,共同培养的时间为1天~15天。在四环素存在的条件下,具有高抗原呈递的dc内tao-1蛋白磷酸激酶基因表达受到抑制,将t细胞与dc细胞共同培养1天以上,形成稳定的免疫突触结构,提高dc细胞抗原呈递能力以及t细胞分化成熟度。
具体地,将具有高抗原呈递的dc与t细胞混合,置于含有四环素的培养基中共同培养共同培养1天~7天,例如2天、3天或4天等。
具体地,混合时,具有高抗原呈递的dc为1×105个/孔,t细胞约为1×106个/孔。将具有高抗原呈递的dc与t细胞共同培养,培养时隔天补加四环素。
s150、收集s140中共同培养后的t细胞,得到抗原特异性t细胞。
实验结果表明,在四环素存在的条件下,导入了基因表达沉默剂的dc细胞更能高效地将抗原呈递给t细胞,提高t细胞的成熟度和抗原特异性。该具有高抗原呈递的dc细胞与t细胞在四环素的条件下,四环素能够调控dc细胞内的基因表达沉默剂的开关,使得dc细胞和t细胞相互接触并形成免疫突触结构的过程中抑制dc细胞内具有负调控作用的tao-1蛋白磷酸激酶的基因表达,增加免疫突触形成的时间和强度,提高形成的免疫突触的稳定性。
而一旦dc细胞与t细胞抗原呈递结束,即可去掉四环素,恢复dc细胞内tao-1蛋白磷酸激酶的表达,保证了dc细胞在非抗原呈递阶段的正常生理功能不受影响。
需要说明的是,制备具有高抗原呈递的dc细胞和高抗原特异性的t细胞不局限于上述s110~s150的顺序,本领域技术人员可根据需要调整先后顺序,例如s120与s130可以调换。
在一个实施方式中,制备得到的抗原特异性t细胞中cd3和hla-dr双阳性的t细胞数量占总t细胞数量的60%以上。
上述制备抗原特异性t细胞,在制备时,向dc细胞内导入基因表达沉默剂,并将负载有抗原的dc细胞与t细胞混合,置于含有四环素的培养基中共同培养。四环素能够调控dc细胞内的基因表达沉默剂的开关,在dc细胞和t细胞相互接触并形成免疫突触结构的过程中抑制具有负调控作用的tao-1蛋白磷酸激酶的基因表达,提高形成的免疫突触的稳定性,增加免疫突触形成的时间和强度。而一旦dc细胞与t细胞抗原呈递结束,即可在去掉四环素,恢复dc细胞内tao-1蛋白磷酸激酶的表达,保证了dc细胞在非抗原呈递阶段的正常生理功能不受影响。
实验结果表明,在四环素存在的条件下,导入了基因表达沉默剂的dc细胞与t细胞共同培养时,dc内tao-1蛋白磷酸激酶基因表达受到抑制,dc细胞与t细胞表面形成的表面突触更加稳定,能够刺激t细胞分化更加成熟,制备的抗原特异性t细胞中cd3和hla-dr双阳性的t细胞数量能够占总t细胞数量的60%以上,增强t细胞的免疫活性,得到的抗原特异性t细胞的免疫应答效果好。
此外,本文还提供一实施方式的抗原特异性t细胞及其在制备抗肿瘤的药物中的应用。
具体地,上述抗原特异性t细胞可以是应用于预防肿瘤的疫苗,也可以是应用于治疗已经确诊为肿瘤甚至癌症的药物。
进一步地,上述抗原特异性t细胞为用于制备抗乳腺癌的药物。
实验结果表明,上述抗原特异性t细胞对乳腺癌有特异性的高效杀伤作用,而对正常的乳腺细胞的杀伤作用很小。因此,该抗原特异性t细胞有望应用在抗肿瘤的药物中,为肿瘤治疗提供一种思路。
下面为具体实施例部分。
以下实施例中,如无特别说明,未注明具体条件的实验方法,通常按照常规条件,例如参见萨姆布鲁克、ef弗里奇、t曼尼阿蒂斯等(金冬雁,黎孟枫等译)所著的分子克隆实验指南[m](北京:科学出版社,1992)中所述的条件或者试剂盒生产厂家推荐的方法实现。实施例中所使用的试剂均为市售。
未特别说明,nc-dc-t表示dc细胞与t细胞共同培养后,收集的第一阴性对照t细胞。elv-dc-t表示plko-tet-on空载体慢病毒感染dc细胞与t细胞共同培养后,收集的第二阴性对照t细胞。tlv-dc-t表示plko-tet-on/tao-1-shrna慢病毒感染dc细胞与t细胞共同培养后,收集的第三阴性对照t细胞。tet-tlv-dc-t(抗原特异性t细胞)表示plko-tet-on/tao-1-shrna慢病毒感染dc细胞与t细胞在四环素的条件下共同培养后,收集的抗原特异性t细胞。
实施例1
制备基因表达沉默剂
(1)设计tao-1蛋白磷酸激酶的shrna
利用thermo网站的shrna序列在线设计程序(http://rnaidesigner.thermofisher.com/rnaiexpress/setoption.do?designoption=shrna&pid=-2900031043253144145),设计出tao-1shrnaoligos序列,如下所示:
正义链:
5’-ccggggaagtcaagtttctacaaagctcgagctttgtagaaacttgacttccttttt-3’(seqidno.1)。
反义链:
5’-aattggaagtcaagtttctacaaagctcgagctttgtagaaacttgacttcc-3’(seqidno.2)。
(2)制备plko-tet-on/tao-1-shrna慢病毒
将上述设计的tao-1蛋白磷酸激酶的shrna送交基因公司合成,利用agei和ecor1双酶切慢病毒载体plko-tet-on,将退火后的tao-1-shrna寡核苷酸链连接到plko-tet-on载体中,dna连接反应体系如下:
室温反应3h后,对连接产物plko-tet-on/tao-1-shrna慢病毒表达质粒进行酶切鉴定。构建的plko-tet-on/tao-1-shrna慢病毒表达质粒经过xhoi单酶切后得到的产物经琼脂糖凝胶电泳检测,结果如图4,分别在大约150bp、200bp和8kb处有三条清晰条带,与预期片段数和片段大小一致(8kb条带因为慢病毒载体plko-tet-on中也有一个xhoi酶切位点)。证明tao-1-shrna寡核苷酸成功插入到plko-tet-on载体中。经酶切鉴定正确后,将其与三个慢病毒包装质粒plp1、plp2、plp/vsvg共转染293t细胞,制备出plko-tet-on/tao-1-shrna慢病毒。
实施例2
dc细胞和t细胞共同培养制备具有高抗原呈递的dc细胞以及抗原特异性t细胞
1、dc细胞和t细胞的培养
(1)抽取健康志愿者外周血50ml,肝素抗凝,用淋巴细胞分离液分离出外周血单个核细胞(pbmc)。
(2)用含10%自体血浆的alys-505培养液重悬pbmc细胞,分装入六孔板中,5×106个/ml,2ml/孔,置于饱和湿度、37℃、5.0%co2的培养箱中培养2h。
(3)洗涤并收集(2)中未贴壁的细胞,该未贴壁细胞为t细胞。将未贴壁的细胞用含50ng/mlcd3单抗、1000u/ml的il-2和0.5%自体血浆的alys-505培养液进行刺激培养,调整细胞密度为1×106/ml,转入六孔板中,2ml/孔,同时每孔添加1000u/ml的ifn-γ,置于饱和湿度、37℃、5.0%co2培养箱中培养。每3天调整细胞密度为1×106/ml,添加含1000u/ml的il-2和0.5%自体血浆的alys-505培养液。
(4)保留(2)中贴壁细胞于六孔板中,贴壁细胞为dc细胞,向六孔板加入含100ng/mlgm-csf、10ng/ml的il-4及10%自体血浆的alys-505培养液,置于饱和湿度、37℃、5.0%co2培养箱中诱导培养dc细胞。培养3天后半量换液并补充新鲜的细胞因子,另外加入一支肿瘤抗原(本专利使用乳腺癌细胞系mcf-7的冻融抗原,1ml)对dc细胞进行抗原负载,置于饱和湿度、37℃、5.0%co2培养箱中继续培养48h。
(5)收集(4中)培养的dc细胞,计数,离心后以含100ng/mlgm-csf、10ng/mlil-4及10%自体血浆的alys-505培养液重悬细胞,调整细胞密度,接种于6孔板中,1×105个细胞/孔,共接种8个孔。实验平均分成四组,每组2个平行对照。4组细胞分别为阴性对照dc细胞组(nc-dc-t)、plko-tet-on空载体慢病毒感染dc细胞组(elv-dc-t)、plko-tet-on/tao-1-shrna慢病毒感染dc细胞组(tlv-dc-t)、四环素诱导的plko-tet-on/tao-1-shrna慢病毒感染t细胞组(tet-tlv-dc-t)。
(6)按照moi=30的比值,elv-dc-t组加入plko-tet-on空载体慢病毒,tlv-dc-t细胞组和tet-tlv-dc-t细胞组分别加入plko-tet-on/tao-1-shrna慢病毒,同时加入8μg/ml的polybrane促进慢病毒感染,病毒转染后,培养24h。
(7)将(6)中培养的各组dc细胞更换新鲜的含100ng/mlgm-csf、10ng/ml的il-4及10%自体血浆的alys-505培养液,继续培养24h。
(8)在(7)中培养的各组dc细胞每孔加入106个(3)中培养的t细胞,与dc细胞共培养。其中,tet-tlv-dc-t细胞组额外加入1mg/ml四环素,共同培养48h。
(9)补加新鲜的t细胞完全培养基(含1000u/mlil-2和0.5%自体血浆的alys-505培养液),tet-tlv-dc-t细胞组额外加入1mg/ml四环素,继续共同培养48h。
(10)补加新鲜的t细胞完全培养基,tet-tlv-dc-t细胞组不再添加四环素,继续共同培养48h。
(11)收获四组dc细胞刺激的t细胞(nc-dc-t、elv-dc-t、tlv-dc-t、tet-tlv-dc-t),其中t细胞增殖较快,而dc细胞基本不增值。共同培养后,贴壁生长的为具有高抗原呈递的dc细胞,悬浮生长为t细胞。然后检测各组t细胞表面hla-dr的表达,以及t细胞对乳腺癌细胞系mcf-7的特异性杀伤作用。
t细胞成熟度的流式检测
将实施例2中收取的第一阴性对照组、第二阴性对照组、第三阴性对照组以及实验组的四组t细胞(nc-dc-t、elv-dc-t、tlv-dc-t、tet-tlv-dc-t)分别取1×106个细胞,pbs洗涤一次后,利用cd3-fitc抗体、hla-dr-percp抗体进行染色,流式上样检测t细胞中cd3+以及hla-dr+的t细胞的比例,以鉴定四组t细胞在成熟度上的差异。
四组t细胞cd3+且hla-dr+比例的流式检测结果如图5所示。流式检测图中左上角内的散点表示cd3-而hla-dr+的t细胞,左下角内的散点表示cd3-且hla-dr-的t细胞,右上角内的散点表示cd3+且hla-dr+双阳性的t细胞,右下角内的散点表示cd3+而hla-dr-的t细胞。一般cd3+表示的淋巴细胞为t细胞,且hla-dr+表示分化后活性好的t细胞。右上角内百分数表示cd3+且hla-dr+的t细胞的比例。其中nc-dc-t组比例最低,为28.30%。elv-dc-t组和tlv-dc-t组的cd3+且hla-dr+比例接近,分别为43.28%和46.03%。说明在没有四环素诱导时,tlv-dc细胞对t细胞的刺激作用与空病毒载体感染elv-dc细胞相比,没有显著差异。而tet-tlv-dc-t细胞组的cd3+hla-dr+比例最高,达到63.58%,与其它组相比有显著差异,说明在四环素诱导下,转染了plko-tet-on/tao-1-shrna慢病毒的dc细胞可以刺激获得更成熟、更活化的t细胞。
t细胞对靶细胞杀伤的流式检测结果
(1)以实施例2中收取的第一阴性对照组、第二阴性对照组、第三阴性对照组以及实验组的四组t细胞nc-dc-t、elv-dc-t、tlv-dc-t、tet-tlv-dc-t分别作为效应细胞,分别以cfse标记的乳腺癌mcf-7细胞、cfse标记的乳腺正常细胞系mcf-10a作为靶细胞,按照20:1的效靶比混合效应细胞和靶细胞,轻轻混匀,置于5%co2,37℃培养箱中孵育。
(2)24h后,加入1μg/mlpi染液,混匀,室温避光孵育15min后,利用流式细胞仪检测cfse+pi+细胞(死亡的靶细胞)的百分率。
实验结果如图6所示:各组t细胞对正常细胞系mcf-10a的杀伤效率差异不大,杀伤效率大致相同,在13%~16%之间。而各组t细胞对乳腺癌mcf-7细胞的杀伤效率则有较大的区别:nc-dc-t细胞的杀伤效率最低,仅有18.23%的靶细胞被杀伤。在dc与t细胞共培养过程中没有添加四环素时,tlv-dc-t细胞对mcf-7的杀伤比例为32.78%。而dc与t细胞共培养时添加1mg/ml四环素获得的tet-tlv-dc-t细胞对mcf-7细胞的杀伤比例提高到了68.92%。
这一结果说明,在四环素诱导下,plko-tet-on/tao-1-shrna慢病毒感染dc细胞所刺激的t细胞(tet-tlv-dc-t)对乳腺癌细胞mcf-7有特异性的高效杀伤作用,而对正常的乳腺细胞mcf-10a的杀伤作用很小。
综上,与对照组相比,在四环素的条件下,经plko-tet-on/tao-1-shrna慢病毒感染dc细胞与t细胞共同培养能够得到具有高抗原呈递的dc细胞。dc细胞刺激收集的抗原特异性t细胞的cd3和hla-dr双阳性的t细胞比例高,t细胞分化更加成熟,dc细胞-t细胞之间的抗原呈递的效率高,t细胞的免疫应答效果好。抗原特异性t细胞对乳腺癌有特异性的高效杀伤作用,而对正常的乳腺细胞的杀伤作用很小,有望应用在抗肿瘤的药物中,为肿瘤治疗提供一种思路。
以上所述实施例仅表达了本发明的一种或几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
sequencelisting
<110>刘韬
<120>具有高抗原呈递的dc细胞和抗原特异性t细胞及其制备方法和应用
<160>2
<170>patentinversion3.3
<210>1
<211>57
<212>dna
<213>人工序列
<400>1
ccggggaagtcaagtttctacaaagctcgagctttgtagaaacttgacttccttttt57
<210>2
<211>52
<212>dna
<213>人工序列
<400>2
aattggaagtcaagtttctacaaagctcgagctttgtagaaacttgacttcc52
- 还没有人留言评论。精彩留言会获得点赞!
- 一种肿瘤特异抗原及其应用的制作方法与工艺
- 用于制备具有增加的特异性基因表达的树突细胞的方法和包含使用所述方法制备的树突细胞的用于治疗或预防自身免疫性疾病的组合物与流程
- 一种兼有NK细胞特质的抗原特异性T细胞的制备方法与流程
- 一种特异性肿瘤抗原NSE的CTL识别表位肽及其应用的制作方法与工艺
- 一种特异性肿瘤抗原SF的CTL识别表位肽及其应用的制作方法与工艺
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 用于建立具有编码抗原特异性T细胞受体的基因的多能性干细胞的方法与流程
- 特异性识别胃癌细胞的DNA适配子GCA‑5及其应用的制造方法与工艺
- 一种制备结直肠癌抗原特异性T细胞的方法与流程
- 用作诱导抗原特异性T细胞反应的免疫原性增强剂的融合蛋白的制造方法与工艺