内切葡聚糖酶基因及其编码蛋白的制作方法
本发明涉及生物基因领域,具体涉及一种内切葡聚糖酶基因及其编码蛋白。
背景技术:
在纤维素酶系中,内切葡聚糖酶(endo-1,4-β-d-glucanohydrolase,ec3.2.1.4)是主要成分,它包含多种同工酶,可以将可溶性纤维素水解成还原性的寡糖。不同来源、不同类型的内切葡聚糖酶的分子量、等电点、酶学特性及分子结构也会有所区别,在纤维素酶系中,内切葡聚糖酶的这种多型性表现是最为明显的。内切葡聚糖酶在增加果汁得率、啤酒过滤及原油开采方面起着重要作用,并能增强纤维素质服装的整体质量,如亮度、平滑度等方面。另外,内切葡聚糖酶是木质纤维素底物粘度快速降低的关键酶。
目前,内切葡聚糖酶由于在耐热和抗冻融等方面存在缺陷,极大地限制了内切葡聚糖酶的应用。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种内切葡聚糖酶基因及其编码蛋白,该基因编码的内切葡聚糖酶兼具良好的耐热性和抗冻融性。
本发明所提供的内切葡聚糖酶基因,其核酸序列如seqidno.1所示。
本发明还提供了上述内切葡聚糖酶基因所编码的蛋白,其蛋白序列如seqidno.2所示。
本发明所述内切葡聚糖酶基因,是从福建省福州市闽侯县收集的一份自然环境的水样品中,通过宏基因组学技术,用试剂盒提取宏基因组dna,并直接对提取好的dna进行pcr扩增得到。
本发明内切葡聚糖酶基因编码的内切葡聚糖酶兼具良好的耐热性和抗冻融性,扩展了其应用范围。
附图说明
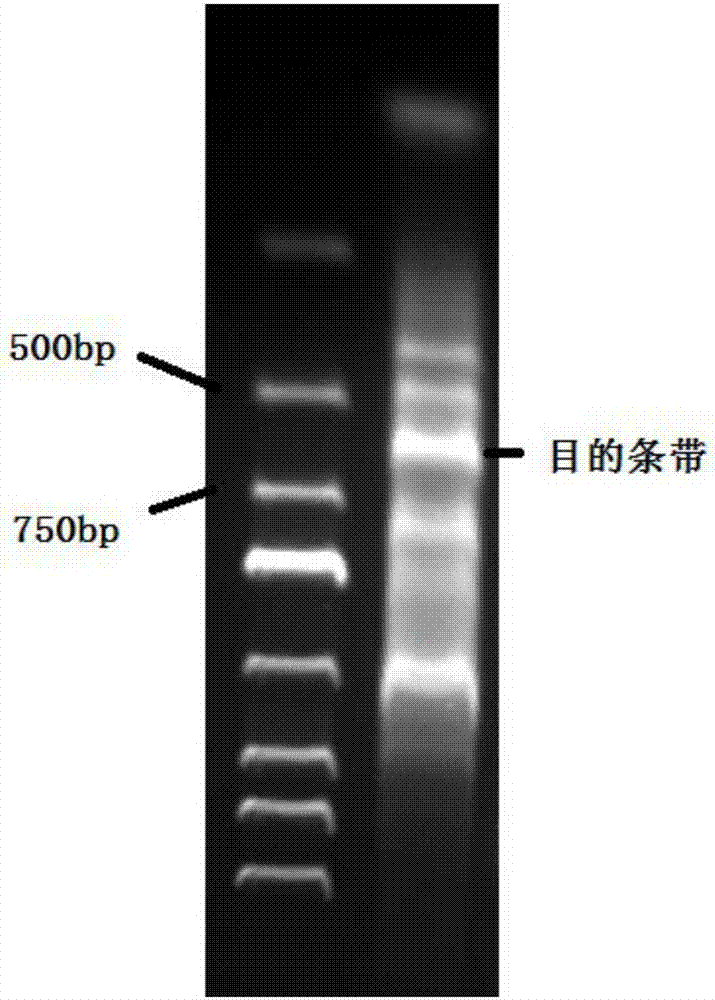
图1为实施例1步骤1中pcr产物的电泳图谱。
具体实施方式
以下结合附图和实施例对本发明做进一步说明。以下未注明具体条件的实验方法,按照本领域常规实验条件或者制造厂商所建议的条件。
本发明所述内切葡聚糖酶基因的核酸序列如seqidno.1所示。
上述内切葡聚糖酶基因的编码蛋白序列如seqidno.2所示。
本发明所述内切葡聚糖酶基因的来源,是从福建福州闽侯收集的一份自然环境的水样品中,通过宏基因组学技术,用0.22微米的微孔滤膜,通过过滤,截留其中的各种生物,用试剂盒(mobio牌,
实施例1
通过分子克隆技术,构建内切葡聚糖酶基因的蛋白表达载体
1、对提取好的宏基因组dna做pcr扩增(50μl体系)
上游引物序列:atatgctcgaggatcccatgaagcgccgcg
下游引物序列:gttagcagccggatccagcgccgggaacacc
pcr体系如下:
pcr程序设定如下:94℃预变性10min;(94℃变性30s,50℃退火30s,72℃延伸45s),并设置30个循环;最后72℃延伸5min。
pcr产物采用琼脂糖凝胶电泳进行鉴定,结果如图1所示,图1左起第一个泳道是marker,第二个泳道是pcr产物,目的条带位置如图1所示。
本实施例所得pcr产物使用sanger法测序(abi3730xl测序仪双向测序,测序引物为上述“上游引物”和“下游引物”,由广州英骏生物公司完成),得到本发明所述内切葡聚糖酶基因的的核酸序列,如seqidno.1所示。
2、胶回收
使用omega公司胶回收试剂盒,货号d2500-01,对步骤1的pcr产物中的目的条带,进行割胶回收。胶回收的pcr产物(内切葡聚糖酶基因)作为后续infusion连接反应的底物,用于连接到表达载体上。
3、线性化表达质粒的制备
质粒载体选择pet15b,先对载体酶切
在37℃下保温30min,酶切产物采用琼脂糖凝胶电泳鉴定,用上述omega试剂盒回收酶切产物条带。胶回收产物浓度为32ng/μl。以上即为制备好的线性化的质粒载体,用于后续的infusion反应。
4、in-fusion连接反应
将纯化好的pcr产物与质粒表达载体相互连接,构建表达载体。
50℃保温15min,然后置于冰上。
5、转化
取in-fusion连接反应获得的连接产物10μl,加入到大肠杆菌stbl3感受态细胞中,混匀,冰浴30min,42℃热激45s,冰浴2min,涂lb平板(带有氨苄青霉素抗性)。将平板在37℃培养箱培养16个小时,平板上形成单克隆菌落。6、验证单克隆
挑取单克隆菌落10个(编号1—10),分别至10个各有10μl无菌水的ep管中,吹打混匀,各取1μl做模板进行菌落pcr,验证目的基因是否连接到质粒载体上。
pcr体系:
空质粒对照:
pcr程序设定如下:94℃预变性10min;(94℃变性30s,50℃退火30s,72℃延伸1min),并设置30个循环;最后72℃延伸5min。pcr产物电泳检测,通过目的条带的有无和大小,判断目的基因是否成功连接于载体,,
7、测序验证与表达菌株的构建
取有目的条带的样品菌,接种到带有氨苄青霉素抗性的液体lb培养基中,培养过夜,菌液送至广州英骏生物公司进行sanger测序验证,使用t7上游和下游通用测序引物进行测序,结果显示序列正确。然后提取该样品的质粒dna,将质粒dna转化到大肠杆菌er2566细胞(蛋白表达的宿主菌)内,将er2566培养过夜。
实施例2
蛋白表达
1、诱导表达
1)取实施例1步骤7中过夜培养的菌液300μl,加入到30mllb中,再加氨苄青霉素,37℃,200rpm培养。
2)大约2h后测od值,当od值达到0.5(0.3~0.5)时,加入iptg,终浓度0.1mm,然后20℃,200rpm培养12h。
2、酶法裂解细胞(30ml菌液)
1)4000g,10min离心收集菌体,去上清,用高纯水洗一次(高纯水重悬沉淀再离心去除上清)。
2)每30ml菌液对应的沉淀重悬于1.2mlcelllysisbuffer(ph8.5),buffer需要确保添加有pmsf。
3)加入溶菌酶粉末至终浓度1mg/ml,混匀,冰浴30min。
4)将离心管转移到摇床,旋紧盖子,倾斜45度放置,230rpm,25℃,震荡10min。
5)加入tritonx-10012μl(终浓度为1%),dna酶0.5μl和rna酶1μl(终浓度均为5μg/ml),置于摇床上,230rpm,25℃,震荡15min。
6)4℃,12000g离心15min,上清为可溶蛋白组分,沉淀为细胞碎片和不溶蛋白组分。上清液用于后续实验。
上清液中基因工程重组表达的内切葡聚糖酶,其蛋白序列如seqidno.2所示。
3、活性检测
用中国人民共和国农业行业标准(ny/t911-2004)的方法进行葡聚糖酶的活性测定。实验测得,该葡聚糖酶的活性为1378u/μl上清液。
1、热稳定性试验
将带有本发明内切葡聚糖酶基因的pet15b‐内切葡聚糖酶‐er2566的裂解上清液于90℃保温10分钟后,再次测定内切葡聚糖酶活性,发现其仍然保留有87%的活性,说明本发明内切葡聚糖酶具有良好的热稳定性。
2、抗冻融能力
将带有本发明内切葡聚糖酶基因的pet15b‐内切葡聚糖酶‐er2566的裂解上清液,放入‐86℃超低温冰箱,冷冻12小时,取出,并在室温(25℃)解冻,再次测定内切葡聚糖酶活性,发现其仍然保留有93%的活性,说明本发明内切葡聚糖酶具有良好的抗冻融能力。
实施例3
对比试验
将genbank编号为kjr61497.1的内切葡聚糖酶的基因,人工合成(由通用生物公司合成)全基因dna,按照实施例1和实施例2的方法,将该基因克隆到表达载体,并诱导目的蛋白表达。
1、热稳定性试验
将表达有目的蛋白的基因工程菌裂解上清液于90℃保温10分钟后,测定内切葡聚糖酶活性,与未高温处理的对照组比较,发现其保留有40%的活性。
2、抗冻融能力
将表达有目的蛋白的基因工程菌裂解上清液放入‐86℃超低温冰箱,冷冻12小时,取出,并在室温(25℃)解冻,再次测定内切葡聚糖酶活性,与未冻融处理的对照组比较,发现其保留有70%的活性。
由实施例2及实施例3的热稳定试验及抗冻融能力测定试验可知,与现有的内切葡聚糖酶相比,本发明内切葡聚糖酶基因编码的内切葡聚糖酶兼具良好的耐热性和抗冻融性,拓宽了该酶的应用范围。
sequencelisting
<110>福州大学
<120>内切葡聚糖酶基因及其编码蛋白
<130>2017
<160>2
<170>patentinversion3.3
<210>1
<211>585
<212>dna
<213>未知
<400>1
atgaagcgccgcgacctgctgcgcaccggcggtgccgccgggctggtgctgggactggga60
accgggccgctgcgcgctgccctgcgggccggcgccgggcgtccggccagcctggacggg120
ggggcgtggcgcgcctacgtccagcgcttcgtccaggccgacgggcgggtgaccgacacc180
ggcaacaagggcgtcagccattccgaaggccaggggtacggcatgctgctggcggcggcg240
gcgggcgaccgcgccaccttcgagtccctgtgggcctggacccgccgcacgctgatggtc300
cgcgacgacggcctcgtcgcgtggcgctgggtgccgggggagggggtgaccgaccgcaac360
aacgcctccgacggggatatcctgatcgcgtgggcgcttttgtgcggggccgaggcgtgg420
cgggtggaggaataccgcaccgccgccgtggcggttctccaggctctggccgccgcggtg480
gtggtggagcaggcggatctgaccgtgctgctgcccgggcgcgacggcttccgccgtggc540
gatgcggtggtggtcaatcccagctactgggtgttcccggcgctg585
<210>2
<211>195
<212>prt
<213>未知
<400>2
metlysargargaspleuleuargthrglyglyalaalaglyleuval
151015
leuglyleuglythrglyproleuargalaalaleuargalaglyala
202530
glyargproalaserleuaspglyglyalatrpargalatyrvalgln
354045
argphevalglnalaaspglyargvalthraspthrglyasnlysgly
505560
valserhissergluglyglnglytyrglymetleuleualaalaala
65707580
alaglyaspargalathrphegluserleutrpalatrpthrargarg
859095
thrleumetvalargaspaspglyleuvalalatrpargtrpvalpro
100105110
glygluglyvalthraspargasnasnalaseraspglyaspileleu
115120125
ilealatrpalaleuleucysglyalaglualatrpargvalgluglu
130135140
tyrargthralaalavalalavalleuglnalaleualaalaalaval
145150155160
valvalgluglnalaaspleuthrvalleuleuproglyargaspgly
165170175
pheargargglyaspalavalvalvalasnprosertyrtrpvalphe
180185190
proalaleu
195
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺