分析样品中多重目标核酸检测方法与流程
本揭示内容是有关于一种pcr的方法和系统,且特别是有关于一种用于检测多重目标序列的数字pcr的方法和系统。
背景技术:
:目前聚合链反应(polymerasechainreaction;pcr)已广泛地运用于核酸分析的许多领域。数字pcr(digitalpcr,也称为单分子pcr)是pcr
技术领域:
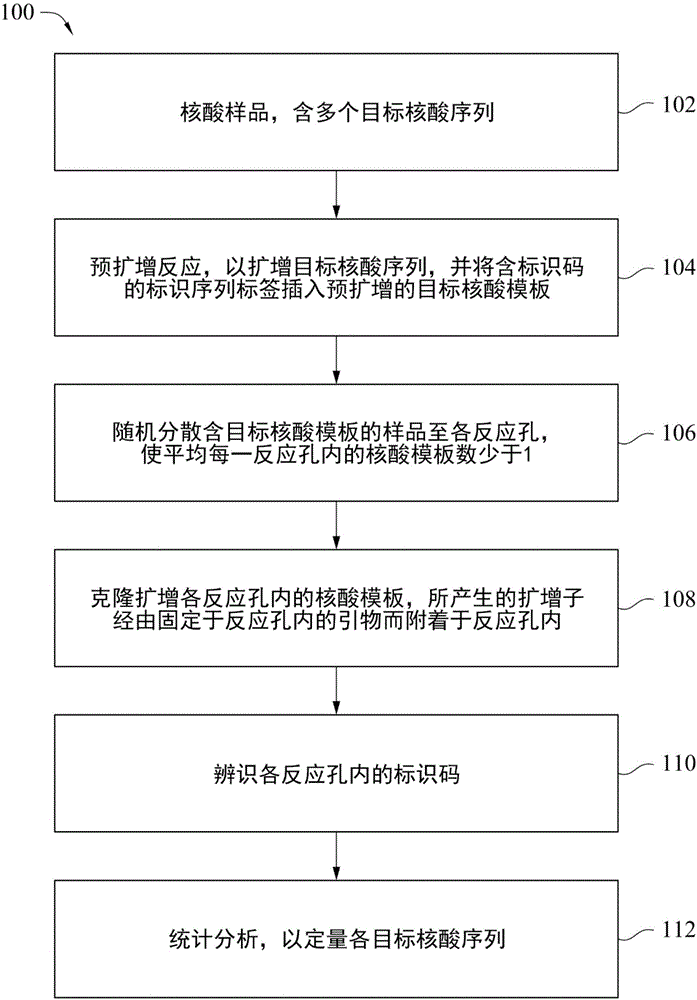
相对新的发展。在定量上,数字pcr与传统定量pcr(qpcr)间最大的不同,是数字pcr将需要定量的样品分隔成大量的小分隔进行扩增反应,平均每一个小分隔中具有少于一个的模板分子,其中一些小分隔中没有模板分子,一些小分隔中具有多于一个模板分子,且一定百分比的小分隔中刚好具有一个模板分子。扩增反应结束后,经由侦测个别小分隔中模板分子的存在与否,来决定样品中模板分子的拷贝数。关于样品中是否具有特定的目标序列,分析结果提供“是”或“否”二进制信号,例如0或1的数字格式。通过统计分析,可由数字pcr中所有小分隔的反应结果,对目标序列进行定量。数字pcr可直接计算目标序列的拷贝数,因此无需依赖对照样品和标准曲线就可进行绝对定量。目前数字pcr已被广泛用于基因序列变异的侦测,例如,拷贝数变异(copynumbervariants)或点突变。在分子诊断上,数字pcr被应用于癌症学、传染病学、胎儿基因筛检及移植排斥反应的预测、microrna研究、评估等位基因不平衡、基因表达的定量分析、dna甲基化状态分析、致病微生物检测等。许多的疾病是“多个基因突变的组合”加上环境因素的配合所造成。以高血压为例,目前已推论出的高血压风险基因突变超过300个,但究竟需要多少个基因突变的组合及环境因素的配合才会让高血压发病则虽尚无定论,但相关疾病的风险基因座的检测对疾病的早期检测及预防有重要的助益。然而,目前数字pcr的方法,是在pcr反应体系中加入荧光结合染料或荧光标记的探针以监测各个小分隔中的扩增反应,因而能同时检测的目标序列的数目受限于荧光标记的种类及对荧光标记的分辨率。因此,需要进一步地改进数字pcr方法,以提升侦测多重目标核酸序列的能力。技术实现要素:本揭示内容的一实施态样是提供一种分析样品中多重目标核酸序列的方法,样品中包含第一目标序列和第二目标序列,此方法包含:(a)在预扩增反应中,由第一目标序列产生第一模板分子其包含:第一通用引物序列,第二通用引物序列,和第一标识序列标签;且由第二目标序列产生第二模板分子其包含:第一引通用物序列,第二通用引物序列,和第二标识序列标签。(b)随机分散产生自(a)步骤的第一模板分子和第二模板分子至一基板,此基板包含复数个预先确定数目的反应孔,并且所述反应孔内平均含有少于1个的所述第一模板分子或所述第二模板分子。(c)克隆扩增反应,第一模板分子产生复数个第一扩增子,且第一扩增子固定于反应孔内;第二模板分子产生复数个第二扩增子,且所述第二扩增子固定于所述的反应孔内。(d)辨识反应孔内的第一标识序列标签和第二标识序列标签,其中第一标识序列标签代表第一目标序列的阳性辨识,第二标识序列标签代表第二目标序列的阳性辨识。以及(e)通过统计分析,包含计量所述反应孔的数目,所述第一目标序列的阳性辨识数目,和所述第二目标序列的阳性辨识数目,以定量所述第一目标序列和所述第二目标序列。根据一实施方式,其中第一标识序列标签包含第一标识码序列,第二标识序列标签包含第二标识码序列。根据一实施方式,其中预扩增反应为基因特异性扩增反应。根据一实施方式,其中预扩增反应为基因特异性5’核酸酶裂解反应。根据一实施方式,其中所述预扩增反应包含目标特异性探针的链接反应以及后续的通用引物序列扩增反应,且此目标特异性探针包含所述第一标识序列标签的核酸序列,或第二标序列标签的核酸序列。根据一实施方式,其中样品包含参考核酸序列,且参考核酸序列模板分子具有一第三标识序列标签。根据一实施方式,其中第一模板分子还包含部分的第一目标序列,且第二模板分子还包含部分的第二目标序列。根据一实施方式,其中基板上的复数个反应孔为在基板表面上形成的凹陷的空间。根据一实施方式,其中基板上的复数个反应孔为在基板中形成的的通孔。根据一实施方式,其中复数个反应孔具有同样的容积。根据一实施方式,其中复数个反应孔形状为圆形或多边形。根据一实施方式,其中基板上的复数个反应孔有不相同的形状。根据一实施方式,更进一步地包含:在步骤(a)的基因预扩增反应后,量化所述第一模板分子或第二模板分子的核酸,且决定样品的稀释倍数。根据一实施方式,更进一步地包含:于步骤(c)之前,加入与水不混溶的液体至所述基板上,以覆盖并隔离各反应孔。根据一实施方式,其中反应孔内固定有第三引物序列,第三引物序列包含与第一通用引物序列或第二通用引物序列互补的序列。根据一实施方式,其中第一核酸扩增子和第二核酸扩增子经由第三引物序列直接附着于反应孔的内表面。根据一实施方式,其中由第一核酸模板分子产生的第一扩增子和第二核酸模板分子产生的第二扩增子经由一中间基质固定于反应孔的内表面。根据一实施方式,利用dna定序,聚合酶延伸、探针杂合,或探针连接反应以辨识标识序列标签。根据一实施方式,还包含进一步分析第一核酸扩增子和第二核酸扩增子的第一标识序列标签或第二标识序列标签之外的核酸序列的组成。根据一实施方式,第一目标序列和第二目标序列为相同核酸序列。根据一实施方式,第一目标序列和第二目标序列为不同核酸序列。根据一实施方式,其中还包括所述基板放置于一流动室,并使反应溶液流过所述基板中的所述反应孔表面。通过将不同的目标序列标识不同的标识序列标签产生模板分子,以及在相互分隔的反应孔内原位地执行克隆扩增和标识序列标签辨识,可提升数字pcr在定量多重目标基因的敏感性和正确性。附图说明图1绘示根据本揭示内容各实施方式的核酸检测方法的流程图;图2a绘示根据本揭示内容一些实施方式的预扩增反应的步骤示意图;图2b绘示根据本揭示内容一些实施方式的预扩增反应的步骤示意图;图3a绘示根据本揭示内容一些实施方式的基板的俯视示意图;图3b绘示根据本揭示内容一些实施方式的基板的俯视示意图;图3c为根据本揭示内容一实施例的基板的俯视影像;图3d为根据本揭示内容一实施例的基板的侧视图;图4a为根据本揭示内容一些实施方式的克隆扩增反应的示意图;图4b为根据本揭内容一些实施方式的克隆扩增反应的示意图;图4c为根据本揭示内容一些实施方式的克隆扩增反应的示意图;图4d为根据本揭内容一些实施方式的克隆扩增反应的示意图;图5绘示根据本揭示内容一些实施方式的标记种类与碱基组成的示意图;图6绘示根据本揭示内容一些实施方式的辨识标识码的流程图;图7为根据本揭示内容一实施例的荧光影像图;图8a绘示根据本揭示内容一些实施方式的流动室的立体示意图;图8b绘示根据本揭示内容另一些实施方式的流动室的立体示意图,显示液体流过基板中反应孔;图9绘示根据本揭示内容一些实施方式的核酸检测系统的侧视示意图。【符号说明】100:方法102、104、106、108、110、112:步骤210:第一目标核酸分子212:第一目标序列220:第二目标核酸分子222:第二目标序列230:第一模板分子232:第一目标模板序列232’:序列240:第二模板分子242:第二目标模板序列242’:序列250:引物252:第一通用引物序列254:第二引物序列256:第一标识序列标签256’:序列260:引物262:第一通用引物序列264:第二引物序列266:第二标识序列标签266’:序列270:引物272:第二通用引物序列274:特异性引物序列280:引物282:第二通用引物序列284:特异性引物序列310:第一目标核酸分子312:第一目标序列320:第二目标核酸分子322:第二目标序列330:第一模板分子340:第二模板分子350:探针352:第一通用引物序列354:第二通用引物序列356:第一标识序列标签356’:序列358:特异性探针序列360:探针362:第一通用引物序列364:第二通用引物序列366:第二标识序列标签366’:序列368:特异性探针序列372:引物374:引物382:引物384:引物410:基板412:反应孔420:基板422、424、426、428、430、432:反应孔440:基板450:反应孔460:基材510:第一反应孔512:第二反应孔520:第三引物序列530:第一扩增子540:第二扩增子550:第一扩增子簇660:第二扩增子簇610:第一反应孔612:第二反应孔620:第三引物序列630:第一扩增子640:第二扩增子650:第一扩增子簇660:第二扩增子簇702:标识序列标签710:标记探针库712:5’端标记探针组714:3’端标记探针组720:标记探针库722:5’端标记探针组724:3’端标记探针组730:标记探针库732:5’端标记探针组734:3’端标记探针组800:流动室810:外壳820:基板822:反应孔830:上盖832:光学检测区834:液体输入端836:液体输出端840:下盖900:系统910:加热和冷却单元912:导热板914:绝热层916:移动平台920:流体系统922:试剂单元930:检测单元940:计算单元a:区域b:区域具体实施方式为了使本揭示内容的叙述更加详尽与完备,下文针对了本发明的实施态样与具体实施例提出了说明性的描述;但这并非实施或运用本发明具体实施例的唯一形式。以下所揭露的各实施方式及各实施例,在有益的情形下可相互组合或取代,也可在一实施例中附加其他的实施例,而无须进一步的记载或说明。在以下描述中,将详细叙述许多特定细节以使读者能够充分理解以下的实施方式及实施例。然而,可在无此等特定细节的情况下实践本发明的实施例。在其他情况下,为简化附图,熟知的结构或装置仅示意性地绘示于图中。须注意的是,为了清楚地表示附图的特征,其结构尺寸可能会任意地增加或减少。本揭示内容的一些实施方式提供用于同时分析多个目标核酸序列的方法和系统,例如用于发现和验证以及临床诊断的多个生物标记检测。本文中,用“目标核酸序列”或“目标序列”或者语法上的等效物表示单链核酸上的核酸序列或与其互补的序列。目标序列可为基因、调控序列、基因组dna、cdna、rna(例如:mrna和rrna)或其他序列中的一部分。目标序列可为任意长度,同时应了解较长序列更具有特异性。在一些实施方式中,可能理想的为,将样品核酸裂解或切割成100个碱基对至10,000个碱基对的片段,在一些实施方式中优选大致500个碱基对的片段。如将为本领域技术人员所认识,互补的目标序列可采用许多形式。例如,目标序列可含于较大核酸序列内,即,基因或mrna中的全部或一部分、质粒dna或基因组dna中的一限制性片段及其他基因序列。在一些实施方式中,不同的目标核酸序列为位于同一基因中。在一些实施方式中,不同的目标核酸序列为位于不同的基因中。本揭示内容的一些实施方式亦可用于检测单核苷酸多型性(snp)。在一实施式中,第一目标序列和第二目标序列为相同的核酸序列。因此,本揭示内容可用以定量单一的目标序列。在一实施方式中,第一目标序列为不同的核酸序列,因此本揭示内容可用以同时定量复数个不同的目标序列。在本揭示内容的实施方式中,以编码的方式,各目标序列指定个别的标识序列标签;之后个别的标识序列标签可代表相应的目标序列。本文中,用“标识序列标签”表示较短人造dna序列,其包含一段特定目标分子的标识码序列。在一些实施方式中,标识码序列的长度小于6个碱基或小于10个碱基。在一些实施方式中,标识码序列的长度可为4个碱基至8个碱基。在一些实施方式中,标识码序列的长度可为10个碱基至20个碱基。标识序列标签还可包含额外的核酸序列,所述额外的核酸序列在解码处理期间为探针杂交所需要。通常,将标识序列标签设计为不同于核酸分析中目标基因体序列。在本揭示内容的多个实施方式中,引入这些标识序列标签作为样品制备中的一部分。然而,并不是所有可能的碱基序列组合均适合作为标识码序列,归因于与核酸分子序列的自我配对或互相作用。例如,以回文序列(acgt)作为标识码序列可能不是个好选择。因此,可用标识码序列的数量可能小于理论数量。本文中,标识码序列的资讯可转换为“标识码”。用“标识码”表示分配给标识序列标签的代码。每一个标识序列标签具有特定的标识码序列。本揭示内容的一实施方式提供基因体特异性或基因特异性预扩增的方法,将设定的带有标识码序列的标识序列标签嵌入基于目标核酸序列所产生的模板分子。图1为根据本发明的各实施态样,多重目标核酸检测方法100的流程图。方法100的部分步骤将于后参照图2a、图2b、图3a、图3b、图3c、图3d、图4a、图4b、图5、图6,并详细叙述之。请参看图1,方法100是开始于步骤102,其是接收一含核酸的样品,核酸样品中含有感兴趣的目标序列。在一些实施例中,一些感兴趣的目标序列可能不存在于样品中,即定量化结果显示这些目标序列的含量为零。在一些实施例中,目标序列包含内生性的参考序列,例如:管家基因。在一些实施例中,于样品中加入外生性核酸序列,且此外生性核酸序列具有预先确定的拷贝数。本文中,“核酸”意指脱氧核糖核酸(dna)或核糖核酸(rna)及其单链、双链、及其任意的化学修饰(例如:甲基化、乙基化等)。包含目标序列的样品可来自生物组织、个体或体液(例如:血液、骨髓、尿、排泄物、泪液、血清、淋巴液、唾液、肛门和阴道分泌物、汗液、精液和其他体液,任意有机体诸如包括人类的哺乳动物);细菌和病菌(包括病毒)的细胞裂解物;硬组织(例如器官,诸如肝脏、脾脏、肾、心脏、肺等);环境样品(包括但不限于,空气样品、农业样品、水样品和土壤样品);生物战剂样品;研究样品(即,样品可为扩增反应产物,所述扩增反应包括诸如pcr扩增反应的目标扩增和信号扩增);纯化样品,诸如纯化基因体dna、rna等;原样(细菌、病毒、基因体dna等)。a.预扩增反应。请参看图1及图2a、图2b,接收含核酸的样品后,方法100进行至步骤104,进行预扩增反应,以扩增目标核酸序列,并将含有标识码序列的标识序列标签插入预扩增反应产生的核酸模板。请参看图2a,其绘示根据一实施方式的基因特异性预扩增反应的示意图。含核酸样品中,包含第一目标核酸分子210和第二目标核酸分子220,其中第一目标核酸分子210含有第一目标序列212,第二目标核酸分子220含有第二目标序列222。进行预扩增反应时,以引物250和引物270为预扩增反应的引物,以第一目标序列212中的序列为预扩增的模板,产生第一模板分子230;相应地,以引物260和引物280为预扩增反应的引物,以第二目标序列222中的序列为预扩增的模板,产生第二模板分子240。请仍参看图2a,其中引物250包含第一通用引物序列252,第一标识序列标签256,和第二引物序列254,其与第一目标序列212的部分序列互补。引物260包含第一通用引物序列262,第二标识序列标签266,和第二引物序列264,其与第二目标序列222的部分序列互补。其中,第一引通用物序列252和第一通用引物序列262为相同的序列。引物270包含第二通用引物序列272,和特异性引物序列274,其与第一目标序列212的部分序列为互补的。引物280包含第二通用引物序列282,和特异性引物序列284,其与第二目标序列222的部分序列为互补的。其中,第二通用引物序列272和第二通用引物序列282为相同的序列。在一实施方式中,第一通用引物序列和第二通用引物序列为不相同的序列。第一标识序列标签256与第二标识序列标签266有不同的标识码序列。第一标识序列标签256包含第一标识码序列,第二标识序列标签266包含第二标识码序列(未图示)。请仍参看图2a,预扩增反应后产生的第一模板分子230,其具有第一目标模板序列232,并且两端具有第一通用引物序列252和第二通用引物序列272,且第一标识序列标签256插入于第一模板分子230中。相应地,第二模板分子240,其具有第二目标模板序列242,并且两端具有第一通用引物序列262和第二通用引物序列282,且第二标识序列标签266插入于第二模板分子240中。因此,第一模板分子和第二模板分子的5’端为相同的通用引物序列,且3’端也为相同的通用引物序列。在一实施方式中,可用相对较小pcr循环数完成基因特异性预扩增,优选地为小于30次循环、20次循环或10次循环,以提供足够的模板分子且保留原始样品中不同目标序列间的比率。请参看图2b,绘示了以基因特异性5’裂解酶预扩增反应,将标识序列标签嵌入模板分子的方法。此反应的聚合酶具有5’至3’核酸外切酶活性,例如tag聚合酶。含核酸样品中,包含第一目标核酸分子310和第二目标核酸分子320,其中第一目标核酸分子310含有第一目标序列312,第二目标核酸分子320含有第二目标序列322。分别对第一目标序列312和第二目标序列322设计探针,探针的作用与tagman即时pcr的探针类似,探针的3’翼与目标序列互补,探针的5’翼在’聚合酶扩增期间,会被5’核酸外切酶从探针上切割下来。探针350的5’翼包含第一通用引物序列352,第一标识序列标签356,和第二通用引物序列354;探针350的3’翼包含特异性探针序列358,其与第一目标序列312的部分序列为互补的。探针360的5’翼包含第一通用引物序列362,第二标识序列标签366,和第二通用引物序列364。探针360的3’翼包含特异性探针序列368,其与第二目标序列322的部分序列为互补的。其中,第一通用引物序列352和第一通用引物序列362为相同的通用引物序列,第二引通用物序列354和第二通用引物序列364为相同的通用引物序列。在一实施方式中,第一通用引物序列和第二通用引物序列为不相同的序列。请继续参看图2b,引物372和引物374分别与第一目标序列312两端附近的部分序列互补。引物382和引物384分别与第二目标序列322两端附近的部分序列互补。将探针与目标序列杂合并进行聚合酶反应时,由于5’核酸外切酶的作用,第一模板分子330从探针350切下,第二模板分子340从探针360切下。第一模板分子330具有第一通用引物序列352,第一标识序列标签356,和第二通用引物序列354。第二模板分子340具有第一通用引物序列362,第二标识序列标签366,和第二通用引物序列364。因为用于5'核酸外切酶裂解预扩增的探针是专门为目标序列所设计,第一模板分子330变为第一目标核酸分子310的对应物,第二模板分子340变为第二目标核酸分子320的对应物。在一实施方式中,目标核酸分子的预扩增反应也可由含有标识序列标签的目标特异性探针的链接反应以及后续的通用引物序列扩增的方法,从而可同时产生多个含有标识序列标签的模板分子。所述此模板分子预扩增反应方法在文献中已有发表,如castiglionic;appl.environ.microbiol.,2004,70(12),7161,在此列为引用文献。在一实施方式中,将生物的基因体dna经亚硫酸氢钠处理,以用于dna甲基化分析。甲基化特异引物和探针可用于目标序列的5'核酸外切酶裂解预扩增中。根据一实施方式,可侦测原始样品中的目标序列是否为甲基化的序列。在一些实施方式中,样品核酸为核糖核酸(rna),例如在基因表达分析的情形下。在进行预扩增反应前,执行逆转录步骤,将rna逆转录为cdna。在一些实施方式中,第一目标序列和第二目标序列的丰度类似。在一些实施方式中,第一目标序列比第二目标序列丰富至少100倍、1000倍或10,000倍。b.随机分散样品至各反应孔。请参看图1及图3a、3b、3c、3d。方法100进行至步骤106,随机分散含目标核酸模板的样品至各反应孔,使平均每一反应孔内的第一模板分子或第二模板分子少于1。根据一些实施方式,利用光刻的方式,在基板上形成凹陷的空间,产生具有多个物理性相互隔绝微孔的基板,这些微孔为进行扩增反应的反应孔。例如,在抛光的基材表面上旋涂一层均匀的光刻胶,通过曝光以形成图案化表面,之后进行蚀刻(例如,反应性离子蚀刻)以形成微孔。基板材料可为硅、玻璃、塑料、或金属材料(例如:铝、不锈钢)。根据多个实施方式,基板材料具有低的荧光背景值,因此与荧光检测相容。根据一些实施方式,反应孔内表面与酶促反应兼容。在一些实施方式中,反应孔的表面可以用表面涂层处理,例如亲水性表面涂层。在一些实施方式中,基板具有至少5,000孔,或10,000孔,或30,000孔。在一些实施方案中,基板具有少于200,000个孔,或100,000个孔,或50,000个孔,或10,000个孔。在一些实施方式中,由于基板的反应孔数目为预先确定的,各反应孔的容积也是预先确定的,因此可通过反应孔数目及容积得知进行反应的样品体积。根据一些实施例,反应孔的边长或直径范围可从2至1000μm,较佳尺寸为10μm至500μm,更佳为50μm至200μm。反应孔的深度范围从10μm至1000μm,较佳为10μm至500μm,更佳为20μm至100μm。根据一些实施例,各反应孔可在基板上排列成不同的形式或图案。请参看图3a,其是根据一些实施例,为基板410的俯视示意图。基板具有多个反应孔412,其中各个反应孔具有相同的尺寸及间距。请参看图3b,其是根据一些实施例,为基板420的俯视示意图。基板420具有圆形和多边形的不同形状的反应孔:反应孔422为矩形,反应孔424为五边形,反应孔426为六边形,反应孔428为圆形,反应孔430为圆形,且反应孔430的直径大于反应孔428的直径,反应孔432为三角形。请参看图3c,其是一实施例的基板俯视影像。影像中的圆形各个反应孔的直径相同,例如每个反应孔的直径为80μm,深度为50μm至100μm。区域a的各相邻反应孔中心的距离为100μm;区域b的各反应孔中心的间距离为120μm。请参看图3d,其是一实施例的基板剖面示意图,其中各反应孔为穿透所述基板的通孔。图3d绘示基板440,反应孔450为穿透基材460的通孔。将含有反应试剂及模板分子的样品水溶液流经基板时,水溶液可流入基板上的各反应孔,因为各反应为物理性互相隔绝的结构,各反应孔内的反应为彼此互相独立的。因此,可有效地将含水样品分配至大量的分隔的反应空间中。这种样品分隔方法比使用乳胶小滴系统的分配方法更快更经济。在一些实施方式中,可以将样品分成重复份(例如重复两份、重复三份等),测定其中的目标分子量。样品可以源自相同的来源,并且在扩增之前分成重复份。另外,可以产生样品的连续稀释物。可采用连续或平行方式分析重复样品和稀释样品。每一个反应孔内平均包含大约1个或更少的模板分子和足以进行聚合酶反应的试剂。与现有技术中“油包液滴”(dropletinoil)数字pcr相比,本揭示内容的实施方式显著地简化了样品的分隔步骤,且不须将反应液与油相溶液乳化,因此反应液分隔步骤更加低成本、高效、快速。在一些实施方式中,可加入密封液体,其可快速地覆盖于基板表面上,以在pcr的热循环期间防止蒸发,且隔离各反应孔。密封液体与水不混溶、与酶促反应相容且在热循环之后易从表面上去除。根据一些实施方式,优选的密封液体包含矿物油。若所述反应孔为通孔时,此密封液体在pcr的热循环期间应覆盖这些通孔的两端。根据一些实施例,模板分子被分布至大量的反应孔。于进行后续步骤中,其中平均各个反应孔内少于一个拷贝的模板分子。可能需要稀释模板分子,来实现各单个反应孔少于一个拷贝的模板分子的目的。根据一些实施例,大部分的反应孔只含有单个模板分子。c.克隆扩增反应。请参看图1及图4a、4b、4c、4d,方法100进行至步骤108,克隆扩增各反应孔内的核酸模板分子,所产生的扩增子经由固定于反应孔内的引物而附着于反应孔内。根据一些实施方式,反应孔内表面固定有引物序列,其与来自预扩增阶段产生的模板分子上的通用引物序列互补。根据一些实施方式,反应孔内表面具有引物,其与来自预扩增阶段产生的模板分子上的特异性引物序列互补。根据一些实施方式,引物的固定方法,为利用物理力或化学键结,在反应孔内表面固定引物序列。根据一些实施方式,引物通过双硫键偶联于反应孔内表面。可通过本领域已知的各种表面化学作用,实现引物连接到反应孔内表面。根据本发明的一些实施方式,可用引物偶联于中间基质上,中间基质可例如为磁性纳米粒子。磁性纳米粒子的材料,例如:fe2o3、fe3o4、cofe2o4或mnfe2o4。磁性纳米粒子的大小为10纳米至500纳米,更佳为15纳米至100。又更佳为15纳米至50纳米。将具有引物序列的磁性奈粒子加入基板上的反应孔中,并且施加磁场于基板下方,以将具有引物的磁性纳米粒子限制在反应孔的底部。可通过本领域已知的各种技术来施加磁场,诸如通过永磁体。请参看图1的步骤108及图4a,来自基因体特异性预扩增反应的一个第一模板分子230位于第一反应孔510内,一个第二模板分子240位于第二反应孔512内。第一反应孔510和第二反应孔512的内表面固定有第三引物序列520,第三引物序列520的序列与如图2a所示的第一通用引物序列252、262或第二通用引物序列272、282互补。第三引物序列520为克隆扩增反应步骤的引物。在第一反应孔510内,以第一模板分子230为模板,产生的第一扩增子530会固定于第一反应孔510内。第一扩增子530具有与第一目标模板序列232互补的序列232’,以及与第一标识序列标签256互补的序列256’。相应地,在第二反应孔512内,以第二模板分子240为模板,产生的第二扩增子540会固定于第二反应孔512内。第二扩增子540具有与第二目标模板序列242互补的序列242’,以及与第二标识序列标签266互补的序列266’。之后热循环反应升温时,第一模板分子230与第一扩增子530分离,第二模板分子240与第二扩增子540分离。之后热循环反应降温时,由于反应试剂中含有与第一通用引物序列252、262相同或互补的引物序列,与第二通用引物序列272、282相同或互补的引物序列,因此以第一扩增子530为模板,产生与第一模板分子230相同的序列,且以第二扩增子540为模板,产生与第二模板分子240相同的序列。于之后的热循环反应中,以固定于反应孔内的第三引物序列520为引物,在第一反应孔510中,以第一模板分子230相同的序列为模板,产生固定于反应孔内的第一扩增子530;在第二反应孔512内,以第二模板分子240相同的序列为模板,产生固定于反应孔内的第二扩增子540。请参看图4b,克隆扩增反应在第一反应孔510内产生多个固定于反应孔内的第一扩增子530,形成第一扩增子簇550。在第二反应孔512内产生多个固定于反应孔内的第二扩增子540,形成第二扩增子簇560。请参看图1的步骤108及图4c,来自基因特异性裂解酶预扩增反应的一个第一模板分子330位于第一反应孔610内,一个第二模板分子340位于第二反应孔612内。第一反应孔610和第二反应孔612的内表面固定有第三引物序列620,第三引物序列620的序列与如图2b所示的第一通用引物序列352、362或第二通用引物序列354、364互补。第三引物序列620可做为克隆扩增反应步骤的引物。在第一反应孔610内,以第一模板分子330为模板,产生第一扩增子630会固定于第一反应孔610内。第一扩增子630具有与第一标识序列标签356互补的序列356’。相应地,在第二反应孔612内,以第二模板分子340为模板,产生第二扩增子640会固定于第二反应孔612内。第二扩增子640具有与第二标识序列标签366互补的序列366’。之后热循环反应升温时,第一模板分子330与第一扩增子630分离,第二模板分子340与第二扩增子640分离。之后热循环反应降温时,由于反应试剂中含有与第一通用引物序列352、362相同或互补的引物序列,和与第二通用引物序列354、364相同或互补的引物序列,因此以第一扩增子630为模板,产生与第一模板分子330相同的序列,且以第二扩增子640为模板,产生与第二模板分子340相同的序列。于之后的热循环反应中,以固定于反应孔内的第三引物序列620为引物,在第一反应孔610中,以第一模板分子330相同的序列为模板,产生固定于反应孔内的第一扩增子630;在第二反应孔612内,以第二模板分子340相同的序列为模板,产生固定于反应孔内的第二扩增子640。请参看图4d,克隆扩增反应在第一反应孔610内产生多个固定于反应孔内的第一扩增子630,形成第一扩增子簇650。在第二反应孔612内产生多个固定于反应孔内的第二扩增子640,形成第二扩增子簇660。根据一些实施方式,来自不同目标分子的扩增子簇分别位于个别的反应孔内,因此不同的扩增子簇的分布是空间上是相互分离的。根据一些实施方式,其中第一核酸模板分子的第一扩增子和第二核酸模板分子的第二扩增子经由一中间基质固定于反应孔的内表面。根据多个实施方式,以单分子克隆扩增来扩增模板分子,以产生用于进一步分析的克隆扩增子簇。在扩增之后,反应孔内每个的扩增子簇可以具大于几万或几十万或几百万的扩增子,取决于所要的分析尺度及条件。在一些实施方式中,dna扩增为聚合酶链反应(pcr),且在克隆扩增期间反应基板处在热循环中。在一些实方式中,替代性的核酸扩增技术可以类似地应用以替代pcr。此类技术包括例如,核酸等温扩增技术(isothermalamplification),连接酶链式反应(lcr)、基于转录的扩增系统(tas)、基于核酸序列的扩增(nasba)、链置换扩增(sda)、滚环扩增(rca)、超分支滚环扩增(hrca)等。在一些实施方式中,扩增子可能为双链dna分子或单链dna分子。如下所述,可使用能增加其中一链的扩增反应技术。d.辨识各反应孔内的标识序列标签。在一些实施方式中,利用dna定序,聚合酶延伸、探针杂合,或探针连接反应辨识各反应孔内的标识序列标签。请参看图1,接下来方法100进行至步骤110,辨识各反应孔内的标识码。各反应孔内如果具备第一目标序列或第二目标序列,则第一标识序列标签或第二标识序列标签会呈现阳性反应,即代表其反应孔内编码所对应的各目标序列的阳性辨识。可使用本领域已知的核酸分析方法,在固定于各反应孔内表面的扩增子上进行序列特异性分析。所述核酸分析方法包括,但不限于标记探针连接、单碱基延伸、dna测序或熔解曲线分析。在一实施方式中,本揭示内容提供一种依序成对探针连接方法,用于判断标识码序列。此方法为进行数个探针连接反应循环,在每一个别探针连接反应循环可同时测两个位置的碱基组成。在每一次探针连接反应循环中,加入一个标记探针库,每个标记探针根据一特定位置的碱基(a、t、c、g)标定不同的荧光标记。每一个标记探针库中存在两个探针组,其中一个为3'端标记探针组,其中的标记探针包含5'端磷酸基和3'端标记;另一个为5'端标记探针组,其中的标记探针包含5'端标记和3'端羟基。标记探针库中的标记探针的序列包含审视位置处的所有可能碱基组成。由杂合连接的探针荧光标记讯号,可判定审视位置的碱基组成。在一些实施方式中,于一探针连接反应循环中,审视标识码序列中的两个碱基位置,根据所配对的探针标记组合判定审视位置的碱基组成。在各个连接反应循环中相继而不重复地审视标识码序列的另2个不同碱基位置。在一些实施方式中,所述探针标记为荧光标记物,采用激光诱导荧光进行逐点扫描,或者采用荧光成像仪,或者荧光倒置显微镜进行成像,成像结果通过ccd图像传感器在计算机上保存。在一些实施方式中,标记1(l1)为与碱基审视位置处的碱基a-标识序列探针有关的标记;标记2(l2)为与碱基审视位置处的碱基c-标识序列探针有关的标记;标记3(l3)为与碱基审视位置处的碱基g-标识序列探针有关的标记;以及标记4(l4)为与碱基审视位置处的碱基t-标识序列探针有关的标记。请参看图5,总结了颜色组合和相应的碱基对组合,假设在5'端标记探针和3'端标记探针中皆用l1、l2、l3和l4标记碱基a、c、g、t。随后,为方便表示起见,标识码可由色码代表。然而,由于颜色组合不能区别这两个碱基的序列,所以ac和ca的碱基序列将产生相同的检测信号。因此,在此实施方式的编码方案中,总共存在10个可区别的标记组合,其中包括4个独特的碱基对组合,如下表1所示;并且存在6个同义(equivalent)的碱基组合,如下表2所示。因此,标识码序列中的每一对碱基可提供10种不同的标识码。表1.唯一的碱基码。检测信号(标识码)l1l2l3l4碱基组合aaccggtt表2同义的碱基码。检测信号(标识码)l1/l2l1/l3l1/l4l2/l3l2/l4l3/l4碱基组合1acagatcgctgt碱基组合2cagatagctctg如果标识码序列长度为2个碱基,那么可用的标识码的理论数量为10个。如果标识码序列为4个碱基,那么可用的标识码的理论数量为10x10个。如果标识码序列为6个碱基,那么可用的标识码的理论数量为10x10x10个。因此,在n对碱基长度的标识码序列,可用的标识码的理论数目为10^n个。在一实施方式中,可编辑多个不同的标签序列,各自带有特定的标识码序列。因此,除了第一目标序列及第二目标序列以外,可同时检测或定量多个目标核酸序列。请参看图6其是根据一实施方式,示例出利用依序成对探针连接方法,判定标识序列标签的标识码。在一些实施方式中,经由dna连接酶(例如:t4连接酶或tth连接酶)连接二个与标识序列标签互补且并置的探针。连接后的成对连接探针可保留在模板分子上,且其两个标记可由检测器在表面上检测。通过严格洗涤从表面上去除未连接探针。在一个成对探针连接反应循环之后,从目标分子上去除成对连接探针,以供继续进行下一个连接反应循环成对连接探针的tm显然不同于未连接探针的tm。可通过变性操作,诸如通过加热或碱性溶液,执行去除成对连接标记探针。相继进行连接反应循环,直到审视所有碱基位置为止。请参看图6,第一标识序列标签256与第二标识序列标签356具有标识码序列,以带有荧光的探针辨识标识码序列,以荧光信号判断标识码。举例来说,图6中的标识序列标签702中的标识码序列为atgact,长度为6个碱基,因此,透过3次探针连接反应循环可判定标识序列标签702的标识码。其中,每一次连接反应中,二个探针的连接位点皆是在标识码序列的中间处(即第3个碱基和第4个碱基之间)。第一连接反应中,所审视的碱基为第3碱基和第4碱基;第二连接反应中,所审视的碱基为第2碱基和第5碱基;第三连接反应中,所审视的碱基为第1碱基和第6碱基。在每一次的连接反应循环中,加入不同的标记探针库,其中的标记探针包含与特定的标识序列标签部分互补的碱基序列,所述特定的标识序列标签部分位于标识码序列的5’侧或3’侧。5'端标记探针的3'末端和3'端标记探针的5'末端皆含有3个碱基序列,所述3个碱基序列的n表示可为a、t、c、g任一种。在第一连接反应循环中,加入标记探针库710,其包含5’端标记探针组712和3’端标记探针组714。其中,5’端标记探针组712的标记探针根据3’端最末位置的碱基标记不同的荧光(例如a、t、c、g分别标记l1、l2、l3、l4);3’端标记探针组714的标记探针根据5’端最末位置的碱基标记不同的荧光(例如a、t、c、g分别标记l1、l2、l3、l4)。在第一连接反应后,l2标记的5’端探针和l4标记的3’端探针杂合且连接至标识序列标签702,且二探针互相连接。移除未反应的探针后,此时可放出l2/l4的检测信号(标识码)。于荧光讯号收集后,进行变性操作,移除第一连接反应的成对探针。之后进行第二连接反应循环,加入标记探针库720,其包含5’端标记探针组722和3’端标记探针组724。与前述标记探针库710中的标记探针相类似,但是5’端标记探针组722中的标记探针,是根据3’端第2个位置的碱基标记不同的荧光;3’端标记探针组724中的标记探针,是根据5’端第2个位置的碱基标记不同的荧光。在第二连接反应后,l1标记的5’端探针和l3标记的3’端探针杂合且连接至标识序列标签702,且二探针互相连接。移除未反应的探针后,此时可放出l1/l3的检测信号(标识码)。于荧光讯号收集后,再进行变性操作,移除第二连接反应的成对探针。之后进行第三连接反应循环,加入标记探针库730,其包含5’端标记探针组732和3’端标记探针组724。与前述标记探针库710中的标记探针相类似,但是5’端标记探针组732中的标记探针,是根据3’端第3个位置的碱基标记不同的荧光;3’端标记探针组734中的标记探针,是根据5’端第3个位置的碱基标记不同的荧光。在第三连接反应后,l4标记的5’端探针和l1标记的3’端探针杂合至标识序列标签702且二探针互相连接。移除未反应的探针后,此时可放出l1/l4的检测信号(标识码)。因此,由3个连接反应循环,可得到标识序列标签702的标识码为“l2/l4-l1/l3-l1/l4”。请参看图7,其是根据一实施例的荧光影像图,于如图6的其中一个探针连接反应后,以荧光显微镜拍摄基板影像,图7显示具有荧光探针的反应孔,且在同一基板上的各反应孔的荧光讯号彼此是分隔的而不会互相干扰。在一些实施方式中,所述碱基审视位置处在从每一个标记探针的连接点起的5个碱基内,且优选地在3个碱基内,以在所述成对探针连接步骤中保持所述碱基识别特异性。在一些实施方式中,dna连接酶根据模板碱基序列选择连接位点任一侧上的大于三个碱基。在远离连接位点的碱基位置,可能存在更多由连接酶造成的错误,取决于连接酶和连接条件。只要扩增子簇上标识码序列的测定一致,所述扩增子簇可具有多达几十万扩增子,那么可容许有一些干扰。标记探针的长度可在6个碱基到40个碱基之间变化,更优选地介于8个碱基与20个碱基之间。在成对探针连接期间,所述碱基序列可优选地具有类似tm,以具有更好的杂交特异性。在一些实施方式中,标记探针上的标记为电化学标记或纳米颗粒。e.定量目标序列。请参看图1,方法100进行至步骤112,统计分析,以定量各目标核酸序列。由于克隆扩增时的模板分子带有特定的标识序列标签,因此可由读取出的标识码代表其所编码的目标核酸序列的阳性辨识。因此可由计数特定的标识码,定量各目标序列。因此,原始样品中的每一目标分子的整体量可以经由统计分析估计而得。在一些实施方式中,进一步包含:根据预先确定的用于样品制备中的稀释倍数,以推断原先样品中的每一个目标核酸序列的量。稀释倍数的设定,是由预扩增的模板分子数和个别反应的体积所决定,调整稀释倍数以使每个反应孔内平均含有少于一个的模板分子。在数字pcr反应中,通常单分子克隆扩增中的模板分子的随机分布遵循泊桑(poisson)分布。c反应孔中的m模板分子的随机分布遵循泊桑分布。在给定反应位点中具有至少一个模板分子的概率表示为p,且每一个反应孔中的模板分子的平均浓度表示为λ:λ=m/c由于反应腔室的数量可任意变大,所以可得到:λ=-ln(1-p)可通过计数数字pcr中的各目标序列的阳性反应孔数,估计概率p。因此,可统计计算每一个反应孔中的模板分子的平均浓度和样品中的相应目标分子量。对95%的置信区间来说,概率p的置信极限可表达为:由于在这些个别的反应孔中,目标模板分子为随机泊桑分布,一些反应孔只包含来自目标模板分子的一个复本的扩增子(单一的阳性反应孔),一些反应孔完全没有扩增子(阴性反应孔),一些反应孔包含多于一个目标板分子的多于一个复本的扩增子(复阳性反应孔)。在辨识标识码后解码,可确定每一个目标模板分子在基板上特定的反应孔位置。在一些实施方式中,通过统计分析,包含计量反应孔的数目,第一目标序列的阳性辨识数目,第二目标序列的阳性辨识数目,以定量所述第一目标序列和所述第二目标序列。在一些实施方式中,通过包含计算每一个目标模板分子的阳性反应孔数、阴性反应孔数、和复阳性反应孔数,通过这些数据的统计分析,得到每一个目标模板分子在稀释样品溶液的量,并由预先确定的样品稀释倍数,定量起始样品中每一个目标序列。在一些实施方式可以进一步分析第一扩增子和第二扩增子的第一标识序列标签或第二标识序列标签之外的核酸序列的组成。例如,可以分析第一扩增子中介于两端引物间的序列,或第二扩增子中介于两端引物间的序列。根据一些实施方式,可同时分析多个目标核酸序列,目标核酸序列的数目,例如:5,10,50,100,200,300,400,500,600,700,800,1000,2000,3000,4000,5000,6000,7000,8000。根据一实施方式,还包含使用某些目标序列(例如,管家基因)作为分析中的定量参考序列,且此参考目标序列在所关注的基因体中具有已知的拷贝数。在一实施方式中,参考核酸序列扩增产生带有标识序列标签的模板分子。f.本揭示内容的另一个实施方式提供一种用于多重核酸分析的流动室和系统。请参看图8a,绘示根据一些实施方式的流动室示意图。流动室800包含外壳810,其内部具有基板820,基板上具有多个反应孔822。上盖830位于外壳810之上,其具有一光学透明窗。上盖830处具有一液体输入端834和液体输出端836,呈相对配置。根据一些实施例,在检测的过程中,经由液体输入端834,引入适当稀释的含模板分子的样品溶液,使得含样品的反应溶液沿着基板820表面流动,且一致地填充至各个反应孔822中。之后经由液体输出端836,移除基板820表面上过量的反应溶液。样品中的目标模板分子因此随机地分布至各反应孔822中。之后,经由液体输入端834,引入与水不混溶的液体,以完全覆盖每一个个别反应孔822,借以分离个别的扩增反应且防止水分的蒸发。根据一实施方式,上盖为光学透明的,以直接侦测基板上各反应孔的影像讯号。请参看图8b,绘示根据一些实施方式的流动室示意图。流动室802内部具有一基板820,所述基板820上具有多个通孔的反应孔822。上盖830处具有一液体输入端834和下盖840处具有液体输出端836,呈相对配置。上盖830处具有一光学检测区832。图9绘示根据一些实施方式的多重核酸分析系统900。其中,流动室800放置于导热板912上,所述导热板912具有一个或(任选地)两个热电加热和冷却单元910,所述热电加热和冷却单元910经连接以调节流动室内部反应表面的温度。绝热层914任选地放置于导热板912之下。整个组件安装于x-y精密移动平台916上,所述移动平台916可调节流动室中检测视窗的扫描区域。流体系统920连接至试剂单元922,其中用于试验的所有必需试剂存储且视情况保持在指定温度下。流体系统控制来自流动室的进口和出口的试剂传输和去除,以及废液控制。检测单元930安装为直接面向流动室的光学检测区832,并且所述检测单元930能够自动地保持聚焦且能够检测用于试验中的光学标记。计算单元940进行所有控制和资料处理。根据一实施方式,导热板由良导热体制成,例如铝、铜、或其组合。根据一实施方式,检测单元为荧光显微镜,其具有多个滤光片,以用于不同的激发和发射光谱。检测单元包含ccd成像照相机。在一些实施方式中,多于一个流动室可安装于上述系统上,以最佳化系统效率且提供样品分析的灵活性。在此种系统上,可为不同的流动室设计程式,以运行不同的试验。例如,可在系统上的一个流动室中运行依序探针连接反应作用,同时可在系统上的另一个流动室中处理荧光成像。也可包括大于一个流体控制单元或检测单元。本揭示内容的有益效果。现有技术中,将乳胶微滴进行数字pcr并将扩增子固定于磁珠的方式,由于磁场作用可能会造成部分磁珠的聚集过密,以致影响影像分析。本揭示内容的实施方式,提供了提高影像准确度和精确度的方法。通过物理性隔绝的反应孔,个别模板分子于反应孔内做原位扩增及辨识标识码,荧光讯号于每一次连接反应中,皆是位于相互分隔的各反应孔内,因此提升了标识码检测时讯号的判读能力。将基板上的各个反应孔配置为物理性相互隔绝的,可更佳地调控检测过程和更佳地量化样品体积,因此个别pcr反应结果更为可靠。本揭示内容的实施方式,由于基板上的反应孔位置及参数为固定的或预先确定的,并且可根据检测需求调整选择合适的反应孔的大小、数目、容积,例如,各个反应孔容积可为相同或不同。因此有利于进行多重目标序列的自动化检测。先前技术中,以乳胶微滴进行数字pcr,并以带有引物的微珠或磁珠作克隆扩增,此方法在样品液分配阶段,部分的反应位点可能没有微珠或磁珠分布,因此造成伪阴性的结果。相对而言,本揭示内容的实施方式的另一优点在于克隆扩增时,以固定于反应孔内的引物将扩增子固定于反应内,因此可在克隆扩增时,确保各反应孔内皆有适量或足够的引物的存在。本揭示内容的另一有益效果在于侦测标识码讯号时,不需先经解码的步骤以确定目标分子的位置,可直接由标识码的检测讯号,判断所编码的相应目标序列的序列状态。虽然本发明已以实施方式揭露如上,然其并非用以限定本发明,任何熟悉此技艺者,在不脱离本发明的精神和范围内,当可作各种的更动与润饰,因此本发明的保护范围当视所附的权利要求书所界定的范围为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1