中位吡咯桥连的卟啉阵列及其合成方法与流程
本发明涉及化学合成技术领域,特别是涉及一种中位吡咯桥连的卟啉阵列及其合成方法。
背景技术:
卟啉是一类由四个吡咯经α碳原子与四个次甲基(ch)桥连而成的大环化合物。最简单的卟啉为卟吩,含有取代基的卟吩则为卟啉。卟啉环含有18个离域的π电子,卟啉具有芳香性。卟啉是高度共轭的大环体系,在可见光区域通常有很强的吸收,卟啉类化合物大都为深色;希腊语中porphyros意指紫色,卟啉(porphyrin)一词由此而来。卟啉类化合物具有独特的结构和优越的物理化学性能,在药物化学、生物化学、超分子化学和材料化学等领域均有广泛应用。
卟啉阵列是通过桥接分子或键组装而成的多卟啉体系。卟啉阵列的构筑方法主要包括非共价组装与共价组装两种方式,前者相对容易但构筑的阵列稳定性较差,后者相对较难但构筑的阵列稳定性较好。根据卟啉桥连位置的差异可以将卟啉阵列分为以下三类:meso-meso桥连的卟啉阵列(也叫中位桥连的卟啉阵列);meso-β桥连的卟啉阵列以及β-β桥连的卟啉阵列。中位桥连的卟啉阵列通常通过中位乙炔基,丁二炔基或芳香基团连接,但是吡咯桥连的卟啉阵列还鲜有报道。具有特定构型的卟啉阵列在光电器件、传感器、非线性光学(nlo)材料、光动力治疗染料、染料敏化太阳能电池和光合作用体系模拟等方面有着较好的应用前景,因此,开发新型的特殊结构的卟啉阵列具有重有意义。
技术实现要素:
基于此,本发明提供了一种新型的中位吡咯桥连的卟啉阵列。
具体技术方案如下:
一种具有式(i)所示结构的中位吡咯桥连的卟啉阵列:
一种具有式(ii)所示结构的中位吡咯桥连的卟啉阵列:
其中,m为金属原子;n大于或等于1。
在其中一些实施例中,式(i)中的n为1、2、3、4、5、6或7;式(ii)中的n’为1、2、3、4、5、6或7,m为ni或zn。
本发明还提供了上述中位吡咯桥连的卟啉阵列的合成方法。
具体技术方案如下:
一种上述的中位吡咯桥连的卟啉阵列的合成方法,包括以下步骤:
步骤a:化合物1与n-溴代琥珀酰亚胺反应得到化合物2和化合物3的混合物;
步骤b:化合物2和化合物3的混合物在催化剂以及碱的作用下与2,5-二硼代吡咯发生铃木偶联反应,得到所述式(i)化合物,其中,n为1或者2;
步骤c:步骤b中制备得到的所述式(i)化合物在碱的存在下与二碳酸二叔丁酯反应,得到式(iii)化合物,其中,m为1或者2;
步骤d:步骤c中制备得到的式(iii)化合物与n-溴代琥珀酰亚胺反应得到式(iv)化合物,其中,m’为1或者2;
步骤e:步骤d中制备得到的式(iv)化合物在催化剂以及碱的作用下与2,5-二硼代吡咯发生铃木偶联反应,得到式(iii)化合物,其中,m为3、4或5;
步骤f:将步骤e中制备得到的式(iii)化合物脱去boc保护,得到所述式(i)化合物,其中,n为3、4或5;
步骤g:步骤b或者步骤f中制备得到的式(i)化合物与m(oac)2·xh2o反应,得到所述式(ii)化合物,其中n’为1、2、3、4或5;m(oac)2·xh2o中的m是指金属原子,x为水合分子的数目;
以所述式(iii)化合物为原料,重复步骤d、步骤e和步骤f,得到n为6或7的式(i)化合物,或者n大于7的式(i)化合物;再重复步骤g,得到n’为6或7的式(ii)化合物,或者n’大于7的式(ii)化合物;
反应路线如下:
在其中一些实施例中,步骤b和步骤e中所述催化剂为摩尔比为1:4的pd2(dba)3和三苯基磷,所述碱为摩尔比为1:0.8-1.2的碳酸铯和氟化铯。
在其中一些实施例中,步骤c中所述碱为4-二甲氨基吡啶。
在其中一些实施例中,步骤a和步骤d中的反应溶剂为三氯甲烷。
在其中一些实施例中,步骤b和步骤e中的反应溶剂为甲苯和n,n-二甲基甲酰胺的混合溶液。
在其中一些实施例中,步骤c中的反应溶剂为四氢呋喃。
在其中一些实施例中,步骤f中的反应溶剂为对二甲苯。
在其中一些实施例中,步骤a和步骤d中的反应条件包括:在冰水浴条件下反应1-3小时。
在其中一些实施例中,步骤b和步骤e中的反应条件包括:在惰性气体保护以及加热回流的条件下反应40-50小时。
在其中一些实施例中,步骤c中的反应条件包括:在惰性气体保护以及室温条件下反应1-3小时。
在其中一些实施例中,步骤f中的所述脱去boc保护的方法包括:将式(iii)化合物在溶剂中搅拌60-80小时,温度为130-150℃。
在其中一些实施例中,步骤a中所述化合物1与n-溴代琥珀酰亚胺的摩尔比为1:1-1.5,步骤d中所述式(iii)化合物与n-溴代琥珀酰亚胺的摩尔比为1:0.8-1.2。
在其中一些实施例中,步骤b中所述化合物2和化合物3的混合物、吡咯二硼、催化剂和碱的摩尔比:1.8-2.2:1:0.08-0.12:1.8-2.2,步骤e中所述式(iv)化合物、吡咯二硼、催化剂和碱的摩尔比:1.8-2.2:1:0.08-0.12:1.8-2.2。
在其中一些实施例中,步骤c中所述式(i)化合物、碱和二碳酸二叔丁酯的摩尔比为1:1.2-1.8:8-12。
在其中一些实施例中,当m为zn时,步骤g包括:所述式(i)化合物与过量的zn(oac)2·2h2o在室温下搅拌反应10-14小时,得到所述式(ii)化合物,所用反应溶剂为二氯甲烷和甲醇的混合溶液;当m为ni时,步骤g包括:所述式(i)化合物与过量的ni(oac)2·4h2o回流反应20-28小时,得到所述式(ii)化合物,所用反应溶剂为甲苯。
本发明的中位吡咯桥连的卟啉阵列及其合成方法具有以下优点有有益效果:
本发明制备得到了一系列结构新颖的中位吡咯桥连的卟啉阵列,因为吡咯具有富电子性,能与卟啉阵列分子中的其他部分形成有效的共轭,并且可以形成氢键,并且吡咯分子存在胺型及亚胺型两种互变异构,所以用吡咯作为桥来构筑的卟啉阵列在光电器件,传感器,光伏器件,非线性光学材料和光动力疗法染料等领域具有潜在的应用价值。另外,本发明的中位吡咯桥连的卟啉阵列具有较高的荧光量子产率,其荧光量子产率在0.15%-3.6%之间,可用于制备荧光材料。
本发明提供的中位吡咯桥连的卟啉阵列的制备方法具有产物易分离,且收率较高的优点。本发明的发明人在实验过程中发现,在对吡咯桥连的卟啉低聚物的中位进行溴代反应时,所得产物混合物中通常同时含有单溴代产物与二溴代产物和未反应的原料,这类化合物溶解性极差,很难分离,很难得到纯的单溴代产物,如果直接以混合物进行反应就会得到多种反应产物,成分复杂,也会增加产物的分离难度,同时会降低目标产物的收率。发明人因此对制备方法进行了改进,用boc酸酐对吡咯桥连卟啉阵列进行保护后再用nbs溴代,发现溴代boc酸酐保护的卟啉阵列具有较好的溶解性,有利于产物的分离,可以较容易的分离得到单溴代卟啉阵列,并且可以通过控制nbs的加入量,较高产率的得到单溴代卟啉阵列。以单溴代卟啉阵列进行铃木偶联反应可以得到产物单一的目标产物,产物较易分离,且收率较高。
附图说明
图1为卟啉阵列的紫外/可见吸收光谱图;
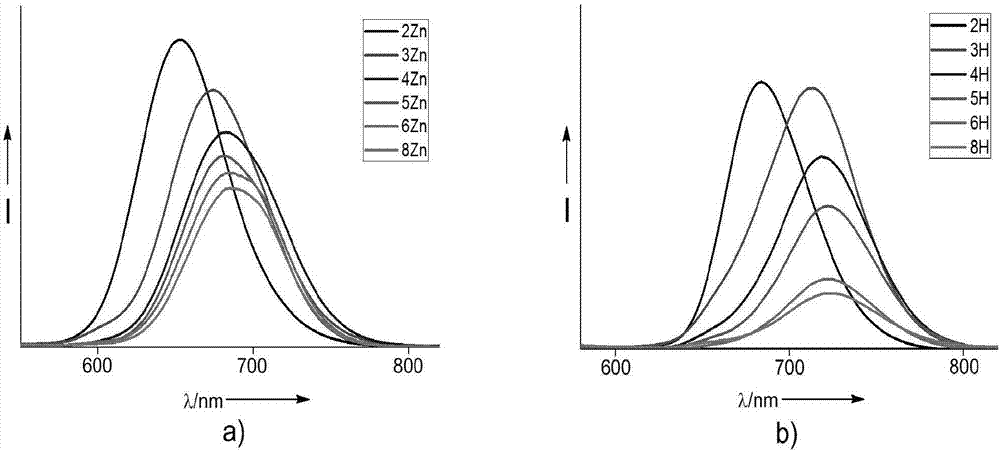
图2为卟啉阵列的荧光发射光谱图。
具体实施方式
以下结合具体实施例对本发明的中位吡咯桥连的卟啉阵列及其合成方法做进一步详细的说明。
实施例1
步骤a:单溴代卟啉和二溴代卟啉的制备
在冰水浴的条件下,将化合物1(300mg,0.436mmol)加入500ml圆底烧瓶中,用300ml三氯甲烷溶解,在搅拌下缓慢滴加用三氯甲烷溶解的n-溴代琥珀酰亚胺(nbs)(101mg,0.567mmol)溶液,反应2小时。反应后,向反应液中加入2ml丙酮淬灭反应。旋转蒸发回收溶剂,所得残余物为化合物2(二溴代卟啉,记为-2br,24%)、化合物3(单溴代卟啉,记为-1br,75%)和化合物1(卟啉原料,1%)的混合物,不经分离直接用于下一步反应。
步骤b:卟啉二聚体和卟啉三聚体的制备
向schlenk反应管中加入步骤a的反应产物(150mg,-1br75%,-2br24%)、吡咯二硼(35.1mg,0.11mmol)、pd2(dba)3(10.07mg,0.011mmol)、三苯基磷(11.53mg,0.044mmol)、碳酸铯(71.5mg,0.22mmol)和氟化铯(33.44mg,0.22mmol),用注射器加入甲苯(3ml)与dmf(1.5ml)。反应体系经三次冷冻-抽真空-解冻循环除氧后充入氩气保护,在加热回流条件下反应48h。冷却后,反应液用三氯甲烷溶液稀释,水洗两遍,再经无水硫酸钠干燥。旋蒸回收溶剂,残余物用硅胶柱层析分离提纯(二氯甲烷/正己烷洗脱),最后用二氯甲烷/甲醇重结晶,得到式(i)化合物(卟啉二聚体和卟啉三聚体,n分别为1和2,分别记为2h和3h),其中得红色固体2h(79mg,0.0549mmol,50%yield)和深绿色固体3h(30mg,0.0137mmol,18%yield)。
2h:1hnmr(500mhz,cdcl3):δ=10.44(s,1h,pyrrole-nh),10.24(s,2h,meso-h),9.72(d,4h,j=5.0hz,β-h),9.37(d,4h,j=5.0hz,β-h),9.12(d,4h,j=5.0hz,β-h),9.10(d,4h,j=5.0hz,β-h),8.16(d,8h,j=1.5hz,ar-o-h),7.86(m,4h,ar-p-h),7.82(d,2h,j=2.5hz,pyrrole-β-h),1.56(s,72h,t-bu-h),and-2.73(s,4h,nh)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=411(341000),511(30000),576(20000),654(12000)nm;hr-ms(maldi-tof-ms):m/z=1436.8811,calcdfor(c100h109n9)+=1436.8832([m]+).fluorescence(ch2cl2,λex=417nm):λmax=684nm,φf=1.2%.
3h:1hnmr(500mhz,cdcl3):δ=10.43(s,2h,pyrrole-nh),10.25(s,2h,meso-h),9.70(d,4h,j=5.0hz,β-h),9.67(d,4h,j=5.0hz,β-h),9.37(d,4h,j=5.0hz,β-h),9.12(d,4h,j=5.0hz,β-h),9.10(d,4h,j=5.0hz,β-h),9.05(d,4h,j=5.0hz,β-h),8.16(d,8h,j=1.5hz,ar-o-h),8.14(d,4h,j=1.5hz,ar-o-h),7.86(m,4h,ar-p-h),7.84(m,2h,ar-p-h),7.83(d,4h,j=2.5hz,pyrrole-β-h),1.56(s,72h,t-bu-h),1.53(s,36h,t-bu-h),-2.29(s,2h,nh),and-2.73(s,2h,nh)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=412(456000),514(47000),586(37000),670(21000),780(15000)nm;hr-ms(maldi-tof-ms):m/z=2186.3269,calcdfor(c152h164n14)+=2186.3290([m]+).fluorescence(ch2cl2,λex=417nm):λmax=713nm,φf=0.53%.
步骤c:boc-保护的卟啉二聚体(记为boc-2h)和boc-保护的卟啉三聚体(记为boc-3h)的制备
boc-3h:向schlenk反应管中加入3h(100mg,0.0457mmol),4-二甲氨基吡啶(8.4mg,0.0685mmol)和二碳酸二叔丁酯(100mg,0.457mmol),体系经多次抽真空-充氩气循环除氧,用注射器加入5ml的四氢呋喃作为溶剂。充入氩气保护,室温下搅拌反应2h。旋转蒸发回收溶剂,残余物用二氯甲烷/甲醇重结晶,得100%产率的红色固体boc-3h。
以2h为原料用同样的方法可以制备得到100%产率的boc-2h。
boc-3h:1hnmr(500mhz,cdcl3):δ=10.24(d,2h,j=5.0hz,meso-h),9.54(m,4h,β-h),9.50(s,4h,β-h),9.36(m,4h,β-h),9.10(m,8h,β-h),9.04(d,4h,j=5.0hz,β-h),8.25(s,1h,ar-o-h),8.20(d,4h,j=1.5hz,ar-o-h),8.12(d,2h,j=1.5hz,ar-o-h),8.08(s,2h,ar-o-h),8.06(s,2h,ar-o-h),7.97(s,1h,ar-o-h),7.83(m,6h,ar-p-h),7.63(m,4h,pyrrole-β-h),1.54(s,72h,t-bu-h),1.53(s,36h,t-bu-h),-0.75(s,9h,boc-t-bu-h),-0.81(s,9h,boc-t-bu-h),-2.30(s,2h,nh),and-2.70(s,4h,nh)ppm.
步骤d:单溴代卟啉二聚体(记为2h-1br)、单溴代卟啉三聚体(记为3h-1br)boc-保护的单溴代卟啉二聚体(记为boc-2h-1br)和boc-保护的单溴代卟啉三聚体(记为boc-3h-1br)的制备
2h-1br:在冰水浴中,将2h(150mg,0.104mmol)加入500ml圆底烧瓶中,用300ml三氯甲烷溶解,在搅拌下缓慢滴加用三氯甲烷溶解的nbs(18.5mg,0.104mmol)溶液。反应2小时。反应后,向反应液中加入2ml丙酮淬灭反应。旋转蒸发回收溶剂,残余物用硅胶柱层析分离提纯(二氯甲烷/正己烷洗脱),用二氯甲烷/甲醇重结晶,得深绿色固体,2h-1br(94.6mg,0.0624mmol,60%yield)。
以3h为原料用同样的方法制备3h-1br,发现所得产物中同时存在3h-1br和3h-2br,其溶解度均很低,试用了各种分离方法都很难分离得到单一的3h-1br产物。
boc-3h-1br:在冰水浴中,将boc-3h(100mg,0.0424mmol)加入500ml圆底烧瓶中,用300ml三氯甲烷溶解,在搅拌下缓慢滴加用三氯甲烷溶解的nbs(7.56mg,0.0424mmol)溶液,反应2小时。反应后加入2ml丙酮淬灭反应。旋转蒸发回收溶剂,残余物用硅胶柱层析分离提纯(二氯甲烷/正己烷洗脱),再用二氯甲烷/甲醇重结晶,得深红色固体boc-3h-1br(57.8mg,0.0237mmol,56%yield)。
以boc-2h为原料用同样的方法可以制备得到boc-2h-1br,其收率为70%,高于以2h为原料用同样的方法制备得到的2h-1br的收率;并且相比于以2h为原料,以boc-2h为原料制备得到的产物更易分离。
2h-1br:1hnmr(500mhz,cdcl3):δ=10.36(s,1h,pyrrole-nh),10.23(s,1h,meso-h),9.67(d,2h,j=5.0hz,β-h),9.64(d,2h,j=5.0hz,β-h),9.60(s,2h,β-h),9.35(d,2h,j=5.0hz,β-h),9.08(m,4h,β-h),8.97(d,2h,j=5.0hz,β-h),8.94(d,2h,j=5.0hz,β-h),8.13(d,4h,j=1.5hz,ar-o-h),8.07(d,4h,j=1.5hz,ar-o-h),7.82(d,4h,j=1.5hz,ar-p-h),7.77(m,2h,pyrrole-β-h),1.54(s,36h,t-bu-h),1.53(s,36h,t-bu-h),-2.50(s,2h,nh),and-2.78(s,2h,nh)ppm.
boc-3h-1br:1hnmr(500mhz,cdcl3):δ=10.24(d,1h,j=5.0hz,meso-h),9.71(m,2h,β-h),9.56(s,2h,β-h),9.52(s,2h,β-h),9.47(s,4h,β-h),9.36(m,2h,β-h),9.11(m,4h,β-h),9.05(m,4h,β-h),8.98(m,4h,β-h),8.27(m,1h,ar-o-h),8.22(m,2h,ar-o-h),8.15(m,2h,ar-o-h),8.13(d,2h,j=1.5hz,ar-o-h),8.10(m,2h,ar-o-h),8.04(m,2h,ar-o-h),7.99(m,1h,ar-o-h),7.85(m,6h,ar-p-h),7.61(m,4h,pyrrole-β-h),1.54(s,36h,t-bu-h),1.53(s,72h,t-bu-h),-0.69(s,5h,boc-t-bu-h),-0.73(s,9h,boc-t-bu-h),-0.80(s,4h,boc-t-bu-h),-2.30(s,2h,nh),-2.45(s,2h,nh),and-2.69(s,2h,nh)ppm.
步骤e:卟啉四聚体(记为4h)、boc-保护的卟啉四聚体(记为boc-4h)、boc-保护的卟啉五聚体(记为boc-5h)和boc-保护的卟啉六聚体(记为boc-6h)的制备
4h:向schlenk反应管中加入2h-1br(100mg,0.066mmol)、吡咯二硼(10.53mg,0.033mmol)、pd2(dba)3(3.02mg,0.0033mmol)、三苯基膦(3.46mg,0.0132mmol)、碳酸铯(21.45mg,0.066mmol)、氟化铯(10.03mg,0.066mmol),用注射器加入甲苯(2ml)与dmf(1ml)。反应体系经三次冷冻-抽真空-解冻循环除氧后充入氩气保护,在加热回流条件下反应48h。冷却后,反应液用三氯甲烷溶液稀释,水洗两遍,再经无水硫酸钠干燥。旋蒸回收溶剂,残余物用硅胶柱层析分离提纯(二氯甲烷/正己烷洗脱),最后用二氯甲烷/甲醇重结晶,得深绿色固体4h(67.8mg,70%)。
4h:1hnmr(500mhz,cdcl3):δ=10.42(s,2h,pyrrole-nh),10.41(s,1h,pyrrole-nh),10.23(s,2h,meso-h),9.69(d,4h,j=5.0hz,β-h),9.65(d,4h,j=5.0hz,β-h),9.64(d,4h,j=5.0hz,β-h),9.36(d,4h,j=5.0hz,β-h),9.11(d,4h,j=5.0hz,β-h),9.09(d,4h,j=5.0hz,β-h),9.04(d,8h,j=5.0hz,β-h),8.15(d,8h,j=1.5hz,ar-o-h),8.13(d,8h,j=1.5hz,ar-o-h),7.85(m,4h,ar-p-h),7.82(m,10h,4hforar-p-hand6hforpyrrole-β-h),1.56(s,72h,t-bu-h),1.53(s,72h,t-bu-h),-2.30(s,4h,nh),and-2.74(s,4h,nh)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=413(492000),515(54000),588(51000),676(32000),781(15000)nm;hr-ms(maldi-tof-ms):m/z=2936.7752,calcdfor(c204h219n19)+=2936.7779([m]+);fluorescence(ch2cl2,λex=417nm):λmax=718nm,φf=0.43%.
boc-5h:向schlenk反应管中加入2h-1br(92.48mg,0.061mmol)、boc-3h-1br(150mg,0.061mmol)、吡咯二硼(19.46mg,0.061mmol)、pd2(dba)3(5.58mg,0.0061mmol)、三苯基膦(6.39mg,0.0244mmol)、碳酸铯(39.65mg,0.122mmol)、氟化铯(18.54mg,0.122mmol),用注射器加入甲苯(2ml)与dmf(1ml)。体系经三次冷冻-抽真空-解冻循环除氧后充入氩气保护,在加热回流条件下反应48h。冷却后,反应液用三氯甲烷溶液稀释,水洗两遍,再经无水硫酸钠干燥。旋蒸回收溶剂,得到混合物先用步骤c的方法经过-boc基团保护再进行分离。残余物用gpc(三氯甲烷洗脱)和硅胶柱层析分离提纯(二氯甲烷/正己烷洗脱),最后用二氯甲烷/甲醇重结晶,得红色固体boc-5h(65mg,26.1%)。本实施例中的2h-1br可以用boc-2h-1br代替。
boc-5h:1hnmr(500mhz,cdcl3):δ=10.26(m,2h,meso-h),9.57(s,4h,β-h),9.53(s,12h,β-h),9.38(m,4h,β-h),9.13(m,12h,β-h),9.08(m,8h,β-h),8.29-8.01(m,20h,ar-o-h),7.86(m,10h,ar-p-h),7.65(m,8h,pyrrole-β-h),1.54(s,72h,t-bu-h),1.53(s,108h,t-bu-h),-0.73(m,36h,boc-t-bu-h),-2.28(s,6h,nh),and-2.69(s,4h,nh)ppm.
boc-6h:向schlenk反应管中加入boc-3h-1br(100mg,0.041mmol)、吡咯二硼(6.54mg,0.0205mmol)、pd2(dba)3(1.86mg,0.00205mmol)、三苯基膦(2.1mg,0.0082mmol)、碳酸铯(13.33mg,0.041mmol)、氟化铯(6.23mg,0.041mmol),用注射器加入甲苯(2ml)与dmf(1ml)。体系经三次冷冻-抽真空-解冻循环除氧后充入氩气保护,在加热回流条件下反应48h。冷却后,反应液用三氯甲烷溶液稀释,水洗两遍,再经无水硫酸钠干燥。旋蒸回收溶剂,得到混合物先用步骤c的方法经过-boc基团保护再分离。残余物用gpc(氯仿洗脱)和硅胶柱层析分离提纯(二氯甲烷/正己烷洗脱),最后用二氯甲烷/甲醇重结晶,得红色固体boc-6h(64mg,63%)。
boc-6h:1hnmr(500mhz,cdcl3):δ=10.25(m,2h,meso-h),9.55(s,4h,β-h),9.51(s,16h,β-h),9.36(m,4h,β-h),9.10(m,8h,β-h),9.06(s,16h,β-h),8.27-8.00(m,24h,ar-o-h),7.84(m,12h,ar-p-h),7.63(m,10h,pyrrole-β-h),1.55(s,72h,t-bu-h),1.54(s,144h,t-bu-h),-0.76(m,45h,boc-t-bu-h),-2.29(s,8h,nh),and-2.70(s,4h,nh)ppm.
以boc-2h-1br为原料用同样的方法可以制备得到boc-4h。或者以4h为原料利用步骤c的方法可以制备得到boc-4h。
boc-4h:1hnmr(500mhz,cdcl3):δ=10.23(m,2h,meso-h),9.54(m,4h,β-h),9.50(s,8h,β-h),9.35(m,4h,β-h),9.10(m,8h,β-h),9.04(m,4h,β-h),8.25(s,2h,ar-o-h),8.20(s,4h,ar-o-h),8.13(m,4h,ar-o-h),8.08(m,4h,ar-o-h),7.99(m,2h,ar-o-h),7.83(m,8h,ar-p-h),7.61(m,6h,pyrrole-β-h),1.54(s,72h,t-bu-h),1.53(s,72h,t-bu-h),-0.78(m,27h,boc-t-bu-h),-2.31(s,4h,nh),and-2.71(s,4h,nh)ppm.
步骤f:卟啉四聚体(记为4h)、卟啉五聚体(记为5h)和卟啉六聚体(6h)的制备
5h:向schlenk反应管中加入boc-5h(65mg,0.016mmol),再加入10ml对二甲苯作溶剂,于140℃下搅拌72h,旋转蒸发回收对二甲苯溶剂,用二氯甲烷/甲醇重结晶,得绿色固体5h,产率100%。
分别以boc-4h和boc-6h为原料用同样的方法制备得到4h和6h,产率均为100%。
4h:1hnmr(500mhz,cdcl3):δ=10.42(s,2h,pyrrole-nh),10.41(s,1h,pyrrole-nh),10.23(s,2h,meso-h),9.69(d,4h,j=5.0hz,β-h),9.65(d,4h,j=5.0hz,β-h),9.64(d,4h,j=5.0hz,β-h),9.36(d,4h,j=5.0hz,β-h),9.11(d,4h,j=5.0hz,β-h),9.09(d,4h,j=5.0hz,β-h),9.04(d,8h,j=5.0hz,β-h),8.15(d,8h,j=1.5hz,ar-o-h),8.13(d,8h,j=1.5hz,ar-o-h),7.85(m,4h,ar-p-h),7.82(m,10h,4hforar-p-hand6hforpyrrole-β-h),1.56(s,72h,t-bu-h),1.53(s,72h,t-bu-h),-2.30(s,4h,nh),and-2.74(s,4h,nh)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=413(492000),515(54000),588(51000),676(32000),781(15000)nm;hr-ms(maldi-tof-ms):m/z=2936.7752,calcdfor(c204h219n19)+=2936.7779([m]+);fluorescence(ch2cl2,λex=417nm):λmax=718nm,φf=0.43%.
5h:1hnmr(500mhz,cdcl3):δ=10.41(s,2h,pyrrole-nh),10.40(s,2h,pyrrole-nh),10.22(s,2h,meso-h),9.67(d,4h,j=5.0hz,β-h),9.62(m,12h,β-h),9.35(d,4h,j=5.0hz,β-h),9.09(d,4h,j=5.0hz,β-h),9.07(d,4h,j=5.0hz,β-h),9.02(d,12h,j=5.0hz,β-h),8.13(m,20h,ar-o-h),7.82(m,18h,10hforar-p-hand8hforpyrrole-β-h),1.54(s,72h,t-bu-h),1.51(s,108h,t-bu-h),-2.32(s,6h,nh),and-2.77(s,4h,nh)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=413(385000),516(50000),590(41000),678(28000)nm;hr-ms(maldi-tof-ms):m/z=3686.2212,calcdfor(c256h274n24)+=3686.2237([m]+);fluorescence(ch2cl2,λex=417nm):λmax=721nm,φf=0.24%.
6h:1hnmr(500mhz,cdcl3):δ=10.41(m,5h,pyrrole-nh),10.22(s,2h,meso-h),9.66(d,4h,j=5.0hz,β-h),9.62(m,20h,β-h),9.35(d,4h,j=5.0hz,β-h),9.09(d,4h,j=5.0hz,β-h),9.07(d,4h,j=5.0hz,β-h),9.01(d,16h,j=5.0hz,β-h),8.12(m,24h,ar-o-h),7.80(m,22h,12hforar-p-hand10hforpyrrole-β-h),1.54(s,72h,t-bu-h),1.51(s,144h,t-bu-h),-2.33(s,8h,nh),and-2.78(s,4h,nh)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=415(214000),513(81000),593(51000),684(46000)nm;hr-ms(maldi-tof-ms):m/z=4436.6701,calcdfor(c308h329n29)+=4436.6726([m]+);fluorescence(ch2cl2,λex=417nm):λmax=722nm,φf=0.23%.
步骤g:ni卟啉阵列与zn卟啉阵列的制备
2zn:将2h(20mg,0.0139mmol)加入到50ml圆底烧瓶中,加入10ml二氯甲烷和2ml甲醇使之溶解,加入zn(oac)2·2h2o(40mg,0.182mmol),室温下搅拌12h,将反应液过短硅胶柱除去未反应的zn(oac)2·2h2o,用二氯甲烷洗脱,旋蒸回收溶剂,用二氯甲烷/甲醇重结晶,以100%的产率得到卟啉二聚体的zn卟啉阵列(记为2zn)。
分别以3h,4h,5h,6h为原料,用同样的方法制备得到3zn,4zn,5zn,6zn,产率均为100%。
2zn:1hnmr(500mhz,cdcl3):δ=10.38(s,1h,pyrrole-nh),10.28(s,2h,meso-h),9.82(d,4h,j=5.0hz,β-h),9.42(d,4h,j=5.0hz,β-h),9.20(d,4h,j=5.0hz,β-h),9.17(d,4h,j=5.0hz,β-h),8.13(d,8h,j=1.5hz,ar-o-h),7.83(m,4h,ar-p-h),7.76(d,2h,j=2.5hz,pyrrole-β-h),and1.54(s,72h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=412(337000),546(33000),600(15000)nm;hr-ms(maldi-tof-ms):m/z=1563.7013,calcdfor(c100h150n9zn2)+=1563.7032([m]+).fluorescence(ch2cl2,λex=417nm):λmax=653nm,φf=3.6%.
3zn:1hnmr(500mhz,cdcl3):δ=10.38(s,2h,pyrrole-nh),10.28(s,2h,meso-h),9.82(d,4h,j=5.0hz,β-h),9.79(d,4h,j=5.0hz,β-h),9.42(d,4h,j=5.0hz,β-h),9.19(d,4h,j=5.0hz,β-h),9.16(d,4h,j=5.0hz,β-h),9.15(d,4h,j=5.0hz,β-h),8.13(d,12h,j=1.5hz,ar-o-h),7.82(m,6h,ar-p-h),7.76(d,4h,j=2.5hz,pyrrole-β-h),1.54(s,72h,t-bu-h),and1.52(s,36h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=413(498000),548(57000),619(37000)nm;hr-ms(maldi-tof-ms):m/z=2377.0671,calcdfor(c152h158n14zn3)+=2377.0683([m]+).fluorescence(ch2cl2,λex=417nm):λmax=674nm,φf=1.9%.
4zn:1hnmr(500mhz,cdcl3):δ=10.37(s,3h,pyrrole-nh),10.28(s,2h,meso-h),9.81(d,4h,j=5.0hz,β-h),9.78(m,8h,β-h),9.42(d,4h,j=5.0hz,β-h),9.19(d,4h,j=5.0hz,β-h),9.16(d,4h,j=5.0hz,β-h),9.15(d,8h,j=5.0hz,β-h),8.13(d,8h,j=1.5hz,ar-o-h),8.12(d,8h,j=1.5hz,ar-o-h),7.81(m,8h,ar-p-h),7.76(d,6h,j=2.5hz,pyrrole-β-h),1.54(s,72h,t-bu-h),and1.52(s,72h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=414(556000),549(57000),623(55000)nm;hr-ms(maldi-tof-ms):m/z=3190.4233,calcdfor(c204h211n19zn4)+=3190.4253([m]+);fluorescence(ch2cl2,λex=417nm):λmax=683nm,φf=1.2%.
5zn:1hnmr(500mhz,cdcl3):δ=10.38(s,4h,pyrrole-nh),10.28(s,2h,meso-h),9.82(d,4h,j=5.0hz,β-h),9.79(m,12h,β-h),9.43(d,4h,j=5.0hz,β-h),9.20(d,4h,j=5.0hz,β-h),9.16(m,16h,β-h),8.13(m,20h,ar-o-h),7.83(m,10h,ar-p-h),7.77(d,8h,j=2.5hz,pyrrole-β-h),1.55(s,72h,t-bu-h),and1.53(s,108h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=414(484000),550(63000),624(58000)nm;hr-ms(maldi-tof-ms):m/z=4003.7823,calcdfor(c256h264n24zn5)+=4003.7847([m]+);fluorescence(ch2cl2,λex=417nm):λmax=681nm,φf=1.2%.
6zn:1hnmr(500mhz,cdcl3):δ=10.36(m,5h,pyrrole-nh),10.28(s,2h,meso-h),9.81(d,4h,j=5.0hz,β-h),9.79(m,16h,β-h),9.42(d,4h,j=5.0hz,β-h),9.19(d,4h,j=5.0hz,β-h),9.16(m,20h,β-h),8.13(m,24h,ar-o-h),7.82(m,12h,ar-p-h),7.76(d,10h,j=2.5hz,pyrrole-β-h),1.54(s,72h,t-bu-h),and1.51(s,144h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=415(311000),552(41000),630(40000)nm;hr-ms(maldi-tof-ms):m/z=4817.1421,calcdfor(c308h317n29zn6)+=4817.1442([m]+);fluorescence(ch2cl2,λex=417nm):λmax=685nm,φf=0.92%.
2ni:将2h(20mg,0.0139mmol)加入到50ml圆底烧瓶中,加入10ml甲苯使之溶解,再加入ni(oac)2·4h2o(40mg,0.161mmol),回流反应24h,冷却后将反应液通过氧化铝柱除去未反应的ni(oac)2·4h2o,用二氯甲烷/甲醇重结晶,以100%的产率得到卟啉二聚体的ni卟啉阵列(记为2ni)。
分别以3h,4h,5h,6h为原料,用同样的方法制备得到3ni,4ni,5ni,6ni产率均为100%。
2ni:1hnmr(500mhz,cdcl3):δ=9.82(s,2h,meso-h),9.77(s,1h,pyrrole-nh),9.47(d,4h,j=5.0hz,β-h),9.13(d,4h,j=5.0hz,β-h),8.93(d,4h,j=5.0hz,β-h),8.92(d,4h,j=5.0hz,β-h),7.90(d,8h,j=1.5hz,ar-o-h),7.75(m,4h,ar-p-h),7.56(d,2h,j=2.5hz,pyrrole-β-h),and1.55(s,72h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=409(205000),528(32000),580(12000)nm;hr-ms(maldi-tof-ms):m/z=1549.7180,calcdfor(c100h105n9ni2)+=1549.7158([m]+).
3ni:1hnmr(500mhz,cdcl3):δ=9.84(s,2h,meso-h),9.77(s,2h,pyrrole-nh),9.48(d,4h,j=5.0hz,β-h),9.43(d,4h,j=5.0hz,β-h),9.15(d,4h,j=5.0hz,β-h),8.95(m,8h,β-h),8.89(d,4h,j=5.0hz,β-h),7.92(d,8h,j=1.5hz,ar-o-h),7.89(d,4h,j=1.5hz,ar-o-h),7.76(m,4h,ar-p-h),7.74(m,2h,ar-p-h),7.59(d,4h,j=2.5hz,pyrrole-β-h),1.50(s,72h,t-bu-h),and1.47(s,36h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=410(286000),532(47000),596(22000)nm;hr-ms(maldi-tof-ms):m/z=2356.0900,calcdfor(c152h158n14ni3)+=2356.0866([m]+).
4ni:1hnmr(500mhz,cdcl3):δ=9.82(s,2h,meso-h),9.75(s,2h,pyrrole-nh),9.73(s,1h,pyrrole-nh),9.46(d,4h,j=5.0hz,β-h),9.41(d,4h,j=5.0hz,β-h),9.39(d,4h,j=5.0hz,β-h),9.13(d,4h,j=5.0hz,β-h),8.94(d,4h,j=5.0hz,β-h),8.93(d,4h,j=5.0hz,β-h),8.86(m,8h,β-h),7.90(d,8h,j=1.5hz,ar-o-h),7.87(d,8h,j=1.5hz,ar-o-h),7.74(m,4h,ar-p-h),7.72(m,4h,ar-p-h),7.57(d,6h,j=2.5hz,pyrrole-β-h),1.48(s,72h,t-bu-h),and1.45(s,72h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=412(323000),533(61000),595(33000)nm.hr-ms(maldi-tof-ms):m/z=3162.4550,calcdfor(c204h211n19ni4)+=3162.4522([m]+).
5ni:1hnmr(500mhz,cdcl3):δ=9.82(s,2h,meso-h),9.74(s,4h,pyrrole-nh),9.46(d,4h,j=5.0hz,β-h),9.40(m,12h,β-h),9.13(d,4h,j=5.0hz,β-h),8.94(m,8h,β-h),8.85(s,12h,β-h),7.89(s,8h,ar-o-h),7.87(s,12h,ar-o-h),7.73(s,4h,ar-p-h),7.71(s,6h,ar-p-h),7.57(d,8h,j=2.5hz,pyrrole-β-h),1.47(s,72h,t-bu-h),and1.44(s,108h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=413(272000),535(51000),600(32000)nm;hr-ms(maldi-tof-ms):m/z=3969.8202,calcdfor(c256h264n24ni5)+=3969.8174([m]+).
6ni:1hnmr(500mhz,cdcl3):δ=9.82(s,2h,meso-h),9.74(m,5h,pyrrole-nh),9.45(d,4h,j=5.0hz,β-h),9.40(d,j=5.0hz,4h,β-h),9.38(d,j=5.0hz,12h,β-h),9.12(d,4h,j=5.0hz,β-h),8.92(m,8h,β-h),8.85(m,16h,β-h),7.89(d,8h,j=1.5hz,ar-o-h),7.86(m,16h,ar-o-h),7.73(m,4h,ar-p-h),7.70(m,8h,ar-p-h),7.56(d,10h,j=2.5hz,pyrrole-β-h),1.47(s,72h,t-bu-h),and1.44(s,144h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=414(148000),536(32000),607(21000)nm;hr-ms(maldi-tof-ms):m/z=4776.1880,calcdfor(c308h317n29ni6)+=4776.1835([m]+).
实施例2
以boc-4h为原料用实施例1中的步骤d的方法制备得到boc-4h-1br,再以实施例1中的步骤e的方法制备得到boc-8h,再以实施例1中的步骤f的方法制备得到8h,再以实施例1中的步骤g的方法制备得到8zn和8ni,具体如下:
boc-4h-1br:在冰水浴中,将boc-4h(150mg,0.047mmol)加入500ml圆底烧瓶中,用300ml三氯甲烷溶解,在搅拌下缓慢滴加用三氯甲烷溶液溶解的nbs(8.4mg,0.047mmol)溶液,反应2小时。反应后加入2ml丙酮将其淬灭。旋转蒸发回收溶剂,残余物用硅胶柱层析分离提纯(二氯甲烷/正己烷洗脱),用二氯甲烷/甲醇重结晶,得深红色固体boc-4h-1br(86.01mg,0.0263mmol,56%yield)。
以4h为原料用同样的方法制备4h-1br,发现所得产物中同时存在4h-1br和4h-2br,其溶解度均很低,试用了各种分离方法都很难分离得到单一的4h-1br产物。
boc-4h-1br:1hnmr(500mhz,cdcl3):δ=10.24(m,1h,meso-h),9.68(m,2h,β-h),9.50(m,12h,β-h),9.36(m,2h,β-h),9.11-8.96(m,16h,β-h),8.25-7.97(m,16h,ar-o-h),7.83(m,8h,ar-p-h),7.61(m,6h,pyrrole-β-h),1.54(s,72h,t-bu-h),1.53(s,72h,t-bu-h),-0.76(m,27h,boc-t-bu-h),-2.32(s,4h,nh),-2.50(s,2h,nh),and-2.72(s,2h,nh)ppm.
boc-8h:向schlenk反应管中加入boc-4h-1br(100mg,0.0306mmol)、吡咯二硼(4.88mg,0.0153mmol)、pd2(dba)3(1.4mg,0.00153mmol)、三苯基膦(1.6mg,0.0612mmol)、碳酸铯(9.94mg,0.0306mmol)、氟化铯(4.65mg,0.0306mmol),用注射器加入甲苯(2ml)与dmf(1ml)。体系经三次冷冻-抽真空-解冻循环除氧后充入氩气保护,在加热回流条件下反应48h。冷却后,反应液用三氯甲烷溶液稀释,水洗两遍,再经无水硫酸钠干燥。旋蒸回收溶剂,得到混合物先用实施例1步骤c的方法经过-boc基团保护再分离。残余物用gpc(氯仿洗脱)和硅胶柱层析分离提纯(二氯甲烷/正己烷洗脱),最后用二氯甲烷/甲醇重结晶,得红色固体boc-8h(67mg,66%)。
boc-8h:1hnmr(500mhz,cdcl3):δ=10.24(m,2h,meso-h),9.54-9.36(m,32h,β-h),9.10-9.05(m,32h,β-h),8.26-7.99(m,32h,ar-o-h),7.83(s,16h,ar-p-h),7.62(m,14h,pyrrole-β-h),1.55(s,72h,t-bu-h),1.54(s,216h,t-bu-h),-0.76(m,63h,boc-t-bu-h),-2.31(s,12h,nh),and-2.72(s,4h,nh)ppm.
8h:向schlenk反应管中加入boc-8h(65mg,0.0103mmol),再加入10ml二甲苯作溶剂,于140℃下搅拌72h,旋转蒸发回收对二甲苯溶剂,用二氯甲烷/甲醇重结晶,得绿色固体8h,产率100%。
8h:1hnmr(500mhz,cdcl3):δ=10.41(s,7h,pyrrole-nh),10.22(s,2h,meso-h),9.66(d,4h,j=5.0hz,β-h),9.61(m,24h,β-h),9.35(d,4h,j=5.0hz,β-h),9.09(m,8h,β-h),9.01(m,24h,j=5.0,β-h),8.13(m,32h,ar-o-h),7.82(m,30h,16hforar-p-hand14hforpyrrole-β-h),1.56(s,72h,t-bu-h),1.54(s,216h,t-bu-h),-2.33(s,12h,nh),and-2.77(s,4h,nh)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=416(428000),602(104800),679(94000)nm;hr-ms(maldi-tof-ms):m/z=5936.5645,calcdfor(c412h439n39)+=5936.5673([m]+);fluorescence(ch2cl2,λex=417nm):λmax=723nm,φf=0.15%.
8zn:将8h(20mg,0.0031mmol)加入到50ml圆底烧瓶中,加入10ml二氯甲烷和2ml甲醇使之溶解,加入zn(oac)2·2h2o(40mg,0.182mmol),室温下搅拌12h,将反应液过短硅胶柱除去未反应的zn(oac)2·2h2o,用二氯甲烷洗脱,旋蒸回收溶剂,用二氯甲烷/甲醇重结晶,以100%的产率得到卟啉八聚体的zn卟啉阵列(记为8zn)。
8zn:1hnmr(500mhz,cdcl3):δ=10.36(s,7h,pyrrole-nh),10.28(s,2h,meso-h),9.81(d,4h,j=5.0hz,β-h),9.79(m,24h,β-h),9.42(d,4h,j=5.0hz,β-h),9.19(d,4h,j=5.0hz,β-h),9.16(m,28h,β-h),8.13(m,32h,ar-o-h),7.82(m,16h,ar-p-h),7.76(s,14h,pyrrole-β-h),1.54(s,72h,t-bu-h),and1.51(s,216h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=416(616000),557(80000),632(87200)nm;hr-ms(maldi-tof-ms):m/z=6443.8586,calcdfor(c412h423n39zn8)+=6443.8629([m]+);fluorescence(ch2cl2,λex=417nm):λmax=685nm,φf=0.88%.
8ni:将8h(20mg,0.0031mmol)加入到50ml圆底瓶中,加入10ml甲苯使之溶解,加入的ni(oac)2·4h2o(40mg,0.161mmol),回流反应24h,冷却后将反应液通过氧化铝柱除去未反应的ni(oac)2·4h2o,用二氯甲烷/甲醇重结晶,以100%的产率得到卟啉八聚体的ni卟啉阵列(记为8ni)。
8ni:1hnmr(500mhz,cdcl3):δ=9.82(s,2h,meso-h),9.74(m,7h,pyrrole-nh),9.45(d,4h,j=5.0hz,β-h),9.39(m,24h,β-h),9.12(d,4h,j=5.0hz,β-h),8.92(m,8h,β-h),8.85(d,j=5.0hz,24h,β-h),7.89(s,8h,ar-o-h),7.86(s,24h,ar-o-h),7.73(s,4h,ar-p-h),7.70(s,12h,ar-p-h),7.56(s,14h,pyrrole-β-h),1.47(s,108h,t-bu-h),and1.44(s,180h,t-bu-h)ppm;uv/vis(ch2cl2):λmax(ε[m-1cm-1])=416(281000),536(60000),608(43000)nm;hr-ms(maldi-tof-ms):m/z=6389.9208,calcdfor(c308h317n29ni6)+=6389.9148([m]+).
实施例3卟啉阵列的光谱性能测试
1、紫外/可见吸收光谱
测试方法:以二氯甲烷作为溶剂,用十万分之一的分析天平准确称量实施例1-2制备的卟啉阵列样品配制成浓度约为10-5m的样品溶液,使用1厘米的比色皿进行紫外光谱测试,波长扫描范围300-1200nm(岛津uv-3600紫外-可见-近红外分光光度计),获得紫外-可见-近红外吸收光谱图。根据lambert-beer定律(a=εbc,其中b=1cm,c为样品浓度)计算样品的摩尔消光系数ε并作图,得uv/vis吸收光谱图。
结果如表1和图1所示:
表1紫外/可见吸收光谱比较
结果分析:卟啉阵列的紫外吸收谱图显示一组尖的soret吸收带(最大吸收值)和多组吸收峰q带,最大吸收值归因于强烈的基态到第一激发态的转变,而q带则归因于基态到第二激发态的转变。以zn卟啉为例,所有的中位吡咯桥连的线性卟啉阵列2zn-8zn都在420nm附近表现出一个明显的sort带和红移的q带。ni、zn和free-base卟啉阵列相应的吸收谱图中化合物的吸收谱图形状是类似的,但是吸收值有发生红移,这说明随着链的延伸,化合物具有更好的π共轭体系,共轭体系越大,则吸收光的波长越长,有利于模拟叶绿素中的吸光天线模型物。
2、荧光光谱
测试方法:所有样品的荧光发射光谱均使用hitachifl-4500型荧光光谱仪进行测试,以二氯甲烷作为溶剂,浓度约10-6m,激发波长为417nm,在发射波长范围500-900nm内进行测试。以四苯基锌卟啉(φf=3.3%)为参比计算样品的荧光量子产率φf。
结果如图2以及表2所示,由结果可知,本发明的无金属化卟啉阵列和金属化锌卟啉阵列都表现出一定的荧光特性,具有较大的荧光量子产率,其荧光量子产率在0.15%-3.6%之间,可用于制备荧光材料。以锌卟啉阵列为例,锌卟啉阵列的发射波长分别为653nm(2zn),674nm(3zn),681nm(4zn),683nm(5zn),685nm(6zn),686nm(8zn),随链的延长,荧光出现红移,但荧光量子产率明显下降,可能是由于链状卟啉阵列随着链的延长其结构更加扭曲所导致。
表2卟啉阵列的荧光量子产率
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!