猪德尔塔冠状病毒TaqMan荧光定量PCR试剂盒及检测方法与流程
本发明属于病毒的分子生物学检测技术领域,尤其涉及一种猪德尔塔冠状病毒taqman荧光定量pcr试剂盒及检测方法。
背景技术:
猪德尔塔冠状病毒(pdcov),又称猪丁型冠状病毒,主要是感染猪的整段小肠,引起肠炎并伴有腹泻和呕吐,乳猪发病率和死亡率高达50%-100%。目前,国内外对于猪德尔塔冠状病毒的检测方法主要是elisa方法、rt-pcr及荧光定量pcr检测方法,由于pdcov与猪流行性腹泻病毒(pedv)、猪传染性肠胃炎病毒(tgev)的临床发病情况比较相似,因此增加了pdcov的检测鉴定难度。在众多的pdcov检测方法中,由于rt-pcr方法具有较高的敏感性和特异性,因而其成为当今检测pdcov研究的主要手段之一,但常规的rt-pcr对pdcov的阳性检出率较低,检测的特异性和灵敏性还不能够满足pdcov的临床样品诊断,因此,在常规的rt-pcr基础上,建立一种特异性强、灵敏性高,同时pdcov的阳性检出率提高的检测方法具有重要意义。
技术实现要素:
本发明的目的在于提供一种猪德尔塔冠状病毒taqman荧光定量pcr试剂盒及检测方法,旨在解决现有猪德尔塔冠状病毒rt-pcr检测时病毒阳性检出率低,检测的特异性和灵敏性还不能够满足猪德尔塔冠状病毒的临床样品诊断的问题。
为实现上述目的,本发明采用的技术方案是:
本发明的第一个目的是提供一种猪德尔塔冠状病毒taqman荧光定量pcr试剂盒,所述试剂盒包含引物和探针;
所述引物的序列为:
上游引物:5'-acgtcgtaagacccagcatc-3';
下游引物:5'-cccacctgaaagttgctctc-3';
所述探针的序列为:
5'-fam-gtatggctgatcctcgcatcatggc-bhq1-3';
扩增猪德尔塔冠状病毒基因部分片段648bp。
优选地,所述引物的浓度为0.75μmol/l,所述探针的浓度为0.2μmol/l。
本发明的第二个目的是提供一种猪德尔塔冠状病毒taqman荧光定量pcr检测方法,所述检测方法使用上述猪德尔塔冠状病毒taqman荧光定量pcr试剂盒,包括提取病毒的rna,制备rna阳性标准品后,按如下taqman荧光定量pcr反应体系和反应条件对病毒进行检测;
所述taqman荧光定量pcr反应体系为:在20μl体系中加入以下成份:5×buffer4μl,dntp0.8μl,rri0.5μl,gotaq0.5μl,质粒标准品2μl,引物(0.75μm)0.6μl,探针(0.2μm)0.4μl,去离子水11.2μl;
所述taqman荧光定量pcr反应条件为:95℃预变性2min,然后95℃变性15s,56℃退火延伸1min,变性与退火延伸过程共40个循环。
本发明的有益效果为:本发明根据pdcov的n基因序列设计并合成了特异性引物和taqman探针,建立了检测pdcov的taqman实时荧光定量pcr方法,该方法能够特异的检测pdcov,而对猪传染性胃肠炎病毒(tgev)、猪流行性腹泻病毒(pedv)、猪嵴病毒(pkv)、猪繁殖与呼吸综合征病毒(prrsv)以及口蹄疫病毒(fmdv)的检测结果均为阴性;用2.66×106、2.66×105和2.66×104copies/μl3个不同浓度的质粒标准品进重复实验,循环阈值ct的变异系数均低于2%,表明该方法具有良好的特异性;标准曲线斜率为-3.461,相关系数为r2=0.998,表明阈值和模板浓度之间具有良好的线性关系。10倍梯度稀释质粒标准品,检测的最低限度为2.66×101copies/μl的质粒dna,表明此方法具有良好的敏感性。利用本发明对194份临床猪粪便样品进行检测,结果显示pdcov阳性率为22.1%,而利用常规rt-pcr对该临床猪粪便样品进行检测的阳性率仅为11.9%,本发明检测pdcov的阳性率高出常规rt-pcr检测pdcov的阳性率近1倍。本发明建立的检测pdcov的taqman探针实时荧光定量pcr方法特异性强、敏感性高、批间和批内重复性好,可用于pdcov临床样品的诊断。
附图说明
图1是本发明实施例提供的pdcovn基因序列的pcr扩增产物图,图中,m1-dna分子质量标准,1-阴性对照,2-pdcov毒株n基因的pcr产物,3-重组质粒hindⅲ+ecorⅰ双酶切产物,m2-dna分子质量标准。
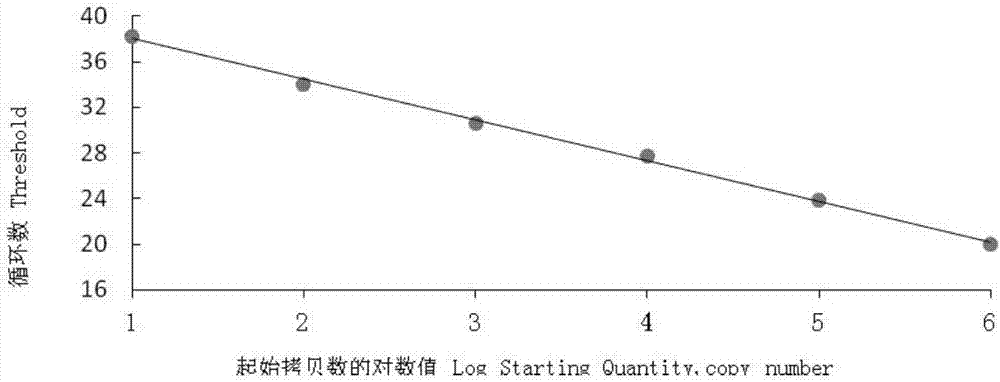
图2是本发明实施例提供的pdcovtaqman探针实时荧光定量pcr的标准曲线图。
图3是本发明实施例提供的pdcovtaqman探针实时荧光定量pcr的动力学曲线图,图中,1-6分别表示pdcov质粒浓度为2.66×106copies/μl、2.66×105copies/μl、2.66×104copies/μl、2.66×103copies/μl、2.66×102copies/μl、2.66×101copies/μl,7-阴性对照。
图4是本发明实施例提供的pdcovtaqman探针实时荧光定量pcr的特异性试验结果图,图中,1-7分别表示pdcov质粒浓度为2.66×107copies/μl、2.66×106copies/μl、2.66×105copies/μl、2.66×104copies/μl、2.66×103copies/μl、2.66×102copies/μl、2.66×101copies/μl,8-阴性对照。
图5是本发明实施例提供的pdcovtaqman探针实时荧光定量pcr的敏感性试验结果图,图中,1-pdcov,2-prrsv,3-fmdv,4-pkv,5-tgev,6-pedv,7-阴性对照。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图及具体实施例对本发明的应用原理作进一步描述,下述实施例中的实验方法,如无特殊说明,均为常规方法;下述实施例中所用的试验材料,如无特殊说明,均为市售。
实施例:一种猪德尔塔冠状病毒taqman荧光定量pcr试剂盒及检测方法。
1、引物及探针设计
根据genbank公布的猪德尔塔冠状病毒(pdcov)全基因组序列,用dnastar软件进行序列比对查找出保守n基因序列,利用探针设计软件primerexpress5.0设计出两对引物和两条探针,具体信息见表1,引物和探针由北京华大基因服务有限公司合成。
表1pdcov引物及探针
2、pdcovrna的提取
pdcovrna的提取按照rneasyminikit(50)qiagen操作说明进行。具体操作:取病毒处理液350μl加入到1.5ml的离心管中,加入等体积的rlt和3.5μl的β-巯基乙醇,在冰上静置5~10min,然后迅速加入700μl无水乙醇,缓慢混匀,取出迷你离心柱,加入700μl的混合物,12000rpm/min离心15s,倒掉收集管液体,重复一次。再加入500μl的rw1,冰上静置1min,12000rpm/min离心15s,换一新的收集管,加入700μl的rw2,12000rpm/min离心15s,倒掉收集管的液体,加700μl的rw2,12000rpm/min离心2min,将迷你离心柱放到预先准备好的无rna酶的1.5ml的离心管中,加入30μl的无rna酶水,静置1min,12000rpm/min离心1min,取出离心柱,将提取的rna放到-20冰箱备用。
3、rna阳性标准品的制备
在荧光定量引物外侧设计一对特异性的引物,将提取的病毒rna反转录得到cdna,再以反转录的cdna为模板,用荧光定量引物外侧的一对引物进行pcr扩增,同时设立阴性对照。扩增得到得产物用1.5%的琼脂糖凝胶电泳检测并观察结果,如图1所示,pcr产物经1.5%的琼脂糖凝胶电泳后,在648bp处有一条特异性条带,扩增结果与设计的目的片段相符,将阳性pcr产物纯化后克隆到pmd-20t载体中,并转化到dh5α感受态细胞中。经蓝白斑筛选挑选出的阳性重组菌扩大培养后提质粒,经hindⅲ+ecorⅰ双酶切,得到2736bp左右的载体条带和648bp左右的目的条带,经北京华大基因测序,结果表明扩增的pcr产物与模板序列比对同源性100%。纯化后通过超微量分光光度计nanodrop2000测定,提取的阳性质粒浓度为98.5ng/μl,od260/od280为1.86,-70度保存备用。
4、荧光定量pcr反应体系及反应条件的优化
荧光定量pcr反应液用美国promega公司的taq酶试剂。
采用梯度实验优化荧光定量pcr引物、探针和taq聚合酶浓度以及延伸温度,综合考虑ct值、荧光强度和重复性,确定最佳的荧光定量pcr反应条件。
筛选出的最佳引物对是:上游引物为pdcov-f2(见表1),其基因序列为:5'-acgtcgtaagacccagcatc-3';下游引物为pdcov-r2(见表1),其基因序列为:5'-cccacctgaaagttgctctc-3';探针为probe2(见表1),其基因序列为:5'-fam-gtatggctgatcctcgcatcatggc-bhq1-3';
优化的反应体系:总量20μl,其中5×buffer4μl,dntp0.8μl,rri0.5μl,gotaq0.5μl,质粒标准品2μl,引物(0.75μm)0.6μl,探针(0.2μm)0.4μl,去离子水11.2μl;
反应条件:95℃预变性2min,然后95℃变性15s,56℃退火延伸1min,变性与退火延伸过程共40个循环。
5、荧光定量标准曲线的建立
通过对荧光定量pcr各条件的优化,利用拷贝数计算公式:拷贝浓度=[6.023×1023×(浓度ng/μl×10-9)]/碱基数×660,计算出其拷贝数为2.66×1010copies/μl,以2.66×106copies/μl为原始浓度经10倍梯度稀释,得到2.66×106、2.66×105、2.66×104、2.66×103、2.66×102、2.66×101copies/μl的质粒为模板,在agilentstratagenemx3005p荧光定量pcr仪上检测,得到检测pdcov的扩增动力学曲线(图3),计出相应的标准曲线,如图2所示,由图2可知,pdcov荧光定量pcr标准品的浓度在2.66×101~2.66×106copies/μl范围内具有良好的线性,y=-3.46×lg(x)+41.58,其扩增效率为94.5%,相关系数r2=0.998。
6、敏感性试验
将阳性质粒以2.66×107copies/μl为原始浓度经10倍梯度稀释,得到2.66×107、2.66×106、2.66×105、2.66×104、2.66×103、2.66×102、2.66×101copies/μl的质粒为模板,进行荧光定量pcr反应,得到敏感性动力学曲线,如图4所示,结合图2中可知,当标准品的拷贝数为2.66×101copies/μl时仍能检测到,而空白对照无扩增,说明该检测方法的最低检测限度可达26.6copies/μl,当ct值低于40时为阳性。
7、特异性试验
为验证本实验建立的荧光定量pcr的特异性,用rna提取试剂盒提取猪繁殖与呼吸综合征病毒(prrsv)、猪口蹄疫病毒(fmdv)、猪嵴病毒(pkv)、猪传染性胃肠炎(tgev)和猪流行性腹泻病毒(pedv)病毒的rna并反转录成cdna,以各自的特异性引物进行pcr扩增,得到相应的特异片段,证实5个病毒均为阳性毒株,并且反转录得到得cdna能够正常扩增。取prrsv、fmdv、pkv、tgev、pedv的cdna为模板进行荧光定量pcr扩增,同时设置阴阳性对照,试验结果如图5所示,由图5可知,prrsv、fmdv、pkv、tgev、pedv及阴性对照的荧光定量pcr均未有扩增曲线,只有以2.66×108copies/μl的质粒pdcov出现了良好的扩增曲线。说明本实验所建立的taqman实时荧光定量pcr检测方法具有良好的特异性。
8、重复性试验
(1)批间重复性试验:取2.66×106、2.66×105和2.66×104copies/μl3个不同浓度的质粒标准样品,在同一条件下进行3次重复试验;将得到的ct值进行检测分析。结果其ct值变异系数分别为1.8%、1.1%、1.7%,均小于2%(如表2),表明本实验建立的taqman实时荧光定量pcr检测pdcov的方法在批间具有良好的重复性。
表2pdcov实时荧光定量pcr的批间重复
(2)批内重复性试验:取2.66×106、2.66×105、和2.66×104copies/μl3个不同浓度的质粒标准样品,,进行批内重复试验,每个浓度重复3次对检测结果进行统计学分析,计算其变异系数,变异系数(β)=标准偏差(sd)/平均数(x),结果试验ct值变异系数分别为1.1%、1.2%、0.4%,均小于2%(如表3)。表明本实验建立的taqman实时荧光定量pcr检测pdcov的方法在批内也具有良好的重复性。
表3pdcov实时荧光定量pcr的批内重复
9、临床样品的检测
用本发明建立的方法将2015-2016从河南、新疆、黑龙江、江苏等地采集的194份猪粪便样品进行taqman荧光定量pcr方法检测,同时设立阴性和阳性对照,并且使用常规rt-pcr方法进行检测作对比。对检测结果与常规rt-pcr进行对照,常规rt-pcr用特异性引物进行,具体方法参见rt-pcr试剂盒操作方法说明进行,检测结果如表4所示:
表4pdcov实时荧光定量pcr对临床样品的检测结果
由表4可知,使用常规的rt-pcr方法可检查出23份阳性样品,阳性率11.9%,而采用本发明taqman实时荧光定量pcr检测方法可检测出43份阳性样品,阳性率22.1%,比常规的rt-pcr方法的检出阳性率高出近1倍,说明本发明所建立的taqman实时荧光定量pcr检测方法对pdcov具有更高的敏感性。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!