一种抗病毒多肽、编码基因、载体、宿主菌及应用的制作方法
本发明具体涉及生物医药技术领域,具体而言涉及一种抗病毒多肽、编码基因、载体、宿主菌及应用。
背景技术:
猪流行性腹泻(porcineepidemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)引起的,以腹泻、呕吐、脱水和对哺乳仔猪高致死率为主要特征的一种高度接触性肠道传染病。截止到2017年,ped已蔓延到全世界大多数养猪国家,给全球猪业造成了巨大的经济损失,已成为世界范围内养猪业共同关注并亟需解决的问题。
技术实现要素:
本发明的第一目的在于提供一种抗病毒多肽。
本发明的第二目的在于提供编码上述抗病毒多肽的编码基因。
本发明的第三目的在于提供含有上述编码基因的表达载体。
本发明的第四目的在于提供含有上述编码基因的宿主菌。
本发明的第五目的在于提供上述抗病毒多肽在制备抗病毒药物中的应用。
本发明的第六目的在于提供一种抗病毒药物。
本发明的第七目的在于提供上述抗病毒多肽在制备抗病毒的抗体及抗病毒的多肽疫苗中的应用。
为了实现本发明的上述目的,采用以下技术方案:
一种抗病毒多肽,抗病毒多肽为第一多肽链、第二多肽链、第三多肽链、第四多肽链、第五多肽链和第六多肽链中的至少一种;第一多肽链的氨基酸序列如seqno.1所示,第二多肽链的氨基酸序列如seqno.2所示,第三多肽链的氨基酸序列如seqno.3所示,第四多肽链的氨基酸序列如seqno.4所示,第五多肽链的氨基酸序列如seqno.5所示,第六多肽链的氨基酸序列如seqno.6所示。
编码上述抗病毒多肽的编码基因。
含有上述编码基因的载体。
含有上述编码基因的宿主菌。
上述的抗病毒多肽在制备抗病毒药物中的应用。
一种抗病毒的药物,药物的活性成分包括上述的抗病毒多肽。
上述的抗病毒多肽在制备抗病毒的抗体及抗病毒的多肽疫苗中的应用。
本发明的有益效果为:本发明提供的一种抗病毒多肽,通过抗病毒多肽与猪流行性腹泻病毒产生竞争性抑制,能安全高效的抑制猪流行性腹泻病毒的感染,通过将编码抗病毒多肽的编码基因克隆到载体上,然后通过宿主菌大量表达出抗病毒多肽,并将该抗病毒多肽应用到抗病毒药物、抗病毒的抗体及抗病毒的多肽疫苗中,制得的抗病毒药物能够广谱、有效的抑制猪流行性腹泻病毒及具有近似多肽序列的猪冠状病毒的感染,具有较高的产业价值和较好的推广应用价值。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实验例1提供的抗病毒多肽表达效果的sds-page示意图;
图2为本发明实验例2提供的抗病毒多肽的毒性实验结果图;
图3为本发明实验例3提供的不同浓度抗病毒多肽的病毒抑制效果图;
图4为本发明实验例3提供的不同感染时期四种多肽的病毒抑制效果图;
图5为本发明实验例4提供的四种多肽病毒抑制的广谱性效果图;
图6为本发明实验例5提供的hr2p蛋白抗体中和实验图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
猪流行腹泻病毒zju/g2/2013(pedv-gfp,通过用pedv的感染性cdna转染vero细胞表达产生gfp蛋白的毒株,genbankaccessionno.ku558701)和zju/g1/2013(genbankaccessionno.ku664503)本实验室保存;escherichiacolidh5a,bl21表达菌株均购自北京全式金生物技术有限公司;mttcellproliferationandcytotoxicityassaykit试剂盒购自碧云天生物技术公司;vero(atcc,ccl-81)和huh7细胞本实验保存;balb/c小鼠购自南京大学模式动物研究所。
猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)s基因由4152nt组成,编码s蛋白。s蛋白在分析现在pedv流行毒株的遗传变异和流行分布情况中发挥重要的作用。s蛋白是pedv的主要结构蛋白,其分子量约为152kd,由1383个氨基酸组成的i型的膜糖蛋白,由4部分组成,分别是信号肽序列(aa1-24)、长的细胞外区域(aa25-1333)、单一跨膜区(aa1334-1356)和短的细胞质尾巴(aa1357-1383)。
s蛋白以三聚体的形式存于病毒粒子的表面,负责病毒的吸附和融合,能够诱导宿主产生中和抗体。s糖蛋白首先与细胞表面受体结合,使融合肽暴露于靶细胞膜的导致构象变化。随后,高度保守的七肽重复(hr)区域相互作用形成六螺旋束(6-hb)结构,这有助于病毒和细胞膜的融合。s蛋白有s1亚基和s2亚基组成;s1位于n端并参与细胞受体的结合,s2主要参与病毒与细胞的融合过程。在冠状病毒感染的许多体外研究报道中,外源可溶性hr2肽可以结合病毒hr1,从而有效阻断病毒进入细胞并抑制复制
下面对本发明实施例的一种抗病毒多肽、编码基因、载体、宿主菌及应用进行具体说明。
一种抗病毒多肽,抗病毒多肽为第一多肽链、第二多肽链、第三多肽链、第四多肽链、第五多肽链和第六多肽链中的至少一种;第一多肽链的氨基酸序列如seqno.1所示,第二多肽链的氨基酸序列如seqno.2所示,第三多肽链的氨基酸序列如seqno.3所示,第四多肽链的氨基酸序列如seqno.4所示,第五多肽链的氨基酸序列如seqno.5所示,第六多肽链的氨基酸序列如seqno.6所示。
本发明根据猪流行性腹泻病毒的s蛋白的保守区序列,巧妙的设计了六条能够与猪流行性腹泻病毒产生竞争性抑制的多肽序列,这六条多肽序列能够与细胞上的受体结合,从而将受体“占用”,导致猪流行性腹泻病毒无法与细胞的相应受体结合,从而无法感染细胞;就不会引起相关的疾病,并且设计的多肽序列也没有致病性,也是安全有效的。
编码上述多肽的编码基因。
进一步地,在本发明的较佳实施例中,编码基因包括如碱基序列seqno.7-12所示的基因序列中的至少一种;碱基序列seqno.7编码第一多肽链,碱基序列seqno.8编码第二多肽链,碱基序列seqno.9编码第三多肽链,碱基序列seqno.10编码第四多肽链,碱基序列seqno.11编码第五多肽链,碱基序列seqno.12编码第六多肽链。
含有上述的编码基因的载体。
含有上述的编码基因的宿主菌。
进一步地,在本发明的较佳实施例中,宿主菌为dh5α、top10、bl21和rosetta中的一种。
使用宿主菌可以克隆和表达出大量的抗病毒多肽,不同的多肽可能需要使用不同的宿主菌,才能完成有效的表达。
上述的抗病毒多肽在制备抗病毒药物中的应用。
一种抗病毒的药物,药物的活性成分包括上述的抗病毒多肽及抗病毒的多肽疫苗。
由于该多肽与猪流行性腹泻病毒的保守区序列类似,能竞争性抑制猪流行性腹泻病毒,因此应用该抗病毒多肽制备的抗体或多肽疫苗也能较好的识别猪流行性腹泻病毒、以及具有与该序列同源或者相似序列片段的病毒。
进一步地,在本发明的较佳实施例中,病毒为猪流行性腹泻病毒。
当然还可以是与该抗病毒多肽具有同源氨基酸序列的病毒或者具有一定相似度的多肽序列的病毒。
上述的抗病毒多肽在制备抗病毒的抗体中的应用。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供一种抗病毒多肽,该抗病毒多肽包括第一多肽链,第一多肽链命名为hr2p,第一多肽链hr2p的氨基酸序列如seqno.1所示。
本实施例还提供编码第一多肽链hr2p的编码基因,该编码基因的碱基序列如seqno.7所示。
实施例2
本实施例提供一种抗病毒多肽,该抗病毒多肽包括第一多肽链和第二多肽链;第一多肽链命名为hr2p,第二多肽链命名为hr2l;第一多肽链hr2p的氨基酸序列如seqno.1所示,第二多肽链hr2l的氨基酸序列如seqno.2所示。
本实施例还提供编码第一多肽链hr2p的编码基因,该编码基因的碱基序列如seqno.7所示。编码第二多肽链hr2l的编码基因,该编码基因的碱基序列如seqno.8所示。
实施例3
本实施例提供一种抗病毒多肽,该抗病毒多肽包括第一多肽链、第二多肽链、第三多肽链、第四多肽链、第五多肽链和第六多肽链;第一多肽链命名为hr2p,第二多肽链命名为hr2l,第三多肽链命名为hr2m,第四多肽链命名为hr2,第五多肽链命名为hr1l,第六多肽链命名为hr1m;第一多肽链hr2p的氨基酸序列如seqno.1所示,第二多肽链hr2l的氨基酸序列如seqno.2所示,第三多肽链hr2m的氨基酸序列如seqno.3所示,第四多肽链hr2的氨基酸序列如seqno.4所示,第五多肽链hr1l的氨基酸序列如seqno.5所示,第六多肽链hr1m的氨基酸序列如seqno.6所示。
本实施例还提供编码如seqno.1-6所示的抗病毒多肽的编码基因;碱基序列seqno.7编码第一多肽链hr2p,碱基序列seqno.8编码第二多肽链hr2l,碱基序列seqno.9编码第三多肽链hr2m,碱基序列seqno.10编码第四多肽链hr2,碱基序列seqno.11编码第五多肽链hr1l,碱基序列seqno.12编码第六多肽链hr1m。
实施例4
本实施例提供构建表达第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m、第四多肽链hr2、第五多肽链hr1l和第六多肽链hr1m的表达载体,以及表达第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m、第四多肽链hr2、第五多肽链hr1l和第六多肽链hr1m宿主菌。
构建表达载体的具体步骤如下:
1.1提取猪流行性腹泻病毒zju/g2/2013(pedv-gfp,通过用pedv的感染性cdna转染vero细胞表达产生gfp蛋白的毒株,genbankaccessionno.ku558701)的基因组作为模板;
1.2用表1中的引物序列进行pcr克隆扩增,获得表达第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m、第四多肽链hr2、第五多肽链hr1l和第六多肽链hr1m的编码序列片段,回收目的片段;
1.3将步骤1.2中的目的片段分别连接到pgex-4t-1载体上,获得表达六条多肽的六种重组质粒。
表1多肽目的片段扩增引物
本实施例还提供重组质粒转化感受态细胞,获得宿主菌的方法,具体步骤如下:
2.1从冰箱中取出大肠杆菌bl21(de3)感受态细胞100μl,于冰上解冻2-5min;
2.2将获得六种重组质粒分别加入到已经解冻的感受态细胞中,冰浴30min;
2.3在42℃条件下热激45s,冰浴2min;
2.4加入900μl的lb液体培养基,37℃,150rpm恢复培养1h;
2.5以4000g离心2min,留上清100μl,重悬菌体,并将重悬菌液涂布于含有氨苄青霉素的固体lb培养基上,37℃倒置培养8-12h;
2.6分别挑取单斑进行验证,获得阳性菌株,得到相应的宿主菌。
实验例1
本实验例对实施例4获得宿主菌进行培养,表达目的蛋白,具体步骤如下:
1.1分别将宿主菌接种到含有50mg/l氨苄青霉素(amp)(sigma,usa)的luria-bertani(lb)肉汤中,并在37℃孵育过夜;
1.2将培养物转移到100ml的新鲜lb培养基中,并在37℃下继续培养;
1.3当od590=0.4的时候,用0.5mm异丙基-β-d-1-硫代吡喃半乳糖苷(iptg)(sigma,usa)诱导目的蛋白表达;
1.4并将培养基转移到30℃,再培养8小时;
1.5在8000g的离心条件下收集菌体,并用预冷的pbs缓冲液冲洗菌体一次。
本实验例还提供对目的蛋白的分离和提取,具体步骤如下:
2.1超声破碎步骤1.5中获得菌体细胞;
2.2在12000rpm条件下,离心10min,取上清;
2.3用0.45μm的过滤器过滤细胞破碎液;
2.4在分离柱中加入proteinisogstresin填料;
2.5用洗脱缓冲液(50mm的tris·hcl,ph=8.0,10mm的还原型谷胱甘肽)洗脱,收集流出的液体;
2.6将洗脱的液体,加入10kd的蛋白超滤浓缩管进行置换浓缩,用bca蛋白浓度测定试剂盒进行蛋白浓度测定。
本实验例还提供对六条抗病毒多肽的sds-page的检测验证实验。
3.1按照配方配制10%的分离胶和5%的浓缩胶;
3.2蛋白样品处理,取15μl的样品和5μl的5×loadingbuffer,混匀95℃变性;
3.3在80v电压条件下电泳至溴酚蓝进入分离胶,调整电压至120v,至溴酚蓝跑出分离胶;
3.4将胶置于染色液中染色,室温1h;
3.5弃染色液,用洗脱液脱色2-3次,每次30min,至完全脱色。
sds-page的结果如图1所示,可以看出,第一多肽链hr2p、第二多肽链hr2l和第三多肽链hr2m有较好的表达。
实验例2
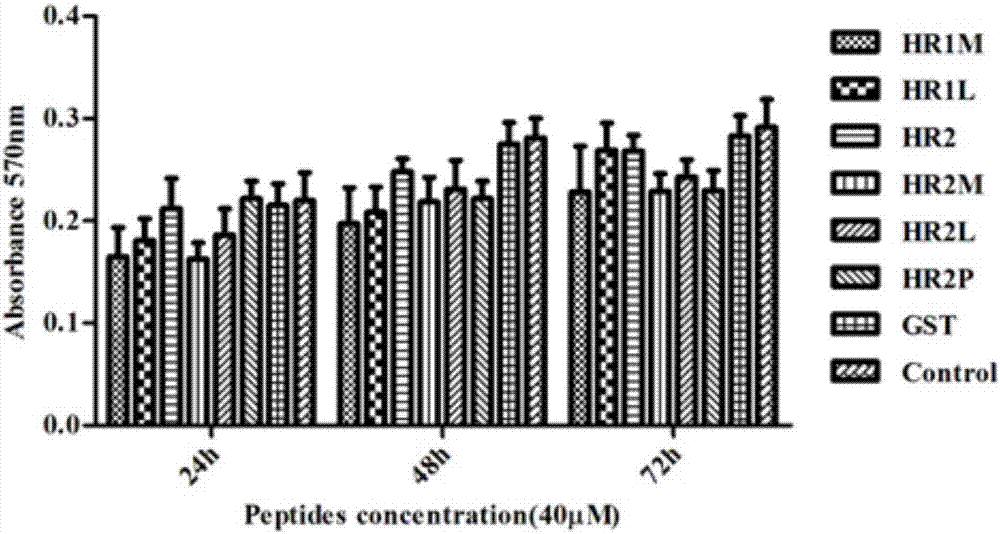
本实验例对实验例1表达获得六条多肽的毒性检测实验,本实验主要采用huh7细胞进行实验。
huh7细胞以1×105/孔的密度接种在96孔板中,并在37℃,5%co2培养24h。分别用获得的六条多肽(40μm)分别处理细胞24h、48h和72h;向每个孔中加入20μlmtt溶液(5mg/ml,即用5mlmtt溶液溶解25mgmtt,配制成5mg/ml的mtt溶液),用dmem作为对照。在37℃孵育4h后,加入100μlformanzan溶液混合,37℃孵育2h。在od570处测量。
结果如图2所示,实验例1表达获得六条多肽对huh7细胞没有毒性,说明实验例1表达获得六条多肽是安全、无毒的蛋白序列结构。
本实验例还提供将第一多肽链hr2p、第二多肽链hr2l和第三多肽链hr2m用于制备抗猪流行性腹泻病毒的药物、抗体以及多肽疫苗。
实验例3
本实验例对实验例1获得多肽进行有效抑制pedv感染多肽的筛实验验证。
huh7细胞计数用含10%小牛血清的dmem稀释到细细胞密度以2×104/孔密度加入到48孔板,置于37℃,5%co2培养箱中待细胞贴壁成单层(约17-18h)。用浓度为5μm、10μm、20μm和40μm的多肽与pedv-gfp(moi=0.01)混合,37℃感染2h。未感染的对照用mm(dmem中加入了0.3%胰蛋白胨磷酸酯肉汤)稀释。除去病毒-肽混合物,用pbs洗3次,在加入mm并在37℃,48h,此时计数gfp阳性细胞的个数。
结果如图3所示,第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m、第四多肽链hr2、第五多肽链hr1l和第六多肽链hr1m在低浓度的条件下,依然具有抑制效果且高于gst对照组;还可以看出,第一多肽链hr2p、第二多肽链hr2l和第三多肽链hr2m在低浓度条件下也具有较好的抑制效果,尤其是第一多肽链hr2p的抑制效果较为明显。
为了验证第一多肽链hr2p、第二多肽链hr2l和第三多肽链hr2m在感染发生时不同阶段对病毒的抑制效果,进行了实验。
采用三种不同的处理方式进行研究分别为:
1)细胞先预处理,第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m和第六多肽链hr1m先于huh7细胞在4℃孵育30min后,去除多肽,
用pbs洗3次,再感染pedv-gfp(moi=0.01),在37℃孵育1h,加入mm,继续培养48h。
2)共孵育,将病毒(pedv-gfp,moi=0.01)与第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m和第六多肽链hr1m混合后,加入huh7细胞在37℃共同孵育1h,用pbs洗3次,加入mm,继续培养48h。
3)后处理,huh7细胞先用pedv-gfp(moi=0.01)在37℃感染45min后,用pbs洗3次,在加入第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m和第六多肽链hr1m,在37℃孵育1h后,用pbs洗3次,加入mm,继续培养48h。
在上述所有的情况下,孵育48h后,用4%的多聚甲醛固定,并通过gfp阳性细胞的个数(即形成的ffu单位)进行评估。
结果如图4所示,第一多肽链hr2p、第二多肽链hr2l和第三多肽链hr2m在各个阶段的抑制率均明显高于第六多肽链hr1m,且在共处理的抑制率明显高于感染前处理和感染后处理的抑制率;也可以用于制备药物或者制备多肽疫苗进行疾病的治疗。
实验例4
本实验例验证第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m和第六多肽链hr1m对另外一种常见的猪流行性腹泻病毒株zju/g1/2013(genbankaccessionno.ku664503)进行抑制效果验证。
huh7细胞计数用含10%小牛血清的dmem稀释到细细胞密度以2×104/孔密度加入到48孔板,置于37℃,5%co2培养箱中待细胞贴壁成单层(约17-18h)。第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m和第六多肽链hr1m分别与zju/g1/2013(moi=0.01)混合,37℃感染2h。除去病毒-肽混合物,用pbs洗3次,在加入mm并在37℃,48h,通过ifa检测。
结果如图5所示,第一多肽链hr2p、第二多肽链hr2l、第三多肽链hr2m和第六多肽链hr1m均有抑制效果,其中第一多肽链hr2p和第二多肽链hr2l的抑制效果明显较高,尤其是第一多肽链hr2p的抑制效果较好。因此可以看出,第一多肽链hr2p不仅在zju/g2/2013(pedv-gfp,genbankaccessionno.ku558701)具有较优的一种效果,对另外一种常见的猪流行性腹泻病毒株zju/g1/2013(genbankaccessionno.ku664503)也具有较好的一种效果。
实验例5
本实验例提供第一多肽链hr2p抗体的制备以及中和试验的测定。
由于第一多肽链hr2p具有较好的猪流行性腹泻病毒竞争抑制效果,因此将第一多肽链hr2p应用于制备抗第一多肽链hr2p的抗体,制得的抗体对猪流行性腹泻病毒也将会有较好的免疫效果。
将确定的猪流行性腹泻病毒抑制效果最好的多肽hr2p的编码基因克隆到含有his标签的原核表达载体pet32a中,进行原核表达,重组蛋白用his融合纯化柱(novoprotein,shanghai,china)表达和纯化。将纯化的可溶性肽用作免疫原(每只小鼠50μg),用于在小鼠中产生多克隆抗体,在接种后14、24、34天在加强免疫(每只小鼠100μg)。最后一次加强免疫7天后,收集血清,得到抗第一多肽链hr2p的血清。
在huh7细胞的单层上进行中和试验测定。将50μl预先接种的血清,抗第一多肽hr2p抗血清和抗pedv-s2单克隆抗体(堪萨斯州立大学的李芳博士赠送)分别进行2倍、4倍、8倍、16倍、32倍、64倍、128倍、256倍、512倍、1024倍和2048倍稀释,稀释液与100ffu的pedv-gfp混合,在mm中培养,在37℃孵育1小时以形成病毒-抗体复合物,并加入到含有10%fbs的dmem的48孔板中生长的huh7细胞中。在37℃孵育1h,设有实验组用pbs洗3次,彻底除去未吸收的pedv-gfp病毒。细胞在感染36h内在4%多聚甲醛固定,gfp阳性细胞通过免疫荧光显微镜计数为ffu。
结果如图6所示,以第一多肽hr2p制得的抗血清和已有的抗体的免疫效果接近,且通过本方法制得的抗血清还具有两种不同的猪流行性腹泻病毒的抗性,具有较高的实用价值。从本实验可以看出,本实验例表达的第一多肽链hr2p注射小鼠产生的抗体能较好的中和猪流行性腹泻病毒。因此说明第一多肽链hr2p具有较好的免疫原性,且由于第一多肽链hr2p无毒的特性,因此可以将第一多肽链hr2p应用于制备疫苗。
综上所述,本发明实施例的抗病毒多肽,能够与猪流行性腹泻病毒形成竞争性抑制,抑制猪流行性腹泻病毒的感染,且抗病毒多肽具有安全无毒的特点;尤其是第一多肽hr2p抑制猪流行性腹泻病毒的效果较好,将抗病毒多肽尤其是第一多肽hr2p制备成抗猪流行性腹泻病毒的药物或引用到抗体制备中,具有较高的应用价值和社会推广价值。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
sequencelisting
<110>浙江大学
<120>一种抗病毒多肽、编码基因、载体、宿主菌及应用
<160>12
<170>patentinversion3.5
<210>1
<211>55
<212>prt
<213>porcineepidemicdiarrheavirus
<400>1
proleuaspvalpheasnalathrtyrleulysleuthrglygluile
151015
alaaspleugluglnargsergluserleuargasnthrthrgluglu
202530
leuglnserleuiletyrasnileasnasnthrleuvalaspleuglu
354045
trpleuasnargvalgluthr
5055
<210>2
<211>49
<212>prt
<213>porcineepidemicdiarrheavirus
<400>2
asnalathrtyrleulysleuthrglygluilealaaspleuglugln
151015
argsergluserleuargasnthrthrglugluleuglnserleuile
202530
tyrasnileasnasnthrleuvalaspleuglutrpleuasnargval
354045
glu
<210>3
<211>42
<212>prt
<213>porcineepidemicdiarrheavirus
<400>3
asnalathrtyrleulysleuthrglygluilealaaspleuglugln
151015
argsergluserleuargasnthrthrglugluleuglnserleuile
202530
tyrasnileasnasnthrleuvalaspleu
3540
<210>4
<211>40
<212>prt
<213>porcineepidemicdiarrheavirus
<400>4
lysleuthrglygluilealaaspleugluglnargsergluserleu
151015
argasnthrthrglugluleuglnserleuiletyrasnileasnasn
202530
thrleuvalaspleuglutrpleu
3540
<210>5
<211>57
<212>prt
<213>porcineepidemicdiarrheavirus
<400>5
seralaileglyasnilethrseralaphegluservallysgluala
151015
ileserglnthrserlysglyleuasnthrvalalahisalaleuthr
202530
lysvalglngluvalvalasnserglnglyalaalaleuthrglnleu
354045
thrvalglnleuglnhisasnphegln
5055
<210>6
<211>64
<212>prt
<213>porcineepidemicdiarrheavirus
<400>6
argasnglnglnleuleualagluserpheasnseralaileglyasn
151015
ilethrseralaphegluservallysglualaileserglnthrser
202530
lysglyleuasnthrvalalahisalaleuthrlysvalglngluval
354045
valasnserglnglyalaalaleuthrglnleuthrvalglnleugln
505560
<210>7
<211>165
<212>dna
<213>porcineepidemicdiarrheavirus
<400>7
cctttagatgtttttaatgccacttatcttaagctcactggtgaaattgcagatttggag60
cagcgttcagagtctctccgtaatactacagaggagctccaaagtcttatatataatatc120
aacaacacactagttgaccttgagtggctcaaccgagttgagaca165
<210>8
<211>147
<212>dna
<213>porcineepidemicdiarrheavirus
<400>8
aatgccacttatcttaagctcactggtgaaattgcagatttggagcagcgttcagagtct60
ctccgtaatactacagaggagctccaaagtcttatatataatatcaacaacacactagtt120
gaccttgagtggctcaaccgagttgag147
<210>9
<211>126
<212>dna
<213>porcineepidemicdiarrheavirus
<400>9
aatgccacttatcttaagctcactggtgaaattgcagatttggagcagcgttcagagtct60
ctccgtaatactacagaggagctccaaagtcttatatataatatcaacaacacactagtt120
gacctt126
<210>10
<211>120
<212>dna
<213>porcineepidemicdiarrheavirus
<400>10
aagctcactggtgaaattgcagatttggagcagcgttcagagtctctccgtaatactaca60
gaggagctccaaagtcttatatataatatcaacaacacactagttgaccttgagtggctc120
<210>11
<211>171
<212>dna
<213>porcineepidemicdiarrheavirus
<400>11
tctgctattggtaatataacttcagcctttgagagtgttaaagaggctattagtcaaact60
tccaagggtttgaacactgtggctcatgcgcttactaaggttcaagaggttgttaactcg120
cagggtgcagctttgactcaacttaccgtacagctgcaacacaacttccaa171
<210>12
<211>192
<212>dna
<213>porcineepidemicdiarrheavirus
<400>12
cggaaccagcaattgcttgctgagtcttttaactctgctattggtaatataacttcagcc60
tttgagagtgttaaagaggctattagtcaaacttccaagggtttgaacactgtggctcat120
gcgcttactaaggttcaagaggttgttaactcgcagggtgcagctttgactcaacttacc180
gtacagctgcaa192
- 还没有人留言评论。精彩留言会获得点赞!