RelA基因rs11820062SNP在制备检测丙型肝炎易感性产品中的应用的制作方法
本发明涉及生物医药领域,特别是一种人基因组中nf-κb通路的rela基因rs11820062单核苷酸多态性(singlenucleotidepolymorphism,snp)在制备检测丙型肝炎易感性产品中的应用。
背景技术:
snp指的是单个核苷酸突变而引起的核酸序列的改变。一个snp位点有两个等位基因,在人类基因组中,平均每100-300个核苷酸中存在一个snp,snps是人类最常见的遗传变异类型。人类基因组的编码区和非编码区均分布有snps,大多数snps存在于非编码区。编码区的snps有非同义突变和同义突变,非同义snps可改变蛋白质的氨基酸序列,同义突变则不影响蛋白质编码。非编码区的snps可能影响基因的剪切、转录因子结合、mrna降解等。人类snps的分布具有差异,导致了不同种族、人群的染色体基因组具有多样性,也导致了人体对疾病的易感性、病程进展、转归,及药物治疗效果存在差异。目前snps已被视为一种生物标志物,广泛用于研究遗传变异与人类疾病的关系。
丙型病毒性肝炎是一种由丙型肝炎病毒(hcv)感染引起的病毒性肝炎。全球共有1.85亿hcv感染者,中国的hcv感染率约为1.6%,输血、注射吸毒、器官移植和血液透析已经成为国内主要的hcv传播途径。hcv急性感染可有两种不同的结局:病毒自限性清除和持续性感染。自限性清除者指的是hcv感染人体后,机体未经治疗、在感染后的12个月内自动清除hcv,从而免于持续性感染,表现为hcvrna阴性,hcv抗体阳性。持续性感染指的是hcv感染人体后,机体未经治疗、在感染后的12个月内不能清除hcv,表现为hcvrna阳性,hcv抗体阳性。超过70%的hcv感染者可发展为持续性感染,其中一部分患者还可能发展成为肝硬化、肝细胞肝癌(hcc)。
hcv感染者的病情发展和转归可受多种因素可影响,包括病毒、宿主免疫和遗传因素。在过去几年中,在全球多项大型临床试验中,新的直接抗病毒药物(direct-actingantiviralagents,daas)将慢性丙肝的治愈率显著提高到95%以上,已成为传统的聚乙二醇干扰素+利巴韦林治疗方案的更优选择。然而,随着daas药物的应用,不断有新问题涌现:hbv/hcv合并感染者使用daa药物可致hbv再激活;在部分获得持续性病毒应答(svr)的肝硬化患者中,daas的应用并不能降低hcc的发生率;daas治疗还可导致耐药的发生,目前已确认的耐药相关突变(resistanceassociatedvariants,ravs)位点包括ns3/4a靶点相关、ns5a靶点相关和ns5b靶点相关的几十个ravs。
考虑到阻止hcv传播的首要问题是筛查、识别易感人群。因此,进行中国人群遗传背景与hcv感染的关系的研究,对于深入探索遗传因素在丙肝病程进展的作用机制,为及时、有效防控丙肝流行提供有效的靶点、工具及理论基础,具有重要的现实意义。
nf-κb是核转录因子,具有和某些基因上启动子区的特定核苷酸序列结合而启动基因转录、调节细胞增殖、凋亡、炎症过程及免疫应答的功能。nf-κb可被细菌/病毒抗原、细胞因子等许多刺激物激活,继而调节150多种基因的表达。nf-κb/rel家族成员有c-rel、nf-κb1(p50)、nf-κb2(p52)、rela(p65)、relb。这些蛋白都有一个大约由300个氨基酸组成的氨基末端,称为rel同源区,包括dna结合部位、二聚体化部位及与nf-κb抑制蛋白(iκb)结合位点。有活性的dna结合的nf-κb是p50与p65二聚体。rel蛋白成员间可形成同源或异源二聚体,不同的nf-κb/rel蛋白二聚体具有不同的结合序列,而且各有特性,不同二聚体可识别不同的dna靶目标,而对不同调节基因的表达能力得以提高。nf-κb蛋白p50/p65、p50/c-rel、p65/c-rel复合体具有转录激活作用,而p50/p50和p52/p52同源二聚体则具有转录抑制作用。
现有研究表明,nf-κb家族基因(nf-κb1、nf-κb2、rela、relb、rel)及其抑制基因iκb可能通过相关snps对宿主对hcv的易感性及体内抗病毒的免疫应答产生影响。2014年,有研究表明nf-κbε(ikbε)rs2233437-a显著提高宿主hcv自限清除能力,提示了nf-κb通路相关基因多态性可能与hcv感染转归存在关联。但目前仅有研究报道,rs11820062与慢性肾病的易感性(o’brown,z.k.,vannostrand,e.l.,higgins,j.p.&kim,s.k.theinflammatorytranscriptionfactorsnfκb,stat1andstat3driveage-associatedtranscriptionalchangesinthehumankidney.plosgenetics11,e1005734(2015))及精神分裂症(hashimoto,r.etal.variantsoftherelageneareassociatedwithschizophreniaandtheirstartleresponses.neuropsychopharmacology36,1921-1931(2011))有关,rs230530与肝癌(gao,j.etal.geneticpolymorphismofnfkb1andnfkbiagenesandlivercancerrisk:anestedcase–controlstudyinshanghai,china.bmjopen4,e004427(2014).)及酒精依赖(edenberg,h.j.etal.associationofnfkb1,whichencodesasubunitofthetranscriptionfactornf-κb,withalcoholdependence.humanmoleculargenetics17,963-970(2008).)有关。然而,目前国内外关于rela基因rs11820062单核苷酸位点的多态性与丙型肝炎感染易感性的研究还没有报道。
技术实现要素:
本发明的目的是提供一种nf-κb通路rela基因单核苷酸多态性rs11820062在制备检测或筛查丙型肝炎易感性产品中的应用。
具体而言,本发明首先提供了以下任一用途:
(1)人基因组中rela基因rs11820062单核苷酸多态性(即等位基因)或基因型在制备检测或筛查丙型肝炎易感性产品中的应用。
(2)人基因组中rela基因rs11820062单核苷酸多态性(即等位基因)或基因型在制备检测或筛查与丙型肝炎相关的单核苷酸多态性的产品中的应用。
其次,本发明还提供了以下任一用途:
(1)检测人基因组中rela基因rs11820062单核苷酸多态性(即等位基因)或基因型的物质在制备检测或筛查丙型肝炎易感性产品中的应用。
(2)检测人基因组中rela基因rs11820062单核苷酸多态性(即等位基因)或基因型的物质在制备检测或筛查与丙型肝炎相关的单核苷酸多态性的产品中的应用。
本发明中,检测人基因组中rela基因rs11820062单核苷酸多态性或基因型的物质包括现有技术中可以用于检测基因型的试剂或者试剂盒,具体而言,这些物质为本领域常规的、可以用于检测rela基因rs11820062单核苷酸多态性的检测方法所涉及的试剂和试剂盒。
目前常用的人类基因组snp分型的检测方法包括:单链构象多态性(sscp)、变性梯度凝胶电泳(dgge)、酶切扩增多态性序列(caps)、等位基因特异性pcr(包括本发明所采用的taqman-pcr法分型)检测、基因直接测序(sanger法)、dna芯片法、变性高效液相色谱(dhplc)及质谱法等等。不同snp分型方法所采用的试剂各有不同;而同一类检测方法,则根据研究者不同的检测目的、位点及分型效果而选用不同设计的引物、探针等,获得检测不同基因型的试剂或者试剂盒。
本发明中,检测或筛查丙型肝炎易感性产品包括上述检测人基因组中rela基因rs11820062单核苷酸多态性或基因型的物质,可以为试剂或者试剂盒,还可以为试剂、试剂盒和仪器的组合产品,如引物和dna测序仪组合获得的产品,由taqmanpcr试剂、dna测序试剂和dna测序仪组合获得的用于检测或筛查丙型肝炎易感性产品。
本发明中,检测或筛查与丙型肝炎相关的单核苷酸多态性的产品同样包括上述检测人基因组中rela基因rs11820062单核苷酸多态性或基因型的物质,可以为试剂或者试剂盒,还可以为试剂、试剂盒和仪器的组合产品,如引物和dna测序仪组合获得的产品,由taqmanpcr试剂、dna测序试剂和dna测序仪组合获得的检测或筛查与丙型肝炎相关的单核苷酸多态性的产品。
本发明还提供了一种taqmanpcr试剂,其含有扩增人基因组中rela基因rs11820062在内的基因组dna片段的pcr引物和taqmanmgb探针。
进一步,本发明所提供的taqmanpcr试剂中,所述pcr引物序列分别如seqidno.1和seqidno.2所示;所述taqmanmgb探针序列分别如seqidno.3和seqidno.4所示,并且seqidno.3和seqidno.4的5’端均标记荧光报告基团,3’端均标记非荧光猝灭基团和dna小沟结合物mgb基团。
本发明中,rs11820062是人类染色体11q13.1上的一个二等位多态性的snp位点,该变异是转换(g→a,在其互补链上则为c→t),所述rs11820062基因型是指基因型为gg、ga或aa;所述gg是rs11820062位点为g的野生基因型,所述aa是rs11820062位点为a的纯合突变基因型,所述ga是rs11820062位点为g和a的杂合突变基因型。所述检测人基因组中rs11820062的单核苷酸多态性或基因型具体是指检测rs11820062的核苷酸种类。本申请说明书实施例表明:携带rs11820062纯合突变aa基因型的个体,在hcv感染者(病例组)群体中的比例,高于携带纯合突变aa基因型的在未感染hcv人群(对照组)中的比例,因此认为,与携带rela基因rs11820062gg野生基因型相比,携带aa基因型的个体对丙型肝炎易感性更高。
进一步,本发明检测人基因组中rela基因rs11820062单核苷酸多态性(即等位基因)或基因型的物质包括taqman-pcr试剂,该试剂包括扩增rela基因rs11820062在内的基因组dna片段的pcr引物和taqman探针。
进一步,本发明中,所述pcr引物是指:正向引物核苷酸序列如seqidno.1所示,反向引物核苷酸序列如seqidno.2所示;所述taqman探针包括:检测野生等位基因g的探针(probe-g):在seqidno.3序列的5’端标记荧光报告基团fam,3’端标记非荧光猝灭nfq基团和dna小沟结合物mgb基团;以及检测突变等位基因a的探针(probe-a):在seqidno.4序列的5’端标记荧光报告基团vic,3’端标记非荧光猝灭nfq基团和dna小沟结合物mgb基团。
本发明申请中,所述的丙型肝炎特指为中国汉族人群的丙型肝炎。
本发明申请中所述的hcv感染者(病例组)为hcv自限性清除和持续性感染的合并人群,即:未经抗hcv治疗,且hcv抗体阳性(hcvrna阴性或阳性)的人群。本文所述的未感染hcv人群(对照组)为hcv抗体阴性且hcvrna阴性的非hcv感染人群。
本发明采用的taqman-mgb探针的5'端连接有荧光报告基团:6-羧基荧光素(fam)或六氯-6-甲基荧光素(vic),3'端连接有非荧光的淬灭基团(non-fluorescentquencher,nfq),其本身不产生荧光,但具有淬灭荧光报告基团所发射荧光的作用。探针上还连接了dna小沟结合物(minorgroovebinder,mgb)修饰基团,能嵌入dna双螺旋结构中的小沟,形成非共价结合,提高杂交链的稳定性。taqman-mgb探针比常规taqman探针具有更高的敏感性和特异性,是检测单碱基突变的有效工具。
pcr扩增刚开始时,探针完整,荧光报告基团与淬灭基团非常接近,荧光信号被淬灭基团吸收,此时检测不到荧光强度。待测产物进行pcr扩增时,taqman探针先与dna模板的序列互补部分结合,随着延伸反应的进行,taqdna聚合酶沿模板链移动,行至荧光报告基团的位置时,发挥5’→3’酶切活性将探针切断,这时荧光报告基团与淬灭基团分离,产生可检测到的荧光信号。每一条pcr新链的合成伴随着一个荧光信号的释放,信号强度与pcr产物的数量呈正比。随着扩增次数的不断增加,释放的荧光信号强度不断增强。通过实时动态检测反应中发射的荧光强度即可对样品孔中pcr产物进行基因分型。
在本发明中由1456名hcv感染者组成的病例组,和由1125名未感染hcv人群组成的对照组中,携带aa基因型的个体在病例组群体中的比例高于该基因型在未感染hcv人群(对照组)中的比例。这说明,与携带rela基因rs11820062gg野生基因型相比,携带aa基因型的个体对丙型肝炎易感性更高,相对危险度为1.531倍,具有统计学意义(p=0.002)。在相加模型、显性模型和隐性模型中,rs11820062a等位基因与hcv易感性的依然存在统计学相关,相对危险度依次为1.241倍(p=0.002)、1.354倍(p=0.003)和1.346倍(p=0.018)。在实际应用中,可将检测rs11820062的多态性(即等位基因)或基因型物质与其他物质(如检测其它的与丙型肝炎相关的单核苷酸多态性(即等位基因)或基因型物质)联合在一起制备筛查丙型肝炎易感者的产品。
本发明的一个实施例中,采用taqman-mgb探针法扩增包括rs11820062在内的基因组dna片段,以两种taqman荧光探针标记同一基因位点上的两种等位基因,使用abi7900ht型荧光定量pcr仪,在384孔板上检测出每一样品孔中探针的相对荧光强度,以终点读板程序判读分型结果,根据荧光信号的种类和强度确定基因型,可实现对大量样本的的高通量等位基因分型。
本发明根据待检测的snps位点,分别设计两条不同的探针和正向、反向引物,分别以fam和vic对探针进行荧光标记,并分析其特异性,确保每条引物与数据库中其它人类基因无同源性。进行taqman-pcr反应时,如果2条染色体的2个位点碱基相同、只发出一种荧光,即可判定为纯合基因型(aa或gg),并且可根据不同荧光信号区别纯合型基因的类型:野生型(gg)或纯合突变型(aa);当2个多态性位点碱基不同时,会有两种荧光信号,表明待测样品的基因型为杂合突变型(ag)。检测结果如附图1所示。
本发明在一个来自中国汉族人群的样本(1456名hcv感染者和1125名对照者)中发现rela基因rs11820062是与丙型肝炎易感性相关的单核苷酸多态性,可将检测rs11820062的单核苷酸多态性(即等位基因)或基因型的物质与其他物质(如检测其它的与丙型肝炎相关的单核苷酸多态性(即等位基因)或基因型物质)联合在一起制备筛查丙型肝炎易感者的产品。
附图说明
图1为taqman-mgb探针法对rela基因rs11820062位点的基因分型图。
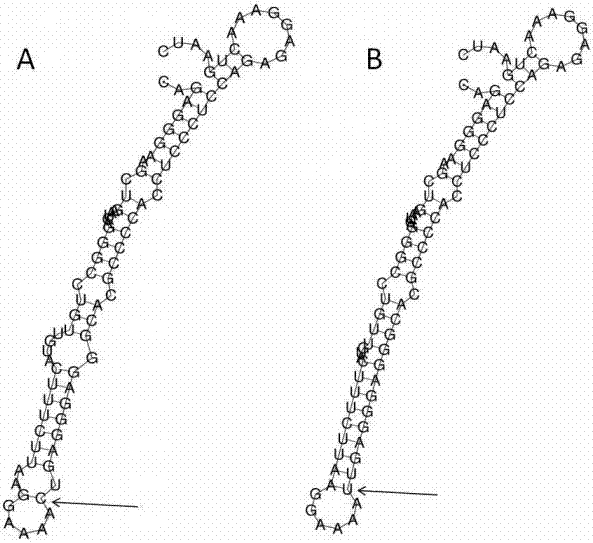
图2为rela基因5’端rs11820062位点附近mrna的重心二级结构示意图。
具体实施方式
下面结合具体实施方式,对本发明进行进一步的详细描述,给出的实施例仅为阐述本发明,而不是为了限制本发明的范围。
本发明实施例含有下述的材料、试剂,如无特殊说明,均可从商业途径得到。以下实施例涉及的核苷酸序列:
seqidno.1(rs11820062位点正向引物序列forwardprimer):
cttgactcagtttccctccacac;
seqidno.2(rs11820062位点反向引物序列reverseprimer):
gagggaaaacggggtaaggaatc;
seqidno.3(rs11820062位点probe-g):tccctcagttttc;
seqidno.4(rs11820062位点probe-a):tccctcaattttc;
seqidno.5(共用引物):aggaagacttccgagcggtc;
seqidno.6(hcv1a基因型特异引物):tgcctggggataggctgac;
seqidno.7(hcv1b基因型特异引物):gagccatcctgcccacccca;
seqidno.8(hcv2基因型特异引物):ccaagagggacgggaacctc;
seqidno.9(hcv3基因型特异引物):accctcgtttccgtacagag;
seqidno.10(hcv4基因型特异引物):gctgagcccaggaccggtcg;
seqidno.11(rs1056890位点正向引物序列forwardprimer):tgggcctcaggagcctag;
seqidno.12(rs1056890位点反向引物序列reverseprimer):
atcaaaagttcaggggcgctag;
seqidno.13(rs1056890位点probe-c):cacctccgagagc;
seqidno.14(rs1056890位点probe-t):cacctctgagagcc;
seqidno.15(rs11820062位点野生型mrna序列):
cagagggaagcugaaucagggccuguuguacuuucuuaaggaaaacugagggagggcacgccccaccucccuccagagaggaaacugaauc;
seqidno.16(rs11820062位点突变型mrna序列):
cagagggaagcugaaucagggccuguuguacuuucuuaaggaaaauugagggagggcacgccccaccucccuccagagaggaaacugaauc。
以下实施例中的实验方法,如无特殊说明,均为常规方法。
以下实施例中所有研究对象均签署了书面的知情同意书,本研究的方案经江苏省人民医院伦理委员会批准,符合2013年世界医学会新修订的赫尔辛基宣言中涉及人类医学研究的伦理准则的条款(worldmedicalassociation.worldmedicalassociationdeclarationofhelsinki:ethicalprinciplesformedicalresearchinvolvinghumansubjects.jama.2013,310(20):2191-2194.)。
研究对象:以下实施例总共纳入:(1)898名hcv持续性感染者:血清hcv抗体阳性(以abbott公司的第三代elisa法试剂盒检测),且hcvrna阳性,alt升高或正常;(2)558名hcv自限性清除者:血清hcv抗体阳性,且hcvrna阴性,alt升高或正常;(3)1125名对照者,血清hcv抗体阴性且hcvrna阴性。组(1)和组(2)合称为感染组(病例组)。对照组与持续感染组、自限性清除组在年龄(<5岁)、性别和地理地区(城、乡)方面匹配。排除合并感染其他肝炎病毒、hiv或以抗病毒药物进行治疗的患者。在研究期间,所有血清学的结果以连续12个月随访期间内的至少三次独立的实验验证。所有受试者由经验丰富的医生,在临床和实验室数据的基础上,以国际公认的标准诊断。
实施例1制备检测人基因组中rela基因rs11820062单核苷酸多态性或基因型的物质
1、基因组dna的提取
(1)edta抗凝管收集患者5ml外周静脉血血,4000rpm离心10min,分离血清、白细胞和红细胞,分装后一一编号,于-80℃冻存备用。
(2)采用酚-氯仿法抽提基因组dna:取3倍体积的细胞裂解液加入离心后血细胞,充分振荡混匀,室温裂解5min,4000rpm离心10min,弃除上清。
(3)观察沉淀颜色,若红色较深,则继续加细胞裂解液处理,破碎去除红细胞,直到离心沉淀物呈白色或浅粉色为止。
(4)取1ml基因组dna抽提液和8μl的蛋白酶k溶液,加至(3)所得的沉淀物中,充分混匀后,37℃水浴过夜。
(5)取出离心管放至冷却,加入1ml的tris饱和酚,压紧管盖,上下颠倒15min,充分混匀,4000rpm离心10min。
(6)取上清液转入另一支干净的离心管中,加入与上清液等体积的氯仿:异戊醇混合液(24:1),压紧管盖,上下颠倒15min,充分混匀,4000rpm离心10min,取上清,平均分装于2支干净的离心管。
(7)加入1/10体积的naac溶液(3mol/l),轻旋充分混匀。再加入等体积的-20℃预冷的冰无水乙醇,上下轻柔颠倒数次,肉眼可见白色絮状沉淀,以8000~10000rpm离心10min,弃上清。
(8)在白色的沉淀物中再次加入-20℃预冷的冰无水乙醇1ml,压紧管盖,上下振荡,冲刷管内壁dna掉落于管内溶液中。再以12000rpm离心10min,弃上清,重复操作一次。
(9)倒置离心管于洁净的滤纸干燥20min,或以真空干燥仪抽干乙醇。
(10)加入100μlte缓冲液,于4℃过夜,待dna完全溶解后,一一核对编号后,置于4℃冰箱。
(11)取200μldna溶液,稀释至100μl,以紫外分光光度法测定od260和od280的吸光度值,以od260确定dna浓度,l~20ng/μl符合实验要求;以od260/od280比值确定dna的纯度,1.8-1.9之间符合实验要求。
(12)根据所测dna浓度,取适量稀释至50-200ng/μl,使dna充分混匀后,置于4℃冰箱保存,以供pcr或taqman法snp基因分型时使用,其余高浓度的dna原溶液于-20℃冻存。
2、hcvrna提取
(1)取300μl血清,加入1ml的rnaisoplus,震荡混匀,室温静置5min。
(2)eppendorf管中加入200μl氯仿,手指压紧管盖,剧烈振荡15s,使管中液体充分乳化,不再分层,室温再次静置5min。
(3)置于冷冻高速离心机中,4℃,12000rpm,离心15min。
(4)吸取离心后的上清液,避免吸到中间白色层,加入新的干净的eppendorf管中,然后加入等体积的异丙醇,颠倒混匀,室温静置10min。
(5)置于冷冻高速离心机中,4℃,12000rpm,离心10min。
(6)吸出丢弃上清,沿eppendorf管壁缓慢加入1ml75%乙醇,轻轻颠倒洗涤管壁。
(7)置于冷冻高速离心机中,4℃,12000rpm,离心5min,吸尽上清。
(8)室温静置10min,干燥沉淀,加入适量水(rnase-free),以移液枪轻轻吹打,使沉淀充分,-80℃冻存。
3、hcvrna扩增
取5μl上一步中所得的hcvrna作为模板,70℃预变性10min,冰浴5min,依次加入以下试剂:5×buffer4μl、10mmol/ldntp1μl、20u/μlrnase0.5μl、50pmol/μl下游引物0.5μl、0.1mol/l二硫苏糖醇(dtt)2μl、m-mlv逆转录酶1μl、加入焦碳酸二乙酯(depc)的灭菌水11μl,反应体系总体积20μl。37℃逆转录1h,95℃灭活5min,迅速冰浴5min。
4、hcvrna定量
血样中hcvrna以由美国罗氏公司的cobastaqmanhcvtest试剂盒定量,具体操作步骤按试剂盒说明书进行。
5、hcv基因分型
(1)hcvrna阳性患者的基因分型:
取上述扩增产物5μl,分别加入5个eppendorf管中,每管含有0.5μl共用引物(核苷酸序列如seqidno.5所示)和含型特异的核心基因编码区引物的反应混合液,总反应体系为50μl。
巢式pcr扩增条件:94℃预变性3min,然后94℃1min、58℃1min、72℃1min共35个循环,72℃延伸10min。取5μl扩增产物进行琼脂糖凝胶电泳,根据片段大小判断hcv基因型。
表1hcv基因型检测引物
(2)hcvrna阴性患者的基因分型
采用murexhcvserotyping1-6assayelisa试剂盒,以基于hcv病毒型特异性抗体的elisa法对hcvrna阴性的自限性清除患者进行hcv基因分型检测(bhattacherjeev,prescottl,pikei,etal.useofns-4peptidestoidentifytype-specificantibodytohepatitiscvirusgenotypes1,2,3,4,5and6[j].journalofgeneralvirology,1995,76(7):1737-1748.)。
检测原理和简要步骤如下:hcv非结构区ns4区的2个高度变异的多肽序列,具有与hcv1~6基因型特异的线性抗原表位,据此人工合成1~6型特异的多肽抗原,包被微孔板。依次加入中和抗原和血清标本。中和抗原有7种不同类型,一种包含所有6型抗原,其余每种仅含1~6型中的5种特异性抗原,而依次缺少1~6型中的某一型抗原,将中和抗体按微量板f至a的顺序,每行依次加入,如标本中含有1型抗体,则不能被缺少1型抗原的中和抗原中和,而与包被微孔板的1型抗原结合。
混合液37℃温育1h后,洗涤去除未结合物质,捕获的特异性抗体,再与hrp标记的二抗igg结合,37℃1h后,加入显色底物,以酶标仪于450nm处测定od值。设未添加中和抗原的为对照h孔,加入所有6型中和抗原的为对照g孔,以“odh/odg≥0.1”、“odsample/odg≥0.4”确认抗体分型结果,具体操作及结果判定按说明书进行。
6、snp候选位点筛选
在hapmap(http://www.hapmap.org)中下载中国北京人群(chb)的snp数据库,导入haploview软件挑选标签snp(tagsnp):参数设定为关联系数r2大于0.8;在中国人群中具有较高频率,即最小等位基因频率(minorallelefrequency,maf)大于0.05。考虑到邻近序列特别是上游启动子区附近序列可能对基因有调控作用,分别将每个候选基因包含其转录起始点上游2000bp和下游2000bp序列纳入分析。另外,结合相关的文献,选择可能影响基因功能的tagsnp位点。根据以上原则,本实施例选择了2个候选位点:rs1056890和rs11820062。
rs11820062位于rela基因的内含子1号或5’端(来源于ncbidbsnp中两种不同的图形管道:https://www.ncbi.nlm.nih.gov/snp/),rela基因位于人类染色体11q13.1,含有11个外显子和10个内含子。rs1056890位于nf-κb2基因的3’-utr区域,nf-κb2基因位于人类染色体10q24.32,含有25个外显子和24个内含子。
7、snp位点基因分型
(1)根据人基因组rs11820062的snps位点,分别设计正向引物(如seqidno.1所示)和反向引物(如seqidno.2所示)和两条不同的探针,即分别以fam和vic对探针进行荧光标记(检测野生型等位基因g的探针:seqidno.3所示的核苷酸序列,且5'端连接有荧光报告基团fam,3'端标记非荧光猝灭nfq基团和dna小沟结合物mgb;检测突变型等位基因a的探针:seqidno.4所示的核苷酸序列,且5'端连接有荧光报告基团vic,3'端标记非荧光猝灭nfq基团和dna小沟结合物mgb,并分析其特异性,确保每条引物与数据库中其它人类基因无同源性。
根据人基因组rs1056890的snps位点,分别设计正向引物(如seqidno.11所示)和反向引物(如seqidno.12所示)和两条不同的探针,即分别以fam和vic对探针进行荧光标记(检测野生型等位基因c的探针:seqidno.13所示的核苷酸序列,且5'端连接有荧光报告基团fam,3'端标记非荧光猝灭nfq基团和dna小沟结合物mgb;检测突变型等位基因t的探针:seqidno.14所示的核苷酸序列,且5'端连接有荧光报告基团vic,3'端标记非荧光猝灭nfq基团和dna小沟结合物mgb,并分析其特异性,确保每条引物与数据库中其它人类基因无同源性。
(2)将待测的dna样本统一稀释到10ng/μl,分装至96孔板,用于随后的排枪加样。将引物和探针干粉以12000rpm离心5min,离心完毕后轻轻打开管盖,以免干粉开盖后喷出。然后加入适量的无菌双蒸水,稀释探针/引物到指定浓度,充分振荡使混匀。
(3)将探针、引物、pcrmastermix溶液12000rpm离心30秒,分别混匀。分装到96孔板的dna样本也以微孔板专用离心机离心1min混匀。然后配制pcr体系如表2所示:
表2taqmanpcr体系配制
上述表2体系即为检测人基因组中rela基因rs11820062单核苷酸多态性或基因型的物质;本实施例中获得的上述物质为包括扩增rela基因rs11820062位点在内的基因组dna片段的pcr引物和taqmanmgb探针的taqmanpcr试剂,在具体实施中,也可以使用其他本领域常规的检测snp基因型的试剂或试剂盒。
实施例2rela基因rs11820062单核苷酸多态性或基因型的应用
1、检测步骤
将实施例1获得的检测人基因组中rela基因rs11820062单核苷酸多态性或基因型的物质(即按照表2体系配制好的体系溶液)分装至8个无菌pcr管。调整排枪量程为5μl,取体系液加入384孔板中,最后再加入dna样本1μl/孔。每板设置2个空白对照(无菌双蒸水),2个已知的阳性对照,以控制试剂、系统污染和检测结果。
(1)以专用的taqmanpcr封膜,将加好样的384孔板封严,离心1min。装入7900ht型荧光定量pcr仪,设置pcr反应条件:50℃预变性5min,95℃始变性10min,95℃退火30秒,60℃延伸30秒,35个循环。
(2)pcr反应结束后,在7900ht荧光定量pcr仪上以appliedbiosystems公司的sequencedetectionsystem软件(sds,版本2.3)读出基因分型结果。
2个snp的位点的基因分型成功率约为95%。
进行taqman-pcr反应时,如果2个多态性位点碱基相同、只发出一种荧光,即可以判定为纯合基因型,并且可根据不同荧光信号区别纯合型基因的类型:野生基因型或纯合突变型;当2个多态性位点碱基不同时,会有两种荧光信号,表明待测样品携带的snps基因型为杂合突变型。rs11820062基因型检测结果如附图1所示,图1中,gg表示表野生gg基因型,ga代表杂合突变ga基因型,aa代表纯合突变aa基因型。
2、质量控制
对所有的研究参与者使用结构标准化问卷面谈记录。问卷收集了文献所报道的hcv感染的主要危险因素,包括性别、年龄、地区、hcv感染史、丙肝环境风险因素暴露史。本研究制定了流行病学调查工作手册和实验检测标准化操作规程,统一培训所有工作人员,以保证本研究中调查资料和实验室测定的数据质量。所有调查表及数据由工作人员编码,两人各自独立录入计算机,双方复核无误后建立数据库。所有检测结果由两名研究者以盲法分别进行判读,即两者不知所测样本来源患者的临床及其他数据。对检测不成功或判读有疑问的样本重复实验,直到测得结果一致。每组分别随机抽取5%的样品重复检测,一致率达100%。
3、统计分析
两名工作人员用epidata3.1软件双轨录入问卷资料及检测结果,经逻辑检查核对后,建立数据库,用spss软件(版本21.0)和stata(版本13)进一步分析。定量变量以平均值(mean)±标准偏差(sd),或中位数(四分位间距(iqr))表示。病例组和对照组之间人口学特征,hcv患者生物学指标和等位基因分布频率的差异,用χ2检验、单因素方差分析(one-wayanova)或非参数kruskal-wallis检验。拟合优度pearson'sχ2检验用于评估对照组的基因型分布是否符合hardy-weinberg平衡。多因素的logistic回归分析计算优势比(ors)和95%置信区间(cis),分析hcv感染的高危因素。分层分析用于控制混杂因素对统计结果的影响。以bonferroni法校正多重比较,此方法最保守,双侧p值<0.025具有统计学意义。非多重比较处,双侧p值<0.05具有统计学意义。
4、研究对象的社会人口学及临床特征
所有研究对象的社会人口学及临床特征如表3所示。持续性感染组包括874例患者(341名男性,533名女性,平均年龄为49.73±10.96岁)。自限性病毒清除组包括557人(225名男性,332名女性,平均年龄为49.01±13.54岁)。健康对照组包括1124名未感染者(422名男性,702名女性,平均年龄为49.54±14.48岁)。三组间的年龄和性别没有显著差异(p>0.05),三组之间alt水平、ast水平、感染途径与对照组存在显著差异(p<0.001),且持续性感染组和自限性清除组的感染病毒型存在显著差异(p<0.001)。
表3hcv持续感染组、自限性清除组和对照组的人口学及临床特征
备注:groupa:对照组(未感染组),groupb:自限性清除组,groupc:持续性感染组,group(b+c):感染组(病例组)。mean:平均值;sd:标准偏差;alt:丙氨酸氨基转移酶;ast:天门冬氨酸氨基转移酶;iqr:四分位间距;a单因素方差分析(one-wayanova);bχ2-检验;ckruskal–wallis检验。
5、hardy-weinberg遗传平衡检验
本研究所涉及的2个snp位点(rs1056890和rs11820062),未感染组作为对照组,rs1056890:p=0.834;rs11820062:p=0.179。p均大于0.05,说明2个位点在对照组的分布频率符合hardy-weinberg平衡,对照组具有人群代表性。
6、nf-κb通路基因多态性与hcv感染易感性的关联分析
nf-κb通路基因中2个snp位点(rs1056890和rs11820062)的基因型分布频率及以三种遗传模型(相加模型、显性模型和隐性模型)分析snp与hcv感染易感性、转归的关联见表4。
表4nf-κb信号通路基因中snps位点与hcv感染易感性、转归的logistic回归分析
备注:ci:置信区间,hcv:丙型肝炎病毒,or:比值比,snp:单核苷酸多态性。
groupa:对照组(未感染组),groupb:自限性清除组,groupc:持续性感染组,group(b+c):感染组(病例组)。
alogistic回归调整后的p值、or值和95%置信区间,调整因素为性别、年龄及感染途径。
blogistic回归调整后的p值、or值和95%置信区间,调整因素为性别、年龄及感染途径。采用bonferroni法对多重比较进行校正,p<0.025(0.05/2)为有统计学差异。
字体加粗者为数据有统计学差异。
经logistic回归调整性别、年龄、alt水平和感染途径这些混杂因素后,结果提示,rs11820062aa基因型携带者感染hcv的风险升高,相对危险度为1.531倍,具有统计学意义(p=0.002)。在相加模型、显性模型和隐性模型中,rs11820062a等位基因与hcv易感性的依然存在统计学相关,相对危险度依次为1.241倍(p=0.002)、1.354倍(p=0.003)和1.346倍(p=0.018)。
以性别、年龄、感染途径作为分层因素,对nf-κb通路基因中rs11820062位点与hcv感染易感性、转归风险进一步的分层分析,见表5。
表5nf-κb信号通路基因中的rs11820062位点与hcv感染易感性、转归关系的分层分析
备注:hcv:丙型肝炎病毒,ci:置信区间,or:比值比,snp:单核苷酸多态性。
groupa:对照组(未感染组),groupb:自限性清除组,groupc:持续性感染组,group(b+c):感染组(病例组)。
alogistic回归调整后的p值、or值和95%置信区间,调整因素为性别、年龄、感染途径。
blogistic回归调整后的p值、or值和95%置信区间,调整因素为性别、年龄、感染途径。字体加粗者为数据有统计学差异。
研究人群按平均年龄,被分为<50岁和≥50岁亚组,用于进一步分析。如表5所示,在年龄<50岁的亚组、女性亚组及有偿献血亚组中,rs11820062a等位基因与hcv易感性存在统计学关联(p值均<0.05),年龄<50岁的亚组的相对危险度为1.494倍(p=0.007),女性亚组的相对危险度为1.353倍(p=0.020),有偿献血亚组的相对危险度为1.494倍(p=0.009)。
7、nf-κb通路基因多态性与hcv自限性清除的关联分析
经logistic回归调整性别、年龄、alt水平、病毒基因型和感染途径这些混杂因素后,未发现rs1056890和rs11820062的基因型分布频率与hcv感染的自限性清除有统计学相关(p均>0.05,见表4、表5)。
8、rs11820062位点二级结构预测
rela基因rs11820062位点野生型和突变型mrna序列(突变位置上下游各50bp)分别如seqidno.15和seqidno.16所示。
为了预测rs11820062位点的突变对rela基因的影响,我们采用在线工具rnafoldwebserver(http://rna.tbi.univie.ac.at/cgi-bin/rnawebsuite/rnafold.cgi)对其mrna的二级结构进行了预测,其结果如附图2所示。突变位置在图中箭头所示处。图2中,不同等位基因型的mrna重心二级结构(具有碱基对最小距离的结构)的最低能量分别为:野生型:-22.50kcal/mol(图2a)和-27.70kcal/mol(图2b)。结果表明,该位点突变前后,维持结构所需要的能量不同,因此可能影响该位置附近的转录因子的结合及rela基因的转录后调控,推测其可能是rs11820062位点与hcv易感性相关的潜在分子机制。
因此,申请人认为,rela基因rs11820062的单核苷酸多态性与丙型肝炎易感性相关,在具体实施中,可利用rela基因rs11820062多态性制备筛查丙型肝炎易感者的产品或检测或筛查与丙型肝炎相关的单核苷酸多态性的产品,如将检测rs11820062的单核苷酸多态性或基因型的物质(如表2所述taqmanpcr体系)与其他物质(如其它检测与丙型肝炎相关的单核苷酸多态性或基因型的物质)或仪器联合在一起制备筛查丙型肝炎易感者的产品或检测或筛查与丙型肝炎相关的单核苷酸多态性的产品,具有广阔的应用前景。
序列表
<110>南京医科大学第一附属医院
南京医科大学
南京大学医学院附属鼓楼医院
<120>rela基因rs11820062snp在制备检测丙型肝炎易感性产品中的应用
<141>2017-10-27
<160>16
<170>siposequencelisting1.0
<210>1
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>1
cttgactcagtttccctccacac23
<210>2
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>2
gagggaaaacggggtaaggaatc23
<210>3
<211>13
<212>dna
<213>人工序列(artificialsequence)
<400>3
tccctcagttttc13
<210>4
<211>13
<212>dna
<213>人工序列(artificialsequence)
<400>4
tccctcaattttc13
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
aggaagacttccgagcggtc20
<210>6
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>6
tgcctggggataggctgac19
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>7
gagccatcctgcccacccca20
<210>8
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>8
ccaagagggacgggaacctc20
<210>9
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>9
accctcgtttccgtacagag20
<210>10
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>10
gctgagcccaggaccggtcg20
<210>11
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>11
tgggcctcaggagcctag18
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>12
atcaaaagttcaggggcgctag22
<210>13
<211>13
<212>dna
<213>人工序列(artificialsequence)
<400>13
cacctccgagagc13
<210>14
<211>14
<212>dna
<213>人工序列(artificialsequence)
<400>14
cacctctgagagcc14
<210>15
<211>91
<212>rna
<213>人工序列(artificialsequence)
<400>15
cagagggaagcugaaucagggccuguuguacuuucuuaaggaaaacugagggagggcacg60
ccccaccucccuccagagaggaaacugaauc91
<210>16
<211>91
<212>rna
<213>人工序列(artificialsequence)
<400>16
cagagggaagcugaaucagggccuguuguacuuucuuaaggaaaauugagggagggcacg60
ccccaccucccuccagagaggaaacugaauc91
- 还没有人留言评论。精彩留言会获得点赞!