新型AAV8突变衣壳和含有其的组合物的制作方法
申请人据此以引用的方式将以电子形式随本文一起提交的序列表材料并入。这个文件标记为“upn-16-7726pct_st25.txt”。
发明背景
腺相关病毒(aav)在人基因疗法中具有极大前景,并且由于它能够提供长期基因表达以及缺乏病原性而已被广泛用于在各种研究中靶向肝、肌肉、心脏、脑、眼、肾和其它组织。aav属于细小病毒科,并且各自含有由两个反向末端重复序列侧接的单链dna。已报道几十种天然存在的aav衣壳,它们的独特衣壳结构使得它们能够识别和转导不同细胞类型和器官。
自从始于1981年的首个试验以来,在基于腺相关病毒(aav)载体的基因疗法的临床试验中,尚未报道任何载体相关毒性。aav载体在临床试验中不断积累的安全性记录联合经证明的功效显示aav是用以共同操作的良好平台。另一具有吸引力的特征是aav相对易于操作,因为aav是具有小型基因组(约4.7kb)和简单遗传组分–反向末端重复序列(itr)、rep和cap基因的单链dna病毒。在aav载体中仅需要itr和aav衣壳蛋白,其中itr充当用于载体产生的复制和包装信号,而衣壳蛋白通过形成衣壳以容纳载体基因组dna,决定组织向性,以及将载体基因组dna递送至靶标细胞中来起主要作用。已主要存在四种方式来获得aav衣壳基因:从培养物或组织样品分离aav,aav定向进化,改组以及合理设计。
已显示aav8会有效转导肝、肌肉。此外,在患有重度b型血友病的患者中,通过单次外周静脉输注达成的经aav8介导的hfix基因转移始终导致fix转基因以治疗水平长期表达,而无急性或持久毒性。
aav载体在基因转移中具有许多优势,但仍然有一些问题待解决。因此,需要更有效的aav载体。
技术实现要素:
在一个方面,提供一种腺相关病毒。病毒包含aav8突变衣壳。在一个实施方案中,衣壳具有序列seqidno:18,并且被称为aav3g1。在另一实施方案中,衣壳具有序列seqidno:20,并且被称为aav8.t20。在另一实施方案中,衣壳具有序列seqidno:22,并且被称为aav8.tr1。在另一方面,提供一种编码如本文所述的衣壳的核酸。在一个实施方案中,衣壳由seqidno:17或与其共有至少95%同一性的序列编码。在另一实施方案中,衣壳由seqidno:19或与其共有至少95%同一性的序列编码。在另一实施方案中,衣壳由seqidno:21或与其共有至少95%同一性的序列编码。
在另一实施方案中,包括aav8突变衣壳的aav至少包括vp3衣壳,其相较于天然aav8(seqidno:34)在以下区域中的至少一个中具有突变:i.氨基酸263至267(seqidno:78);ii.氨基酸457至氨基酸459;iii.氨基酸455至氨基酸459(seqidno:81);或iv.氨基酸583至氨基酸597(seqidno:69)。在一个实施方案中,相较于aav8,具有aav8突变衣壳的aav在靶标组织中具有增加的转导。在一个实施方案中,靶标组织是肌肉、肝、肺、气道上皮、神经元、眼或心脏。在另一实施方案中,相较于天然aav8,具有aav8突变衣壳的aav具有增加的逃脱aav中和抗体的能力。
在一个实施方案中,vp1和/或vp2独特区域源于与提供vp3独特区域的aav(即aav8)不同的aav。在一个实施方案中,提供vp1和vp2序列的aav是rh.20。在一个实施方案中,rh.20vp1序列是seqidno:88。
在另一实施方案中,aav进一步包括aav反向末端重复序列和异源性核酸序列,所述核酸序列可操作地连接至指导由所述异源性核酸序列编码的产物在靶标细胞中表达的调控序列。
在另一方面,提供一种转导靶标组织的方法。在一个实施方案中,方法包括施用具有如本文所述的衣壳的aav。在一个实施方案中,提供一种转导肝组织的方法,其包括施用具有aav3g1衣壳的aav。在另一实施方案中,提供一种转导肌肉组织的方法,其包括施用具有aav3g1衣壳的aav。在另一实施方案中,提供一种转导气道上皮的方法,其包括施用具有aav3g1或aav8.t20衣壳的aav。在另一实施方案中,提供一种转导肝组织的方法,其包括施用具有aav8.tr1衣壳的aav。在另一实施方案中,提供一种转导眼部细胞的方法,其包括施用具有aav3g1衣壳的aav。
在另一方面,提供一种产生相较于野生型衣壳,具有增加的靶标组织转导的突变aav衣壳的方法。方法包括在针对野生型衣壳的中和抗体的接触区处进行诱变;以及在单克隆抗体存在下进行体外选择。在一个实施方案中,方法包括在衣壳的高变区处进行额外突变。在另一实施方案中,方法进一步包括用来自不同aav衣壳的vp1和/或vp2序列取代vp1和/或vp2独特序列。
在另一方面,提供一种产生包含aav衣壳的重组腺相关病毒(aav)的方法。在一个实施方案中,方法包括培养含有以下各物的宿主细胞:(a)编码aav衣壳蛋白的分子,相较于天然aav8(seqidno:34),衣壳在以下区域中的至少一个中具有突变:i.氨基酸263至267(seqidno:78);ii.氨基酸457至氨基酸459;iii.氨基酸455至氨基酸459(seqidno:81);或iv.氨基酸583至氨基酸597(seqidno:69);(b)功能性rep基因;(c)包含aav反向末端重复序列(itr)和转基因的小基因;和(d)足以容许所述小基因包装至所述aav衣壳蛋白中的辅助功能物。
在另一方面,提供一种重组腺相关病毒(aav)。在一个实施方案中,raav包括具有选自以下的氨基酸序列的aav衣壳:seqidno:2、4、6、8、10、12、14、16、18、20、22、24、26、28、30和32。所述衣壳有时在本文中称为“aav8突变衣壳”。raav进一步包括非aav核酸序列。在另一方面,提供一种编码aav衣壳序列的核酸分子。在一个实施方案中,核酸序列选自seqidno:1、3、5、7、9、11、13、15、17、19、21、23、25、27、29和31。
在另一方面,提供一种aav衣壳蛋白。相较于天然aav8(seqidno:34),aav衣壳在以下区域中的至少一个中具有突变:i.氨基酸263至267(seqidno:78);ii.氨基酸457至氨基酸459;iii.氨基酸455至氨基酸459(seqidno:81);或iv.氨基酸583至氨基酸597(seqidno:69)。在另一方面,提供一种编码如本文所述的aav衣壳的核酸序列。
在另一方面,提供一种用如本文所述的腺相关病毒转染的宿主细胞。
在另一方面,提供一种组合物,其至少包含如本文所述的aav以及生理上可相容的载剂、缓冲剂、佐剂和/或稀释剂。
在另一方面,提供一种将转基因递送至细胞中的方法。方法包括使细胞与如本文所述的aav接触的步骤,其中所述raav包含转基因。
附图说明
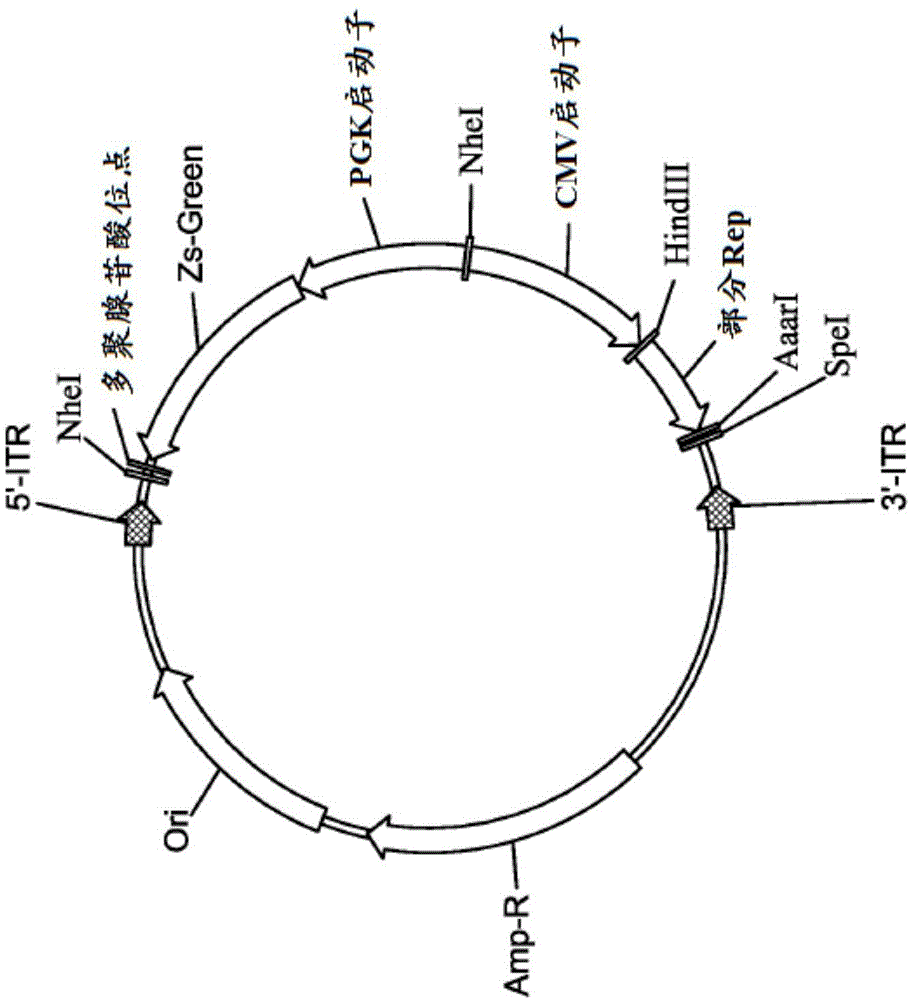
图1a提供用于aav突变体文库构建的质粒的图谱。
图1b说明aav突变体文库构建的选择过程。
图2a是说明在抗体-衣壳接触位点处的诱变赋予体外nab抗性的条形图。hek293细胞由携带cmv.egfp、与培养基(无ab)、抗体adk8、adk8/9或adk9混合的aav8和突变体感染。m.o.i.是约1e4。2天后,获取和分析gfp图像。参见实施例2b2。
图2b是说明在抗体-衣壳接触位点处的诱变赋予体内nab抗性的散点图。将aav8突变体装填以tbg.犬f9-wpre盒,并且在存在/不存在抗体adk8下通过静脉内注射来在b6中测试。在载体注射之前2小时,静脉内注射100ul稀释adk8。aav8用作对照。用elisa自施用之后1周收集的血浆测量犬f9水平。来自adk8存在动物的f9相对于来自adk8不存在动物的f9的百分比和p值(t检验)显示在上方。参见实施例2b6。
图3a-图3b是如本文所述的aav8、aav3g1、aav8.t20和aav8.tr1的蛋白质比对。
图4a说明相较于aav8,aav3g1对汇合人ivig(hivig)具有抗性。使携带cb7.ci.荧光素酶盒的aav8(实心条)或aav3g1(空心条)与各种稀释度的汇合人ivig一起孵育,随后施加于96孔板中的huh7细胞(m.o.i.约1e4)。在感染之后72小时读取荧光素酶水平。x轴是hivig的稀释倍数。y轴代表相较于“单独载体”对照的荧光素酶表达百分比。灰色点线指示50%表达水平。
图4b说明aav3g1中的所有三个突变都促进nab抗性。用人血浆(4个样品)和抗aav8猴血清(4个样品)在体外测试aav8、aav3g1和携带构成aav3g1的三个突变的所有组合的突变体。使aav8和变体与稀释血清/血浆(混合物中最终抗aav8nab滴度1:4)一起孵育,随后施加于96孔板中的huh7细胞。72小时后读取荧光素酶表达,并且换算成各“单独载体”对照的表达水平的百分比。对于各血清/血浆,根据它们的残余表达对各载体指定等级数值(最高残余表达的等级数值是1,并且最低是8)。参见实施例2c。
图5a是用携带cb7.ci.荧光素酶盒的aav8或aav3g1肌肉内注射的小鼠的照片。以3x1010gc/小鼠的剂量向b6肌肉中施用载体,4只小鼠/组。在给药之后2周和4周监测荧光素酶活性。这些研究结果说明通过肌肉内注射,相较于aav8,aav3g1偏好肌肉而非肝。参见实施例2c。
图5b是在肌肉内注射携带与图5a中所示的转基因盒不同的转基因盒的aav载体之后的肌肉组织的照片。这些实验显示aav3g1在b6小鼠中的类似肌肉偏好。剂量,1x109gc/动物,5x108gc/25ul/腿,两条腿。在载体注射之后第3周,肌肉切片,x-gal染色,各组的最佳切片,4x。
图5c.肌肉内注射携带第三转基因盒tmck.人f9的aav载体显示aav3g1在b6小鼠中的类似肌肉偏好。tmck是肌肉特异性启动子。剂量,3e10gc/小鼠,3只小鼠/组。分别在给药之后28和30天收集血浆和肌肉。通过elisa自血浆和肌肉溶解产物测量人f9。aav3g1的肌肉f9表达水平是aav8的11.2倍。参见实施例2b6。
图5d.第28天血浆的中和抗体滴度显示aav8的抗原性和aav3g1的抗原性不同。血浆样品来自图5c的研究。参见实施例2b6。
图6a.来自接受aav8或aav3g1载体的小鼠的心脏、肌肉和肝的x-gal染色切片的概述。mps3ahet小鼠(b6背景)静脉内接受5e11gc的aav.cmv.lac/小鼠。14天后收集组织。各动物的代表性肌肉切片在4x下。参见实施例2c。
图6b.用以比较静脉内施用于b6小鼠中的具有cb7.ci.ff荧光素酶转基因盒的aav8和aav3g1的代表性体内荧光素酶成像图像。剂量,3e11gc/小鼠,在载体注射之后第2周。左侧是aav8;右侧是aav3g1。参见实施例2c。
图7a.aav3g1对小鼠气道上皮细胞具有较高转导,并且通过用rh.20替换vp12区域,转导得以进一步改进。b6小鼠鼻内接受1e11gc/小鼠的aav.cb7.ci.荧光素酶。在载体施用之后2、3和4周监测荧光素酶活性。右侧图是研究的代表性图像(第4周)。左侧图是用living
图7b.aav8、aav8.t20、aav9和aav6.2的气道上皮细胞转导比较。b6小鼠鼻内接受1e11gc/小鼠的aav.cb7.ci.荧光素酶,4只小鼠/载体。在载体施用之后1、2和3周监测荧光素酶活性。living
图8a.aav3g1的肝素亲和力增加。在dpbs中稀释aav载体,并且将2e11gc的载体上样于肝素柱上,随后用dpbs和具有各种浓度的nacl的dpbs洗涤。采用抗体b1,用pvdf膜进行点印迹。
图8b.aav8.tr1的电荷降低使它的肝素亲和力降低。在tris缓冲液(ph7.4,0.01m)中使相等gc的aav8.tr1.tbg.hf9co.wpre.bgh和aav3g1.cb7.ci.荧光素酶.rbg混合在一起,上样于肝素柱上,并且依序用各种缓冲液洗涤。在过程期间收集级分:ft+w,流过液加具有tris缓冲液的洗涤液,0.05m-2.0m,tris缓冲液加0.052.0mnacl。采用bgh和rbg探针,通过qpcr来测量载体分布。
图8c显示使aav3g1的电荷降低而产生的突变aav8.tr1部分地恢复肝转导。以1e10gc/小鼠的剂量,用aav.tbg.hf9co.wpre.rbg向b6小鼠静脉内施用,5只小鼠/组。在载体注射之后第1、2和4周收集血浆,并且通过人f9elisa来测量。
图8d提供体外huh7nab测定的结果。报告蛋白:cb7.ci.ff荧光素酶;m.o.i.约1e3。样品是来自与图8c相同的研究的各组3个动物的第4周血浆。
图8e提供来自图8c的小鼠的载体基因组拷贝分布。
图9提供paav.de.0的图谱。
图10提供paav.de.1的图谱。
图11提供paav.de.1.hvr.i的图谱。
图12提供paav.de.1.hvr.iv的图谱。
图13a是显示用aav.tbg.人f9以1e10gc/小鼠静脉内注射的小鼠(5只小鼠/组)中的人f9表达(ng/ml)的图。在处理之后1、2和4周收集血浆。
图13b是显示在图13a的小鼠中在第4周时针对aav8的中和抗体滴度的图。huh7细胞与1e9gc/ml的最终浓度的aav8.cb7.荧光素酶一起使用。指示各组的平均值。
图14提供paavinvivo的图谱。
图15是用aav3g1.tmck.pi.ffluc.bgh(dd-pcr(pk)),以3e9或3e10gc/小鼠、1条腿/小鼠肌肉内注射的雄性b6小鼠的照片,3只小鼠/组。显示第1周结果。对于各图,左侧是经aav8处理,右侧是经aav3g1处理。
具体实施方式
受近年来自临床试验的鼓舞性结果所激励,基于腺相关病毒(aav)的基因疗法正显示日益增加的前景。直至现时,利用衣壳的aav载体已显示用于体内基因递送的巨大潜力,其中在血管内输注之后在啮齿动物中达成几乎完全转导许多组织。因此,aav8是用于设计改进载体的合理起点。为推进平台,本文提供具有增加的中和抗体抗性、产率、表达或转导的aav8突变体。方法涉及使用aav来靶向各种组织和治疗各种病状。
除非另外定义,否则本文所用的技术和科学术语具有与由本发明所属领域普通技术人员所通常理解以及通过查阅出版的教科书所通常理解相同的含义,所述教科书向本领域技术人员提供对本申请中使用的许多术语的一般性指导。以下定义仅为明晰起见而提供,并且不意图限制要求保护的本发明。如本文所用,术语“一个(种)(a/an)”是指一个(种)或多个(种),例如“一个(种)眼部细胞”应理解为代表一个(种)或多个(种)眼部细胞。因此,术语“一个(种)”、“一个(种)或多个(种)”和“至少一个(种)”在本文中可互换使用。除非另外规定,否则如本文所用,术语“约”意指从给与的参照值具有10%可变性。尽管说明书中的各种实施方案使用“包含”措辞加以呈现,但在其它情况下,也意图使用“由…组成”或“基本上由…组成”措辞来解释和描述相关实施方案。
关于以下描述,意图本文所述的各组合物在另一实施方案中都适用于本发明方法中。此外,也意图在本文中描述为适用于方法中的各组合物在另一实施方案中都自身是本发明的一实施方案。
如本文所用,术语“靶标组织”可指意图由主题aav载体转导的任何细胞或组织。所述术语可指肌肉、肝、肺、气道上皮、神经元、眼(眼部细胞)或心脏中的任何一者或多者。在一个实施方案中,靶标组织是肝。在另一实施方案中,靶标组织是眼。
如本文所用,术语“眼部细胞”是指眼中或与眼的功能相关的任何细胞。所述术语可指感光细胞(包括视杆细胞、视锥细胞和光敏神经节细胞)、视网膜色素上皮(rpe)细胞、穆勒(mueller)细胞、双极细胞、水平细胞、无长突细胞中的任何一者或多者。在一个实施方案中,眼部细胞是双极细胞。在另一实施方案中,眼部细胞是水平细胞。在另一实施方案中,眼部细胞是神经节细胞。
如本文所用,术语“哺乳动物受试者”或“受试者”包括需要本文所述的治疗或防治的方法的任何哺乳动物,特别包括人。需要所述治疗或防治的其它哺乳动物包括狗、猫或其它驯化动物、马、家畜、实验室动物,包括非人灵长类动物等。受试者可为雄性或雌性。
如本文所用,术语“宿主细胞”可指raav在其中由质粒产生的包装细胞系。在替代方案中,术语“宿主细胞”可指需要转基因在其中表达的靶标细胞。
a.aav衣壳
如本文所述的重组aav衣壳蛋白的特征在于相较于天然全长(vp1)aav8衣壳序列(seqidno:34),可变蛋白3(vp3)在以下区域中中的至少一个中具有突变:i.氨基酸263至267(seqidno:78);ii.氨基酸457至氨基酸459;iii.氨基酸455至氨基酸459(seqidno:81);或iv.氨基酸583至氨基酸597(seqidno:69)。相较于aav8,具有这种衣壳的aav在靶标组织中具有增加的转导。本发明也涵盖编码本文所述的新型aav、衣壳及其片段的核酸序列。
如本文所用,术语“天然”是指在衣壳蛋白的i.氨基酸263至267;ii.氨基酸457至氨基酸459;iii.氨基酸455至氨基酸459;或iv.氨基酸583至氨基酸597(使用aav8编号)中不具有突变的天然aav序列。然而,不意图仅有天然存在的aav8是野生型序列的来源。在本文中适用的是非天然存在的aav,包括不限于重组aav、经修饰或经改变aav、经改组aav、嵌合aav、杂合aav、经进化aav、合成aav、人工aav等。倘若它们用作用于产生本文所述的突变衣壳的“起始序列”,那么这包括除在i.氨基酸263至267;ii.氨基酸457至氨基酸459;iii.氨基酸455至氨基酸459;或iv.氨基酸583至氨基酸597(使用aav8编号)中以外的衣壳的各区域中具有突变的aav。
aav衣壳由归因于替代性起始密码子使用而在长度方面不同的三个重叠编码序列组成。这些可变蛋白被称为vp1、vp2和vp3,其中vp1最长,而vp3最短。aav粒子由全部三种衣壳蛋白以约1:1:10(vp1:vp2:vp3)的比率组成。在n末端包含在vp1和vp2中的vp3是构造粒子的主要结构组分。衣壳蛋白可使用若干不同编号系统来提及。为方便起见,如本文所用,aav序列使用以代表vp1的第一残基的氨基酸1起始的vp1编号来提及。然而,本文所述的衣壳蛋白包括在蛋白质的相应区域中具有突变的vp1、vp2和vp3(在本文中可与vp1、vp2和vp3互换使用)。在aav8中,使用全长vp1的编号,可变蛋白对应于vp1(氨基酸1至738)、vp2(氨基酸138至738)和vp3(氨基酸204至738)。天然aav8vp1的氨基酸序列以seqidno:34显示。
aav衣壳含有遍及aav分离株显示最大序列趋异性的9个高变区(hvr)。参见govindasamy等,jvirol.2006年12月;80(23):11556-70.电子出版2006年9月13日,其以引用的方式并入本文。因此,当合理设计新载体时,hvr是有意义的靶标。在一个实施方案中,aav衣壳在hvrviii区域中具有突变。在一个实施方案中,提供一种相较于aav8天然序列,在氨基酸583-氨基酸597中具有突变的aav衣壳。在一个实施方案中,aav衣壳具有如以下在表1中显示的氨基酸583-597序列。本文涵盖衣壳蛋白和具有衣壳蛋白的raav,所述衣壳蛋白具有包括表1中显示的一个氨基酸序列的vp1、vp2和/或vp3序列。
表1:衣壳突变
在hvr.1和hvr.iv区域处进行额外突变。因此,在一个实施方案中,aav衣壳在氨基酸263至氨基酸267中具有突变。在一个实施方案中,aav衣壳具有突变263ngtsg267(seqidno:78)-->sgth(seqidno:79)。在另一实施方案中,aav衣壳具有突变263ngtsg267(seqidno:78)-->sdth(seqidno:80)。本文涵盖衣壳蛋白和具有衣壳蛋白的raav,所述衣壳蛋白具有包括氨基酸序列seqidno:79或seqidno80中的一者的vp1、vp2和/或vp3序列。
在一个实施方案中,aav衣壳在氨基酸457至氨基酸459中具有突变。在另一实施方案中,aav衣壳在氨基酸455至氨基酸459中具有突变。在一个实施方案中,aav衣壳具有突变457tan459-->srp。在一个实施方案中,aav衣壳具有突变455ggtan459(seqidno:81)-->dgsgl(seqidno:82)。本文涵盖衣壳蛋白和具有衣壳蛋白的raav,所述衣壳蛋白具有包括氨基酸序列seqidno:79或seqidno80中的一者的vp1、vp2和/或vp3序列。
在另一实施方案中,aav8衣壳(或本文所述的其它aav衣壳)的vp1/vp2独特区域可用来自不同衣壳的vp1/vp2区域替换。在一个实施方案中,vp1/vp2独特区域用rh.20的vp1/vp2独特区域替换。在aav8中,使用aav8vp1编号,vp2起始于氨基酸138,并且vp3起始于氨基酸204。因此,在一个实施方案中,aav8的vp1/2区域(氨基酸1至203)被调换成另一衣壳的相应部分(vp1/2)。经调换衣壳中的vp1/2区域可具有相同或不同氨基酸长度。举例来说,在aavrh.20中,vp1/2区域跨越那个序列(seqidno:88)的氨基酸1至202。参见limberis等,molther.2009年2月;17(2):294–301(其以引用的方式并入本文)。在另一实施方案中,vp1/vp2独特区域用aav1、aav6、aav9、rh.8、rh.10、rh.20、hu.37、rh.2r、rh.43、rh.46、rh.64r1、hu.48r3或cy.5r4的vp1/vp2独特区域替换。vp1/2区域可易于基于本领域中可用的比对来确定。参见例如wo2006/110689,其以引用的方式并入本文。
aav衣壳vp1orf包括第二orf,其编码aav装配活化蛋白(aap)。orf2的aap编码序列在vp3编码序列之前起始。aav8aap天然编码序列以seqidno:35显示。天然aap氨基酸序列以seqidno:36显示。在一个实施方案中,使aavvp1orf突变以产生替代性aap氨基酸序列。因此,在一个实施方案中,aavvp1核酸序列与天然aav8编码序列共有至少95%同一性。在另一实施方案中,aavvp1核酸序列包括以seqidno:37显示的orf2(aap编码序列)。在另一实施方案中,aavaap氨基酸序列以seqidno:38显示。参见sonntag等,aviralassemblyfactorpromotesaav2capsidformationinthenucleolus,procnatlacadsciusa.2010年6月1日;107(22):10220–10225,其以引用的方式并入本文。
如以下实施例中所示,本发明者已显示被称为aav3g1(也有时称为aav8.triple或triple)的aav有效转导肝、肌肉和气道上皮。实际上,采用各种转基因盒诸如cb7.ci.ff荧光素酶、cmv.lacz和tmck.人f9,以肌肉内与静脉内两种方式,相较于天然aav8,aav3g1均显示转导增加至10倍。aav3g1突变体的另一认定益处是它显示对猴和人的各种抗血清以及人ivig的抗性(关于人ivig,处于是aav8的抗性的2至4倍的水平下)。此外,鼻内施用aav3g1导致的气道上皮转导效率是aav8的气道上皮转导效率的2至3倍。因此,在一个实施方案中,aav衣壳具有aav3g1的如以seqidno:18显示的序列。
如以下实施例中所示,被称为aav8.t20的aav以是aav8的约10倍的水平转导气道上皮。因此,在一个实施方案中,aav衣壳具有aav8.t20的如以seqidno:20显示的序列。
如以下实施例中所示,被称为aav8.tr1的aav有效转导肝。因此,在一个实施方案中,aav衣壳具有aav8.tr1的如以seqidno:22显示的序列。
在另一实施方案中,提供一种具有以seqidno:2显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:4显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:6显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:8显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:10显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:12显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:14显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:16显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:18显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:20显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:22显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:24显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:26显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:28显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:30显示的序列的aav衣壳。在另一实施方案中,提供一种具有以seqidno:32显示的序列的aav衣壳。在另一实施方案中,aav衣壳具有如以seqidno:2、4、6、8、10、12、14、16、18、20、22、24、26、28、30或32(其显示vp1序列)中的任一者显示的vp1、vp2或vp3蛋白。
在另一方面,提供编码本文所述的aav病毒、衣壳和片段的核酸序列。因此,在一个实施方案中,提供一种编码seqidno:2、4、6、8、10、12、14、16、18、20、22、24、26、28、30或32的核酸。在一个实施方案中,提供一种编码aav3g1衣壳(seqidno:18)的核酸。在另一实施方案中,提供一种编码aav8.t20衣壳(seqidno:20)的核酸。在另一实施方案中,提供一种编码aav8.tr1衣壳(seqidno:22)的核酸。在一个实施方案中,编码aav3g1的核酸序列以seqidno:17显示。在一个实施方案中,编码aav8.t20的核酸序列以seqidno:19显示。在一个实施方案中,编码aav8.tr1的核酸序列以seqidno:21显示。在另一实施方案中,编码衣壳的核酸序列以seqidno:1、3、5、7、9、11、13、15、17、19、21、23、25、27、29或31或与这些序列中的任一者共有至少80%同一性的序列显示。在另一实施方案中,核酸分子也编码功能性aavrep蛋白。
b.raav载体和组合物
在另一方面,本文描述利用本文所述的aav衣壳序列(包括其片段)来产生适用于将异源性基因或其它核酸序列递送至靶标细胞中的病毒载体的分子。在一个实施方案中,适用于本文所述的组合物和方法中的载体至少含有编码如本文所述的所选aav衣壳例如aav3g1、aav8.t20或aav.tr1衣壳或其片段的序列。在另一实施方案中,适用载体至少含有编码所选aav血清型rep蛋白例如aav8rep蛋白或其片段的序列。任选地,所述载体可含有aavcap蛋白与rep蛋白两者。在其中提供aavrep与cap两者的载体中,aavrep序列和aavcap序列可均具有一个血清型来源,例如全都具有aav8来源。或者,可使用其中rep序列来自与提供cap序列的野生型aav不同的aav的载体。在一个实施方案中,rep序列和cap序列从单独来源(例如单独载体、或宿主细胞和载体)表达。在另一实施方案中,这些rep序列同框融合于不同aav血清型的cap序列以形成嵌合aav载体,诸如以引用的方式并入本文的美国专利号7,282,199中所述的aav2/8。任选地,载体进一步含有小基因,其包含由aav5'itr和aav3'itr侧接的所选转基因。在另一实施方案中,aav是自身互补性aav(sc-aav)(参见us2012/0141422,其以引用的方式并入本文)。自身互补性载体包装可折叠成dsdna的反向重复基因组,而不需要dna合成或多个载体基因组之间的碱基配对。因为scaav不需要在表达之前使单链dna(ssdna)基因组转变成双链dna(dsdna),所以它们是更高效载体。然而,这个效率的折衷方案是损失载体的一半编码容量。scaav适用于小型蛋白质编码基因(直至约55kd)和任何当前可用的基于rna的疗法。
在一个方面,本文所述的载体含有编码如本文所述的完整aav衣壳的核酸序列。在一个实施方案中,衣壳包含seqidno:18、20或22的氨基酸1至738。在另一实施方案中,aav具有重组aav衣壳,所述重组aav衣壳相较于天然aav8(seqidno:34),在以下区域中的至少一个中包含突变:i.氨基酸263至267(seqidno:78);ii.氨基酸457至氨基酸459;iii.氨基酸455至氨基酸459(seqidno:81);或iv.氨基酸583至氨基酸597(seqidno:69)。在一个实施方案中,相较于aav8,aav在靶标组织中具有增加的转导。在一个实施方案中,aav具有包括263ngtsg267(seqidno:78)-->sgth(seqidno:79)或263ngtsg267(seqidno:78)-->sdth(seqidno:80)的突变。在另一实施方案中,aav具有包括457tan459-->srp或455ggtan459(seqidno:81)-->dgsgl(seqidno:82)的突变。在另一实施方案中,aav具有包括583adnlqqqntapqigt597(seqidno:69)-->gdnlqlyntapgsvf(seqidno:70)的突变。在另一实施方案中,aav具有以下突变:263ngtsg267(seqidno:78)-->sgth(seqidno:79)、457tan459-->srp、以及583adnlqqqntapqigt597(seqidno:69)-->gdnlqlyntapgsvf(seqidno:70)。
在另一实施方案中,aav具有其中vp1/vp2独特区域已用来自不同于aav8的衣壳的vp1/vp2独特区域替换的衣壳蛋白。在一个实施方案中,vp1/vp2独特区域来自aavrh.20。在一个实施方案中,rh.20vp1序列是seqidno:88。
其中一种aav的衣壳用异源性衣壳蛋白替换的假型载体(pseudotypedvector)在本文中是适用的。出于说明目的,与aav2itr一起利用本文所述的aav8突变衣壳的aav载体用于下述实施例中。参见mussolino等(以上引用)。除非另外规定,否则aavitr和本文所述的其它所选aav组分可个别地从包括不限于以下的任何aav血清型之中加以选择:aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9或其它已知和未知aav血清型。在一个合乎需要的实施方案中,使用aav血清型2的itr。然而,可选择来自其它适合血清型的itr。这些itr或其它aav组分可易于使用可为本领域技术人员所用的技术来从某一aav血清型分离。所述aav可从学术来源、商业来源或公共来源(例如美国典型培养物保藏中心(americantypeculturecollection),manassas,va)分离或获得。或者,aav序列可通过参照公开序列诸如可在文献中或在数据库诸如像genbank、pubmed等中获得的序列,通过合成或其它适合手段来获得。在一个实施方案中,aav包含序列seqidno:17,其对应于aav3g1的全长dna编码序列。在另一实施方案中,aav包含序列seqidno:19,其对应于aav8.t20的全长dna序列。在另一实施方案中,aav包含序列seqidno:21,其对应于aav8.tr1的全长dna序列。
本文所述的raav也包含小基因。小基因至少由如下所述的异源性核酸序列(转基因)和它的调控序列、以及5’和3’aav反向末端重复序列(itr)组成。就是这个小基因被包装至衣壳蛋白中,并且递送至所选靶标细胞中。
转基因是对于侧接于转基因的载体序列是异源性的核酸序列,其编码目标多肽、蛋白质或其它产物。核酸编码序列以容许转基因在靶标细胞中转录、翻译和/或表达的方式操作性地连接于调控组分。异源性核酸序列(转基因)可源于任何生物体。aav可包含一个或多个转基因。
转基因序列的组成将取决于所得载体将被置于的用途。举例来说,一种类型的转基因序列包括报告基因序列,其在表达后产生可检测信号。所述报告基因序列包括不限于编码以下各物的dna序列:β-内酰胺酶、β-半乳糖苷酶(lacz)、碱性磷酸酶、胸苷激酶、绿色荧光蛋白(gfp)、增强gfp(egfp)、氯霉素乙酰基转移酶(cat)、荧光素酶、针对其的高亲和力抗体存在或可通过常规手段产生的膜结合蛋白(包括例如cd2、cd4、cd8、流感血凝素蛋白和本领域中熟知的其它膜结合蛋白)和包含适当融合于尤其来自血凝素或myc的抗原标签结构域的膜结合蛋白的融合蛋白。
这些编码序列在与驱动它们的表达的调控元件相关联时提供可通过常规手段检测的信号,所述常规手段包括酶促测定、放射摄影测定、比色测定、荧光测定或其它光谱测定、荧光激活细胞分选测定和免疫测定,包括酶联免疫吸附测定(elisa)、放射免疫测定(ria)和免疫组织化学分析。举例来说,当标记序列是lacz基因时,携带信号的载体的存在性通过针对β-半乳糖苷酶活性的测定来检测。当转基因是绿色荧光蛋白或荧光素酶时,携带信号的载体可在光度计中通过颜色产生或光产生来目视测量。
然而,合乎需要的是,转基因是编码适用于生物学和医学中的产物诸如蛋白质、肽、rna、酶、显性负性突变体或催化rna的非标记序列。合乎需要的rna分子包括trna、dsrna、核糖体rna、催化rna、sirna、小发夹rna、反式剪接rna和反义rna。适用rna序列的一个实例是抑制或压制所靶向核酸序列在所治疗动物中表达的序列。通常,适合靶标序列包括肿瘤学靶标和病毒性疾病。对于所述靶标的实例,参见以下在与免疫原相关的部分中鉴定的肿瘤学靶标和病毒。
转基因可用于修正或改善基因缺陷,所述基因缺陷可包括其中正常基因以小于正常水平表达的缺陷或其中功能性基因产物不表达的缺陷。或者,转基因可向细胞提供不天然地在所述细胞类型中或在宿主中表达的产物。优选类型的转基因序列编码在宿主细胞中表达的治疗性蛋白质或多肽。本发明进一步包括使用多个转基因。在某些情况下,不同转基因可用于编码蛋白质的各亚单位,或编码不同肽或蛋白质。这在编码蛋白质亚单位的dna的大小较大时是合乎需要的,例如对于免疫球蛋白、血小板源性生长因子或肌营养不良蛋白(dystrophinprotein)。为使细胞产生多亚单位蛋白质,将细胞用含有各不同亚单位的重组病毒感染。或者,蛋白质的不同亚单位可由同一转基因编码。在这个情况下,单一转基因包括编码各亚单位的dna,其中各亚单位的dna由内部核酶进入位点(ires)分隔。这在编码各亚单位的dna的大小较小时是合乎需要的,例如编码亚单位的dna和ires的总大小小于5千碱基。作为ires的替代物,dna可由编码在翻译后事件中自我裂解的2a肽的序列分隔。参见例如m.l.donnelly等,j.gen.virol.,78(pt1):13-21(1997年1月);furler,s.等,genether.,8(11):864-873(2001年6月);klumph.等,genether.,8(10):811-817(2001年5月)。这个2a肽显著小于ires,从而使得它充分适合于在空间是限制因素时使用。更经常地,当转基因较大,由多亚单位组成,或两个转基因被共同递送时,携带所需转基因或亚单位的raav被共同施用以使它们在体内进行多联以形成单一载体基因组。在这种实施方案中,第一aav可携带表达单一转基因的表达盒,并且第二aav可携带表达不同转基因的表达盒以达成在宿主细胞中共同表达。然而,所选转基因可编码任何生物活性产物或其它产物例如合乎研究需要的产物。
由转基因编码的适用的治疗性产物包括激素以及生长和分化因子,包括不限于胰岛素、升糖素、生长激素(gh)、甲状旁腺激素(pth)、生长激素释放因子(grf)、卵泡刺激激素(fsh)、促黄体生成激素(lh)、人绒毛膜促性腺激素(hcg)、血管内皮生长因子(vegf)、促血管生成素、血管抑素、粒细胞集落刺激因子(gcsf)、红血球生成素(epo)、结缔组织生长因子(ctgf)、碱性纤维母细胞生长因子(bfgf)、酸性纤维母细胞生长因子(afgf)、表皮生长因子(egf)、转化生长因子α(tgfα)、血小板源性生长因子(pdgf)、胰岛素生长因子i和ii(igf-i和igf-ii)、转化生长因子β超家族中的任一者(包括tgfβ)、活化素、抑制素、或骨形态发生蛋白质(bmp)bmp1-15中的任一者、调蛋白/神经调节蛋白/aria/neu分化因子(ndf)家族的生长因子中的任一者、神经生长因子(ngf)、脑源性神经营养因子(bdnf)、神经营养素nt-3和nt-4/5、睫状神经营养因子(cntf)、神经胶质细胞系源性神经营养因子(gdnf)、神经秩蛋白、集聚蛋白(agrin)、脑信号蛋白/脑衰蛋白家族中的任一者、导素-1(netrin-1)和导素-2、肝细胞生长因子(hgf)、肝配蛋白、头蛋白(noggin)、音猬因子和酪氨酸羟化酶。
其它适用的转基因产物包括调控免疫系统的蛋白质,包括不限于细胞因子和淋巴因子诸如血小板生成素(tpo)、白介素(il)il-1至il-25(包括il-2、il-4、il-12和il-18)、单核细胞趋化蛋白、白血病抑制因子、粒细胞-巨噬细胞集落刺激因子、fas配体、肿瘤坏死因子α和β、干扰素α、β和γ、干细胞因子、flk-2/flt3配体。由免疫系统产生的基因产物也适用于本发明中。这些包括不限于免疫球蛋白igg、igm、iga、igd和ige、嵌合免疫球蛋白、人源化抗体、单链抗体、t细胞受体、嵌合t细胞受体、单链t细胞受体、i类和ii类mhc分子以及工程改造的免疫球蛋白和mhc分子。适用的基因产物也包括补体调控蛋白诸如互补调控蛋白、膜辅因子蛋白(mcp)、衰变加速因子(daf)、cr1、cf2和cd59。
其它适用的基因产物包括激素、生长因子、细胞因子、淋巴因子、调控蛋白和免疫系统蛋白质的受体中的任一者。本发明涵盖用于胆固醇调控的受体,包括低密度脂蛋白(ldl)受体、高密度脂蛋白(hdl)受体、极低密度脂蛋白(vldl)受体和清道夫受体。本发明也涵盖诸如类固醇激素受体超家族的成员(包括糖皮质素受体和雌激素受体)、维生素d受体和其它核受体的基因产物。此外,适用基因产物包括转录因子,诸如jun、fos、max、mad、血清应答因子(srf)ap-1、ap2、myb、myod和肌细胞生成素、含有ets框的蛋白、tfe3、e2f、atf1、atf2、atf3、atf4、zf5、nfat、creb、hnf-4、c/ebp、sp1、ccaat框结合蛋白、干扰素调控因子(irf-1)、威尔姆斯肿瘤(wilmstumor)蛋白、ets结合蛋白、stat、gata框结合蛋白例如gata-3、以及叉头家族的翼状螺旋蛋白(wingedhelixprotein)。
其它适用基因产物包括氨基甲酰基合成酶i、鸟氨酸转氨甲酰酶、精氨丁二酸合成酶、精氨丁二酸裂解酶、精氨酸酶、反丁烯二酰基乙酰乙酸水解酶、苯丙氨酸羟化酶、α-1抗胰蛋白酶、葡萄糖-6-磷酸酶、胆色素原脱氨酶、因子viii、因子ix、胱硫醚β合成酶、支链酮酸脱羧酶、白蛋白、异戊酰基-辅酶a脱氢酶、丙酰基辅酶a羧化酶、甲基丙二酰基辅酶a变位酶、戊二酰基辅酶a脱氢酶、胰岛素、β-葡萄糖苷酶、丙酮酸羧化酶、肝磷酸化酶、磷酸化酶激酶、甘氨酸脱羧酶、h-蛋白、t-蛋白、囊性纤维化跨膜调控子(cftr)序列和肌营养不良蛋白cdna序列。其它适用基因产物包括诸如可适用于酶补充疗法中的酶,所述酶补充疗法适用于由缺乏酶活性所致的多种病状中。举例来说,含有甘露糖-6-磷酸的酶可用于针对溶酶体贮积病的疗法中(例如适合基因包括编码β-葡萄糖醛酸苷酶(gusb)的基因)。
其它适用的基因产物包括非天然存在的多肽,诸如具有含有插入、缺失或氨基酸取代的非天然存在的氨基酸序列的嵌合或杂合多肽。举例来说,单链工程改造的免疫球蛋白可适用于某些免疫受损患者中。其它类型的非天然存在的基因序列包括可用于使靶标的过度表达降低的反义分子和催化核酸诸如核酶。
使基因的表达降低和/或对基因的表达的调节特别合乎治疗特征在于细胞过度增殖的过度增生性病状的需要,也合乎治疗癌症和牛皮癣的需要。靶标多肽包括相较于正常细胞,仅仅在过度增殖性细胞中产生或以较高水平在过度增殖性细胞中产生的那些多肽。靶标抗原包括由致癌基因诸如myb、myc、fyn以及易位基因bcr/abl、ras、src、p53、neu、trk和egrf编码的多肽。除致癌基因产物作为靶标抗原之外,用于抗癌治疗和保护性方案的靶标多肽包括由b细胞淋巴瘤产生的抗体的可变区和t细胞淋巴瘤的t细胞受体的可变区,其在一些实施方案中也用作自体免疫疾病的靶标抗原。其它肿瘤相关多肽可用作靶标多肽,诸如以较高水平见于肿瘤细胞中的多肽,包括由单克隆抗体17-1a识别的多肽和叶酸结合多肽。
其它适合的治疗性多肽和蛋白质包括可适用于通过以下方式来治疗罹患自体免疫疾病和病症的个体的那些:赋予针对与自体免疫性相关的靶标的广泛保护性免疫应答,所述靶标包括细胞受体和产生针对自身的抗体的细胞。t细胞介导的自体免疫疾病包括类风湿性关节炎(ra)、多发性硬化症(ms)、休格连氏综合征(
或者,或此外,本发明的载体可含有本发明的aav序列和编码诱导对所选免疫原的免疫应答的肽、多肽或蛋白质的转基因。举例来说,免疫原可选自多种病毒科。将需要针对其的免疫应答的合乎需要的病毒科的实例包括微小核糖核酸病毒科,其包括鼻病毒属,其导致约50%的普通感冒病例;肠病毒属,其包括脊髓灰质炎病毒、柯萨奇病毒、埃可病毒和人肠病毒诸如甲型肝炎病毒;以及口蹄疫病毒属,其导致主要是在非人动物中的足口病。在微小核糖核酸病毒科的病毒内,靶标抗原包括vp1、vp2、vp3、vp4和vpg。另一病毒科包括萼状病毒科,其涵盖是流行性胃肠炎的重要病原体的诺瓦克(norwalk)组病毒。合乎在对抗原进行靶向时使用以在人和非人动物中诱导免疫应答需要的另一病毒科是外衣病毒科,其包括α病毒属,其包括辛德毕斯病毒(sindbisvirus)、罗斯河病毒(rossrivervirus)以及委内瑞拉马脑炎病毒、东部马脑炎病毒和西部马脑炎病毒;以及风疹病毒属,包括风疹病毒。黄病毒科包括登革热(dengue)病毒、黄热病病毒、日本脑炎病毒、圣路易斯(st.louis)脑炎病毒和蜱传播脑炎病毒。其它靶标抗原可从丙型肝炎或冠状病毒科产生,所述冠状病毒科包括许多非人病毒诸如传染性支气管炎病毒(家禽)、猪可传播胃肠病毒(猪)、猪血凝性脑脊髓炎病毒(猪)、猫传染性腹膜炎病毒(猫)、猫肠冠状病毒(猫)、犬冠状病毒(狗)和人呼吸道冠状病毒,其可导致普通感冒和/或非甲、乙或丙型肝炎。在冠状病毒科内,靶标抗原包括e1(也称为m或基质蛋白)、e2(也称为s或刺突蛋白)、e3(也称为he或血凝素-elterose)糖蛋白(不存在于所有冠状病毒中)或n(核衣壳)。可针对弹状病毒科来靶向其它抗原,所述弹状病毒科包括水疱病毒属(例如水泡性口炎病毒)和丽沙病毒属(例如狂犬病)。在弹状病毒科内,适合抗原可源于g蛋白或n蛋白。包括出血热病毒诸如马尔堡(marburg)病毒和埃博拉(ebola)病毒的丝状病毒科可为适合抗原来源。副粘病毒科包括1型副流感病毒、3型副流感病毒、3型牛副流感病毒、德国麻疹病毒(腮腺炎病毒(mumpsvirus))、2型副流感病毒、4型副流感病毒、新城病病毒(鸡)、牛瘟病毒、包括麻疹病毒和犬瘟热病毒的麻疹病毒、以及包括呼吸道融合性病毒的肺病毒。流感病毒被分类在正粘病毒科内,并且是适合抗原(例如ha蛋白、n1蛋白)来源。布尼亚病毒科包括布尼亚病毒属(拉克罗斯加利福尼亚脑炎(californiaencephalitis,lacrosse))、白蛉病毒属(里夫特山谷热(riftvalleyfever))、汉坦病毒属(普马拉(puremala)是一种出血热病毒)、内罗毕病毒属(内罗毕绵羊病)和各种未指定的本雅病毒(bungavirus)。沙粒病毒科提供针对lcm和拉沙热(lassafever)病毒的抗原来源。呼肠孤病毒科包括呼肠孤病毒属、轮状病毒属(其导致儿童急性胃肠炎)、环状病毒属和科罗拉多蜱传热病毒属(cultivirus)(科罗拉多蜱传热(coloradotickfever)、莱邦博病毒(人)、马器质性脑病、蓝舌病)。
逆转录病毒科包括致癌病毒亚科,其涵盖诸如猫白血病病毒、htlvi和htlvii的人疾病和兽医学疾病病毒;慢病毒亚科(其包括人免疫缺陷病毒(hiv)、猿猴免疫缺陷病毒(siv)、猫免疫缺陷病毒(fiv)、马传染性贫血病毒)和泡沫病毒亚科。在hiv与siv之间,许多适合抗原已被描述,并且可易于选择。适合hiv和siv抗原的实例包括不限于gag、pol、vif、vpx、vpr、env、tat和rev蛋白以及其各种片段。此外,已描述对这些抗原的多种修饰。适于这个目的的抗原为本领域技术人员所知。举例来说,可选择编码gag、pol、vif、和vpr、env、tat和rev以及其它蛋白质的序列。参见例如描述于美国专利5,972,596中的经修饰gag蛋白。也参见描述于d.h.barouch等,j.virol.,75(5):2462-2467(2001年3月)以及r.r.amara等,science,292:69-74(2001年4月6日)中的hiv和siv蛋白。这些蛋白质或其亚单位可单独递送,或通过单独载体或由单一载体组合递送。
乳多空病毒科包括多瘤病毒亚科(bku和jcu病毒)和乳头状瘤病毒亚科(与癌症、或乳头状瘤的恶性进展相关)。腺病毒科包括导致呼吸道疾病和/或肠炎的病毒(ex、ad7、ard、o.b.)。细小病毒科包括猫细小病毒(猫肠炎)、猫泛白细胞减少症病毒、犬细小病毒和猪细小病毒。疱疹病毒科包括α疱疹病毒亚科,其涵盖单纯病毒属(hsvi、hsvii)、水痘病毒属(假性狂犬病病毒、水痘带状疱疹病毒);以及β疱疹病毒亚科,其包括巨细胞病毒属(hcmv、鼠巨细胞病毒);和γ疱疹病毒亚科,其包括淋巴潜隐病毒属、ebv(伯基特氏淋巴瘤)、传染性鼻气管炎病毒、马立克氏病(marek'sdisease)病毒和猴病毒属。痘病毒科包括脊椎动物痘病毒亚科,其涵盖正痘病毒属(痘疮(天花)和痘苗(牛痘))、副痘病毒属、禽痘病毒属、羊痘病毒属、野兔痘病毒属、猪痘病毒属;以及昆虫痘病毒亚科。嗜肝dna病毒科包括乙型肝炎病毒。可为适合抗原来源的一种未分类病毒是丁型肝炎病毒。其它病毒来源可包括禽传染性腔上囊病病毒和猪呼吸和繁殖综合征病毒。α病毒科包括马动脉炎病毒和各种脑炎病毒。
本发明也可涵盖适用于使人或非人动物针对感染人和非人脊椎动物的其它病原体(包括细菌、真菌、寄生微生物或多细胞寄生物)进行免疫或来自癌细胞或肿瘤细胞的免疫原。细菌性病原体的实例包括病原性革兰氏阳性球菌,包括肺炎球菌(pneumococci);葡萄球菌(staphylococci);和链球菌(streptococci)。病原性革兰氏阴性球菌包括脑膜炎球菌(meningococcus);淋球菌(gonococcus)。病原性肠革兰氏阴性杆菌包括肠杆菌科(enterobacteriaceae);假单胞菌(pseudomonas)、不动杆菌(acinetobacteria)和埃肯菌(eikenella);类鼻疽(melioidosis);沙门氏菌(salmonella);志贺氏菌(shigella);嗜血杆菌(haemophilus);莫拉菌(moraxella);杜克嗜血杆菌(h.ducreyi)(其导致软下疳(chancroid));布鲁氏菌(brucella);野兔热弗朗西斯氏菌(franisellatularensis)(其导致野免热);耶尔森氏菌(yersinia)(巴斯德菌(pasteurella));念珠状链杆菌(streptobacillusmoniliformis)和螺旋菌(spirillum);革兰氏阳性杆菌包括单核细胞增多性李斯特菌(listeriamonocytogenes);红斑丹毒丝菌(erysipelothrixrhusiopathiae);白喉棒杆菌(corynebacteriumdiphtheria)(白喉);霍乱菌;炭疽杆菌(b.anthracis)(炭疽);杜诺凡病(donovanosis)(腹股沟肉芽肿(granulomainguinale))菌;和巴尔通氏体病(bartonellosis)菌。由病原性厌氧细菌引起的疾病包括破伤风;肉毒杆菌中毒;其它梭菌病;结核病;麻风病;和其它分支杆菌病。病原性螺旋体疾病包括梅毒;密螺旋体病:雅司病(yaws)、品他病(pinta)和地方性梅毒;以及钩端螺旋体病(leptospirosis)。由高等病原体细菌和病原性真菌引起的其它感染包括放线菌病;诺卡氏菌病;隐球菌病、芽生菌病、组织胞浆菌病和球孢子菌病;假丝酵母病、曲霉病和毛霉菌病;孢子丝菌病;副球孢子菌病、霉样真菌病、球拟酵母病、足分枝菌病和着色真菌病;以及皮肤真菌病。立克次氏体感染包括斑疹伤寒(typhusfever)、洛基山斑疹热(rockymountainspottedfever)、q热和立克次氏体痘(rickettsialpox)。支原体和衣原体感染的实例包括:肺炎支原体感染;性病淋巴肉芽肿;鹦鹉病(psittacosis);和围产期衣原体感染。病原性真核生物涵盖病原性原虫和蠕虫,并且由其产生的感染包括:阿米巴病;疟疾;利什曼病;锥虫病;弓浆虫病;卡氏肺囊虫(pneumocystiscarinii)病;trichans;刚地弓形虫(toxoplasmagondii)病;巴贝虫病;贾第鞭毛虫病;旋毛虫病;丝虫病;血吸虫病;线虫病;吸虫病或片形吸虫病;和条虫(绦虫)感染。
这些生物体和/或由其产生的毒素中的许多已由疾病控制中心[(cdc),美国卫生与公众服务部(departmentofhealthandhumanservices,usa)]鉴定为有潜力用于生物攻击中的作用物。举例来说,这些生物剂中的一些包括炭疽芽孢杆菌(bacillusanthracis)(炭疽)、肉毒梭菌(clostridiumbotulinum)和它的毒素(肉毒杆菌中毒)、鼠疫耶尔森氏菌(yersiniapestis)(瘟疫)、重型天花(variolamajor)(天花)病毒、野兔热弗朗西斯氏菌(francisellatularensis)(野免热)和病毒性出血热病毒,其全都在当前被分类为a种类作用物;伯氏考克斯氏体(coxiellaburnetti)(q热);布鲁氏菌属种(布鲁氏杆菌病)、鼻疽伯克霍尔德氏菌(burkholderiamallei)(鼻疽)、蓖麻(ricinuscommunis)和它的毒素(篦麻毒素)、产气荚膜梭菌(clostridiumperfringens)和它的毒素(ε毒素)、葡萄球菌属(staphylococcus)种和它们的毒素(肠毒素b),其全都在当前被分类为b种类作用物;以及立百病毒(nipanvirus)和汉坦病毒(hantavirus),其在当前被分类为c种类作用物。此外,这样分类或以不同方式分类的其它生物体可在未来被鉴定和/或用于这种目的。将易于了解的是,本文所述的病毒载体和其它构建体适用于递送来自这些生物体、病毒、它们的毒素或其它副产物的抗原,此将预防和/或治疗由这些生物剂达成的感染或其它不利反应。
针对t细胞的可变区来施用本发明的载体以递送免疫原引发用以消除那些t细胞的免疫应答,包括ctl。在类风湿性关节炎(ra)的情况下,已表征在疾病中涉及的t细胞受体(tcr)的若干特定可变区。这些tcr包括v-3、v-14、v-17和vα-17。因此,递送编码这些多肽中的至少一者的核酸序列将引发将靶向ra中涉及的t细胞的免疫应答。在多发性硬化症(ms)的情况下,已表征在疾病中涉及的tcr的若干特定可变区。这些tcr包括v-7和vα-10。因此,递送编码这些多肽中的至少一者的核酸序列将引发将靶向ms中涉及的t细胞的免疫应答。在硬皮病的情况下,已表征在疾病中涉及的tcr的若干特定可变区。这些tcr包括v-6、v-8、v-14和vα-16、vα-3c、vα-7、vα-14、vα-15、vα-16、vα-28和vα-12。因此,递送编码这些多肽中的至少一者的核酸分子将引发将靶向硬皮病中涉及的t细胞的免疫应答。
在一个合乎需要的实施方案中,选择转基因以提供光遗传疗法。在光遗传疗法中,通过向在剩余视网膜回路中的存活细胞类型进行光活化通道或泵的基因递送来构建人造光受体。这特别适用于已丧失大量光受体功能,但两极细胞向神经节细胞和视神经的回路系统保持完整的患者。在一个实施方案中,异源性核酸序列(转基因)是视蛋白(opsin)。视蛋白序列可源于任何适合的单细胞或多细胞生物体,包括人、藻类和细菌。在一个实施方案中,视蛋白是视紫红质(rhodopsin)、光视蛋白(photopsin)、l/m波长(红色/绿色)视蛋白或短波长(s)视蛋白(蓝色)。在另一实施方案中,视蛋白是通道视紫红质或盐细菌视紫红质。
在另一实施方案中,选择转基因以用于基因加强疗法中,即用以提供缺失或缺陷性基因的补充拷贝。在这个实施方案中,转基因可易于由本领域技术人员选择以提供必要补充基因。在一个实施方案中,缺失/缺陷性基因与眼部病症相关。在另一实施方案中,转基因是nyx、grm6、trpm1l或gpr179,并且眼部病症是先天性静止性夜盲症。参见例如zeitz等,amjhumgenet.2013年1月10日;92(1):67-75.电子出版2012年12月13日,其以引用的方式并入本文。在另一实施方案中,转基因是rpgr。
在另一实施方案中,选择转基因以用于基因抑制疗法中,即在转录或翻译水平上打断或抑制一个或多个天然基因的表达。这可使用短发夹rna(shrna)或本领域中熟知的其它技术来实现。参见例如sun等,intjcancer.2010年2月1日;126(3):764-74以及o'reillym等amjhumgenet.2007年7月;81(1):127-35,其以引用的方式并入本文。在这个实施方案中,转基因可易于由本领域技术人员基于需要被沉默的基因来选择。
在另一实施方案中,转基因包括超过一个转基因。这可使用携带两个或更多个异源性序列的单一载体,或使用两个或更多个各自携带一个或多个异源性序列的aav来实现。在一个实施方案中,aav用于基因抑制(或敲低)和基因加强共疗法。在敲低/加强共疗法中,使目标基因的缺陷性拷贝沉默,并且提供非突变拷贝。在一个实施方案中,这使用两个或更多个共同施用的载体来实现。参见millington-ward等,moleculartherapy,2011年4月,19(4):642–649,其以引用的方式并入本文。转基因可易于由本领域技术人员基于所需结果来选择。
在另一实施方案中,选择转基因以用于基因修正疗法中。这可使用例如锌指核酸酶(zfn)诱导的dna双链断裂与外源性dna供体底物联合来实现。参见例如ellis等,genetherapy(电子出版2012年1月)20:35-42,其以引用的方式并入本文。转基因可易于由本领域技术人员基于所需结果来选择。
在一个实施方案中,本文所述的衣壳适用于美国临时专利申请号61/153,470、62/183,825、62/254,225和62/287,511中所述的crispr-cas双载体系统中,所述美国临时专利申请各自以引用的方式并入本文。衣壳也适用于递送归巢核酸内切酶或其它兆碱基大范围核酸酶。
在另一实施方案中,在本文中适用的转基因包括报告基因序列,其在表达后产生可检测信号。所述报告基因序列包括不限于编码以下各物的dna序列:β-内酰胺酶、β-半乳糖苷酶(lacz)、碱性磷酸酶、胸苷激酶、绿色荧光蛋白(gfp)、红色荧光蛋白(rfp)、氯霉素乙酰基转移酶(cat)、荧光素酶、针对其的高亲和力抗体存在或可通过常规手段产生的膜结合蛋白(包括例如cd2、cd4、cd8、流感血凝素蛋白和本领域中熟知的其它膜结合蛋白)和包含适当融合于尤其来自血凝素或myc的抗原标签结构域的膜结合蛋白的融合蛋白。
这些编码序列在与驱动它们的表达的调控元件相关联时提供可通过常规手段检测的信号,所述常规手段包括酶促测定、放射摄影测定、比色测定、荧光测定或其它光谱测定、荧光激活细胞分选测定和免疫测定,包括酶联免疫吸附测定(elisa)、放射免疫测定(ria)和免疫组织化学分析。举例来说,当标记序列是lacz基因时,携带信号的载体的存在性通过针对β-半乳糖苷酶活性的测定来检测。当转基因是绿色荧光蛋白或荧光素酶时,携带信号的载体可在光度计中通过颜色产生或光产生来目视测量。
合乎需要的是,转基因编码适用于生物学和医学中的产物,诸如蛋白质、肽、rna、酶或催化rna。合乎需要的rna分子包括shrna、trna、dsrna、核糖体rna、催化rna和反义rna。适用的rna序列的一个实例是压制所靶向核酸序列在所治疗动物中表达的序列。
调控序列包括常规控制元件,其以容许转基因在用载体转染或用如本文所述产生的病毒感染的细胞中转录、翻译和/或表达的方式可操作地连接于转基因。如本文所用,“可操作地连接的”序列包括与目标基因邻接的表达控制序列与以反式或在某一距离起控制目标基因的作用的表达控制序列两者。
表达控制序列包括适当的转录起始、终止、启动子和增强子序列;高效rna加工信号,诸如剪接和多聚腺苷酸化(多聚腺苷酸)信号;使细胞质mrna稳定的序列;增强翻译效率的序列(即kozak共有序列);增强蛋白质稳定性的序列;和当需要时,使所编码产物的分泌增强的序列。包括启动子的许多表达控制序列在本领域中是已知的,并且可被利用。
适用于本文提供的构建体中的调控序列也可含有合乎需要地位于启动子/增强剂序列与基因之间的内含子。一个合乎需要的内含子序列源于sv-40,并且是被称为sd-sa的100bp小内含子剪接供体/剪接接受体。另一适合的序列包括土拔鼠肝炎病毒转录后元件。(参见例如l.wang和i.verma,1999proc.natl.acad.sci.,usa,96:3906-3910)。多聚腺苷酸信号可源于许多适合的物种,包括不限于sv-40、人和牛。
适用于本文所述的方法中的raav的另一调控组分是内部核糖体进入位点(ires)。ires序列或其它适合的系统可用于从单一基因转录物产生超过一个多肽。ires(或其它适合的序列)用于产生含有超过一个多肽链的蛋白质或从同一细胞或在同一细胞内表达两种不同蛋白质。一示例性ires是脊髓灰质炎病毒内部核糖体进入序列,其支持在光受体、rpe和神经节细胞中进行转基因表达。优选地,ires位于raav载体中转基因的3’。
在一个实施方案中,aav包含启动子(或启动子的功能性片段)。可从广泛数目的可使所选转基因在所需靶标细胞中表达的组成型或诱导型启动子之中进行待用于raav中的启动子的选择。在一个实施方案中,靶标细胞是眼部细胞。启动子可源于任何物种,包括人。合乎需要地,在一个实施方案中,启动子具有“细胞特异性”。术语“细胞特异性”意指选择用于重组载体的特定启动子可指导所选转基因在特定细胞组织中表达。在一个实施方案中,启动子对于转基因在肌肉细胞中表达来说具有特异性。在另一实施方案中,启动子对于在肺中表达来说具有特异性。在另一实施方案中,启动子对于转基因在肝细胞中表达来说具有特异性。在另一实施方案中,启动子对于转基因在气道上皮中表达来说具有特异性。在另一实施方案中,启动子对于转基因在神经元中表达来说具有特异性。在另一实施方案中,启动子对于转基因在心脏中表达来说具有特异性。
表达盒通常含有启动子序列作为表达控制序列的一部分,例如位于所选5’itr序列与免疫球蛋白构建体编码序列之间。在一个实施方案中,在肝中表达是合乎需要的。因此,在一个实施方案中,使用肝特异性启动子。组织特异性启动子、组成型启动子、可调控启动子[参见例如wo2011/126808和wo2013/04943]或对生理提示具有应答性的启动子可用于本文所述的载体中。在另一实施方案中,在肌肉中表达是合乎需要的。因此,在一个实施方案中,使用肌肉特异性启动子。在一个实施方案中,启动子是基于mck的启动子,诸如dmck(509bp)或tmck(720bp)启动子(参见例如wang等,genether.2008年11月;15(22):1489-99.doi:10.1038/gt.2008.104.电子出版2008年6月19日,其以引用的方式并入本文)。另一适用的启动子是spc5-12启动子(参见rasowo等,europeanscientificjournal2014年6月版第10卷,第18期,其以引用的方式并入本文)。在一个实施方案中,启动子是cmv启动子。在另一实施方案中,启动子是tbg启动子。在另一实施方案中,使用cb7启动子。cb7是具有巨细胞病毒增强子元件的鸡β-肌动蛋白启动子。或者,可使用其它肝特异性启动子[参见例如theliverspecificgenepromoterdatabase,coldspringharbor,rulai.schl.edu/lspd,α1抗胰蛋白酶(a1at);人白蛋白,miyatake等,j.virol.,71:512432(1997),humalb;以及乙型肝炎病毒核心启动子,sandig等,genether.,3:10029(1996)]。ttr最小增强子/启动子、α抗胰蛋白酶启动子、lsp(845nt)25(需要无内含子scaav)。
启动子可选自不同来源,例如人巨细胞病毒(cmv)即刻早期增强子/启动子、sv40早期增强子/启动子、jc多瘤病毒启动子、髓磷脂碱性蛋白(mbp)或神经胶质原纤维酸性蛋白(gfap)启动子、单纯疱疹病毒(hsv-1)潜伏期相关启动子(lap)、劳斯肉瘤病毒(rsv)长末端重复序列(ltr)启动子、神经元特异性启动子(nse)、血小板源性生长因子(pdgf)启动子、hsyn、黑色素聚集激素(mch)启动子、cba、基质金属蛋白质启动子(mpp)和鸡β-肌动蛋白启动子。
表达盒可含有至少一个增强子即cmv增强子。可包括其它增强子元件,例如载脂蛋白增强子、斑马鱼增强子、gfap增强子元件和诸如描述于wo2013/1555222中的脑特异性增强子、土拔鼠肝炎后转录后调控元件。另外,或替代地,可选择其它启动子例如杂合人巨细胞病毒(hcmv)-即刻早期(ie)-pdgr启动子,或其它启动子-增强子元件。在本文中适用的其它增强子序列包括irbp增强子(nicoud2007,jgenemed.2007年12月;9(12):1015-23)、即刻早期巨细胞病毒增强子、源于免疫球蛋白基因或sv40增强子的增强子、在小鼠近端启动子中鉴定的顺式作用性元件等。
除启动子之外,表达盒和/或载体也可含有其它适当的转录起始、终止、增强子序列;高效rna加工信号,诸如剪接和多聚腺苷酸化(多聚腺苷酸)信号;使细胞质mrna稳定的序列;增强翻译效率的序列(即kozak共有序列);增强蛋白质稳定性的序列;和当需要时,使所编码产物的分泌增强的序列。多种适合的多聚腺苷酸是已知的。在一个实例中,多聚腺苷酸是兔β球蛋白诸如127bp兔β-球蛋白多聚腺苷酸化信号(genbank#v00882.1)。在其它实施方案中,选择sv40多聚腺苷酸信号。可选择其它适合多聚腺苷酸序列。在某些实施方案中,包括内含子。一种适合内含子是鸡β-肌动蛋白内含子。在一个实施方案中,内含子是875bp(genbank#x00182.1)。在另一实施方案中,使用可从promega获得的嵌合内含子。然而,可选择其它适合内含子。在一个实施方案中,包括间隔体以使载体基因组与天然aav载体基因组具有近似相同大小(例如在4.1与5.2kb之间)。在一个实施方案中,包括间隔体以使载体基因组是约4.7kb。参见wu等,effectofgenomesizeonaavvectorpackaging,molther.2010年1月;18(1):80–86,其以引用的方式并入本文。
对这些和其它常见载体和调控元件的选择是常规的,并且许多所述序列是可用的。参见例如sambrook等,和其中在例如第3.18-3.26和16.17-16.27页处引用的参考文献,以及ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1989。当然,并非所有载体和表达控制序列都将完全同等地起表达所有如本文所述的转基因的作用。然而,本领域技术人员可在不脱离本发明的范围的情况下在这些和其它表达控制序列之中进行选择。
在另一实施方案中,提供一种产生重组腺相关病毒的方法。通过培养宿主细胞来产生适合重组腺相关病毒(aav),所述宿主细胞含有编码如本文所述的aav衣壳蛋白或其片段的核酸序列;功能性rep基因;至少由aav反向末端重复序列(itr)和编码合乎需要的转基因的异源性核酸序列组成的小基因;以及足以容许所述小基因包装至所述aav衣壳蛋白中的辅助功能物。可以反式向宿主细胞提供为在宿主细胞中培养以使aav小基因包装在aav衣壳中所需的组分。或者,任何一种或多种所需组分(例如小基因、rep序列、cap序列和/或辅助功能物)可由已使用为本领域技术人员所知的方法来工程改造以含有一种或多种所需组分的稳定宿主细胞提供。
本文也提供用如本文所述的aav转染的宿主细胞。最适合地,这种稳定宿主细胞将含有在诱导型启动子的控制下的所需组分。然而,所需组分可在组成型启动子的控制下。本文在以下对适于与转基因一起使用的调控元件的讨论中提供适合的诱导型启动子和组成型启动子的实例。在另一替代方案中,所选稳定宿主细胞可含有在组成型启动子的控制下的所选组分和在一个或多个诱导型启动子的控制下的其它所选组分。举例来说,可产生源于293细胞的稳定宿主细胞(其含有在组成型启动子的控制下的e1辅助功能物),但其含有在诱导型启动子的控制下的rep和/或cap蛋白。其它稳定宿主细胞可由本领域技术人员产生。在另一实施方案中,宿主细胞包含如本文所述的核酸分子。
可将为产生本文所述的raav所需的小基因、rep序列、cap序列和辅助功能物以会转移其上携带的序列的任何遗传元件形式递送至包装宿主细胞中。所选遗传元件可通过任何适合方法(包括本文所述的那些)来递送。用于构建本发明的任何实施方案的方法都为具有核酸操作技能者所知,并且包括遗传工程改造、重组工程改造和合成技术。参见例如sambrook等,molecularcloning:alaboratorymanual,coldspringharborpress,coldspringharbor,ny。类似地,产生raav病毒粒子的方法是熟知的,并且对适合方法的选择不是对本发明的限制。参见例如k.fisher等,1993j.virol.,70:520-532和美国专利5,478,745以及其它参考文献。这些出版物以引用的方式并入本文。
本文也提供用于产生本文所述的载体的质粒。所述质粒描述于实施例部分中。
c.药物组合物和施用
在一个实施方案中,任选通过常规方法来评估含有如上详述的为在靶标细胞中使用所需的转基因和细胞特异性启动子的重组aav的污染,接着将所述重组aav配制成意图向有需要的受试者施用的药物组合物。所述配制涉及使用药学上和/或生理上可接受的媒介物或载剂,诸如用以维持ph在适当生理水平下的缓冲盐水或其它缓冲剂例如hepes,以及任选使用其它医学药剂、药物制剂、稳定剂、缓冲剂、载剂、佐剂、稀释剂等。对于注射,载剂将通常是液体。示例性生理上可接受的载剂包括无菌无热原水和无菌无热原磷酸盐缓冲盐水。多种所述已知载剂提供于以引用的方式并入本文的美国专利公布号7,629,322中。在一个实施方案中,载剂是等张氯化钠溶液。在另一实施方案中,载剂是平衡盐溶液。在一个实施方案中,载剂包括吐温(tween)。如果病毒将长期储存,那么它可在甘油或吐温20存在下加以冷冻。在另一实施方案中,药学上可接受的载剂包括表面活性剂诸如全氟辛烷(普氟隆(perfluoron)液体)。在适于在人受试者中输注的缓冲剂/载剂中配制载体。缓冲剂/载剂应包括防止raav粘着于输注管,但不干扰raav体内结合活性的组分。
在本文所述的方法的某些实施方案中,以肌肉内方式向受试者施用上述药物组合物。在其它实施方案中,通过静脉内方式来施用药物组合物。可适用于本文所述的方法中的其它施用形式包括但不限于直接向所需器官(例如眼)递送(包括视网膜下或玻璃体内递送)、口服、吸入、鼻内、气管内、静脉内、肌肉内、皮下、真皮内和其它胃肠外施用途径。如果需要,可将施用途径组合。
此外,在某些实施方案中,可合乎需要的是在载体施用之前进行某些检查以鉴定需要细胞被靶向以进行治疗的区域。在一个实施方案中,当需要向眼递送时,非侵袭性视网膜成像和功能性研究用以鉴定待被靶向以进行治疗的特定眼部细胞的区域。参见例如wo2014/124282,其以引用的方式并入本文。也参见国际专利申请号pct/us2013/022628,其以引用的方式并入本文。
视待治疗的区域的大小、所用病毒滴度、施用途径和方法的所需效果而定,组合物可以约0.1μl至约10ml的体积(包括在范围内的所有数值)递送。在一个实施方案中,体积是约50μl。在另一实施方案中,体积是约70μl。在另一实施方案中,体积是约100μl。在另一实施方案中,体积是约125μl。在另一实施方案中,体积是约150μl。在另一实施方案中,体积是约175μl。在另一实施方案中,体积是约200μl。在另一实施方案中,体积是约250μl。在另一实施方案中,体积是约300μl。在另一实施方案中,体积是约450μl。在另一实施方案中,体积是约500μl。在另一实施方案中,体积是约600μl。在另一实施方案中,体积是约750μl。在另一实施方案中,体积是约850μl。在另一实施方案中,体积是约1000μl。在另一实施方案中,体积是约1.5ml。在另一实施方案中,体积是约2ml。在另一实施方案中,体积是约2.5ml。在另一实施方案中,体积是约3ml。在另一实施方案中,体积是约3.5ml。在另一实施方案中,体积是约4ml。在另一实施方案中,体积是约5ml。在另一实施方案中,体积是约5.5ml。在另一实施方案中,体积是约6ml。在另一实施方案中,体积是约6.5ml。在另一实施方案中,体积是约7ml。在另一实施方案中,体积是约8ml。在另一实施方案中,体积是约8.5ml。在另一实施方案中,体积是约约9ml。在另一实施方案中,体积是约9.5ml。在另一实施方案中,体积是约10ml。
携带在调控序列的控制下的编码所需转基因的核酸序列的重组腺相关病毒的有效浓度合乎需要地在每毫升约107至1014个载体基因组(vg/ml)(也称为基因组拷贝/ml(gc/ml))的范围内。在一个实施方案中,raav载体基因组通过实时pcr来测量。在另一实施方案中,raav载体基因组通过数字pcr来测量。参见lock等,absolutedeterminationofsingle-strandedandself-complementaryadeno-associatedviralvectorgenometitersbydropletdigitalpcr,humgenethermethods.2014年4月;25(2):115-25.doi:10.1089/hgtb.2013.131.电子出版2014年2月14日,其以引用的方式并入本文。在另一实施方案中,raav感染单位如以引用的方式并入本文的s.k.mclaughlin等,1988j.virol.,62:1963中所述来测量。
优选地,浓度是约1.5x109vg/ml至约1.5x1013vg/ml,并且更优选是约1.5x109vg/ml至约1.5x1011vg/ml。在一个实施方案中,有效浓度是约1.4x108vg/ml。在一个实施方案中,有效浓度是约3.5x1010vg/ml。在另一实施方案中,有效浓度是约5.6x1011vg/ml。在另一实施方案中,有效浓度是约5.3x1012vg/ml。在另一实施方案中,有效浓度是约1.5x1012vg/ml。在另一实施方案中,有效浓度是约1.5x1013vg/ml。本文所述的所有范围都包括端点。
在一个实施方案中,剂量是约1.5x109vg/kg体重至约1.5x1013vg/kg,并且更优选是约1.5x109vg/kg至约1.5x1011vg/kg。在一个实施方案中,剂量是约1.4x108vg/kg。在一个实施方案中,剂量是约3.5x1010vg/kg。在另一实施方案中,剂量是约5.6x1011vg/kg。在另一实施方案中,剂量是约5.3x1012vg/kg。在另一实施方案中,剂量是约1.5x1012vg/kg。在另一实施方案中,剂量是约1.5x1013vg/kg。在另一实施方案中,剂量是约3.0x1013vg/kg。在另一实施方案中,剂量是约1.0x1014vg/kg。本文所述的所有范围都包括端点。
在一个实施方案中,有效剂量(递送的总基因组拷贝)是约107至1013个载体基因组。在一个实施方案中,总剂量是约108个基因组拷贝。在一个实施方案中,总剂量是约109个基因组拷贝。在一个实施方案中,总剂量是约1010个基因组拷贝。在一个实施方案中,总剂量是约1011个基因组拷贝。在一个实施方案中,总剂量是约1012个基因组拷贝。在一个实施方案中,总剂量是约1013个基因组拷贝。在一个实施方案中,总剂量是约1014个基因组拷贝。在一个实施方案中,总剂量是约1015个基因组拷贝。
合乎需要的是利用病毒的最低有效浓度以使诸如毒性的不合需要影响的风险降低。在这些范围内的其它剂量和施用体积可由主治医师在考虑所治疗受试者(优选是人)的身体状态、受试者的年龄、特定病症和病症(如果是进行性的)已显现的程度的情况下加以选择。静脉内递送例如可需要约1.5x1013vg/kg的剂量。
d.方法
如本文所讨论,包含aav8突变衣壳的载体能够以高水平转导靶标组织。因此,本文提供一种将转基因递送至肝细胞中的方法。方法包括使细胞与具有aav3g1衣壳的raav接触,其中所述raav包含转基因。在另一实施方案中,方法包括使细胞与具有aav8.tr1衣壳的raav接触,其中所述raav包含转基因。在另一实施方案中,方法包括使细胞与具有任何本文所述的衣壳的raav接触,其中所述raav包含转基因。在另一方面,提供具有aav3g1衣壳的raav用于将转基因递送至肝中的用途。在另一方面,提供具有aav8.tr1衣壳的raav用于将转基因递送至肝中的用途。
本文也提供一种将转基因递送至肌肉细胞中的方法。方法包括使细胞与具有aav3g1衣壳的raav接触,其中所述raav包含转基因。在另一实施方案中,方法包括使细胞与具有任何本文所述的衣壳的raav接触,其中所述raav包含转基因。在另一方面,提供具有aav3g1衣壳的raav用于将转基因递送至肌肉中的用途。
此外,提供一种将转基因递送至气道上皮中的方法。方法包括使细胞与具有aav3g1衣壳的raav接触,其中所述raav包含转基因。在另一实施方案中,方法包括使细胞与具有aav8.t20衣壳的raav接触,其中所述raav包含转基因。在另一实施方案中,方法包括使细胞与具有任何本文所述的衣壳的raav接触,其中所述raav包含转基因。在另一方面,提供具有aav3g1衣壳的raav用于将转基因递送至气道上皮中的用途。在另一方面,提供具有aav8.t20衣壳的raav用于将转基因递送至气道上皮中的用途。
此外,提供一种将转基因递送至眼部细胞中的方法。方法包括使细胞与具有aav3g1衣壳的raav接触,其中所述raav包含转基因。在另一实施方案中,方法包括使细胞与具有任何本文所述的衣壳的raav接触,其中所述raav包含转基因。在另一方面,提供具有aav3g1衣壳的raav用于将转基因递送至眼部细胞中的用途。
如以下实施例中所述,在体外,aav3g1突变体显示对猴和人的各种抗血清以及人ivig的抗性(关于人ivig,处于是aav8的抗性的2至4倍的水平下)。所有三个突变都促进所观察的抗性。在小鼠中,相较于aav8,aav3g1的肝转导效率降低,然而,它的肌肉转导是aav8的肌肉转导的约10倍。此外,相比于aav8,aav3g1显示更高肝素亲和力。引起关注的是,降低hvr.iv突变的正电荷使载体的肝素亲和力降低,而肝转导得以部分恢复。与在肌肉的情况下观察的趋势类似,鼻内施用aav3g1导致的转导效率是aav8的转导效率的2至3倍,通过使aav3g1的vp1独特区域与另一aav血清型的vp1独特区域调换,所述转导效率进一步改进至相比于aav8,是约10倍的水平。这些研究结果与疾病模型相关,其中需要高效率肌肉内、眼部或鼻内基因递送以及对预先存在的中和抗体的抗性。
如本文所示,在一个实施方案中,本文所述的衣壳(例如aav3g1、aavt20或aavtr1衣壳)能够逃避由针对aav8的预先存在的中和抗体(nab)达成的中和。在一个实施方案中,相较于天然aav8,具有所述衣壳的raav显示在对由aav8中和抗体达成的中和的抗性方面增加至至少约2倍。在一个实施方案中,相较于天然aav8,具有所述衣壳的raav显示在对由aav8中和抗体达成的中和的抗性方面增加至至少约3倍。在一个实施方案中,相较于天然aav8,具有所述衣壳的raav显示在对由aav8中和抗体达成的中和的抗性方面增加至至少约4倍。在一个实施方案中,相较于天然aav8,具有所述衣壳的raav显示在对由aav8中和抗体达成的中和的抗性方面增加至至少约5倍。在一个实施方案中,相较于天然aav8,具有所述衣壳的raav显示在对由aav8中和抗体达成的中和的抗性方面增加至至少约10倍。在一个实施方案中,相较于天然aav8,具有所述衣壳的raav显示在对由aav8中和抗体达成的中和的抗性方面增加至至少约15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、220、240、260倍或更多倍。评估抗体中和的方法在本领域中是已知的,并且在本文中加以描述。参见例如lochrie等,jvirol.,2006年1月,80(2):821-34,其以引用的方式并入本文。在一个实施方案中,aav8中和抗体是adk8。参见gurda等,j.virol,2012年8月;86(15):7739-51.doi:10.1128/jvi.00218-12.电子出版2012年5月16日,其以引用的方式并入本文。在另一实施方案中,aav8中和抗体是adk8/9。
在由aav8抗体达成的中和方面的这个降低提供逃脱可存在于受试者中的预先存在的aav8抗体的优势。这适用于其中aav8载体用于治疗受试者的某一病状,并且需要加强剂量或第二治疗需要使用aav载体的情况下。
对aav8高变区(hvr)viii进行饱和诱变,此由抗体-衣壳结构信息指导。得以证明的是衣壳突变体能够逃脱aav8中和抗体,并且维持肝转导。以一个上述衣壳突变体–aav8.c41作为骨架开始,对hvr.i和hvr.iv区域进行饱和诱变,随后在小鼠肝中进行三轮体内富集,从而产生被称为aav3g1(也称为aav8.triple或triple)的aav8突变体。aav3g1显示对猴和人的各种抗血清以及人ivig的抗性(关于人ivig,处于是aav8的抗性的2至4倍的水平下)。所有三个突变都促进所观察的抗性。出乎意料的是,相较于天然aav8,aav83g1显示肝转导效率降低(约1/6xaav8),而它的肌肉转导增加(约10xaav8)。相比于aav8,aav3g1显示更高肝素亲和力。降低hvr.iv和hvr.i突变的正电荷使载体的肝素亲和力降低,伴有肝转导部分恢复(所得突变体被称为aav8.tr1)。鼻内施用aav3g1导致的转导效率是aav8的转导效率的2至3倍。通过以下方式来产生新突变体aav8.t20:将一个高转导成员rh.20的vp1/2独特区域调换至aav3g1中,从而产生aav8.t20。即,将aavrh.20(seqidno:88)的氨基酸1-202与aav3g1衣壳的氨基酸1至203调换。通过鼻内施用,在小鼠中,相比于aav8,aav8.t20的转导是约10倍。
e.实施例
实施例1:研究设计
产生了在hvr.viii区域中具有突变的若干aav8突变体,即c41、c42、c46、g110、g113、g115和g117。如gurda等(以上引用)中所讨论,主要adk8表位处于hvr.viii区域(氨基酸586至591,使用aav8vp1编号)中。在体外测试那些突变体的adk8抗性,并且在体内测试它们中的一些的adk8抗性。参见例如lochrie2006(以上引用)。
挑选突变体c41作为用于在hvr.i和hvr.iv区域处进一步诱变的骨架。突变体c41具有以seqidno:2显示的序列(dna序列以seqidno:1显示)。c41氨基酸序列是aav8的氨基酸序列,在hvr.viii区域中具有以下突变:583adnlqqqntapqigt597(seqidno:69)-->gdnlqlyntapgsvf(seqidno:70)。
对于hvr.i或hvr.iv诱变,进行三轮体内选择。hvr.i突变sgth和hvr.iv突变ggsrp于是被并入克隆c41骨架中以产生aav3g1。体外nab测试显示aav3g1显示一定程度的hivig抗性;所有三个突变(c41、sgth和ggsrp)都促进抗性。
采用各种转基因盒诸如cb7.ci.ff荧光素酶、cmv.lacz和tmck.人f9,以肌肉内与静脉内两种方式,相比于aav8,aav3g1均显示更高肌肉转导。
相比于aav8,aav3g1也显示在鼠气道上皮细胞中的更高转导。通过用rh.20的vp1/2区域替换vp1/2区域,所得突变体aav8.t20显示转导是aav8的约10倍。在向b6小鼠进行经鼻施用的情况下,相对于aav8(100%,cb7.ci.荧光素酶)加以标准化,aav3g1以375%转导,而aav8.t20以988%转导。
相比于aav8,aav3g1具有更高肝素亲和力。设计新突变体以在hvr.i和hvr.iv中引入带负电荷残基(hvri:sgth→sdth。hvr.iv:ggsrp用在选择过程期间显露的另一突变dgsgl(seqidno:82)替换。所得突变体aav8.tr1显示肝素亲和力降低,并且它的肝转导得以部分恢复。相较于aav8(100%,tbg.人f9),aav3g1以18%转导肝,而aav.tr1以52%转导。
实施例2:材料和方法
a.用于文库构建的质粒。
1.paav.de.0
通过在两个aavitr之间放置以下组分来构建质粒paav.de.0–zsgreen表达盒,继之以cmv启动子,继之以aav2基因组(nc_001401)的片段1883-2207,继之以限制位点aari和spei(用于插入aavvp1orf)。paav.de.0以seqidno:39和图9显示。
2.paav.de.1
质粒paav.de.1基于paav.de.0,具有以下修改:1)移除nhei片段;2)在3’itr与spei限制识别位点之间插入兔β-球蛋白多聚腺苷酸化信号序列。paav.de.1以seqidno:40和图10显示。
3.paav.de.1.hvr.i
该质粒基于paav.de.1,伴有1)将aav8.c41的vp1orf插入paav.de.1中的aari与spei之间;2)通过沉默诱变来移除两个bsmbi限制识别位点;3)将在它的末端携带两个bsmbi位点的小型dna片段插入在aav8.c41vp1orf的hvr.i区域处以产生用于hvr.i诱变的克隆位点。paav.de.1.hvri以seqidno:41和图11显示。
4.paav.de.1.hvr.iv
该质粒基于paav.de.1,伴有1)将aav8.c41的vp1orf插入paav.de.1中的aari与spei之间;2)通过沉默诱变来移除两个bsmbi限制识别位点;3)将在它的末端携带两个bsmbi位点的小型dna片段插入在aav8.c41vp1orf的hvr.iv区域处以产生用于hvr.iv诱变的克隆位点。paav.de.1.hvriv以seqidno:42和图12显示。
5.prep
该质粒基于paav2/8质粒(seqidno:43)。质粒paav2/8用afei消化,接着部分地用bbsi消化,进行末端精修,接着进行自我连接。
b.文库构建、选择和产生aav3g1、aav8.t20和aav8.tr1
1.hvr.viii文库
建立三个pcr:pcr1:引物031(seqidno:49),引物032(seqidno:50)和引物009(seqidno:45);pcr2:引物016(seqidno:46)和引物030(seqidno:48),以质粒paav2/8作为模板;pcr3:引物033(seqidno:49)和引物017(seqidno:47),以质粒paav2/8作为模板。引物显示于下表2中。三种pcr产物用qiaquickpcr纯化试剂盒(qiagen)纯化,合并在一起,用bsmbi(newenglandbiolabs)消化并再次纯化,随后在16℃下用t4dna连接酶(roche)连接。对428bp片段进行凝胶提取,并且与paav2/8的6908bpbsmbi片段连接。连接产物充当采用引物.aav8start和引物aav8endnd5r的pcr模板。纯化pcr产物,通过aari和spei来克隆至paav.de.0中,并且转化至stbl4(invitrogen)中。从过夜转化培养物提取质粒,并且它是aav8hvr.viii诱变的质粒文库。
使质粒文库与辅助质粒(padδf6)和prep混合,接着通过磷酸钙方法来转染至293细胞中。在转染之后3天,收集细胞溶解产物,再混悬于dpbs中,并且用全能核酸酶(benzonase)(merck)处理。接着将溶解产物短暂离心以移除碎片。上清液是aav诱变文库,并且储存在-20℃下供进一步使用。用实时pcr进行滴定。
使1x109个基因组拷贝(gc)的aav诱变文库与0.5μladk8(aav8nab滴度--1:2560)混合,并且添加完全培养基直至1ml。在37℃下孵育混合物30分钟,接着施加于293细胞(moi,约1x104)。2天后,以1:5的比率裂解细胞。2天后,将细胞用质粒padδf6和prep转染。2天后,从细胞提取rna和基因组dna作为rt-pcr或pcr的模板。pcr引物是引物016(seqidno:46)和引物017(seqidno:47)。将pcr产物克隆至topo载体(invitrogen)中,并且测序。从topo质粒切割aav片段,并且在bsmbi位点处克隆至paav2/8中以产生反式质粒。以paav.cmv.egfp作为顺式质粒,将个别反式质粒装填至常规aav载体中,以进行进一步分析。
引物列表:表2
2.体外nab测定
使1x109gc的携带egfp盒的各aav突变体与不同单克隆抗体(adk8,[nab]aav8=1:2560,0.5μl/孔;adk8/9,[nab]aav8=1:2560,0.5μl/孔;adk9,[nab]aav8=5,0.5μl/孔;无ab:培养基)混合,用培养基达到100μl,在37℃下孵育30分钟,接着施加于293细胞(在感染之前1天以5x104个细胞/孔接种于96孔板中)。监测gfp表达,并且用imagej定量。图2a。
3.hvr.i和hvr.iv文库
在体内进行三轮选择。对于各轮,在汇合人ivig(hivig)存在下将aav文库静脉内注射至b6小鼠中。
对于第1轮,hvr.i:
以paav2/8.c41作为模板,以及分别以引物098(seqidno:55)+引物156(seqidno:58)、引物155(seqidno:57)+引物作为引物组,通过pcr来制备两个片段。采用引物098(seqidno:55)+引物.aav8end(seqidno:68),通过pcr来将两个片段装配在一起。接着通过hindiii和spei位点来将所得片段克隆至paav.de.1中作为用于产生aav文库的质粒文库。文库产生与hvr.viii文库类似,例外之处是它用碘克沙醇(iodixanol)梯度纯化,采用与常规aav载体相同的方式。
对于第1轮,hvr.iv:
过程极其类似于hvr.i,例外之处是引物组是引物098(seqidno:55)+引物158(seqidno:60)、引物157(seqidno:59)+引物.aav8end(seqidno:68)。
接着在人ivig存在下,将文库静脉内注射至小鼠中。2周后,收集肝。提取基因组dna和rna。通过pcr来重新得到aavdna片段,并且克隆至质粒中以用于产生新文库。
第2轮和第3轮类似于第1轮,例外之处是:
对于hvr.i,使用引物175(seqidno:63)和引物200(seqidno:64),并且克隆载体是paav.de.1.hvr.i;对于hvr.iv,使用引物201(seqidno:65)和引物202(seqidno:66),并且克隆载体是paav.de.1.hvr.iv。
在第3轮之后,从小鼠肝提取基因组dna,通过pcr来扩增,并且克隆至反式质粒骨架中以进行进一步分析。
4.产生aav3g1、aav8.t20和aav8.tr1
反式质粒paav2/8.triple基于paav2/8.c41(seqidno:44),其中hvr.i区域用编码sgth的dna替换,并且hvr.iv区域用编码ggsrp的dna替换。
反式质粒paav2/8.t20基于paav2/8.triple,其中vp12区域用aavrh.20的相应区域替换。
反式质粒paav2/8.tr基于paav2/8.triple,其中hvr.i区域用编码sdth(seqidno:80)的dna替换,并且hvr.iv区域用编码dgsgl(seqidno:82)的dna替换。
5.aav载体产生
根据由lock,m,alvira,m,vandenberghe,lh,samanta,a,toelen,j,debyser,z等(2010).rapid,simple,andversatilemanufacturingofrecombinantadeno-associatedviralvectorsatscale.humangenetherapy21:1259-1271描述的方法制备aav载体。
6.针对犬f9和人f9的elisa
用于测量犬f9的elisa由wang,ll,calcedo,r,nichols,tc,bellinger,da,dillow,a,verma,im等(2005).sustainedcorrectionofdiseaseinnaiveandaav2-pretreatedhemophiliabdogs:aav2/8-mediated,liver-directedgenetherapy.blood105:3079-3086描述,所述文献以引用的方式并入本文。简要来说,将aav8突变体装填以tbg.犬f9-wpre盒,并且在存在/不存在抗体adk8下通过静脉内注射来在b6小鼠中测试。在载体注射之前2小时,静脉内注射100ul稀释的adk8。aav8用作对照。用elisa自在施用之后1周收集的血浆测量犬f9水平。来自adk8处理动物的f9相对于来自adk8原初动物的f9的百分比和p值(t检验)显示于图2b中。
使用人f9进行类似实验。肌肉内注射携带第三转基因盒tmck.人f9的aav载体显示aav3g1在b6小鼠中的类似肌肉偏好。tmck是肌肉特异性启动子。剂量是3x1010gc/小鼠,n=3只小鼠/组。分别在给药之后28和30天收集血浆和肌肉。通过elisa自血浆和肌肉溶解产物测量人f9。相比于在用aav8转导之后,在用aav3g1转导之后的肌肉f9表达水平是11.2倍。图5c。对第28天血浆的中和抗体滴度的测量显示aav8的抗原性和aav3g1的抗原性不同。图5d。
c.体外nab测定,以荧光素酶作为报告基因
用人血浆(4个样品)和抗aav8猴血清(4个样品)在体外测试aav8、aav3g1和携带构成aav3g1的三个突变的所有组合的突变体。将huh7细胞以5x104个细胞/孔接种在具有透明底部的96孔黑色板(corning)中。2天后,在完全培养基中稀释aav8和变体,并且与稀释的血清/血浆(混合物中最终抗aav8nab滴度1:4)一起孵育,随后施加于96孔板中的huh7细胞。在37℃下孵育混合物30分钟,随后转移至huh7板中。
72小时后读取荧光素酶表达,并且换算成各“单独载体”对照的表达水平的百分比。对于各血清/血浆,根据它们的残余表达对各载体指定等级数值(最高残余表达的等级数值是1,并且最低是8)。图4b。这些数据显示aav3g1中的所有三个突变都促进nab抗性。
1.体内荧光素酶测定
以3x1010gc/小鼠的剂量,向c57bl6小鼠中肌肉内施用携带cb7.ci.荧光素酶盒的aav8或aav3g1,4只小鼠/组。在给药之后2周和4周监测荧光素酶活性。通过肌肉内注射,相较于aav8,aav3g1偏好肌肉而非肝。图5a。
进行第二实验,其中以1x109gc/动物(5x108gc/25ul/腿,两条腿)的剂量在c57bl6小鼠中肌肉内施用携带不同转基因的aav8和aav3g1载体。在载体注射之后第3周,肌肉切片、x-gal染色、各组的最佳切片显示于图5b(4x放大)中。这些研究显示肌肉内注射携带另一转基因盒的aav载体显示aav3g1在b6小鼠中的类似肌肉偏好。
mps3ahet小鼠(c57bl6背景)静脉内接受5x1011gc的aav.cmv.lac/小鼠。14天后收集组织。制备来自接受aav8或aav3g1载体的小鼠的心脏、肌肉和肝的x-gal染色切片(数据未显示)。这些研究显示静脉内注射显示相较于aav8,aav8.triple肌肉偏好增加。各动物的代表性肌肉切片在4x下显示于图6a中。
在cb7.ci.ff荧光素酶转基因盒的情况下比较aav8和aav3g1。以3x1011gc/小鼠的剂量对b6小鼠进行静脉内注射。在载体注射之后2周,使荧光素酶成像。图6b。左侧是aav8;右侧是aav3g1。
aav3g1对小鼠气道上皮细胞具有较高转导,并且通过用rh.20替换vp1/2区域,转导得以进一步改进。b6小鼠鼻内接受1x1011gc/小鼠的aav.cb7.ci.荧光素酶。4只小鼠接受各载体。在载体施用之后2、3和4周监测荧光素酶活性。图7a,右侧图是研究的代表性图像(第4周)。左侧图是用living
aav8、aav8.t20、aav9和aav6.2的气道上皮细胞转导比较。b6小鼠鼻内接受1x1011gc/小鼠的aav.cb7.ci.荧光素酶,4只小鼠/载体。在载体施用之后1、2和3周监测荧光素酶活性。living
使小鼠麻醉。将d-虫荧光素(xenogen)以15ug/ul,10ul/鼻孔,20ul/小鼠滴注至小鼠鼻孔中。5分钟后,通过
2.肝素结合测定
在所需缓冲液中稀释aav载体,并且通过
表3:产量表(纯化载体的总gc/细胞堆。diy)
实施例3:详细研究
aav突变体文库制备。被称为paavinvivo的质粒用于文库制备。质粒含有cmv启动子、部分rep序列(aav2,nc_001401,1881-2202)18、aav8vp1基因和兔β球蛋白(rbg)多聚腺苷酸化信号,由两个aavitr侧接(图14)。用携带nnk简并密码子的引物在所需位点处进行饱和诱变。nns与nnk两者均涵盖全部20种氨基酸。对于人密码子使用,nns略微高于nnk(图15a);然而,太多gc对于pcr和/或病毒复制来说可能并不良好–nns的平均gc%是67%,而nnk是50%(图15b)。总之,选择nnk。将两种辅助质粒padδf6(携带腺病毒组分)和prep(携带aavrep基因)以及质粒文库转染至hek293细胞中以产生aav文库。下游步骤利用先前所述的aav载体制造技术。质粒文库大小是约1x106-3x107。aav文库的产量是约1.52x1011-2.56x1013gc。
结构指导的饱和诱变快速消除由抗体达成的载体中和。我们首先挑选残基583、588、589、594-597(aav8vp1编号,seqidno:34)进行诱变,因为根据由gurda等人解析的结构,它们在单克隆中和抗体adk8与aav8衣壳之间的接触区内。在adk8存在下在hek293细胞中进行1轮体外选择之后,随机挑选突变体,并且用nab测定加以测试。突变序列列于表1中。如图2a中所示,相较于aav8,所有突变体都对adk8具有抗性。它们也显示对adk8/9的抗性,从而暗示在两个抗体之间具有表位重叠。相比于aav8,一个突变体c42显示高得多的293细胞转导,可能是归因于残基589变为精氨酸。huh7细胞显示类似结果(数据未显示)。
在b6小鼠中评估肝转导。小鼠以1x1011gc/动物的剂量静脉内接受cb7.ci.egfp载体,并且2周后收集肝。g112的剂量是每个动物3.5x1010。在cb7.ci.egfp报告基因的情况下在b6小鼠中的肝转导显示c41、g110和g112的gfp表达好于aav8;g113和g115大致相当于aav8;与它的高293细胞转导不同,c42在小鼠肝中表达较少gfp(数据未显示)。
当将lsp.犬f9转基因盒装填至那些aav8突变体中,并且静脉内注射adk8之后2小时向小鼠中静脉内施用时,在体内测试中,抗性保持(图2b)。无突变体显示对若干aav8nab阳性人血浆的明确抗性(数据未显示),此是预期的,因为那些突变体的单一表位被消除,而aav抗血清可能是多克隆的,如由黑猩猩中的aavnab的广泛中和谱所证明。
进一步诱变以及产生aav3g1。当在cb7.ci.egfp转基因盒的情况下在体内测试时,一个突变体c41显示对两种aav8nab阳性人血浆的一定抗性(数据未显示)。这个突变体用作用于进一步诱变的骨架。分别挑选hvr.i区域和hvr.iv区域用于下一轮诱变,因为蛋白质的突出部分可能更具抗原性。将(nnk)5分别在位置263-267和455-459处装载至paavinvivo.c41骨架(paavinvivo.c41与paavinvivo相同,其中aav8vp1用aav8.c41vp1替换)中以产生文库,接着经受在小鼠中三轮体内选择。对于各轮,在汇合人静脉内免疫球蛋白(hivig)注射之后2小时,将aav文库静脉内注射至小鼠中。在载体注射之后2周,用pcr从小鼠肝重新得到aav序列,并且装载至paavinvivo.c41中以产生用于以增加量的hivig进行的下一轮选择的文库。在三轮选择之后,sgth是在所有pcr阳性动物之中从最高ivig组回收的唯一突变体。引起关注的是,它是不破坏vp123和装配活化蛋白的orf的3bp缺失突变体(dna变化是:aacgggacatcggga(seqidno:83)-->tctggtactcat(seqidno:84))。hvr.iv的信号仍然是多样的,从而暗示它在构象方面具有柔性,并且可能不是在汇合hivig的情况下的主要表位。通过将三个突变即c41(hvr.viii突变)、sgth(hvr.i突变)和ggsrp(hvr.iv突变)一起组合至aav8骨架中来产生aav3g1。挑选gsrp,因为它在所有测试hvr.iv突变体之中,在体外nab测定中显示对hivig的最高抗性(数据未显示)。
aav3g1显示nab抗性,并且所有三个突变都促进抗性。aav3g1显示对hivig的抗性(图4a)。为了解各突变对抗性的贡献,我们制备一系列aav8突变体加上aav8和aav3g1以涵盖所有组合,并且用抗aav灵长类动物血清或血浆测试它们。如图4b中所示,构成aav3g1的所有三个突变都促进nab抗性。
aav3g1的肝转导下降,而它的肌肉转导上升。我们以tbg.人f9(hf9)作为报告基因,在小鼠中评估aav3g1的肝转导。以1x1010gc/动物的静脉内剂量,在载体施用之后第1、2和4周,在血浆中表达的f9是aav8的约18%。相比于aav8注射动物,来自aav3g1注射小鼠的针对aav8的中和抗体滴度是1/12(图13b)。与f9表达数据一致,aav3g1的在肝中的载体基因组拷贝是aav8的20%。对于两种处理,载体基因组dna的肝/脾比率类似,其中aav3g1是285,而aav8是237(图8e)。我们接着评估aav3g1在小鼠中的肌肉转导。使用三种报告基因盒:cb7.ci.荧光素酶、cmv.lacz和tmck.hf9。如在图5a中,肌肉内注射3e10gc的cb7.荧光素酶明确显示大量aav8载体去向肝,这与先前研究一致;相比之下,对于aav3g1,相比于aav8,肌肉转导高得多,并且较小比例的载体去向肝。静脉内注射显示类似结果(图6c)。以肌肉内与静脉内两种方式,在cmv.lacz的情况下也均是这样(图5b、图6a),并且以肌肉内方式,在tmck.hf9的情况下也是这样(图5c)。对于tmck.hf9肌肉内注射,相比于aav8,来自aav3g1注射小鼠的肌肉溶解产物中的f9水平是约10倍;相比之下,两种载体的血浆f9水平类似,这与先前报道肌肉不是用于f9表达的理想组织一致。我们也在tmck.hf9研究中测量nab。与先前在论文中所述的研究一致,相比于aav3g1注射小鼠,aav8注射小鼠中的aav8nab更高(约12倍),而相比于aav3g1注射小鼠,aav8注射小鼠中的aav3g1nab更低(约1/4)(图5d)。结果显示相比于aav8,aav3g1具有更好肌肉转导,并且指示两种衣壳在血清学上不同。
aav3g1的肝素亲和力增加,并且使它的表面电荷降低的合理设计成功降低它的肝素亲和力,并且部分地恢复它的鼠肝转导。尽管它的三个突变中的两个是在小鼠肝中对aav8.c41骨架的三轮体内选择中鉴定,但aav3g1的肝转导降低。肝素结合测定显示aav3g1的亲和力增加(图8a)。与肝素或一些其它带负电荷大分子结合可导致载体在它们到达肝细胞之前变得被圈闭/捕集。为消除肝素结合,我们通过以下方式来将负电荷引入aav3g1衣壳上:使hvr.i突变sgth变为sdth,以及将hvr.iv突变ggsrp替换成在选择过程期间显露的另一带负电荷突变dgsgl,从而产生新突变体--aav8.tr1。修改成功降低了肝素结合(图8b),并且肝转导得以部分恢复(图13a)。相比于aav8处理小鼠,aav8nab滴度是1/19(图13b)。惊人地,相比于aav8处理小鼠,aav8.tr1处理小鼠的脾载体dna更高(图8e)。通过鼻内载体施用,在小鼠中,相比于aav8,aav3g1的转导更高,并且用rh.20替换它的vp1/2区域的合理设计使转导进一步改进。如图7a中所示,通过鼻内施用,在小鼠中,相比于aav8,aav3g1的转导更高。先前综合研究显示aav之中的各种气道转导。通过分析来自以引用的方式并入本文的limberis,mp等,(2009).transductionefficienciesofnovelaavvectorsinmouseairwayepitheliuminvivoandhumanciliatedairwayepitheliuminvitro.molther17:294-301中的表1的数据,我们发现密码子24在aav进化枝e的低分成员与高分成员之间(数据未显示),尤其是在rh.39与hu.37之间不同,所述rh.39和所述hu.37仅具有一个氨基酸差异(a24d),而它们的评分十分不同(4相对于13)。我们推断vp1/2区域可能在aav气道转导中起一定作用。
通过用rh.20替换aav3g1的vp1/2区域(1-202),我们产生称为aav8.t20的另一突变体。实际上,相比于aav8,aav8.t20的转导是8-12倍(图7b),接近aav9水平(图7b)。
材料和方法
动物研究。
用于研究的所有小鼠都饲养在宾夕法尼亚大学(universityofpennsylvania)的实验室动物护理评估和认证联合会(associationforassessmentandaccreditationoflaboratoryanimalcare)认可和公共卫生局(publichealthservice)确保的设施中。所有动物程序都遵循由宾夕法尼亚大学的动物护理和使用机构委员会(instituteofanimalcareandusecommittees)核准的方案。所有小鼠都从jacksonlaboratory(barharbor,me)购买。除非明确描述,否则小鼠是c57bl/6j小鼠(雄性,6-8周龄)。质粒文库构建。
起始质粒paavinvivo显示于图14中。采用phusion(thermofisherscientific,ma)和简并寡聚物ctacagaggaatacggtatcgtgnnkgataacttgcagnnknnkaacacggctcctnnknnknnknnkgtcaacagccagggggccttac(seqidno:85),通过pcr来构建hvr.viii诱变文库,随后克隆至paavinvivo中,并且通过电穿孔来转化至stbl4感受态细胞(invitrogen,ca)中。hvr.i和hvr.iv的初始文库以相同方式构建,对于hvr.i采用简并寡聚物caaccacctctacaagcaaatctccnnknnknnknnknnkggagccaccaacgacaacacctact(seqidno:86),并且对于hvr.iv,采用简并寡聚物ctacttgtctcggactcaaacaacannknnknnknnknnkacgcagactctgggcttcagccaa(seqidno:87)。
克隆质粒是paavinvivo.c41---aav8vp1用aav8.c41vp1替换。在第1轮选择之后,用侧接有bsmbi位点的引物重新得到aav序列,并且克隆至通过以下方式来根据paavinvivo.c41构建的两种新克隆质粒中:通过沉默突变来移除两个内源性bsmbi位点,接着引入分别侧接于hvr.i和hvr.iv的两个bsmbi位点。此处使用的感受态细胞是megaxdh10btmt1relectrocomptm细胞(invitrogen,ca)作为替代。以与常规aav载体制备相同的方式产生病毒文库。
aav文库产生。
对于hvr.viii,使质粒文库与pδf6和prep混合,并且用磷酸钙方法转染至ek293细胞中。在转染之后3天,收集细胞溶解产物,再混悬于dpbs中,并且用全能核酸酶(merck)处理。接着将溶解产物短暂离心以移除碎片。上清液是aav诱变文库,并且储存在-20℃下供进一步使用。对于hvr.i和hvr.iv,以与常规aav载体相同的方式产生文库(参见下文)。用实时pcr进行滴定。
选择。
hvr.viii经受1轮体外选择。具体来说,使1e9个基因组拷贝(gc)的aav诱变文库与0.5μladk8(aav8nab滴度--1:2560)混合,并且添加完全培养基直至1ml。在37℃下孵育混合物30分钟,接着施加于293细胞(moi,约1e4)。2天后,将细胞裂解,随后在2天后,用质粒padδf6和prep转染。在转染之后2天,通过pcr来从细胞重新得到aav片段,克隆至topo载体(invitrogen)中以进行测序,接着克隆至反式质粒中以产生aav.cmv.egfp载体来进行进一步分析。
采用2.53e10gc/小鼠(对于hvr.i)和4e10gc/小鼠(对于hvr.iv)的剂量、3只小鼠/组、静脉内注射,hvr.i和hvr.iv经受在b6小鼠中三轮体内选择。在文库注射之前2小时,静脉内注射100ul用dpbs稀释的hivig。对于第1轮,1组小鼠用于各hvr,采用hivig滴度1:40;对于第2轮,2组用于各hvr,第1组采用hivig滴度1:40,并且第2组采用hivig滴度1:80;对于第3轮,3组用于各hvr,第1组采用hivig滴度1:80,第2组采用hivig滴度1:160,并且第3组采用hivig滴度1:320。在载体注射之后2周,通过pcr来从肝重新得到aav序列以进行以上所述的下一文库构建。aav载体产生如由lock等,2010所述来制备aav载体。
针对犬f9和人f9的elisa。用于测量犬f9的elisa由wang等,2005描述。人f9elisa方案是犬f9elisa的修改形式,也由wang等人开发。
体外nab测定,以egfp作为报告基因。使1e9gc的携带egfp盒的各aav突变体与不同单克隆抗体(adk8,aav8nab滴度1:2560,0.5μl/孔;adk8/9,aav8nab滴度1:2560,0.5μl/孔;adk9,aav8nab滴度1:5,0.5μl/孔)混合,用培养基达到100μl,在37℃下孵育30分钟,接着施加于293细胞(在感染之前1天以5e4个细胞/孔接种于96孔板中)。监测gfp表达,并且用imagej定量。体外nab测定,以荧光素酶作为报告基因。将huh7细胞以5e4个细胞/孔接种在具有透明底部的96孔黑色板(corning)中。2天后,在完全培养基中稀释aav载体,接着使血清/血浆样品与各种稀释液混合。在37℃下孵育混合物30分钟,随后转移至huh7板中。在载体感染之后3天,用claritytm发光微板读取器(biotek)读取发光。
体内荧光素酶测定
对于用鼻内施用进行的研究,使小鼠麻醉。将d-虫荧光素(xenogen)以15ug/ul,10ul/鼻孔,20ul/小鼠滴注至小鼠鼻孔中。5分钟后,通过
肝素结合测定
在所需缓冲液(dpbs或tris缓冲液)中稀释aav载体,并且通过
这个研究的另一方面是用h.20替换aav3g1的vp1/2区域(1-202)。通过组合来自limberis等人的研究(limberis,mp等,(2009).transductionefficienciesofnovelaavvectorsinmouseairwayepitheliuminvivoandhumanciliatedairwayepitheliuminvitro.molther17:294-301,其以引用的方式并入本文)和我们的序列分析的数据,我们发现在aav进化枝e内的高肺转导成员与低肺转导成员之间存在密码子24区别。因为3个最高进化枝e成员rh.64r1、rh.10和rh.20的1-202区域的氨基酸是相同的,所以我们将这个区域替换至aav3g1中,从而导致aav3g1的鼻转导进一步改进。
实施例4:肌肉中比较aav8和aav3g1
用由vectorcore制造和滴定的aav3g1.tmck.pi.ffluc.bgh(dd-pcr(pk)),以3e9或3e10gc/小鼠、1条腿/小鼠,对雄性b6小鼠进行肌肉内注射,3只小鼠/组。第1周结果显示于图15中。对于各图,左侧是经aav8处理,右侧是经aav3g1处理。
尽管载体是肌肉内注射,但大比例的aav8载体去向肝,这与先前研究一致,并且即使在由肌肉特异性启动子tmck控制时,转基因也在肝中表达。相比于aav8,aav3g1的肌肉转导好得多。
实施例5
使用来自原初nhp的血清,测定针对aav8、av83g1和aav9的中和抗体滴度。结果确认aav8和aav3g1在血清学上不同。
(序列表自由文本)
对于含有处于数字标识符<223>下的自由文本的序列,提供以下信息。
本说明书中引用的所有出版物都以引用的方式整体并入本文,2016年4月15日提交的美国临时专利申请号62/323,389也是如此。类似地,本文参照以及出现在随附序列表中的seqidno以引用的方式并入本文。尽管本发明已参照特定实施方案加以描述,但应了解可在不脱离本发明的精神的情况下进行修改。所述修改意图属于随附权利要求的范围。
- 还没有人留言评论。精彩留言会获得点赞!