核酸、蛋白和小分子在玻璃体囊泡体中的递送的制作方法
本发明根据国立卫生研究院的授权号ul1tr000457-06在政府支持下完成。政府享有本发明的某些权利。
本发明涉及用于将治疗剂递送至眼部组织以治疗眼科疾病的方法和组合物。
背景技术:
涉及将核酸(诸如基因、mrna、dna、sirna、mirna或其他非编码rna)、蛋白和/或小分子递送至眼内结构的疗法在包括眼部疾病的疾病中具有巨大的治疗潜力。然而,不能将生物活性分子直接递送至其靶点是眼部疾病治疗中的主要限制。血-视网膜屏障阻止大多数分子渗入视网膜。对于其他眼部组织而言也存在类似的限制。
例如,许多视网膜变性疾患是由单基因突变引起的。递送突变基因的正常拷贝或由该基因编码的蛋白具有防止此类疾病进展的潜力。这些基因的直接递送受到许多因素的限制,包括细胞外环境中游离遗传物质的不稳定性。蛋白的直接递送同样可受到细胞外组织中的不稳定性限制,以及渗透血-视网膜和其他天然屏障的限制。开发一种将核酸、蛋白或小分子带入细胞内的方法可以改变眼部治疗。
类似地,已经将许多视网膜疾病诸如湿性年龄相关性黄斑变性、糖尿病性视网膜病变、源自多种原因的黄斑水肿等与血管内皮生长因子(vegf)水平升高联系起来。玻璃体内注射抑制vegf的抗体或小分子是针对这些疾病的有效疗法;然而,往往需要频繁注射。已经尝试了许多方法以通过替代性方法来减少vegf,例如使用编码天然存在的抗vegf蛋白诸如sflt-1的基因的基因疗法。历史上,这些基因疗法使用病毒载体诸如腺病毒载体(或腺相关病毒(aav)载体)进行基因递送。由于病毒载体本身的潜在毒性或免疫原性,针对视网膜疾病的基于aav载体的基因递送受到限制。而且,最近的临床试验试图利用这种技术,但试验因失败而停止。
本发明旨在克服本领域的这种和其他缺陷。
技术实现要素:
本发明的第一方面涉及一种包含一种或多种房水和/或玻璃体液细胞外囊泡体的组合物。所述组合物的房水和玻璃体囊泡体经修饰为含有一种或多种外源性物质。
本发明的另一方面涉及一种将治疗剂递送至受试者的选定细胞或组织的方法。该方法涉及提供一种包含一种或多种房水和/或玻璃体液囊泡体的组合物,其中所述组合物的囊泡体经修饰为含有一种或多种治疗剂。该方法还涉及在将包含经修饰为含有一种或多种治疗剂的所述一种或多种房水和/或玻璃体液细胞外囊泡体的组合物有效递送至所述受试者的选定细胞或组织的条件下,将所述组合物施用给所述受试者。
本发明的另一方面涉及一种制备包含一种或多种房水和/或玻璃体液囊泡体的组合物的方法,其中所述组合物的囊泡体经修饰为含有一种或多种外源性物质。该方法涉及提供包含玻璃体液和/或房水液的哺乳动物眼内液样品,并从所述眼内液样品中分离囊泡体。该方法还涉及将所述一种或多种外源性物质插入分离的囊泡体中。
本文描述了使用存在于眼睛玻璃体液和/或房水中的囊泡体来递送用于治疗目的的基因、蛋白或小分子的组合物和方法。可以从眼睛中安全地采集这些囊泡体,排空其天然内容物,然后填充治疗物质(核酸、蛋白或小分子)。然后可以通过多种途径,包括静脉内或通过眼内注射,将它们施用给患者。囊泡体被靶细胞吸收,并以适于发挥疗效的形式释放有效载荷。可以修饰囊泡体的细胞表面上的靶向分子,以允许将囊泡体直接靶向疾病部位,从而减少对附近组织的毒性。最重要的是,因为这些囊泡体是已经存在于玻璃体内的内源性生理体,所以可以进行其收获、装载和用于治疗目的的再施用,对眼睛的精细神经结构几乎没有毒性或免疫原性。
附图说明
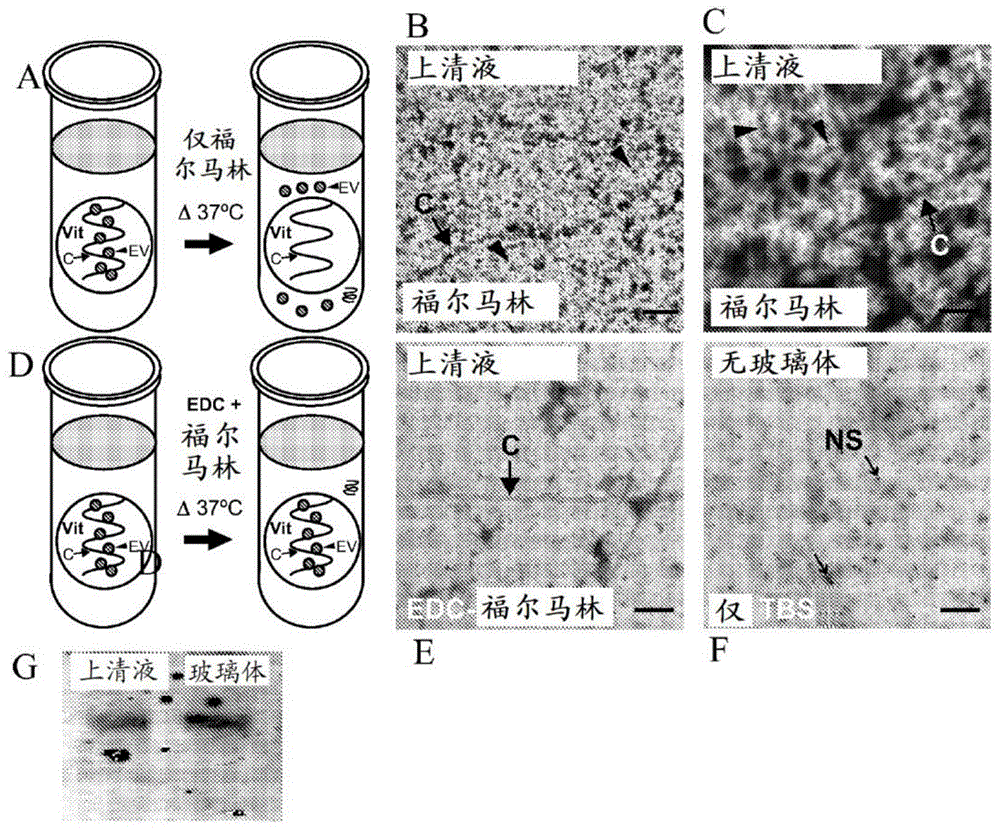
图1a-1g显示细胞外囊泡(ev)从福尔马林固定的牛玻璃体组织中逃逸并经1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)-福尔马林固定而保留。图1a是示意图,显示福尔马林固定的浸入洗涤缓冲液(上清液)中并加热至37℃的玻璃体(vit)组织导致ev(箭头)和玻璃体胶原蛋白(c,实心箭号)逃逸到上清液中。图1b-1c是在37℃下温育后从福尔马林固定的牛玻璃体组织收集的上清液的代表性透射电子显微术(tem)显微照片,并且乙酸双氧铀(ua)和柠檬酸铅染色显示胶原蛋白链(c,实心箭号)和许多ev(箭头)丢失到洗涤缓冲液中的迹象。图1d是示意图,显示edc福尔马林固定的浸入洗涤缓冲液中并加热至37℃的玻璃体组织导致ev保留在组织中,没有ev丢失且玻璃体胶原蛋白链最低限度地丢失到上清液中。图1e显示了在37℃下温育后得自edc-福尔马林固定的玻璃体组织的上清液的代表性tem显微照片,并且ua和柠檬酸铅染色显示上清液中有少量胶原蛋白链(c,实心箭号)而没有ev。图1f显示了特异性对照即单独的pbs的代表性tem照片,其在上清液中既未显示胶原蛋白纤维也未显示ev,但确实显示出尺寸小于20nm的电子致密灶的非特异性点状染色(ns,空心箭号)。图1g显示了检测福尔马林固定的玻璃体组织(左侧泳道)和玻璃体样品(右侧泳道)的上清液(洗涤缓冲液)中的外来体标记物tsg-101的western印迹。比例尺为(图1b)2.5μm、(图1c)500nm和(图1e-1f)200nm。
图2a-2f显示通过多焦点显微镜术(mpm)成像,当与单独的福尔马林固定相比时,edc-福尔马林固定牛玻璃体保留了ev。图2a是置于视力测试卡上的牛玻璃体的总体图像,其展示了高度透明的凝胶状结构。图2b显示了用单独的福尔马林固定并用标记蛋白(橙色)的cfse和标记细胞核(紫色)的hoechst染色的全封固的(wholemount)牛玻璃体样本的代表性mpm显微照片。在细胞核周围观察到cfse信号(图2b,左图,空心箭号),但在细胞外间隙未观察到。细胞核染色未显示细胞外信号(图2b,左图,紫色,空心箭号)。图2c显示edc-福尔马林固定的用cfse(橙色)和hoechst(紫色)染色的玻璃体的代表性mpm显微照片。图像的覆盖图显示出与细胞体(用空心箭号表示)一致的阳性信号以及在大小和形状上与ev一致的细胞外蛋白信号灶(箭头)。图2d是图2c的插图(白色方框),其显示围绕细胞核染色区域(图2d,右图,空心箭头,紫色)的多个圆形细胞内灶(图2d,左图,空心箭头,橙色)。观察到许多局灶性细胞外蛋白信号(图2d,左图,实心箭头,橙色),其在大小和形状上与ev一致,未观察到细胞外dna。图2e是表示每个玻璃体细胞的ev的平均值±标准偏差数的图表,并且显示edc-福尔马林固定的玻璃体表现出比福尔马林固定的玻璃体明显更多的ev。图2f是通过mpm成像的牛玻璃体ev直径的频率分布的图示。对4,000个ev测量ev大小,并且将ev的频率相对于ev的直径作图。多光子显微镜的下限为200nm,测量了达6000nm的ev。将ev与细胞区别开来并且定义为含有细胞外蛋白或rna,无细胞外dna。p值<0.05。比例尺为(图2a)1cm、(图2b)40μm、(图2c)50μm和(图2d)10μm。
图3a-3c显示用edc-福尔马林固定牛玻璃体原位保留了ev和细胞外rna。图3a-3c显示了用edc-福尔马林(图3a和图3b)或单独的福尔马林(图3c)交联,用标记dna和rna的碘化丙啶(pi,红色)、使dna和细胞核可视化的hoechst(蓝色)和对蛋白染色的羧基荧光素琥珀酰亚胺酯(cfse,绿色)染色的全封固的牛玻璃体样本的代表性共聚焦荧光显微照片。图3a是来自edc-福尔马林固定的牛玻璃体的图像的覆盖图,并且显示与细胞体(图3a,用空心箭号表示)一致的阳性信号以及在大小和形状上与ev一致的细胞外rna(实心箭头)和细胞外蛋白(实心箭头)的灶。图3b显示了edc-福尔马林固定的玻璃体的代表性共聚焦荧光显微照片,并显示了多个圆形细胞灶(图3b,所有图,空心箭头)以及细胞之间的细胞外rna(图3b,左图,pi染色,红色)和细胞外蛋白(图3b,右图,cfse染色,绿色)的许多局灶性信号。图3c显示单独用福尔马林固定的全封固的牛玻璃体的代表性显微照片,并显示细胞核中rna的信号(图3c,左图,pi,红色),类似于细胞核染色(图3c,中图,hoechst,蓝色)。仅福尔马林固定的玻璃体未显示出细胞外rna信号的灶(图3c,左图)。cfse染色显示出细胞信号(空心箭号),但没有ev形细胞外蛋白信号(图3c,右图,绿色,在空心箭号之间未观察到点状染色)。仅福尔马林固定中细胞大小看起来较小,这可能是由于与单独的福尔马林相比,edc-福尔马林保留了更多的细胞质rna和蛋白。比例尺为(图3a)25μm和(图3b-3c)50μm。
图4a-4c显示:用rna酶处理经pi染色的edc-福尔马林固定的牛玻璃体显示出减少的细胞外信号。图4a显示用edc-福尔马林交联并用pi染色的全封固的牛玻璃体样本的低倍宽视野(low-powerwide-field)荧光显微照片(图4a,上图,红色)并显示玻璃体组织的细胞外环境中的信号(用实心箭头表示,插图),显示了标记的细胞核(图4a,中图,hoechst,蓝色)和合并的图像(图4a,下图)。玻璃体细胞核用pi和hoechst染色呈阳性;共定位信号以绿色显示(图4a,下图,插图)。细胞用空心箭号表示,并且细胞外pi信号的灶用实心箭头标记(图4a,上图和中图,插图)。将细胞核染色,未观察到细胞外dna信号(图4a,下图)。图4b显示用edc-福尔马林固定并用rna酶a处理的全封固的牛玻璃体的显微照片。显示了经pi(图4b,上图,红色)、hoechst(图4b,中图)染色的样品和合并的图像(图4b,下图)。经rna酶a处理的样品未显示出有细胞外rna的迹象,如细胞体之间缺乏信号所证明的那样(图4b,上图和中图),并且在两个细胞核之间也未显示出信号(空心箭号)。经rna酶a处理的样品中的细胞质rna的pi信号(图4b,上图)看起来比rna酶处理前的样品(图4a,上图)小,这可能是由于edc-福尔马林保留了更多的细胞质rna。图4c是rna酶处理前用pi染色的edc-福尔马林固定的组织的细胞外信号灶的平均值±标准偏差的图示,并且在rna酶处理后显示,rna酶处理后的ev更少。每个细胞的ev的平均值+/-标准误差在rna酶处理前为60.7+/-35.1且在rna酶处理后为0.03+/-0.04,注意到在rna酶处理前每个细胞的ev明显更多(p<0.001)(图4c)。比例尺为(图4a-4b)50μm和(4a插图、4b插图)20μm。
图5a-5b显示edc-福尔马林固定牛玻璃体保留了可用显微照相成像的ev。图5a-5b显示了用edc-福尔马林(图5a)或单独的福尔马林(图5b)交联的全封固的牛玻璃体样本的低倍宽视野荧光显微照片。图5a显示用edc-福尔马林固定并用标记蛋白的cfse(图5a,上图和中图,白色)和标记细胞核的hoechst(图5a,下图,蓝色)染色的牛玻璃体的代表性显微照片,并且显示具有与ev一致的许多细胞外蛋白信号(上图和中图,csfe,白色)的多个圆形细胞灶(图5a,所有图,空心箭头)。图5b显示用福尔马林固定的全封固的牛玻璃体的显微照片仅显示与cfse共定位(图5b,上图和中图,白色)的核染色(图5b,中图和下图,hoechst,蓝色),分别与细胞dna和核酸一致。没有细胞外蛋白信号的迹象(图5b,上图和中图,csfe,白色)。与edc-福尔马林固定(图5a,中图)相比,在仅福尔马林固定(图5b,中图)中cfse染色的细胞大小看起来较小,这可能是由于edc-福尔马林与单独的福尔马林固定相比保留了更多的小蛋白。比例尺为(图5a-5b)100μm。
图6a-6i显示牛和人玻璃体液含有ev。图6a显示用乙酸双氧铀(ua)和柠檬酸铅染色的牛玻璃体组织切片的代表性透射电子显微术(tem)显微照片,并且显示了大量在大小上具有多形性(箭头)并且接触胶原蛋白链(用“c”和箭号标记)的ev。插图(右上角)是右下角中区域封闭方框的放大图,并显示了与胶原蛋白链缔合的ev。图6b显示了从牛玻璃体分离并用电子致密蛋白染剂csfe染色的ev的代表性tem显微照片,其描绘了ev形态并且显示了许多在大小上具有多形性的ev(用箭头标记较小的ev,用双箭头标记较大的ev)。图6c显示了从牛玻璃体分离并且经电子致密核酸染剂吖啶橙(ao)染色的ev的代表性tem显微照片,并且显示了大ev(双箭头)阳性核酸信号。图6d显示了在用溴化乙锭(etbr)(一种电子致密核酸染剂)染色的全封固的牛玻璃体内的胶原蛋白网络中的多个ev(箭头)。图6e显示了基于从牛玻璃体分离的ev的纳米粒子跟踪分析,根据ev直径的平均值(黑线)±标准误差(红色条)浓度ev的图示。图6f显示用ua和柠檬酸铅染色的死后人眼切片的代表性tem显微照片,显示出玻璃体基底部(vit)处的大量ev,与睫状体的非色素上皮(npe)相邻(用箭头标记较小的ev,用双箭头标记较大的ev)。ev(图6f-6g,箭头)与胶原蛋白链(箭号)接触。图6h显示了从人玻璃体分离并用ao染色的ev的代表性tem显微照片,显示出具有阳性核酸信号的ev(箭头)。图6i是人玻璃体ev直径的频率分布的图示。比例尺为(图6a、图6g)100nm、(图6b)50nm、(图6c-6d、图6h)200nm和(图6f)2μm。
图7a-7d显示正常牛玻璃体中ev特异性蛋白tgs-101的免疫组织化学染色。图7a显示用福尔马林固定并在低温下处理的全封固的牛玻璃体样本的代表性宽视野荧光显微照片,并且展示细胞外间隙中ev相关蛋白tgs-101的免疫组织化学染色(图7a,上图和中图,箭头,alexa488,绿色)。插图(图7a,所有图,右上)是中间方框的高倍放大图像(图7a,所有图)。细胞核经hoechst复染剂标记(图7a,上部和下部,蓝色,空心箭号)。观察到数百个点状细胞外信号(图7a,上部和中部)。没有观察到细胞外dna的迹象(图7a,下部)。图7b显示来自tsg-101免疫组织化学的以下特异性对照的代表性显微照片:用非特异性igg抗体(绿色)标记的全封固的正常牛玻璃体。插图(图7b,所有图,右上)是中间方框的高倍放大图像(图7b,所有图)。在细胞核周围观察到信号(图7b,上部和中部,alexa488,绿色)。图像未显示细胞外信号的迹象(图7b,上部和下部,hoechst,蓝色)。图7c是细胞外和细胞内间隙中tsg-101信号的平均值+/-标准误差的图示,通过学生非配对t检验所示,*p<0.05。图7d显示在福尔马林固定的玻璃体的细胞外间隙中观察到tsg-101的阳性信号(图7d,左,绿色)。细胞核用hoechst(图7d,左,蓝色)和pi(图7d,右,红色)标记。在福尔马林固定的样品中没有细胞外rna的迹象(图7d,右,红色)。比例尺为(图7a-7b)40μm和(图7a插图、图7b插图和图7d)10μm。
图8a-8b显示低速离心后牛玻璃体不含细胞。图8a显示在低速离心后接着进行苏木精和伊红染色的全封固的牛玻璃体的代表性低倍光学显微镜显微照片。这些图像显示与玻璃体胶原蛋白一致的嗜酸性信号(粉色,箭号),没有苏木精染色的细胞核的迹象。图8b显示离心前全封固的玻璃体的图像。这些图像显示与玻璃体胶原蛋白一致的嗜酸性信号(粉色,箭号),有苏木精染色的细胞核的迹象(紫色,空心箭号)。比例尺为(图8a-8b)50μm。
图9a-9i显示人和牛玻璃体ev将内源rna转运到培养的细胞中。图9a-9c显示用大剂量的经核酸染剂吖啶橙(ao)预标记的牛玻璃体ev处理24小时后人视网膜色素上皮细胞(arpe-19)的代表性共聚焦显微照片图像。图像显示arpe-19细胞中ev标记的rna的摄取(图9a,绿色)。标记细胞核(图9b,hoechst,紫色),并且合并的图像(图9c)显示arpe-19细胞转染,细胞质中有ao信号。图9d是用牛玻璃体ev处理的arpe-19细胞的转染效率(转染细胞的%)的图示(误差条表示标准偏差,n=3,p<0.05)。图9e-9f显示用24小时大剂量的经ao预标记的牛ev体处理的人胚肾(hek)细胞的代表性共聚焦显微照片,并且显示细胞质中的染色(图9e)。标记细胞核,并显示了合并的图像(图9f)。图9g和图9h是用大剂量的从死后人玻璃体中分离并用ao预标记的ev处理3小时的arpe-19细胞的代表性低倍荧光显微照片图像。图9g的图像显示细胞转染(图9g,ao,绿色)。标记细胞核(图9h,hoechst,蓝色)。图9i是用人玻璃体ev处理的arpe-19细胞的转染效率(转染细胞的%)的图示(误差条表示标准偏差,n=3,p<0.05)。比例尺为(图9a-9c)50μm、(图9e-9f)15μm和(图9g-9h)100μm。
图10a-10f显示通过牛玻璃体细胞外囊泡(ev)向培养的人视网膜色素上皮(arpe-19)细胞递送重组牛血清白蛋白(bsa)和重组绿色荧光蛋白(gfp)。图10a是用大剂量的牛玻璃体ev处理的arpe-19细胞的代表性显微照片,所述牛玻璃体ev已通过在300v下电穿孔预载有1μg与荧光素缀合的bsa。图10a显示细胞质中的荧光素染色(黄色)。图10a的中间图像显示用hoechst染剂(蓝色)标记的细胞核,合并的图像(图10a,右)显示大量经转染的细胞。图10b是用大剂量的牛玻璃体ev处理的arpe-19细胞的代表性显微照片,所述牛玻璃体ev已与bsa荧光素混合而未进行电穿孔(0v,对照)。图10b的左侧图像显示没有荧光素染色,而图10b的右侧图像显示了用hoechst染剂(蓝色)进行的细胞核标记。图10c是用通过在300v下电穿孔而载有3μg、1μg或0.5μgbsa荧光素的玻璃体ev,用未进行电穿孔(0v,对照)而载有0.5μgbsa-荧光素的ev或用未进行电穿孔(0v,对照)的单独pbs处理的arpe-19细胞的平均值±标准偏差转染效率(转染细胞的%)的图示。对于在300v下装载的所有bsa-荧光素剂量相对于0v的对照而言,p<0.001。图10d显示施加大剂量的通过在300v下电穿孔而预载有1μg重组gfp的牛玻璃体ev后arpe-19细胞的代表性显微照片。图10d的左侧图像显示了细胞质中的阳性gfp染色(绿色)。图10d的中间图像显示用hoechst染剂(蓝色)标记的细胞核,合并的图像(图10d,右)显示大量经转染的细胞。图10e的右侧图像显示施加大剂量的牛玻璃体ev后arpe-19细胞的代表性显微照片中无荧光染色,所述牛玻璃体ev已与gfp荧光素混合,未进行电穿孔(0v,对照)。图10e的右侧图像显示了对照样品中用hoechst染剂(蓝色)进行的细胞核标记。图10f是施加通过在300v下电穿孔而载有1μg、0.5μg或0.25μggfp或未进行电穿孔(0v,对照)而载有1μggfp的ev后,arpe-19细胞的平均值±标准偏差转染效率(转染细胞的%)的图示。对于在300v下装载的所有gfp剂量相对于0v的对照而言,p<0.05。比例尺为(图10a-10e)50μm。
图11a-11d显示牛玻璃体ev靶向视网膜并在体内递送重组蛋白。图11a是在注射稀释量的载有与荧光素缀合的重组牛血清白蛋白(bsa)的牛ev之后,在注射后第3天小鼠视网膜组织切片的代表性宽视野荧光显微照片。图11a的左侧图像仅显示bsa荧光素,图11a的中间图像仅显示用hoeschst进行的细胞核染色,图11a的右侧图像显示合并的图像。图11a的图像显示玻璃体中不穿透内界膜(ilm)的信号。图11b是注射bsa-荧光素后3周的小鼠视网膜组织切片的代表性共聚焦显微照片,其显示在视网膜外网层(opl)和内网层(ipl,箭号)中的表达。图11b的左侧图像仅显示bsa荧光素,图11b的中间图像仅显示细胞核染色,图11b的右侧图像显示合并的图像。图11c是显示穿过ipl和opl的细胞以及神经节细胞(用插图方框标记)中的信号的图像。来自(图11c)的插图方框在(图11d)以更高倍率显示,展示了神经节细胞层(gcl)和视网膜神经纤维层中的细胞簇中的阳性染色。图11c-d的左侧图像仅显示bsa荧光素,图11c-d的中间图像仅显示细胞核染色,图11c-d的右侧图像显示合并的图像。比例尺为30μm(图11a)、50μm(图11b-11c)和25μm(图11d)。光感受器节段(ph节段)、外核层(onl)、内核层(onl)。
图12a-12e显示牛玻璃体ev靶向角膜、睫状体和视网膜以在体内递送重组蛋白。图12a是在注射通过电穿孔(300v)而载有与荧光素缀合的重组牛血清白蛋白(bsa)(bsa-荧光素)的牛ev之后,在注射3周后的小鼠眼组织切片的代表性共聚焦荧光显微照片,其显示角膜中来自内皮细胞和角膜细胞的信号(图12a的左侧图像仅显示bsa荧光素,图12a的中间图像仅显示用hoeschst进行的细胞核染色,图12a的右侧图像显示合并的图像)。图12b是注射3周后来自未进行电穿孔(0v)的与bsa-荧光素混合的牛ev的对照组的图像,其显示在内皮细胞和角膜细胞中都没有表达,但确实显示了角膜上皮的非特异性染色(图12b的左侧图像仅显示bsa荧光素,图12b的中间图像仅显示用hoeschst进行的细胞核染色,图12b的右侧图像显示合并的图像)。图12c是在注射通过电穿孔(300v)而载有bsa-荧光素的ev3周后来自小鼠眼部的代表性共聚焦荧光显微照片,其显示出非色素睫状上皮细胞中的信号(图12a的左侧图像仅显示bsa荧光素,图12c的中间图像仅显示用hoeschst进行的细胞核染色,图12c的右侧图像显示合并的图像)。图12d是显示光感受器、内网层(ipl)、视网膜色素上皮(rpe)细胞和脉络膜中bsa-荧光素的稳健表达的图像(图12d的左侧图像仅显示bsa荧光素,图12d的中间图像仅显示用hoeschst进行的细胞核染色,图12d的右侧图像显示合并的图像)。图12e是通过ev递送的用重组bsa蛋白转染的小鼠视网膜光感受器和视网膜色素上皮(rpe)的图像。比例尺为25μm(图12a-12e)。角膜上皮(epi)、角膜内皮(endo)、外网层(opl)、外核层(onl)、内网层(onl)。
图13a-13i显示载有荧光标记的sirna的牛玻璃体囊泡体高效转染到人视网膜色素上皮细胞内。图13a-13c是人视网膜色素上皮(arpe-19)细胞的低倍荧光显微照片,其显示在350v下用牛囊泡体进行电穿孔后与花青3染料缀合的抗gapdhsirna(sirna-cy3)的转染(图13a,黄色,cy3),细胞核经hoechst染料标记(图13b,蓝色),并且图13a和图13b的合并图像显示了大量经转染的细胞(图13c)。图13d-13f是在200v下进行电穿孔后经含有sirna-cy3的牛玻璃体囊泡体处理的arpe-19细胞的低倍显微照片。图13d显示了细胞质中的sirna-cy3染色(黄色)。细胞核经hoescht染剂标记(图13e,蓝色),并且图13f的合并图像显示了细胞质中的染色,与350v相比细胞染色减少。图13g-13h是显示用大剂量的牛囊泡体和抗gapdhsirna-cy3处理而未进行电穿孔(0v)的arpe-19细胞的图像。图13g显示arpe-19细胞中没有sirna-cy3染色,并且图13h显示了经hoechst染剂(蓝色)标记的细胞核。13i的图表显示按电穿孔电压计,经sirna-gapdh-cy3转染的细胞的百分比。比例尺为50μm(图13a-13h)。
图14a-14f显示牛睫状体非色素上皮产生丰富的囊泡体并将其释放到细胞内间隙中。图14a-14c是来自用乙酸双氧铀染色的牛睫状体非色素上皮(npe)切片的tem显微照片图像,其显示了在扩大的细胞内间隙(isp)的内腔中和从npe表面(图14a,星号)出芽的多个囊泡体(图14a,箭头)。图像的取向使得显示出npe的基底部和标记的玻璃体基底部(vit)以及内界膜(ilm)。图14b是图14a上部方框的插图,并且显示了isp内的囊泡体。图14c显示了图14a的下部插图并且显示了具有出芽到isp内腔中的囊泡体的npe细胞(图14c,星号)。图14d是npe的tem显微照片,其显示了细胞内(图14d,楔形)和isp内腔中的囊泡体(图14d,箭头)中的电子致密体。图14e是睫状体色素上皮(pe)的tem显微照片,其未显示出芽囊泡的迹象。图14f是附着于睫状体的牛玻璃体基底部的tem图像,其显示了在胶原蛋白基质(图14f,箭号)内具有几个玻璃体(图14f,箭头)的胶原蛋白纤维。比例尺为1um(图14a)、200nm(图14b和图14f)、250nm(图14c)和500um(图14d-14e)。
图15a-15i显示了载有外源性蛋白的玻璃体囊泡体高效地转染到人视网膜色素上皮细胞内。图15a-15c是人视网膜色素上皮(arpe-19)细胞的低倍荧光显微照片,其显示了外源性牛血清白蛋白的摄取。将牛玻璃体液囊泡体在350v下用bsa-荧光素电穿孔,然后大剂量给予arpe-19细胞,其在细胞质中显示出大量染色(图15a,黄色)。细胞核用hoechst染剂标记(图15b,蓝色),并且图15a和图15b的合并图像显示了针对荧光素染色的大量arpe-19细胞(图15c)。用含有bsa-荧光素(在200v下电穿孔)的牛玻璃体囊泡体处理的arpe-19细胞也在细胞质中显示染色(图15d)。这些细胞的细胞核用hoechst染剂标记(图15e,蓝色),并且合并的图像(图15f)显示细胞质染色减少,这意味着与暴露于300v电穿孔的ev的细胞相比,转染的细胞更少。图15g-15h是显示用牛囊泡体和bsa-荧光素处理而未进行电穿孔的arpe-19细胞的显微照片。未观察到arpe-19细胞中的bsa荧光素染色,如图15g所示)。细胞核经hoechst染剂标记(图15h,蓝色)。图15i是显示蛋白转染效率的图表(测量结果的误差条标准偏差,n=3)。比例尺为50μm(图15a-15h)。
图16a-16e显示房水含有丰富的囊泡体。图16a是用吖啶橙标记的全封固的牛房水的tem显微照片,其显示了各种大小的多个囊泡体(图16a,单箭头、双箭头和箭号分别标记小囊泡、中等囊泡和大囊泡)。图16b是tem显微照片,其描绘了用与胶原蛋白链(图16b,箭号)缔合的cfse(图16b,箭头)染色的囊泡体。图16c-16d是通过差速超速离心分离后用乙酸双氧铀(图16c)和吖啶橙(图16d)染色的牛前房外来体的tem显微照片,其显示各种大小的囊泡体的簇(图16c)。图16e是来自超速离心分离的外来体的纳米粒子跟踪分析的平均有限轨道长度调整(finitetracklengthadjustment)大小/浓度图表(误差条指示+/-1个平均值标准误差)。数据中浓度为1.10e8,平均值为140.8nm,标准偏差为127.9nm,峰值在15nm、35nm、65nm、115nm、185nm、205nm、225nm、275nm、415nm、505nm和615nm(图16e)。比例尺为200nm(图16a、图16c-16d)、500nm(图16b)。
图17a-17r显示分离的牛ev可以转染人皮肤细胞。将分离的牛ev针对内源蛋白(cfse)和rna(吖啶橙)进行标记,然后在培养物中转染人皮肤细胞(pam-212)。图17a-17c是人皮肤细胞pam-212的低倍宽视野显微照片,所述人皮肤细胞pam-212经牛玻璃体rna转染,在转染3小时后用吖啶橙(ao)标记。图17d-17f显示转染24小时后用ao标记的ev转染的pam-212细胞。图像显示牛evrna向人皮肤细胞的稳健转运。图17g-17i的图像显示经牛玻璃体ev转染的pam-212细胞,所述牛玻璃体ev先前使用cfse对所有蛋白进行标记,再次分离ev,然后使pam212细胞暴露于大剂量的ev标记的蛋白。转染3小时(图17g-17i)和24小时(图17j-17l)后,细胞显示出稳健的牛ev蛋白摄取。阴性对照显示在3小时(图17m-17o)和24小时(图17p-17q)没有转染。所有图像的比例尺均为100μm。
具体实施方式
本发明基于在健康的人眼和牛眼的玻璃体液和房水中意外发现了囊泡网络。该网络的囊泡载有许多不同的蛋白及编码和非编码rna,它们可以短距离和长距离转运到其他眼部组织。如本文所描述和证明的,这些囊泡体可以安全地从健康个体的眼内液中分离出来并进行修饰以用作治疗性递送媒介物。
因此,本发明的第一方面涉及一种包含一种或多种房水和/或玻璃体液细胞外囊泡体的组合物。所述组合物的房水和/或玻璃体细胞外囊泡体经修饰为含有一种或多种外源性物质。
如本文所用的术语“细胞外囊泡”是指由细胞分泌的纳米级膜粒子。细胞外囊泡,也称为ev、多泡体和核外粒体(ectosome),是通过将生物分子(诸如蛋白、脂质和rna)从一个细胞转运到另一个细胞而与细胞间通讯有关联的天然转运纳米囊泡。根据大小,细胞外囊泡与其他分泌的囊泡(例如外来体和凋亡小体)不同,即外来体的直径通常为约40-100nm,细胞外囊泡的大小通常为100-1000nm,并且凋亡小体的大小通常为1-5μm。
根据本公开,玻璃体液和房水的细胞外囊泡的特征在于其大小,即其直径。术语“直径”是指囊泡的最大尺寸,应当理解的是,囊泡不一定为球形。囊泡直径可以使用用于测量纳米粒子大小的常规技术测量,例如显微镜技术(例如,透射电子显微术或光散射技术)。在另一个实施方案中,使用纳米粒子跟踪分析来测量囊泡直径(参见授予carr和geddess的wo03/093801,其据此通过引用整体并入)。
玻璃体液的囊泡体的大小是不均匀的,直径在100nm至6000nm的范围内。在一个实施方案中,所述组合物的源自玻璃体液的细胞外囊泡的直径在100nm至1000nm的范围内。在另一个实施方案中,所述组合物的源自玻璃体液的细胞外囊泡的直径为约150nm至500nm。在另一个实施方案中,所述组合物的源自玻璃体液的细胞外囊泡的直径为约150nm至300nm。
房水的囊泡体的大小也是不均匀的,并且通常小于玻璃体囊泡体。在一个实施方案中,所述组合物的源自房水的细胞外囊泡的直径在50nm至600nm的范围内。在另一个实施方案中,所述组合物的源自房水的细胞外囊泡的直径为约50-400nm。在另一个实施方案中,所述组合物的源自房水的细胞外囊泡的直径为约50-200nm。
在一个实施方案中,包含房水和/或玻璃体液细胞外囊泡体的组合物包含囊泡体群体。囊泡“群体”是指至少2个囊泡体、至少5个囊泡体、至少10个囊泡体、至少50个囊泡体、至少100个囊泡体、至少500个囊泡体、至少1000个囊泡体、至少10000个囊泡体、至少100,000个囊泡体、至少1,000,000个囊泡体或更多个囊泡体的集合。
在另一个实施方案中,玻璃体液和房水的囊泡体的特征在于其蛋白组学特征。例如,玻璃体液的囊泡表达几种已知的外来体标记物,包括cd-9、hsp-90β、膜联蛋白-ii和tsg-101蛋白。下文中表1提供了玻璃体细胞外囊泡中存在并富含的外来体标记蛋白的完整列表。在一个实施方案中,所述组合物包含表达表1中所列的一种或多种外来体标记物的玻璃体液细胞外囊泡群体。在另一个实施方案中,所述组合物包含表达表1中所列的两种、三种、四种、五种、六种、七种、八种、九种或所有十种外来体标记物的玻璃体液细胞外囊泡群体。
本公开的组合物的玻璃体液囊泡还具有如本文实施例中所述的眼特异性蛋白的各种蛋白组学特征,参见下文表2。在一个实施方案中,所述组合物包含表达表2中所列的一种或多种眼特异性蛋白的玻璃体液细胞外囊泡群体。在另一个实施方案中,所述组合物包含表达表2中所列的两种、三种、四种、五种、六种、七种、八种、九种、十种或所有十一种眼特异性蛋白的玻璃体液细胞外囊泡群体。
玻璃体细胞外囊泡的完整蛋白特征在下文表3中提供。表3指出了所列蛋白在玻璃体液的细胞外囊泡级分与玻璃体液的无细胞级分之间的差异性表达。因此,在一个实施方案中,本文所述的组合物包含表达表3中所列的一种或多种蛋白的细胞外囊泡群体。在另一个实施方案中,本文所述的组合物包含表达一种或多种在玻璃体级分的细胞外级分中富含的蛋白的细胞外囊泡群体。在另一个实施方案中,本文所述的组合物包含表达一种或多种表3中鉴定为仅在细胞外囊泡级分中表达的蛋白的细胞外囊泡群体。本文所述的细胞外囊泡群体可以通过鉴定为仅在细胞外囊泡级分中差异性表达的蛋白的任何组合的表达来定义。
在一个实施方案中,组合物的房水和/或玻璃体液囊泡体是分离的囊泡体。如本文所用,术语“分离的”是指已经从人体或动物体中,即从动物或人的眼内液中取出,并且基本上与在体内通常与之相关联的细胞或细胞碎片分开的囊泡体。在一个实施方案中,包含细胞外囊泡的组合物>75%、>80%、>85%、>90%、>95%不含通常在体内与所述囊泡体相关联的细胞或细胞碎片。
所述组合物的细胞外囊泡可以使用几种技术来分离和/或纯化。这些技术包括单独使用或组合使用的过滤、离心、离子色谱法或浓缩。本文描述了示例性分离方法,该方法涉及一系列低速离心。本领域已知的并且适合于根据本发明使用的分离或纯化细胞外囊泡的其他示例性方法包括但不限于由例如vanderpol等人,“recentdevelopmentsinthenomenclature,presence,isolation,detectionandclinicalimpactofextracellularvesicles,”jthrombhaemost14:48-56(2016);授予balaj的美国专利申请公布第2016/0216253号;授予cohen的wo2015/143113;授予dhellin的wo2000/44389和授予lamparski的wo2001/82958公开的那些,这些文献据此通过引用整体并入。
在一个实施方案中,如本文所公开的组合物包含来自玻璃体液的细胞外体。玻璃体液或玻璃体位于晶状体与视网膜之间。它是光学透明的、大部分无细胞的凝胶状结构,几乎没有已知的生物学功能。在一个实施方案中,细胞外囊泡获自健康的正常玻璃体,即获自健康受试者。在另一个实施方案中,细胞外囊泡获自患有眼部疾病的受试者的玻璃体。在另一个实施方案中,所述组合物包含来自房水的细胞外体。房水是填充眼前房的透明液体,位于晶状体与角膜之间。在一个实施方案中,细胞外囊泡获自健康的正常房水,即获自健康受试者。在另一个实施方案中,细胞外囊泡获自患有眼部疾病的受试者的房水。在另一个实施方案中,所述组合物包含获自房水和玻璃体液的细胞外体的混合物。
在一个实施方案中,如本文所述的细胞外囊泡是由睫状体(例如睫状体上皮)分泌的。在另一个实施方案中,如本文所述的细胞外囊泡是由睫状体色素上皮、睫状体非色素上皮、睫状突分泌的。在另一个实施方案中,如本文所述的细胞外囊泡是由视网膜细胞分泌的,这些细胞包括米勒(müller)细胞、神经节细胞、无长突细胞、水平细胞、光感受器(视杆和视锥)双极细胞、视网膜色素上皮细胞或视网膜内皮细胞。在另一个实施方案中,如本文所述的细胞外囊泡是由角膜细胞分泌的,这些细胞包括角膜上皮细胞、角膜基质细胞(角膜细胞)、角膜内皮细胞或角膜缘干细胞。在另一个实施方案中,如本文所述的细胞外囊泡是由虹膜细胞分泌的,这些细胞包括色素细胞或非色素细胞、纺锤形成纤维细胞、巨噬细胞(koganei团块细胞)、括约肌平滑肌细胞或后上皮细胞。在另一个实施方案中,如本文所述的细胞外囊泡是由小梁网细胞分泌的,这些细胞包括小梁网细胞或施莱姆氏管(schlemm′scanal)的内皮细胞衬里。在另一个实施方案中,如本文所述的细胞外囊泡是由晶状体细胞分泌的,这些细胞包括晶状体上皮细胞、晶状体纤维细胞或晶状体囊细胞。在另一个实施方案中,如本文所述的细胞外囊泡是由脉络膜细胞分泌的,这些细胞包括立方上皮细胞、室管膜细胞层、脉络丛上皮细胞或脉络膜内皮细胞。在另一个实施方案中,如本文所述的细胞外囊泡是由视神经细胞分泌的,这些细胞包括少突胶质细胞、视网膜神经节细胞轴突或神经胶质细胞。在另一个实施方案中,如本文所述的细胞外囊泡是由干细胞和祖细胞分泌的,这些细胞包括间充质干细胞、角膜缘干细胞、视网膜干细胞。
如本文所述的组合物的玻璃体液和/或房水细胞外囊泡可以是任何哺乳动物的玻璃体液或房水细胞外囊泡。在一个实施方案中,所述组合物包含牛玻璃体液和/或房水细胞外囊泡。在另一个实施方案中,所述组合物包含人玻璃体液和/或房水细胞外囊泡。在另一个实施方案中,所述组合物包含源自非人灵长类动物、狗、猫、啮齿动物(例如,小鼠、大鼠和豚鼠)、马、鹿、绵羊或猪的玻璃体液和/或房水细胞外囊泡。
如本文所证明的,玻璃体液和房水的细胞外囊泡可以经分离、修饰为含有一种或多种外源性物质,并用作递送媒介物将所述一种或多种外源性物质递送至靶组织或细胞。该外源性物质可以是治疗剂或诊断剂。合适的治疗剂和诊断剂包括但不限于核酸分子、蛋白和多肽、小分子、激素及其任何组合。
在一个实施方案中,外源性物质是治疗性核酸分子。所述核酸分子可以是单链或双链核酸。单链核酸包括具有磷酸二酯、2′o-甲基、2′-甲氧基-乙基、氨基磷酸酯、甲基膦酸酯和/或硫代磷酸酯主链化学结构的那些。在一个实施方案中,核酸分子是选自核糖核酸分子(rna)、脱氧核糖核酸分子(dna)、rna-dna杂交体、其经修饰的rna分子、经修饰的dna分子或经修饰的rna/dna分子的核酸分子。
在一个实施方案中,治疗性核酸分子是rna分子,例如小rna分子、互补rna、非编码rna分子、sirna、pi-rna分子、微rna分子、sno-rna分子、长非编码rna分子、信使rna分子、核糖体rna分子、反义核酸分子、锁核酸(lna)、antagomir、rna适体、mirna模拟物、mir海绵、crispr/cas基因编辑rna、反式激活crrna(tracrrna)、由“支架”序列构成的短合成rna(grna)、小卡哈尔体(cajalbody)特异性rna(scarna)、天然顺式反义sirna(顺式-nat-sirna)、反式作用sirna(tasirna)、重复相关小干扰rna(rasirna)、7sk、转运信使rna(tmrna)、转运rna(trna)、7slrna、信号识别粒子rna(srp)及其任何组合。
在一个实施方案中,将细胞外囊泡修饰为含有适于治疗眼部疾病或疾患的治疗性rna。适于治疗眼部疾病的治疗性rna包括但不限于靶向β2-肾上腺素能受体以治疗青光眼的sirna(syl040012)(
在另一个实施方案中,使用本文所述的方法获得的玻璃体液和/或房水的分离的细胞外囊泡经修饰以表达或包含mrna。所述mrna可以编码抑制、下调、降低其过量水平与眼部疾病、病症或疾患相关的蛋白表达和/或活性的治疗剂。这样的治疗剂可以是肽、抗体或其他多肽或蛋白,包括本文所述那些中的任一种。在一个实施方案中,所述mrna编码抗体、可溶性受体或其他结合蛋白。通常,合适的mrna编码抑制、下调或减少在眼部疾病、病症或疾患中在量和/或活性上过量存在的蛋白的抗体。在一些实施方案中,合适的mrna编码激活、上调或增加在眼部疾病、病症或疾患中缺乏的蛋白活性的抗体。由可以引入如本文所述的玻璃体液和/或房水的细胞外囊泡中的mrna编码的示例性抗体包括但不限于针对vegf、tnfα、il-6、icam-1、vcam-1或可溶性受体如vegf受体(例如vegfr1)的抗体。
适于使用如本文所述的细胞外囊泡治疗眼部疾病或疾患的其他mrna分子包括例如但不限于:用于减少新血管形成的编码内皮抑素(endostatin)、血管抑素(angiostatin)、金属蛋白酶组织抑制剂3(timp3)、色素上皮源性因子(pedf)或可溶性血管内皮生长因子受体(sflt-1)的蛋白或生物活性片段的mrna分子;用于治疗色素性视网膜炎的编码prph2、rho、cgmp磷酸二酯酶β-亚基(bpde)、bcl2、pedf、成纤维细胞生长因子(fgf-2)、睫状神经营养因子(cntf)和c-mer原癌基因酪氨酸激酶(mertk)的蛋白或生物活性片段的mrna分子;用于治疗青光眼的编码脑源性神经营养因子(bdnf)、cntf和gdnf的蛋白或生物活性片段的mrna分子;用于治疗葡萄膜炎的编码il-10和白细胞介素-1受体激动剂(il-1ra)的蛋白或生物活性片段的mrna分子;以及用于治疗视网膜母细胞瘤的编码ifn-β和胸苷激酶(tk)的蛋白或生物活性片段的mrna分子。
在一个实施方案中,如本文所述的细胞外囊泡经修饰以携带以下一种或多种mrna治疗剂:mrna-1440、mrna-1851、mrnamrk-1777、mrna-1388、mrna-1325、mrna-1706、mrna-1647、mrna-1653、mrna-4157、mrna-2416、mrna-2905、mrnaazd-8601、mrg-106、mir-155、mrg-201、mrg-107和mrg-110。
在另一个实施方案中,装载到如本文所述的细胞外囊泡中的mrna分子编码疫苗抗原。mrna指导细胞产生并表达抗原性蛋白,这些抗原性蛋白被分泌或处于细胞表面上,就像天然感染一样,但没有引起疾病或传播的能力。对于治疗性疫苗,使用本文所述的细胞外囊泡递送基于mrna的个体化癌症疫苗以引发免疫系统识别癌细胞并对每个患者的癌症产生强烈的定制反应。细胞外囊泡包含编码患者的特定肿瘤新抗原(neoantigen)、或该特定患者的肿瘤中存在的独特突变的mrna。
在另一个实施方案中,rna分子是催化性rna。核酶是催化性rna,其起到酶的作用并且不需要蛋白来进行催化。大多数已知的天然核酶是自加工rna,其催化rna裂解和连接反应。可以使用如本文所述的细胞外囊泡递送的合适的核酶治疗剂包括但不限于血管酶(angiozyme)、庚酶(heptazyme)、my-2、rrz1、oz1(rrz1)、ccr5核酶、l-tr/tameo。
适于使用如本文所述的细胞外囊泡治疗疾病或疾患的其他rna治疗性分子包括例如但不限于spc3649(lna)、贝伐西尼、agn-745、pf-655、qpi-1007、td101、syl040012、syl1001、excellairtm、aln-rsv01、ceq508、sig12dloder、tkm-apob、tkm-plk1、aln-vsp02、aln-ttr01、bcr-ablsirna、atu027、i5np、calaa-01、fang疫苗、ipsirna、tat/revshrna、sirna-epha2-dopc、td101、atu027、nd-l02-s0201、dcr-ph1、stp705、aln-go1、fitusiran(aln-at3sc)、aln-cc5、aln-as1、dcr-myc、tkm080301、sig12d-loder、inclisiran(aln-pcssc)、pf-655、syl1001、bamosiran(syl040012)、qpi-1007、qpi-1002、patisiran(aln-ttr02)、isth0036、ezn-2968(ro7070179)、lerafaon-etu、akcea-apociii-lrx、biib067(ionis-sod1rx)、azd5312、cenersen、ionis-httrx、ionisangptl3-lrx、azd9150、qr-010、sb012、aeg35156、ds-5141b、akcea-apo(a)-lrx、apatorsen(ogx-427)、ionis-hbvrx、ionisgcgrrx、asm8、sb010、sb011、g4460、prexigebersen(bp1001)、ionis-fxirx、aganirsen(gs-101)、eteplirsen(avi-4658)、alicaforsen、volanesorsen、ionis-ttrrx、custirsen(ogx-011)、lipo-merit、ivac突变组(mutanome)/储库、tnbc-merit、cv7201、cv8102、mrna-1851、mrna-1440、mrnamrk-1777、mrnaazd-8601、mrna-1325、cv9103、ags-004、ags-003-lng、ihivarna-01、ags-003。
在一个实施方案中,使用本文所述的方法获得的玻璃体液和/或房水的经分离的细胞外囊泡经修饰以表达或包含可用于编辑基因组的核酸酶基因组编辑系统。如本文所述的基因组编辑可包括基因插入、缺失、修饰(例如核苷酸转换、颠换、一个或多个核苷酸的插入或缺失或者任何核苷酸序列的重复)、基因激活和基因沉默。如本领域技术人员所理解的,基因组编辑可以用于纠正不良基因突变、引入基因突变、改变基因序列(例如,以改善、增强或抑制基因功能)、插入基因序列(例如,以激活或抑制基因表达)等。核酸酶基因组编辑系统的实例包括但不限于成簇规则间隔短回文重复序列(crispr)核酸酶系统,例如,包括靶向grna和crispr相关(cas)基因(诸如crispr-cas9);转录激活物样效应核酸酶(talen)和mito-talen;锌指核酸酶(zfn)和其他治疗性核酸,例如小干扰rna、微rna、抗微rna、拮抗剂、小发夹rna和适体(基于rna、dna或肽(包括affimer))。
在一个实施方案中,本文所述的组合物的细胞外囊泡经遗传修饰以表达或包含crispr核酸酶系统,诸如crispr/cas9ii型基因组编辑系统,包括cas核酸酶和导向rna(grna),导向rna包含反式激活rna(tracrrna)和crisprrna(crrna)的融合体。crisprrna包括靶向rna序列和独特的非编码直接rna重复序列阵列。crrna和tracrrna与选定的cas核酸酶有关。如本领域技术人员将认识到的,指出crrna和tracrrna(grna的组分)与cas核酸酶“有关”,这意味着crrna和tracrrna对一种或多种特定的cas核酸酶具有特异性并且被所述酶识别。
在一个实施方案中,将crispr核酸酶系统设计为编辑与眼部疾患相关的一种或多种基因缺陷。例如但不限于,crispr核酸酶系统可以被设计为编辑在年龄相关性黄斑变性中过表达的vegf基因,如kim等人,“genomesurgeryusingcas9ribonucleoproteinsforthetreatmentofage-relatedmaculardegeneration,”genomeresearch27:419-426(2017)所述,其据此通过引用整体并入。在另一个实施方案中,crispr核酸酶系统可以被设为灭活nrl或nr2e3基因,以防止与色素性视网膜炎相关的变性,如zhu等人,“geneandmutationindependenttherapyviacrispr-cas9mediatedcellularreprogramminginrodphotoreceptors,”cellres.27:830-833(2017)所述,其据此通过引用整体并入。
在另一个实施方案中,所述核酸分子是dna分子。合适的dna分子包括但不限于小dna分子、cdna分子、寡核苷酸、锁核酸(lna)、脱氧核糖核酸适体、脱氧核糖核酸酶(dna酶)及其任何组合。
在一个实施方案中,治疗性核酸包括基因组序列,例如cdna序列和较小的工程化基因区段,所述基因组序列表达或者可适于表达蛋白、多肽、融合蛋白、抗体和蛋白/肽变体。所述核酸可包含约5至约12000个或更多个核苷酸、核苷或碱基对的连续核酸序列。根据本发明的这个方面的治疗性核酸分子可以编码疾病所涉及的细胞因子、酶、激素、蛋白的天然激动剂和拮抗剂等。治疗性核酸分子还包括经证实有益于治疗或预防疾病或与健康有关的疾患的治疗性核酸的生物学功能等效物。因此,与已知核酸分子具有约70%至约99%序列同一性的序列是根据本发明这个方面的合适的治疗性核酸分子。
在一个实施方案中,将细胞外囊泡修饰为含有适于治疗眼部疾病或疾患的治疗性dna分子。合适的治疗性dna分子包括例如但不限于:用于减少新血管形成的编码内皮抑素、血管抑素、金属蛋白酶组织抑制剂3(timp3)、色素上皮源性因子(pedf)或可溶性血管内皮生长因子受体(sflt-1)的蛋白或生物活性片段的dna分子;用于治疗色素性视网膜炎的编码prph2、rho、cgmp磷酸二酯酶β-亚基(bpde)、bcl2、pedf、成纤维细胞生长因子(fgf-2)、睫状神经营养因子(cntf)和c-mer原癌基因酪氨酸激酶(mertk)的蛋白或生物活性片段的dna分子;用于治疗青光眼的编码脑源性神经营养因子(bdnf)、cntf和gdnf的蛋白或生物活性片段的dna分子;用于治疗葡萄膜炎的编码il-10和白细胞介素-1受体激动剂(il-1ra)的蛋白或生物活性片段的dna分子;以及用于治疗视网膜母细胞瘤的编码ifn-β和胸苷激酶(tk)的蛋白或生物活性片段的dna分子。可以引入如本文所述的组合物的细胞外囊泡中的其他合适的dna治疗剂是本领域已知的,参见liu等人,“genetherapyforoculardiseases,”postgrad.med.j.87(1029):487-95(2011),其据此通过引用整体并入。
在另一个实施方案中,适于治疗眼部疾病的载入本文所述组合物的细胞外囊泡中的治疗性dna分子是适体。合适的适体包括例如但不限于:靶向vegf活性以治疗眼部新生血管性疾病的macugen/哌加他尼(pegaptanib)(nx1838),靶向pdgfb链的活性以治疗年龄相关性黄斑变性的fovista/哌普拉尼(pegpleranib)(nx1975),以及靶向补体组分5(c5)以治疗年龄相关性黄斑变性的zimura/arc1905(参见drolet等人,“fitfortheeye:aptamersinoculardisorders,”nucleicacidther.26(3):127-146(2016),其据此通过引用整体并入)。其他合适的适体包括rna适体(rb006或pegnivacogin)、arc19499(bax499)、reg1(rb006和rb007)、arc1905、tar诱饵、rre诱饵。
在一个实施方案中,将治疗性rna和dna分子的组合引入本文所述组合物的细胞外囊泡中。在一个实施方案中,治疗性rna和dna分子的组合协同作用以治疗眼部疾病。例如但不限于,能够使突变体视紫红质的表达沉默的sirna分子可以与编码野生型视紫红质基因的dna分子组合施用,以治疗色素性视网膜炎(o′reilly等人,“rnainterference-mediatedsuppressionandreplacementofhumanrhodopsininvivo,”amjhumgenet.81:127-135(2007),其据此通过引用整体并入)。
在另一个实施方案中,所述核酸是诊断性核酸。诊断性核酸是可以应用于诊断疾病或与健康有关的疾患的核酸。诊断性核酸序列编码一种或多种报告蛋白。“报告蛋白”是指当存在于细胞或组织中时可检测到并且可与细胞中存在的其他基因序列或编码多肽区分开的氨基酸序列。在一些实施方案中,治疗性核酸分子可以与编码报告蛋白的诊断性核酸融合。例如,两种核酸分子可以通过例如内部核糖体进入位点与相同的启动子连接、或与双向启动子连接。使用此类技术,治疗性核酸和诊断性核酸的表达相互关联。因此,当将所述组合物用于如本文所述的方法中时,可以测量治疗性核酸表达的位置、量和持续时间。
优选地,报告序列编码的蛋白容易因其存在、其与可检测部分的缔合、或因其导致产生可检测信号的活性而被检测到。在某些方面,可检测部分可包括放射性核素、荧光团、发光团、微粒、微球、酶、酶底物、多肽、多核苷酸、纳米粒子和/或纳米球,其全部都可以与识别报告分子和/或与报告分子相互作用的抗体或配体偶联。示例性诊断性核酸分子包括但不限于编码以下蛋白的核酸分子:β-内酰胺酶、β-半乳糖苷酶(lacz)、碱性磷酸酶、胸苷激酶、绿色荧光蛋白(gfp)、氯霉素乙酰转移酶(cat)、荧光素酶、膜结合蛋白,包括例如g蛋白偶联受体(gpcr)、生长抑素受体、cd2、cd4、cd8、流感血凝素蛋白、同向转运体(诸如nis)和本领域熟知的其他蛋白。
在一个实施方案中,将本文所述组合物的细胞外囊泡修饰为包含裸核酸分子,例如裸dna或裸rna。在另一个实施方案中,将核酸包装在适于在原核生物或真核生物或两者中表达,优选适于在哺乳动物细胞中表达的表达载体中。合适的表达载体包括病毒载体(例如,腺病毒载体、腺相关病毒载体、慢病毒载体、疫苗病毒载体、逆转录病毒载体、疱疹病毒载体)、细菌载体、质粒载体、人工染色体、噬菌体或其任何组合。表达载体通常含有调控序列和用于翻译和/或转录所插入的编码序列的其他必要元件。例如,编码序列优选与启动子和/或增强子可操作地连接,以帮助控制所需基因产物的表达。根据基因表达的预期控制类型,生物技术中使用的启动子具有不同的类型。通常可将其分为组成型启动子、组织特异性或发育阶段特异性启动子、诱导型启动子和合成启动子。根据所用的载体系统和宿主,可以使用任何数量的合适的转录和翻译元件。在哺乳动物细胞系统中,优选使用来自哺乳动物基因或来自哺乳动物病毒的启动子。
构建含有所需核酸分子以及适当转录和翻译控制元件的表达载体的方法是本领域熟知的。这些方法包括体外重组dna技术、合成技术和体内遗传重组。此类技术在sambrook等人,molecularcloning,alaboratorymanual(coldspringharborpress,plainview,n.y.,1989)和ausubel等人,currentprotocolsinmolecularbiology(johnwiley&sons,newyork,n.y.,1989)中有描述,其据此通过引用整体并入。
可以使用本领域已知的技术(例如电穿孔)使细胞外囊泡载有一种或多种目标核酸。电穿孔涉及使用电脉冲(例如,100-400v/cm)向囊泡中引入孔隙,其中所述一种或多种核酸通过孔隙进入囊泡。替代性地,可以使用显微注射或粒子轰击使细胞外囊泡载有一种或多种目标核酸。替代性地,可以使用可商购的试剂盒和试剂进行脂质转染或转染,或通过使用热休克进行转化,而装载细胞外囊泡。
在另一个实施方案中,玻璃体液和/或房水囊泡载有用于递送的治疗性蛋白和/或肽。在一个实施方案中,治疗性蛋白是外源性蛋白或肽。外源性是指囊泡通常不与之相关联的蛋白或肽。
待装载到囊泡中的蛋白和/或肽基于该蛋白和/或肽对靶细胞的所需作用来选择。可以将单一蛋白或肽掺入囊泡中。替代性地,可以将多于一种蛋白和/或肽掺入囊泡中。所述多于一种蛋白和/或肽可以作用于相同或不同的靶标以产生所需的治疗和/或预防效果。
在一个实施方案中,待装载到囊泡中的蛋白和/或肽是抗体或抗体片段。如本文所提及的术语“抗体”包括完整抗体(即,两条重链和两条轻链)、其抗体结合片段(例如,单链抗体(scfv)、单结构域抗体(例如,纳米抗体或fv)、fab、fab’、f(ab’)2)及其变体(例如,串联scfv、fd片段、双链抗体(diabody)、三链抗体(triabody))。这些抗体片段可以使用本领域技术人员已知的常规技术获得,并且可以按与完整抗体相同的方式针对实用性筛选片段。
就结合结构域而言,本文公开的抗体和抗体片段可为单价、二价或三价的,并且可以通过设计使结合结构域在结合特异性方面为单特异性、双特异性或三特异性的。合适的抗体包括单克隆抗体或多克隆抗体混合物。抗体可以是嵌合抗体、cdr-移植抗体、人源化抗体或前述任何抗体的抗原结合部分。治疗性抗体可以源自多种物种,包括但不限于小鼠、人、骆驼、美洲驼、山羊、兔、牛和软骨鱼。
在一个实施方案中,抗体或其抗原结合片段是适于治疗眼部疾病或疾患的抗体或其抗原结合片段。合适的抗体或其抗原结合片段包括但不限于结合并优先阻断或降低与疾病相关的整联蛋白活性的抗体,诸如抗αvβ3整联蛋白抗体和抗α4β1整联蛋白抗体。可以引入本文所述组合物的细胞外囊泡中的其他合适的抗体包括例如但不限于:抗表皮生长因子受体抗体、抗血管内皮生长因子(vegf)受体抗体、抗vegf抗体(例如贝伐单抗(bevacizumab)、雷珠单抗(ranibizumab))、抗tnfα抗体(例如英夫利昔单抗(infliximab)和阿达木单抗(adalimumab))、抗成纤维细胞生长因子抗体、抗表皮生长因子抗体、抗cd20抗体、抗cd52抗体、抗cd11a抗体和抗il-2抗体。
可以引入本文所述组合物的细胞外囊泡中的其他合适的抗体包括例如但不限于:阿昔单抗(abciximab)(reopro)、阿达木单抗(humira、amjevita)、阿法西普(alefacept)(amevive)、阿仑单抗(alemtuzumab)(campath)、巴利昔单抗(basiliximab)(simulect)、贝利单抗(belimumab)(benlysta)、贝洛托单抗(bezlotoxumab)(zinplava)、康纳单抗(canakinumab)(ilaris)、赛妥珠单抗(certolizumabpegol)(cimzia)、西妥昔单抗(cetuximab)(erbitux)、达利珠单抗(daclizumab)(zenapax、zinbryta)、地诺单抗(denosumab)(prolia、xgeva)、依法利珠单抗(efalizumab)(raptiva)、戈利木单抗(golimumab)(simponi、simponiaria)、英夫利昔单抗(inflectra)(remicade)、伊匹单抗(ipilimumab)(yervoy)、伊西贝单抗(ixekizumab)(taltz)、那他珠单抗(natalizumab)(tysabri)、纳武单抗(nivolumab)(opdivo)、奥拉单抗(olaratumab)(lartruvo)、奥马珠单抗(omalizumab)(xolair)、帕利珠单抗(palivizumab)(synagis)、帕尼单抗(panitumumab)(vectibix)、帕博利珠单抗(pembrolizumab)(keytruda)、利妥昔单抗(rituximab)(rituxan)、托珠单抗(tocilizumab)(actemra)、曲妥珠单抗(trastuzumab)(herceptin)、苏金单抗(secukinumab)(cosentyx)、优特克单抗(ustekinumab)(stelara)。另外的抗血管生成蛋白/肽治疗剂包括但不限于:雷莫芦单抗(ramucirumab)、阿西替尼(axitinib)、阿西替尼、mgcd516、西地尼布(cediranib)、奥拉帕尼(olaparib)、来他替尼(lestaurtinib)、奥拉帕尼、西地尼布、帕唑帕尼(pazopanib)、多西他赛(docetaxel)、盐酸帕唑帕尼、trc105、帕唑帕尼、x4p-001、纳武单抗、甲磺酸艾日布林(eribulinmesylate)、酮康唑(ketoconazole)、治疗性氢化可的松(hydrocortisone)、抗体j591、多西他赛、普那布林(plinabulin)、sf1126、卡非佐米(carfilzomib)、羟氯喹(hydroxychloroquine)、阿地白介素(aldesleukin)、贝伐单抗、厄洛替尼(erlotinib)、索拉非尼(sorafenib)、凡德他尼(vandetanib)、德瓦鲁单抗(durvalumab)、奥拉帕尼、西地尼布、萨帕尼塞蒂布(sapanisertib)、阿柏西普(ziv-aflibercept)、贝伐单抗、ly2157299一水合物(ly2157299)、替莫唑胺(temozolomide)、sgt-53、马来酸西地尼布、奥拉帕尼、贝伐单抗奥希替尼(bevacizumabosimertinib)、瑞格非尼(regorafenib)、伊曲康唑(itraconazole)。
在另一个实施方案中,治疗性蛋白是抗体模拟物。“抗体模拟物”涵盖可以像抗体一样特异性结合抗原并且为约3-20kda的任何有机化合物,例如肽或多肽。在一个实施方案中,抗体模拟物包含支架,其经由类似于抗体cdr环的暴露环中的氨基酸结合其靶抗原。这些抗体模拟物包括但不限于:阿德奈汀(adnectin)、脂质运载蛋白(lipocalin)、基于kunitz结构域的粘合剂、亲合力多聚体(avimer)、knottin、fynomer、atrimer和基于细胞毒性t淋巴细胞相关蛋白-4(ctla4)的粘合剂(在weidle等人,“theemergingroleofnewproteinscaffold-basedagentsforthetreatmentofcancer,”cancergenomics&proteomics10:155-168(2013)中进行综述,其据此通过引用整体并入)。
在另一个实施方案中,治疗性蛋白是蛋白或肽抑制剂。蛋白或肽抑制剂可以是全长蛋白或其生物活性肽片段,其天然拮抗或抑制与待治疗的疾病或疾患相关的一种或多种受体、酶、激素、蛋白酶、激酶、生长因子、信号转导通路、转录因子等的作用或活性。蛋白或肽抑制剂可以充当显性负性受体或配体,或诱饵受体或配体。
在一个实施方案中,将如本文所述的组合物的细胞外囊泡修饰为含有适于治疗眼部疾病的蛋白或肽抑制剂。例如,所述蛋白或肽抑制剂可以是血管生成抑制剂。合适的血管生成蛋白/肽抑制剂包括但不限于血管抑制素(包括全长血管抑制素及其生物活性片段和类似物)和内皮抑素(包括全长内皮抑素及其生物活性片段和类似物);其他胶原蛋白来源的肽,诸如肿瘤抑素(tumstatin)肽、肿瘤抑素片段和潘它斯达汀(pentastatin);含rgd的肽,例如西仑吉肽(cilengitide)和其他纤连蛋白来源的肽;以及源自层粘连蛋白的肽,诸如c16y和c16s(参见rosca等人,“antiangiogenicpeptidesforcancertherapeutics,”curr.pharm.biotechol.12(8):1101-1116(2011),其据此通过引用整体并入)。
可以装载到细胞外囊泡中的其他合适的蛋白或肽抑制剂包括但不限于整联蛋白拮抗剂(例如,lfa-1、vla-4、mac-1、icam-1、icam-2、vcam拮抗剂)、趋化因子拮抗剂(例如,mcp-1、mcp-5、mcp-3、mip1α、ccr5、rantes拮抗剂)和选择素拮抗剂(例如,e-选择素、p-选择素和l-选择素拮抗剂)。
可以装载到细胞外囊泡中的其他合适的蛋白或肽抑制剂包括但不限于抗vegf剂、雷珠单抗(lucentis,genentech,southsanfrancisco)、阿柏西普(eylea,regeneronpharmaceuticals,tarrytown,n.y.)、lucentis、贝伐单抗(avastin,genentech)、皮质类固醇、玻璃体内类固醇、缓慢释放的生物可降解的地塞米松植入物、ozurdex(allergan,irvine,calif.)、vitreolytics(包括ocriplasmin)(jetrea,thrombogenics,leuven,belgium)、抗pdgf疗法、rth258(一种抑制vegfa的所有同种型的小的人源化抗vegf抗体片段)、抗vegfdarpin(阿比斯帕培果(abiciparpegol))、抗pdgf剂fovista(ophthotech,newyork)和iluvien(一种适用于dme的洗脱类固醇醋酸氟轻松的不可生物降解的植入物)。
可以通过许多不同的技术将外源性蛋白和/或肽引入囊泡中。在一个实施方案中,通过电穿孔或使用转染试剂来装载囊泡。电穿孔条件可根据治疗性货物的电荷和大小而变化。典型电压在20v/cm至1000v/cm的范围内,诸如20v/cm至100v/cm,电容通常介于25μt与250μt之间,诸如介于25μt与125μt之间。对于为囊泡装载抗体,优选150mv至250mv的电压,特别是200mv的电压。
替代性地,可以使用转染试剂为囊泡装载外源性蛋白和/或肽。尽管囊泡大小较小,但常规的转染剂即可用于用蛋白和/或肽转染囊泡。根据本发明使用的优选转染试剂包括阳离子脂质体。
在另一个实施方案中,还可以通过用表达目标治疗性蛋白或肽的核酸构建体转化或转染宿主细胞来装载细胞外囊泡,使得当由细胞产生囊泡时治疗性蛋白或肽被摄取到细胞外囊泡中。
在另一个实施方案中,玻璃体液和/或房水囊泡载有用于递送的治疗性小分子。在一个实施方案中,该小分子是用于治疗眼部疾病的小分子。可以装载到玻璃体液和/或房水细胞外囊泡中的合适的眼科治疗剂包括但不限于:碳酸酐酶抑制剂,例如布林佐胺(brinzolamide);β肾上腺素能阻滞剂,诸如倍他洛尔(betaxolol)、卡替洛尔(carteolol)、左布诺洛尔(levobunolol)、美替洛尔(metipranolol)、马来酸噻吗洛尔(timololmaleate)和噻吗洛尔半水合物;α2肾上腺素能激动剂,诸如阿可乐定(apraclonidine)、洛芬定(lopindine)、溴莫尼定(brimonidine)和阿法根(alphagan);前列腺素,诸如比马前列素(bimatoprost)、氯替泼诺(loteprednol)和溴芬酸(bromfenac);抗感染剂,诸如抗生素、抗真菌剂和抗病毒剂;t细胞免疫抑制剂,如环孢素(cyclosporine)、亲脂性类固醇、以及抗生素和类固醇组合;小分子酪氨酸激酶抑制剂(tki),诸如舒尼替尼(sunitinib)和索拉非尼。
如本文所述,可装载到细胞外玻璃体液和/或房水囊泡中用于递送至眼部组织的其他治疗剂包括但不限于iquix(通用名:左氧氟沙星(levofloxacin))、natacyn(通用名:纳他霉素(natamycin))、tobrex(通用名:妥布霉素(tobramycin))、polytrim(通用名:多粘菌素b(polymyxinb)/甲氧苄啶(trimethoprim))、ciloxan(通用名:环丙沙星(ciprofloxacin))、viroptic(通用名:三氟尿苷(trifluridine))、moxeza(通用名:氧氟沙星(oxifloxacin))、zymar(通用名:加替沙星(gatifloxacin))、besivance(通用名:贝西沙星(besifloxacin))、vigamox(通用名:莫西沙星(moxifloxacin))、zirgan(通用名:更昔洛韦(ganciclovir))、azasite(通用名:阿奇霉素(azithromycin))、ak-chlor(通用名:氯霉素(chloramphenicol))、ak-poly-bac(通用名:杆菌肽(bacitracin)/多粘菌素b)、ak-tob(通用名:妥布霉素)、betadine眼用溶液(通用名:聚维酮碘(povidoneiodine))、bleph-10(通用名:磺胺醋酰钠)、氯霉素眼药(通用名:氯霉素)、chloroptic(通用名:氯霉素)、dendrid(通用名:碘苷(idoxuridine))、eyemycin(通用名:红霉素(erythromycin))、garamycin眼药(通用名:庆大霉素(gentamicin))、genoptic(通用名:庆大霉素)、gentacidin(通用名:庆大霉素)、gentak(通用名:庆大霉素)、gentasol(通用名:庆大霉素)、ilotycin(通用名:红霉素)、isoptocetamide(通用名:磺胺醋酰钠)、neo-polycin(通用名:杆菌肽/新霉素(neomycin)/多粘菌素b)、neocidin(通用名:杆菌肽/新霉素/多粘菌素b)、neocidin眼用溶液(通用名:短杆菌肽(gramicidin)/新霉素/多粘菌素b)、neosporin眼药(通用名:短杆菌肽/新霉素/多粘菌素b)、ocu-chlor(通用名:氯霉素)、ocu-mycin(通用名:庆大霉素)、ocu-spore-b(通用名:杆菌肽/新霉素/多粘菌素)、ocuspore-g(通用名:短杆菌肽/新霉素/多粘菌素b)、ocu-tracin(通用名:杆菌肽)、ocuflox(通用名:氧氟沙星(ofloxacin))、polycin-b(通用名:杆菌肽/多粘菌素b)、quixin(通用名:左氧氟沙星)、roymicin(通用名:红霉素)、sulf-10(通用名:磺胺醋酰钠)、土霉素与硫酸多粘菌素(通用名:土霉素/多粘菌素b)、tobrasol(通用名:妥布霉素)、tomycine(通用名:妥布霉素)、vira-a(通用名:阿糖腺苷(vidarabine))、vitrasert(通用名:更昔洛韦)、zymaxin、阿托品(atropine)、派立明(azopt)、杆菌肽、betadine、倍他洛尔、贝特舒(betoptic)、布林佐胺(brinzolamide)、bss(平衡盐溶液)、卡巴胆碱(carbachol)、头孢唑啉(cefazolin)、celluvisc、氯霉素、ciloxan、环丙沙星、cosopt、地美溴胺(demecarium)、地塞米松、地匹福林(dipivefrin)、多佐胺(dorzolamide)、肾上腺素(epinephrine)、荧光素、氟比洛芬(flurbiprofen)、毒扁豆碱(physostimine)、庆大霉素、毛果芸香碱(pilocarpine)、羟丙甲基纤维素(goniosol)、多粘菌素b、短杆菌肽、泼尼松龙(prednisolone)、优目缩(humorsol)、丙美卡因(proparacaine)、海拉丁(hylartin)、普罗品(propine)、高渗氯化钠(hypertonicnacl)、puralube、吲哚菁绿(indocycaninegreen)、玫瑰红(rosebengal)、伊曲康唑(itraconazole)、透明质酸钠、拉坦前列素(latanoprost)、舒洛芬(suprofen)、甘露醇、土霉素、醋甲唑胺(methazolamide)、噻吗洛尔(timolol)、咪康唑(miconazole)、妥布霉素、迈斯特(miostat)、曲安奈德(triamcinolone)、muro128、三氟尿苷、新霉素、托吡卡胺(tropicamide)、甲醋唑胺舒净露(neptazanetrusopt)、ocuflox、阿糖腺苷(vidarabine)、氧氟沙星、vira-a、氧四环素(oxytetracycline)、viroptic、苯肾上腺素(phenylephrine)、适利达(xalatan)、nvc-422、fst-100、luveniq、esba105、mapracorat(zk245186/bol-303242-x)、nepafenac0.3%、dexasite(或isv-305)、azasiteplus(或isv-502)、cf101和lifitegrast(sar1118)。
如本文所述,可以装载到细胞外玻璃体液和/或房水囊泡中用于递送至眼部组织以治疗青光眼的另外的治疗剂包括但不限于:前列腺素类似物,包括
可以装载到细胞外玻璃体液和/或房水囊泡中用于递送至眼部组织以治疗干眼病的另外的治疗剂包括但不限于:restasis眼药、lacrisert眼药、systaneultra眼药、羧甲基纤维素钠眼药、soothexp眼药、systane(丙二醇)眼药、freshkote眼药、refreshoptiveadvanced眼药、genteal凝胶眼药、retainemgd(pf)眼药、清眼止痒舒缓眼药(cleareyesitchyeyerelief)、systane平衡眼药、人工泪液(refreshtears)、人造眼泪滴眼液(refreshliquigel)、hypotears、清眼红肿舒缓眼药(cleareyesrednessrelief)、biontears(pf)、peg400-丙二醇眼药、人工泪液(refreshoptivesensitive)(pf)眼药、人工泪液(refreshplus)眼药、泪然人工泪液(tearsnaturalefree)(pf)、liquitears、环孢菌素眼药、gentealpm眼药、systane夜用眼药、genteal重度眼药、systane凝胶眼药、refreshlacri-lube眼药、refreshp.m.眼药、滴眼剂、怡然(isoptotears)、puralube眼药、丝泪(theratears)、聚乙烯醇眼药、聚乙二醇-聚乙烯醇滴眼剂、泪然人工泪液(tearsnaturalepm)、泪然人工泪液(tearsnaturaleforte)、右旋糖酐70-羟丙甲纤维素眼药、lubrifreshpm眼药、润滑滴眼剂、refreshcelluvisc眼药、羧甲基纤维素-甘油(pf)眼药、润滑滴眼剂(pg-peg400)、systane液体凝胶眼药、soothe水合眼药、refresh经典(pf)眼药、refreshoptive眼药、systaneultra(pf)眼药、systane(pf))眼药、soothe润滑眼药、清眼全能眼药(cleareyescompleteophthalmic)、retainepm眼药、滴眼剂(含聚维酮)、人工泪液(聚乙烯醇)、visine全能眼药、opti-clear眼药、四氢唑啉-peg眼药、保湿滴眼药、tearsagain、tearspure、goniosoft眼药、gonak眼药、润滑滴剂、聚乙烯醇聚维酮眼药、白凡士林-矿物油眼药、人工泪液(羟丙甲纤维素)、genteal轻度眼药、goniotaire眼药、tearfairfortheeye、天然泪液、无菌滴眼剂、超清新眼药、超清新pm眼药、peg400-羟丙甲纤维素-甘油眼药、萘甲唑啉-peg300眼药、萘甲唑啉-羟丙甲纤维素眼药、丙二醇眼药、全清ar眼药、丙二醇-甘油眼药、纯净温和眼药、forsty缓解眼药、人工泪液(右旋糖酐-羟丙甲纤维素-甘油)、无菌润滑眼药、羟丙基纤维素眼药、高级舒缓滴眼剂、润滑眼药、轻质矿物油-矿物油眼药、干眼缓解药、眼部红肿缓解眼药、四氢唑啉-右旋糖酐70-peg400-povdn眼药、含羊毛脂的人工泪液、1号眼用润滑剂组合、羧甲基纤维素sod-羟丙甲纤维素眼药、高级眼部缓解剂、萘甲唑啉-甘油眼药、genteal轻度至中度眼药、人工泪液(羟丙甲纤维素)(pf))、羧甲基纤维素-甘油眼药、润滑红肿缓解眼药、人工泪液(甘油/丙二醇)、萘甲唑啉-硫酸锌-甘油眼药、润滑滴眼剂(甘油-丙二醇)、红肿缓解润滑眼药、goniovisc眼药、高级眼部舒缓(mo-wpet)眼药、refreshcontacts眼药、右旋糖酐70-羟丙甲纤维素(pf)眼药、人工泪液(pf)、天然泪液(pf)、四氢唑啉-peg400-羟丙甲纤维素-glyc眼药、润滑眼药(右旋糖酐70/羟丙甲纤维素)、人工泪液(凡士林/矿物油)、泪液滴眼剂、聚维酮眼药、peg400-丙二醇(pf)眼药、聚乙烯醇-聚维酮(pf)眼药、高级配方滴眼剂、retainecmc眼药、轻质矿物油-矿物油(pf)眼药、羧甲基纤维素-甘油-聚山梨醇酯80眼药、最强红肿缓解眼药、干眼润滑缓解剂、eq温和眼药、羧甲基甘油-聚山梨醇酯80-pf眼药、超润滑眼药、保湿润滑眼药、润滑+(lubricatingplus)眼药、复苏+(reviveplus)眼药、naphazohcl-羟丙甲纤维素-ps80-znsulf眼药、akwa泪液(聚乙烯醇)眼药、visine泪液、visine眼部疲劳缓解剂、visine最强红肿缓解剂、visine高级红肿缓解剂、refreshoptive高级(pf)眼药、四氢唑啉-锌-peg400-羟丙甲纤维素-甘油眼药、retainehpme眼药、眼部润滑(丙二醇)眼药、眼部润滑(羧甲基纤维素-甘油)眼药、眼部润滑(cmc-甘油)(pf)眼药、眼部润滑(pg-peg400)(pf)眼药、润滑舒缓眼药、润眼凝胶眼药、泪液恢复眼药、润滑+(lubricantplus)眼药、天然平衡泪液眼药、清眼凉爽舒适眼药、清眼最强红肿舒缓眼药、genteal泪液眼药、tearsagain(pva)眼药、人工泪液(右旋糖酐70-羟丙甲纤维素)眼药、人工泪液(聚乙烯醇/聚维酮)眼药、人工泪液(pg400-羟丙甲纤维素-甘油)眼药、genteal泪液(右旋糖酐-羟丙甲纤维素-甘油)眼药和
在一个实施方案中,进一步修饰所述组合物的玻璃体液和/或房水细胞外囊泡,以在囊泡体的外表面上表达或展示真核细胞特异性靶向分子或部分。在一个实施方案中,靶向部分是作为与通常在细胞外囊泡的表面上表达的跨膜蛋白的融合蛋白而表达的肽。合适的肽是与细胞表面部分结合的肽,所述细胞表面部分诸如为在要靶向的细胞的细胞表面上发现的受体或其配体。合适的靶向部分的实例是短肽(通常长度小于100个氨基酸,例如长度小于50个氨基酸,长度小于30个氨基酸,至最小长度为10、5、3、2或1个氨基酸)、全长蛋白、抗体或其抗原结合片段和衍生物(例如,fab、fab′、f(ab′)2、scfv、fv等),以及完整蛋白,只要该靶向部分可以在细胞外囊泡的表面上表达,并且不会干扰膜蛋白插入细胞外囊泡中即可。通常,靶向肽对跨膜细胞外囊泡蛋白是异源的。
可以选择靶向部分以将细胞外囊泡靶向特定的组织类型,例如眼、肌肉、脑、肝、胰腺、肺等,或靶向病变组织,诸如肿瘤。在本发明的一个实施方案中,使细胞外囊泡靶向眼部组织。
在一个实施方案中,通过在细胞外囊泡的外体表面上表达被眼部组织流入转运蛋白识别的部分或配体,可以使细胞外囊泡靶向眼部组织。几种氨基酸和肽转运蛋白在眼部组织和细胞上表达。例如,氨基酸转运蛋白asct1(slc1a4)在角膜和原代角膜上皮细胞中表达,氨基酸转运蛋白asct2(slc1a5)在视网膜米勒细胞上表达。b0,+(slc6a14)是一种在角膜上皮中表达的具有广泛底物特异性的中性阳离子氨基酸转运蛋白。lat1(slc7a5)在人角膜中表达,lat2(slc7a8)在视网膜色素上皮细胞中表达。肽转运蛋白pept1和pept2在角膜上皮和视网膜米勒细胞中表达。除氨基酸和肽转运蛋白外,在各种眼部组织上还鉴定了有机阳离子/阴离子(slc22)、单羧酸(slc16)和核苷转运蛋白(slc28和29)。因此,细胞外囊泡可以用转运蛋白特异性靶向部分修饰,以指导由细胞外囊泡携带的治疗性货物的递送。合适的靶向部分包括但不限于l-天冬氨酸、γ-谷氨酸和苯丙氨酸,以经由b(0,+)氨基酸转运蛋白直接递送(参见例如,majumdar等人,“transcornealpermeationofl-andd-aspartateesterprodrugsofacyclovir:delineationofpassivediffusionversustransporterinvolvement,”pharmres.26(5):1261-9(2009);anand等人,“aminoacidprodrugsofacycloviraspossibleantiviralagentsagainstocularhsv-1infections:interactionswiththeneutralandcationicaminoacidtransporteronthecornealepithelium,”curreyeres.29(2-3):153-66(2004);以及dun等人,“functionalandmolecularanalysisofd-serinetransportinretinalmullercells,”expeyeres.84(1):191-9(2007),它们据此通过引用整体并入);l-缬氨酸、甘氨酸-缬氨酸、缬氨酸-缬氨酸、酪氨酸-缬氨酸部分,以经由视网膜和角膜上的寡肽转运蛋白靶向递送(参见例如,anand和mitra,“mechanismofcornealpermeationofl-valylesterofacyclovir:targetingtheoligopeptidetransporterontherabbitcornea,”pharmres.19(8):1194-202(2002);gunda等人,“comealabsorptionandanteriorchamberpharmacokineticsofdipeptidemonoesterprodrugsofganciclovir(gcv):invivocomparativeevaluationoftheseprodrugswithval-gcvandgcvinrabbits,”joculpharmacolther.22(6):465-76(2006);majumdar等人“dipeptidemonoesterganciclovirprodrugsfortreatinghsv-1-inducedcornealepithelialandstromalkeratitis:invitroandinvivoevaluations,”joculpharmacolther.21(6):463-74(2005);katragadda等人,“modulationofp-glycoprotein-mediatedeffluxbyprodrugderivatization:anapproachinvolvingpeptidetransporter-mediatedinfluxacrossrabbitcomea,”joculpharmacolther.22(2):110-20(2006);kansara等人,“dipeptidemonoesterganciclovirprodrugsfortransscleraldrugdelivery:targetingtheoligopeptidetransporteronrabbitretina,”joculpharmacolther.23(4):321-34(2007),它们据此通过引用整体并入);生物素,以经由视网膜上的钠依赖性多维生素转运蛋白靶向递送(参见例如,janoria等人,“vitrealpharmacokineticsofbiotinylatedganciclovir:roleofsodium-dependentmultivitamintransporterexpressedonretina,”joculpharmacolther.25(1):39-49(2009),其据此通过引用整体并入);以及葡萄糖以靶向递送至视网膜色素上皮细胞上的glut1受体(参见例如,dalpiaz等人,“molecularmechanisminvolvedinthetransportofaprodrugdopamineglycosylconjugate,”intjpharm.336(1):133-9(2007),其据此通过引用整体并入)。
肽靶向部分通过以下方式在细胞外囊泡的表面上表达:作为与细胞外囊泡跨膜蛋白的融合蛋白而表达。已知许多蛋白与细胞外囊泡相关联;也就是说,它们在形成时被并入细胞外囊泡中。用于靶向本发明的细胞外囊泡的优选蛋白是那些作为跨膜蛋白的蛋白。实例包括但不限于lamp-1、脂筏标记蛋白(flotillin)、突触融合蛋白-3(syntaxin-3)、cd9、cd63、cd81、hla-dm(mhcii)、免疫球蛋白、mhc-i或mhc-ii组分和四次跨膜蛋白(tetraspanin)。
在其他实施方案中,特异性靶向部分不需要包括在细胞外囊泡中。例如,细胞外囊泡可以直接施用于需要治疗的部位。替代性地,通过例如眼周或眼内施用进行的递送可足以产生所需的反应。
在一些实施方案中,尤其是当组合物的细胞外囊泡经修饰为含有外源性治疗剂时,该组合物还包含药学上可接受的载剂。“药学上可接受的载剂”(赋形剂)是用于将组合物的细胞外囊泡递送给受试者的药学上可接受的溶剂、悬浮剂或任何其他药理学惰性媒介物。典型的药学上可接受的载剂包括但不限于粘合剂(例如,预胶化玉米淀粉、聚乙烯吡咯烷酮或羟丙基甲基纤维素等);填充剂(例如,乳糖和其他糖类、微晶纤维素、果胶、明胶、硫酸钙、乙基纤维素、聚丙烯酸酯或磷酸氢钙等);润滑剂(例如,硬脂酸镁、滑石、二氧化硅、胶体二氧化硅、硬脂酸、金属硬脂酸盐、氢化植物油、玉米淀粉、聚乙二醇、苯甲酸钠、乙酸钠等);崩解剂(例如,淀粉、羟基乙酸淀粉钠等);或润湿剂(例如,十二烷基硫酸钠等)。
本文提供的组合物可另外含有通常发现于药物组合物中的其他辅助组分。因此,例如,所述组合物可以含有另外的相容性药学活性材料,或者可以含有另外的可用于物理配制本发明组合物的各种剂型的材料,诸如染料、调味剂、防腐剂、抗氧化剂、增稠剂和稳定剂。然而,此类材料在添加时不应不当地干扰本文提供的组合物的组分的生物活性。
在一个实施方案中,将玻璃体液和/或房水细胞外囊泡的组合物配制在缓慢释放或持续释放材料中。例如,在一个实施方案中,组合物可以被配制成包括薄膜衣,其将组合物的细胞外囊泡缓慢释放到靶区域或靶组织。可用于制备适用于缓慢释放或持续释放包衣的包衣的方法和材料是本领域技术人员熟知的。合适的包衣应该是生物相容的并且与细胞外囊泡组合物相容的。在一个实施方案中,薄膜由一种或多种生物可吸收的聚合物构成。合适的生物可吸收的弹性体的实例在授予bezwada的美国专利第5,468,253号和授予mehta的美国专利第6,627,246号中有描述。有用的聚合物包括l-丙交酯、d-丙交酯、ε-己内酯和乙交酯的混合物。这些混合物的相对组成可用于控制包衣水解和吸附的速率、细胞外囊泡释放的速率和膜的强度。可用于制备适于缓慢释放的薄膜的其他聚合物材料包括(但不限于)聚酰胺、聚亚烷基草酸酯(polyalkylenesoxalate)、聚(氨基酸)、共聚(醚-酯)、聚(亚氨基碳酸酯)、聚原酸酯、聚(酸酐)及其共混物。可在眼中降解以缓慢释放眼用组合物的天然存在的聚合物包括透明质酸、可吸收的生物相容性多糖(诸如壳聚糖或淀粉)、纤维蛋白、弹性蛋白、纤维蛋白原、胶原蛋白和脂肪酸(及其酯)。在一个实施方案中,含有细胞外囊泡组合物的聚合物可以例如通过将含有溶解的聚合物(含有细胞外囊泡组合物)的溶液喷洒到待涂覆的表面上或通过将一部分植入物浸入这些溶液中而施加到植入物上。薄膜通常提供几周的持续递送,直到膜中的治疗剂耗尽。厚度将取决于期望的递送时间和细胞外囊泡装载的浓度。通常,厚度为5-30微米或更小,但也允许其他厚度。
本公开的另一方面涉及一种将治疗剂递送至受试者的选定细胞或组织的方法。该方法涉及:提供经修饰为含有治疗剂的玻璃体液细胞外囊泡和/或房水细胞外囊泡的组合物,以及在将包含经修饰为含有治疗剂的玻璃体液和/或房水细胞外囊泡的组合物有效递送至受试者的选定细胞或组织的条件下,将该组合物施用给受试者。
根据本发明的这个方面,合适的受试者包括任何哺乳动物受试者。通常,受试者是人,然而,适于接受如本文所述的细胞外囊泡组合物的非人哺乳动物包括非人灵长类动物、狗、猫、啮齿动物(例如,小鼠、大鼠、豚鼠)、马、鹿、家畜牛和奶牛、羊和猪。
在一个实施方案中,细胞外囊泡的组合物是自体组合物,即组合物的细胞外囊泡从眼内液,即施用该组合物的同一受试者的玻璃体液和/或房水中分离。在另一个实施方案中,所述组合物是同种异体组合物,其中提供含有细胞外囊泡的眼内液的供体受试者和待治疗的接受受试者是相同的物种但为不同的个体。在一个替代性实施方案中,所述组合物可以是异种的。在该实施方案中,玻璃体液和/或房水囊泡获自与接受物种不同的物种的供体受试者。例如,可以分离和修饰牛细胞外囊泡以产生适于治疗人类受试者的组合物。
在一个实施方案中,施用本文所述的细胞外囊泡组合物的受试者是患有眼部疾病的受试者,并且组合物的施用作为对该眼部疾病的治疗将治疗剂递送至受试者的眼部细胞或组织。
可经由施用本文所述的组合物来治疗的眼部疾病包括但不限于眼部退行性疾病,诸如干性黄斑变性、血管病症继发性黄斑水肿、色素性视网膜炎和湿性黄斑变性;所有形式的青光眼,即开角型青光眼(例如低眼压和正常眼压性青光眼)、闭角型青光眼、先天性青光眼、继发性青光眼、新生血管性青光眼、色素性青光眼、原发性青少年青光眼、假性剥脱性青光眼、虹膜角膜内皮综合征,以及各种起源的青光眼(例如,与眼内肿瘤、视网膜脱离、化学灼伤、虹膜萎缩相关的青光眼和中毒青光眼);炎症性疾病,诸如鸟枪弹样视网膜病变、糖尿病性视网膜病变、harada和vogt-koyanagi-harada综合征、虹膜炎、多灶性脉络膜炎和全葡萄膜炎、睫状体扁平部炎、后巩膜炎、结节病、系统性红斑狼疮引起的视网膜炎、交感性眼炎、视网膜下纤维化、葡萄膜炎综合征、白点综合征;与新血管形成相关的眼部病症,包括年龄相关性黄斑变性、血管样条纹、视网膜分支静脉阻塞、脉络膜炎、角膜创伤相关病症、糖尿病相关虹膜新血管形成、糖尿病性视网膜病变、特发性脉络膜新血管形成、病理性近视、视网膜脱离、视网膜肿瘤、早产儿视网膜病变和镰状细胞性视网膜病变;与脉络膜、视网膜或角膜相关的眼部感染,诸如巨细胞病毒性视网膜炎、组织胞浆菌、视网膜脉络膜炎、弓形虫、视网膜脉络膜炎和结核性脉络膜炎;肿瘤性疾病,诸如视网膜、脉络膜、葡萄膜、玻璃体或角膜中的异常组织生长,脉络膜黑素瘤,脉络膜、玻璃体或视网膜的眼内淋巴瘤,转移性病变,视网膜母细胞瘤和来自视网膜母细胞瘤的玻璃体种植(vitreousseeding);以及创伤,诸如因受伤或手术造成的创伤或因暴露于激光或强光造成的视网膜损伤。
适于使用本文所述的方法和组合物治疗的特定角膜病症包括角膜擦伤、角膜营养不良、角膜溃疡、角膜新血管形成、富克斯营养不良(fuchs′dystrophy)、角膜炎、圆锥形角膜、过敏性结膜炎、干眼综合征、干眼病、类风湿性关节炎、舍格伦综合征(
适于使用本文所述的方法和组合物治疗的结膜病症包括但不限于急性结膜炎、急性特应性结膜炎、急性化学性结膜炎、慢性过敏性结膜炎、其他慢性过敏性结膜炎、腺病毒性结膜炎、病毒性结膜炎、结膜松弛症、结膜出血、结膜黄斑(pingueculum)、睑裂斑炎(pingueculitis)、浆液性结膜炎。
适于使用本文所述的方法和组合物治疗的角膜营养不良包括但不限于内皮(富克斯)、颗粒状、格子状、斑点状、其他遗传性角膜营养不良,诸如前基底膜营养不良和多形性角膜后层营养不良、阿韦利诺角膜营养不良(avellinocornealdystrophy)、斑点状角膜营养不良、胶滴状营养不良、施奈德角膜营养不良(schnydercornealdystrophy)、francois-neetans斑点状营养不良、先天性遗传性基质层营养不良。还包括角膜水肿/混浊/变性、大泡性角膜病变、隐形眼镜继发性角膜水肿、特发性角膜水肿、继发性角膜水肿、德斯密氏膜破裂(ruptureindescemet’smembrane)、中心性角膜混浊、外周角膜混浊、其他角膜瘢痕和混浊、轻微角膜混浊、老年环、带状角膜病变、角膜软化、结节性角膜变性、周围角膜变性、圆锥形角膜稳定、圆锥形角膜不稳、角膜膨隆(cornealectasia)、后弹力层膨出(descemetocele)、角膜移植、角膜移植排斥、角膜移植失败、角膜移植感染、角膜移植的其他并发症。适于使用本文所述的方法和组合物治疗的还包括角膜异物/损伤/裂伤、角膜异物、结膜异物、角膜和结膜囊灼伤、结膜损伤和无异物的角膜擦伤、眼裂伤和破裂伴有眼内组织脱出或缺失、眼裂伤和破裂不伴有眼内组织脱出或缺失、眼球和眼周组织挫伤(例如外伤性前房积血)、单纯性疱疹、疱疹病毒性角膜炎、疱疹病毒性结膜炎、其他疱疹病毒性疾病、带状疱疹、带状疱疹性结膜炎、带状疱疹性角膜炎、带状疱疹性巩膜炎、其他带状疱疹、角膜炎、中心性角膜溃疡、环形角膜溃疡、伴前房积脓的角膜溃疡、边缘性角膜溃疡、蚕蚀性角膜溃疡(mooren’scornealulcer)、真菌性角膜溃疡、穿孔性角膜溃疡、角膜脓肿、丝状角膜病变、光角膜炎、点状暴露性角膜结膜炎、干燥性角膜结膜炎、神经营养性角膜结膜炎、伴有角膜结膜炎的干燥综合征、泡性角膜结膜炎、间质性角膜炎(例如,科干综合征(cogansyndrome))、角膜局限性血管形成、干眼病、复发性角膜糜烂、隐形眼镜引起的角膜病症、舍格伦综合征(sjogren’ssyndrome)、干燥综合征、翼状胬肉、周围性翼状胬肉、静止性翼状胬肉、进行性翼状胬肉、复发性翼状胬肉。
包括白内障的晶状体病症也可以用本文所述的方法和组合物治疗。
可用本文所述的方法和组合物治疗的神经眼科疾患包括但不限于睑痉挛、颅神经麻痹、面部肌张力障碍、巨细胞/颞动脉炎、颅内高压、缺血性视神经病变、多发性硬化、视神经肿瘤、视神经炎、视神经病变、视野缺损和非动脉前部缺血性视神经病变(naion)。
可用本文所述的方法和组合物治疗的视网膜疾病包括但不限于视网膜分支静脉阻塞、视网膜中央静脉阻塞、中心性浆液性脉络膜视网膜病变、脉络膜脱离、复杂性视网膜脱离、先天性x连锁视网膜劈裂、视网膜前膜、家族性渗出性玻璃体视网膜病变、特发性中心凹性毛细血管扩张症、传染性视网膜炎、人工晶状体脱位、黄斑水肿、黄斑裂孔、持续性胎儿血管化、息肉状脉络膜血管病变、玻璃体后脱离、假定眼组织胞浆菌病综合征、晶状体碎片残留、视网膜动脉阻塞、色素性视网膜炎和视网膜假体、早产儿视网膜病变、河盲症/盘尾丝虫病、玻璃体黄斑牵引综合征、视网膜母细胞瘤、黄斑皱褶、黄斑裂孔、飞蚊症、比蒂氏结晶型营养不良(bietti’scrystallinedystrophy)、组织胞浆菌病、视网膜母细胞瘤、亚瑟综合征(usher’ssyndrome)。
可用本文所述的方法和组合物治疗的视网膜病症包括但不限于1型糖尿病引起的糖尿病性视网膜病变,伴有或不伴有以下并发症;未提及并发症,伴有轻度非增生性视网膜病变,伴有黄斑水肿,伴有轻度非增生性视网膜病变,不伴有黄斑水肿,伴有中度非增生性视网膜病变,伴有黄斑水肿,伴有中度非增生性视网膜病变,不伴有黄斑水肿,伴有重度非增生性视网膜病变,伴有黄斑水肿;伴有重度非增生性视网膜病变,不伴有黄斑水肿,伴有增生性视网膜病变,伴有黄斑水肿;伴有增生性视网膜病变,不伴有黄斑水肿。2型糖尿病引起的糖尿病性视网膜病变;未提及并发症,伴有轻度非增生性视网膜病变,伴有黄斑水肿,伴有轻度非增生性视网膜病变,不伴有黄斑水肿,伴有中度非增生性视网膜病变,伴有黄斑水肿,伴有中度非增生性视网膜病变,不伴有黄斑水肿,伴有重度非增生性视网膜病变,伴有黄斑水肿,伴有重度非增生性视网膜病变,不伴有黄斑水肿,伴有增生性视网膜病变,伴有黄斑水肿,伴有增生性视网膜病变,不伴有黄斑水肿。其他视网膜病症包括黄斑和后极型变性、非渗出性黄斑变性(干性)、渗出性黄斑变性(湿性)黄斑囊肿、裂孔或假孔、中心性浆液性脉络膜视网膜病变、黄斑囊样变性(cme)、黄斑皱褶(erm)、黄斑玻璃膜疣(退行性)、玻璃体黄斑牵引、白内障术后黄斑囊样水肿、玻璃体型变性(包括玻璃体出血)、玻璃体变性(例如,pvd)玻璃体黄斑粘连(vmt)、玻璃体结晶沉积、其他玻璃体混浊(例如,玻璃体浮游物)、其他玻璃体病症、视神经型病症(包括视盘缺损、视盘玻璃膜疣、缺血性视神经病变、视神经乳头炎、其他视神经萎缩)、颅内压增加相关的视乳头水肿、原发性视神经萎缩、球后神经炎、眼内炎、其他眼内炎、全眼球炎(急性)、全葡萄膜炎、化脓性眼内炎、交感性葡萄膜炎。遗传性视网膜营养不良、主要涉及视网膜色素上皮的营养不良、主要涉及感觉神经视网膜的其他营养不良(例如,斯特格式病(staargardt’sdisease))、色素性(例如,色素性视网膜炎)营养不良、玻璃体视网膜营养不良、虹膜睫状体炎、慢性虹膜睫状体炎、晶状体诱发性虹膜睫状体炎、原发性虹膜睫状体炎、复发性急性虹膜睫状体炎、继发性感染性虹膜睫状体炎、继发性非感染性虹膜睫状体炎、一时性黑蒙、眼球萎缩(例如,眼球痨)、白内障术后眼内白内障(晶状体)碎片退行性近视(例如,恶性)、复视(重影)、有先兆偏头痛(非顽固性);伴有偏头痛持续状态的有先兆偏头痛(非顽固性);不伴有偏头痛持续状态的有先兆偏头痛(顽固性);伴有偏头痛持续状态的有先兆偏头痛(顽固性);不伴有偏头痛持续状态、眼痛、眼肌麻痹性偏头痛(非顽固性)、眼肌麻痹性偏头痛(顽固性)、其他葡萄糖异常(例如,前驱糖尿病)其他偏头痛(非顽固性);伴有偏头痛持续状态的其他偏头痛(非顽固性);不伴有偏头痛持续状态的其他偏头痛(顽固性);伴有偏头痛持续状态的其他偏头痛(顽固性);不伴有偏头痛持续状态、其他长期(当前)药物治疗、其他视觉障碍(视力模糊)、其他主观视觉障碍(例如,视觉晕圈)类风湿性关节炎、突然性视力丧失、短暂性视力丧失、红斑狼疮。后极黄斑瘢痕(炎症后)(创伤后)、日光性视网膜病变、脉络膜视网膜炎症、脉络膜出血、脉络膜破裂、脉络膜良性肿瘤、脱离术后脉络膜视网膜瘢痕、浆液性脉络膜脱离、出血性脉络膜脱离、高血压性视网膜病变、渗出性视网膜病变、视网膜微动脉瘤、未特指的视网膜新血管形成、未特指的其他非糖尿病增生性视网膜病变视网膜出血、视网膜水肿(例如,棉絮状斑)视网膜缺血、外周视网膜变性类型、视网膜格子样变性、视网膜铺路石微囊样变性(microcystoiddegenerationofretinapavingstone)、视网膜变性、视网膜年龄相关性网状变性、继发性玻璃体视网膜变性、视网膜脱离、单发性视网膜脱离、多发性视网膜脱离、巨大裂孔性视网膜脱离、视网膜脱离伴锯齿缘离断(retinaldialysis)、全视网膜脱离、其他视网膜脱离、未特指的牵拉性视网膜脱离(例如,pvr伴视网膜脱离)、视网膜劈裂、其他视网膜劈裂和视网膜囊肿、浆液性视网膜脱离、浆液性视网膜脱离、视网膜撕裂型、视网膜裂孔、视网膜马蹄形撕裂不伴脱离、视网膜圆洞不伴脱离、视网膜多处缺损不伴脱离。
所有类型的视网膜血管阻塞也可用本文所述的方法和组合物治疗,它们包括视网膜中央动脉阻塞(crao)、视网膜分支动脉阻塞(brao)、视网膜中央静脉阻塞(crvo)、视网膜支流(分支)静脉阻塞(brvo)、早产儿视网膜病变(rop)型即早产儿视网膜病变rop0期、早产儿视网膜病变1期、早产儿视网膜病变2期、早产儿视网膜病变3期、早产儿视网膜病变4期、早产儿视网膜病变5期。视网膜层的分离(包括中心性浆液性脉络膜视网膜病变(csr)、视网膜色素上皮浆液性脱离和视网膜色素上皮出血性脱离)也可以根据本文所述的方法和组合物进行治疗。
可用本文所述的方法和ev组合物治疗的脉络膜和视网膜病症包括但不限于脉络膜视网膜炎症、局灶性脉络膜视网膜炎症、局灶性脉络膜视网膜炎、脉络膜炎、视网膜炎、视网膜脉络膜炎、播散性脉络膜视网膜炎症:脉络膜视网膜炎、脉络膜炎、视网膜炎、视网膜脉络膜炎、渗出性视网膜病变、后睫状体炎、睫状体扁平部炎、其他脉络膜视网膜炎症、原田氏病(harada′sdisease)、未特指的脉络膜视网膜炎症;脉络膜视网膜炎、脉络膜炎、视网膜炎、视网膜脉络膜炎、脉络膜视网膜瘢痕、后极性黄斑瘢痕(炎症后)(创伤后)、日光性视网膜病变、脉络膜变性、脉络膜萎缩、脉络膜硬化、血管样条纹、遗传性脉络膜营养不良、无脉络膜症、营养不良、脉络膜(中央晕轮状)(广泛性)(视盘周围)、回旋状萎缩、脉络膜鸟氨酸高脂血症(choroidornithinaemia)、脉络膜出血和破裂、未另外特指的脉络膜出血、驱逐性脉络膜脱离、其他特指的脉络膜病症、其他分类的疾病中的脉络膜视网膜病症、其他分类的疾病中的脉络膜视网膜病症、其他分类的感染性疾病和寄生虫疾病中的脉络膜视网膜炎症、脉络膜视网膜炎(梅毒性、晚期、弓形虫、结核性)、其他分类的疾病中的其他脉络膜视网膜病症、视网膜脱离和断裂、视网膜脱离、视网膜劈裂(包括x连锁视网膜劈裂)、视网膜动脉阻塞、视网膜静脉阻塞、高血压性视网膜病变、年龄相关性黄斑变性、黄斑变性、视网膜前膜、外周视网膜变性、遗传性视网膜营养不良、色素性视网膜炎、中心性浆液性视网膜病变、视网膜脱离、视网膜色素上皮脱离、其他特指的视网膜病症、黄斑水肿、未特指的视网膜病症、其他分类的疾病中的视网膜病症。
也可以用如本文所述的方法和组合物治疗的眼睑、泪器系和眼眶的病症包括但不限于睑外翻、兔眼症、睑皮松垂、上睑下垂、睑板腺囊肿、睑腺炎、眼睑黄斑瘤、其他分类的疾病中的眼睑寄生虫感染、由蠕形螨引起的眼睑皮炎、眼睑寄生虫感染,包括利什曼病(leishmaniasis)、罗阿丝虫病(loiasis)、盘尾丝虫病(onchocerciasis)、虱病(phthiriasis)、其他分类的感染性疾病中涉及的眼睑疾病。疱疹病毒(单纯性疱疹)感染、麻风病、触染性软疣、结核病、带状疱疹中涉及的眼睑疾病,其他分类的其他疾病中涉及的眼睑疾病,脓疱病、泪腺炎、溢泪、甲状腺功能障碍性突眼症、甲状腺眼病中涉及的眼睑疾病,
可用本文所述的方法和组合物治疗的青光眼病症包括但不限于前期青光眼开角型伴边界性所见(preglaucomaopenanglewithborderlinefindings)、开角型、低风险、解剖狭角性可疑原发性房角关闭(anatomicalnarrowangleprimaryangleclosuresuspect)、类固醇反应者、高眼压、不伴有青光眼损伤的原发性房角关闭(没有视神经或视野缺损的pas或高眼内压)、未特指的开角型青光眼、原发性开角型青光眼、慢性单纯性青光眼、低眼压性青光眼、色素性青光眼、伴晶状体假性层状剥落的囊膜性青光眼、开角型青光眼残余期、未特指的原发性闭角型青光眼、急性闭角型青光眼发作、慢性闭角型青光眼、间歇性闭角型青光眼、闭角型青光眼残余期、继发于眼外伤的青光眼、继发于眼部炎症的青光眼、继发于其他眼部病症的青光眼,所述其他眼部病症包括视网膜血管阻塞、复杂性1型糖尿病、复杂性2型糖尿病、晶状体病症、人工晶状体病症、其他眼部症状后的病症、肿瘤、良性肿瘤或恶性肿瘤。还包括药物继发性青光眼、巩膜浅层静脉压增加的青光眼、分泌过多性青光眼、房水逆流恶性青光眼、其他分类的疾病中的青光眼、先天性青光眼、阿克森费尔德(axenfeld’sanomaly)异常、牛眼、儿童青光眼、新生儿青光眼、水眼、球形角膜、先天性青光眼大角膜伴青光眼、先天性青光眼中的巨眼畸形、巨角膜伴青光眼、绝对期青光眼。还包括眼科药物和制剂的不良作用、急性滤泡性结膜炎、碳酸酐酶抑制剂的不良作用、以及眼科药物和制剂的剂量不足的不良作用。
可以用如本文所述的方法和组合物治疗的视神经病症包括但不限于青光眼视神经萎缩、视神经乳头炎、球后神经炎、未特指的视神经萎缩、原发性视神经萎缩、未特指的视神经炎、其他视神经炎、视盘假性视神经乳头水肿、未特指的视神经乳头水肿、视神经乳头水肿、缺血性视神经病变、视神经交叉障碍、与其他肿瘤相关的视神经交叉障碍、与血管病症相关的视神经交叉障碍、与炎性病症相关的视神经交叉障碍、其他视神经病症、视神经受压、中毒性视神经病变、营养性视神经病变、遗传性视神经萎缩、皮质盲、眼眶肉芽肿(例如眼眶假瘤(炎性))、强直性瞳孔、脑垂体良性肿瘤、未特指的眼眶部位的良性肿瘤、瞳孔不等大、有感觉症状的转换障碍、脑膜良性肿瘤、眼痛、甲状腺毒症伴弥漫性甲状腺肿伴甲状腺毒危象或甲亢危象(例如格雷夫斯病(graves’disease)、未另外特指的突眼或毒性甲状腺肿)、甲状腺毒症伴弥漫性甲状腺肿不伴甲状腺危象或甲亢危象(例如格雷夫斯病、未另外特指的突眼或毒性甲状腺肿)、瞳孔扩大、瞳孔不等大、其他特指的双眼运动病症(例如反向偏斜)、会聚功能不全核间性眼肌麻痹、其他巨细胞动脉炎、强直性瞳孔、其他主观视觉障碍(例如视觉晕圈)、红细胞沉降率升高、脑梗塞、(例如中风)短暂性脑缺血发作、眼眶恶性肿瘤、进行性眼外肌麻痹、局灶性脉络膜视网膜炎症、近视乳头(juxtapapillary)、后天性色视力缺乏、盲点区暗点、视网膜局部动脉阻塞(例如伦赫斯特氏(hollenhorst’s))、共轭凝视麻痹(痉挛)、复视(重影)其他斜视类型、内隐斜视、外隐斜视、垂直斜视(例如上斜眼)、麻痹型、第三眼运动神经、第四眼运动神经、第六眼运动神经、上睑下垂、先天性上睑下垂、机械性上睑下垂、肌源性上睑下垂、麻痹性上睑下垂、视野障碍、短暂性视力丧失(例如闪光暗点)、同侧性双侧视野缺损、异侧性双侧视野缺损。
可以用如本文所述的方法和组合物治疗的神经系统病症包括但不限于一时性黑蒙、霍纳氏综合征(horner’ssyndrome)、睑痉挛、多发性硬化、短暂性脑缺血发作、良性颅内高压、眼肌麻痹性偏头痛(非顽固性)、眼肌麻痹性偏头痛(顽固性)、不伴(急性)加重的重症肌无力、伴(急性)加重的重症肌无力、阵挛性半面痉挛。
适于用经修饰为含有治疗剂的玻璃体液和/或房水细胞外囊泡的组合物治疗的其他疾患包括如本文所述的那些,但不限于:血液恶性肿瘤、皮肤t细胞淋巴瘤、成人t细胞淋巴瘤/白血病、病理性纤维化、皮肤纤维化、特发性肺纤维化、其他纤维化指征、神经变性、缺血、急性间歇性卟啉症、实体癌、肝癌、肾上腺皮质癌、胰腺癌、高胆固醇血症、糖尿病性黄斑水肿、急性非动脉炎性前部缺血性视神经病变、预防急性肾损伤、肾移植受者的移植功能延迟、家族性淀粉样多发性神经病、晚期癌症、甘油三酯升高、肌萎缩侧索硬化、前列腺癌、骨髓增生异常综合征、亨廷顿氏病(huntington′sdisease)、甘油三酯升高/家族性高胆固醇血症、实体癌、囊性纤维化、溃疡性结肠炎、实体癌、杜氏肌营养不良(duchennemusculardystrophy)、高脂蛋白血症(a)、乙型肝炎感染、2型糖尿病、过敏原诱发的哮喘、哮喘、特应性皮炎、液体癌、骨髓性白血病、凝血障碍、结肠袋炎(pouchitis)、家族性乳糜微粒血综合征、家族性局部脂肪萎缩、家族性淀粉样多神经病、前列腺癌、非小细胞肺癌、黑素瘤、三阴性乳腺癌、狂犬病(rabies)、rsv、hiv、甲型流感、心血管疾病、寨卡病(zika)、前列腺癌、多发性骨髓瘤、急性髓性白血病、非小细胞肺癌、肾细胞癌、实体癌、先天性甲肥厚、肝纤维化、原发性高草酸尿症1型、肥厚性瘢痕、重型血友病a或b、阵发性睡眠性血红蛋白尿症、肝病和肺病、血友病和罕见出血性疾病、高胆固醇血症、急性肝卟啉症、补体介导的疾病、原发性高草酸尿症1型、遗传性attr淀粉样变性、乙型和丙型肝炎病毒感染、hcv、amd/dme、amd、naion、先天性甲肥厚、fap/结肠癌、pdac、cml、aki和dgf。
根据本公开的该实施方案,组合物的细胞外囊泡经修饰为含有一种或多种适于治疗眼部疾病的治疗剂。合适的治疗剂即核酸分子(治疗性rna和dna)、蛋白和肽治疗剂以及小分子治疗剂如上文所述。针对特定的眼部疾病选择合适的治疗剂完全在眼科领域的技术人员的技术水平范围内。
根据本发明的这个方面,含有玻璃体液和/或房水细胞外囊泡的组合物可以使用局部施用、全身施用、眼周施用或眼内施用方式向有需要的受试者施用。所选的特定施用途径取决于所治疗的疾患和组合物的配方。
在一个实施方案中,全身施用所述组合物。全身施用可以经由静脉内施用、口服施用、动脉内施用、吸入、鼻内施用、腹膜内施用、腹内施用、皮下施用、关节内施用、鞘内施用、经硬膜施用、透皮施用、粘膜下施用、舌下施用、肠内施用、肠胃外施用、经皮施用、关节周围施用或心室内施用而实现。
在另一个实施方案中,局部施用所述组合物。在一个实施方案中,将组合物局部施用于眼部组织。如本文所提到的,眼部组织是指眼,包括巩膜内的组织(例如,视网膜)和巩膜外的组织(例如,眼眶内的眼肌)。眼部组织还包括与眼以神经方式连接(但不同于眼)的组织,诸如视神经、膝状体核和视皮质。向眼部组织的局部施用可经由眼内施用而实现。根据该实施方案,眼内施用可以经由前房内施用、玻璃体内施用或视网膜下施用来进行。
在另一个实施方案中,向眼部组织的局部施用可经由眼周施用而实现。眼周施用可经由结膜下注射、眼球筋膜囊下注射、直接眼周注射或眼周积存注射来进行。
细胞外囊泡的靶细胞和/或组织可包括任何期望的细胞和/或组织类型。在一个实施方案中,靶细胞为眼部细胞。适于经由如本文所述的细胞外囊泡递送治疗剂的眼部细胞包括但不限于睫状体上皮细胞、睫状体色素上皮细胞、睫状体非色素上皮细胞、睫状突细胞、视网膜细胞(包括米勒细胞、神经节细胞、无长突细胞、水平细胞、光感受器(视杆和视锥)双极细胞、视网膜色素上皮细胞或视网膜内皮细胞)、角膜细胞(包括角膜上皮细胞、角膜基质细胞(角膜细胞)、角膜内皮细胞或角膜缘干细胞)、虹膜细胞(包括色素细胞或非色素细胞、纺锤形成纤维细胞、巨噬细胞(koganei团块细胞)、括约肌平滑肌或后上皮细胞)、小梁网细胞(包括小梁网细胞或施莱姆氏管的内皮细胞衬里)、晶状体细胞(包括晶状体上皮细胞、晶状体前上皮细胞、含晶状体蛋白的晶状体纤维细胞、晶状体纤维细胞或晶状体囊细胞)、脉络膜细胞(包括立方上皮细胞、室管膜细胞层、脉络丛上皮细胞或脉络膜内皮细胞)、视神经细胞(包括少突胶质细胞、视网膜神经节细胞轴突或神经胶质细胞)、干细胞和祖细胞(包括间充质干细胞、角膜缘干细胞、视网膜干细胞)。
在另一个实施方案中,携带治疗剂的细胞外囊泡的靶细胞和/或组织包括非眼部细胞。使用如本文所述的细胞外囊泡进行治疗剂递送的非眼部靶细胞和组织包括但不限于外分泌分泌细胞和组织,包括但不限于上皮细胞、唾液腺粘液细胞(分泌物富含多糖)、唾液腺1号(分泌物富含糖蛋白酶)、舌部的冯·埃布纳腺细胞(vonebner′sglandcell)(冲刷味蕾)、乳腺细胞(分泌乳汁)、泪腺细胞(分泌泪液)、耳中的耵聍腺细胞(分泌耳垢)、小汗腺暗细胞(eccrinesweatglanderingdarkcell)(分泌糖蛋白)、小汗腺明细胞(eccrinesweatglandclearcell)(分泌小分子)、顶泌汗腺细胞(分泌性激素敏感的有气味的物质)、眼睑莫氏腺(glandofmoll)细胞(专用汗腺)、皮脂腺细胞(分泌富含脂质的皮脂)、鼻部鲍曼氏腺(bowman′sgland)细胞((冲刷嗅觉上皮)、十二指肠布鲁纳氏腺(brunner′sgland)细胞(酶和碱性粘液)、精囊细胞(分泌精液组分,包括精子游动所需的果糖)、前列腺细胞(分泌精液组分)、尿道球腺细胞(分泌粘液)、巴多林氏腺(bartholin′sgland)细胞(分泌阴道润滑物质)、尿道腺(glandoflittre)细胞(分泌粘液)、子宫内膜细胞(分泌碳水化合物)、呼吸和消化道的孤立杯状细胞(分泌粘液)、胃粘膜细胞(分泌粘液)、胃腺酶原细胞(分泌胃蛋白酶原)、胃腺泌酸细胞(分泌盐酸)、胰腺腺泡细胞(分泌碳酸氢盐和消化酶)、小肠潘氏细胞(分泌溶菌酶)、肺ii型肺细胞(分泌表面活性物质)、肺棒状细胞。
在另一个实施方案中,携带治疗剂的细胞外囊泡的靶细胞和/或组织包括激素分泌细胞,这些激素分泌细胞包括但不限于垂体前叶细胞、促生长激素细胞、催乳素细胞、促甲状腺细胞、促性腺细胞、促皮质激素细胞、垂体中叶细胞(分泌黑素细胞刺激激素)、大细胞性神经分泌细胞(不分泌催产素,分泌后叶加压素)、肠道和呼吸道细胞(分泌血清素,分泌内啡肽,分泌生长激素抑制素,分泌胃泌素,分泌分泌素,不分泌胆囊收缩素,分泌胰岛素,分泌胰高血糖素,不分泌蛙皮素)、甲状腺细胞、甲状腺上皮细胞、滤泡旁细胞、副甲状腺细胞、副甲状腺主细胞、嗜酸细胞、肾上腺细胞、嗜铬细胞(分泌类固醇激素(盐皮质激素和糖皮质激素))、分泌睾丸激素的睾丸间质细胞、分泌雌激素的卵泡内膜细胞、分泌孕酮的破裂卵泡的黄体细胞、粒黄体细胞、膜黄体细胞、近肾小球细胞(分泌肾素)、肾脏致密斑细胞、肾脏极周细胞、肾脏系膜细胞、胰岛(郎格罕氏岛(isletsoflangerhans))α细胞(分泌胰高血糖素)、β细胞(分泌胰岛素和胰淀素(amylin))、δ细胞(分泌生长激素抑制素)、pp细胞(γ细胞)(分泌胰腺多肽)、ε细胞(分泌胃饥饿素(ghrelin))。
在另一个实施方案中,携带治疗剂的细胞外囊泡的靶细胞和/或组织包括主要源自外胚层的细胞,这些主要源自外胚层的细胞包括来自皮肤系统的细胞,角质化上皮细胞,表皮角质形成细胞(分化的表皮细胞),表皮基底细胞(干细胞),指甲和趾甲角质形成细胞,甲床基底细胞(干细胞),髓质毛干细胞,皮质毛干细胞,角质层毛干细胞,角质层毛根鞘细胞,赫胥黎层(huxley′slayer)毛根鞘细胞,亨勒层(henle′slayer)毛根鞘细胞,外毛根鞘细胞,毛母质细胞(干细胞),湿层状屏障上皮细胞,角膜、舌、口腔、食管、肛管、远端尿道和阴道的复层鳞状上皮的表面上皮细胞,角膜、舌、口腔、食管、肛管、远端尿道和阴道的上皮的基底细胞(干细胞),尿路上皮细胞(内衬膀胱和尿管)。
在另一个实施方案中,携带治疗剂的细胞外囊泡的靶细胞和/或组织包括神经系统细胞,这些神经系统细胞包括但不限于感官传感器细胞、柯蒂氏器(organofcorti)的听觉内毛细胞、柯蒂氏器的听觉内毛细胞、柯蒂氏器的听觉外毛细胞、嗅上皮基底细胞(嗅觉神经元干细胞)、冷敏初级感觉神经元、热敏初级感觉神经元、表皮梅克尔细胞(merkelcell)(解觉感受器)、嗅觉受体神经元、痛敏初级感觉神经元(各种类型)、眼视网膜的感光细胞、感光视杆细胞、眼感光蓝敏视锥细胞、眼感光绿敏视锥细胞、眼感光红敏视锥细胞、本体感受初级感觉神经元(各种类型)、触敏初级感觉神经元(各种类型)、i型颈动脉体细胞(血液ph感受器)、ii型颈动脉体细胞(血液ph感受器)、耳前庭系统i型毛细胞(加速度和重力)、耳前庭系统ii型毛细胞(加速度和重力)、i型味蕾细胞、自主神经元细胞、胆碱能神经细胞(各种类型)、肾上腺素能神经细胞(各种类型)、肽类神经细胞(各种类型)、感觉器官和外周神经元支持细胞、柯蒂氏器内柱细胞、柯蒂氏器外柱细胞、柯蒂氏器内指状细胞、柯蒂氏器外指状细胞、柯蒂氏器边缘细胞、柯蒂氏器汉森细胞(hensencell)、前庭器官支持细胞、味蕾支持细胞、嗅觉上皮支持细胞、雪旺细胞(schwanncell)、卫星胶质细胞(包裹周围神经细胞体)、肠胶质细胞、中枢神经系统神经元和胶质细胞、神经元细胞(多种类型,仍然分类不佳)、中间神经元、篮状细胞、车轮细胞、星状细胞、高尔基细胞(golgicell)、颗粒细胞、卢加洛细胞(lugarocell)、单极刷细胞、马尔提诺蒂细胞(martinotticell)、枝形细胞、中型多刺神经元、cr细胞(cajal-retziuscell)、双刷细胞(double-bouquetcell)、神经胶质状细胞、脊髓中间神经元、闰绍细胞(renshawcell)、主细胞、纺锤形神经元、锥体细胞、定位细胞、网格细胞、速度细胞、头朝向细胞、贝茨细胞(betzcell)、星状细胞、边界细胞、星形胶质细胞(各种类型)、少突胶质细胞、室管膜细胞和伸长细胞(tanycyte)。
在另一个实施方案中,携带治疗剂的细胞外囊泡的靶细胞和/或组织包括主要源自中胚层的细胞,这些主要源自中胚层的细胞包括但不限于代谢和储藏细胞,即脂肪细胞:白色脂肪细胞、褐色脂肪细胞、肝脏脂肪细胞;屏障功能细胞(肺、肠、外分泌腺和泌尿生殖道);肾脏细胞、肾壁细胞、肾小球足细胞、肾近端小管刷状缘细胞、亨利氏环薄段细胞(loopofhenlethinsegmentcell)、肾远端小管细胞、肾集合管细胞、主细胞、闰细胞(intercalatedcell);其他细胞,即i型肺细胞(肺气室衬里细胞(liningairspaceoflungcell))、胰管细胞(泡心细跑)、非纹状管细胞(汗腺、唾液腺、乳腺等的细胞)、主细胞、闰细胞、管细胞(精囊、前列腺等的细胞)、肠刷状边缘细胞(含微绒毛)、外分泌腺纹状管细胞、胆囊上皮细胞、输精小管非纤毛细胞、附睾主细胞、附睾基底细胞、内皮细胞。
在另一个实施方案中,携带治疗剂的细胞外囊泡的靶细胞和/或组织包括细胞外基质细胞,这些细胞外基质细胞包括但不限于成釉上皮细胞(分泌牙釉质)、耳前庭系统的半月平面上皮细胞(蛋白多糖分泌)、柯蒂氏器齿间上皮细胞(分泌覆盖毛细胞的盖膜)、疏松结缔组织成纤维细胞、角膜成纤维细胞(角膜细胞)、肌腱成纤维细胞、骨髓网状组织成纤维细胞、其他非上皮成纤维细胞、周细胞、椎间盘髓核细胞、成牙骨质细胞/牙骨质细胞(齿根骨样伊万细胞(ewancell)分泌)、成牙质细胞/牙本质细胞(odontocyte)(牙本质分泌)、透明软骨软骨细胞、纤维软骨软骨细胞、弹性软骨软骨细胞、成骨细胞/骨细胞、骨祖细胞(成骨细胞干细胞)、眼玻璃体的透明细胞、耳外淋巴间隙的星状细胞、肝星状细胞(伊东细胞(itocell))、胰腺星状细胞(pancreaticstellecell)。
在另一个实施方案中,携带治疗剂的细胞外囊泡的靶细胞和/或组织包括收缩细胞,这些收缩细胞包括但不限于骨骼肌细胞、红骨骼肌细胞(慢)、白骨骼肌细胞(快)、中间骨骼肌细胞、肌梭核袋细胞、肌梭核链细胞、卫星细胞(干细胞)、心肌细胞、普通心肌细胞、结节心肌细胞、浦肯野纤维细胞(purkinjefibercell)、平滑肌细胞(各种类型)、虹膜肌上皮细胞、外分泌腺肌上皮细胞。
在另一个实施方案中,携带治疗剂的细胞外囊泡的靶细胞和/或组织包括血液和免疫系统细胞,这些血液和免疫系统细胞包括但不限于红细胞(红血球)、巨核细胞(血小板前体)、单核细胞(白血球)、结缔组织巨噬细胞(各种类型)、表皮朗格汉斯细胞(langerhanscell)、破骨细胞(骨内)、树突细胞(淋巴组织内)、小神经胶质细胞(中枢神经系统内)、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、杂交瘤细胞、肥大细胞、辅助t细胞、抑制性t细胞、细胞毒性t细胞、自然杀伤t细胞、b细胞、自然杀伤细胞、网状细胞、血液和免疫系统的干细胞和定向祖细胞(各种类型)、生殖细胞(包括但不限于卵原细胞/卵母细胞、精细胞、精母细胞、精原细胞(精母细胞的干细胞)、精子)、营养细胞(包括但不限于卵巢卵泡细胞、塞尔托利细胞(sertolicell)(睾丸内)、胸腺上皮细胞)和间质细胞(包括肾脏间质细胞)。
根据本公开的这个方面,向受试者施用治疗有效量的组合物。治疗有效量是有效缓和、抑制、减轻、延迟和/或预防所治疗的病症的至少一种症状或其他方面的量。在另一个实施方案中,治疗有效量是有效改善所治疗的眼部疾患的量。剂量可以根据各种参数确定,尤其是根据疾患的严重程度、待治疗的患者的年龄和体重;施用途径;和所需方案来确定。医师将能够确定任何特定患者所需的施用途径和剂量。最佳剂量可以根据所施用的组合物的相对效力而变化,并且通常可以基于发现在体外和体内模型中有效的半数最大有效浓度(ec50)来估计。通常,剂量为0.01mg/kg至100mg/kg体重。根据特定构建体的效力、待治疗的受试者的年龄、体重和状况、疾病的严重程度及施用频率和途径,典型的日剂量为约0.1至50mg/kg,优选约0.1mg/kg至10mg/kg体重。根据施用是通过全身施用还是局部施用来进行的,可以施用不同剂量的构建体。
由于治疗剂的清除(和任何靶向治疗分子的分解),受试者可能必须重复治疗,例如每天、每周、每月或每年一次或多次。基于测得的构建体在体液或组织中的停留时间和浓度,本领域的普通技术人员可以容易地估计给药的重复率。在治疗成功后,可能需要让患者进行维持治疗,其中以范围为0.01mg/kg至100mg/kg体重的维持剂量施用构建体,每天、每月、每年一次或多次等。
本公开的另一方面涉及制备包含如本文所述的玻璃体液和/或房水细胞外囊泡的组合物的方法。示例性方法涉及提供包含玻璃体液和/或房水液的哺乳动物眼内液样品,并从所述眼内液样品中分离囊泡体。该方法还涉及将一种或多种外源性治疗剂插入分离的囊泡体中。
在一个实施方案中,眼内液样品是人眼内液样品。在另一个实施方案中,眼内液样品是牛眼内液样品。在另一个实施方案中,眼内液样品是非人哺乳动物眼内液样品,诸如从非人灵长类动物、狗、猫、啮齿动物、鹿、绵羊、猪等获得的眼内液样品。
在一个实施方案中,眼内液样品是健康的正常眼内液样品。在另一个实施方案中,眼内液样品是患病的眼内液样品,或是从患有眼部疾病或疾患的受试者获得的。可以使用本领域已知的和本文描述的方法获得眼内液样品。在一个实施方案中,经由玻璃体活检或房水活检或抽吸获得眼内液样品。
本文描述了从眼内液中分离细胞外囊泡的合适方法。在一个实施方案中,分离细胞外囊泡的方法涉及一系列离心步骤。如本文所提到的,“眼内液”包括但不限于来自玻璃体液的液体,来自房水的液体,或包含玻璃体液和/或房水液的任何眼内液样品。
如本文所述,将从房水和/或玻璃体液分离的细胞外囊泡修饰为含有一种或多种外源性物质。将一种或多种外源性物质插入细胞外囊泡中的方法可以如本文所述使用容易知道且在本领域中实践的方法和技术来实现,这些方法和技术包括但不限于电穿孔、转染、病毒载体递送或其任何组合。
在一个实施方案中,在插入所述一种或多种外源性物质之前,除去分离的细胞外囊泡的内源性内容物。可以使用紫外线辐射来实现去除细胞外囊泡的内源性内容物的方法。本领域已知的用于排空囊泡体内容物的其他方法也适于根据本公开的这个方面使用。
本公开的另一方面涉及鉴定、检测、诊断、监测或预测受试者的眼部疾病的方法。该方法涉及提供包含来自受试者的玻璃体液和/或房水液的眼内液样品,并从眼内液样品中分离细胞外囊泡。该方法还涉及分析所分离的细胞外囊泡的至少一种分子或物理性质,并将所分离的囊泡体的该至少一种经分析的分子或物理性质与从参考样品获得的分离的囊泡体中的分子或物理性质进行比较。基于该比较来鉴定、检测或诊断是否存在眼部疾病。替代性地,该比较提供关于眼部疾病或疾患的进展或预后的信息。上文提供了可以基于玻璃体液和/或房水细胞外囊泡的分子和/或物理性质来检测、诊断和监测的眼部疾患的详细列表。
本文描述了在正常、健康的玻璃体液和房水中发现了广泛的细胞外囊泡网络。已经进行了全面的蛋白组学分析以表征这种细胞外囊泡网络的正常、健康的蛋白组。这种蛋白组学特征的变化可用作鉴定、检测、诊断、预测和/或监测个体眼部健康变化的手段。类似地,还可以获得分离的细胞外囊泡的其他分子性质,诸如,从正常、健康眼内液获得的样品中的细胞外囊泡的基因表达和脂质含量,并用作参考值以跟踪个体眼部健康随时间的变化。细胞外囊泡的基因表达和/或脂质含量的变化可用于鉴定、检测、诊断、预测和/或监测个体眼部健康的变化。
因此,在一个实施方案中,从健康受试者获得包含房水和/或玻璃体液的眼内液样品,并分离或纯化其中所含的细胞外囊泡。进行蛋白组学、基因组学或脂质分析以确定受试者的基线或参考蛋白或基因表达特征或脂质含量。随后,获得包含房水和/或玻璃体液的第二眼内液样品,分离房水和/或玻璃体液的细胞外囊泡,并确定细胞外囊泡的蛋白表达、基因表达和/或脂质含量分布。可以在收集第一样品后的任何时间,从受试者收集第二眼内液样品。在一个实施方案中,在受试者正在经历眼部疾患的一种或多种症状时或差不多的时间收集第二样品。在其他实施方案中,在受试者尚未经历或表现出任何眼部健康变化时收集第二样品。将收集的第一样品的蛋白表达、基因表达和/或脂质含量分别与收集的第二样品的蛋白表达、基因表达和/或脂质含量进行比较,以检测一个或多个因素即蛋白表达、基因表达和/或脂质含量的变化。将蛋白表达、基因表达或脂质含量的任何变化与一种或多种眼部疾患的已知变化相互关联,以鉴定、检测、诊断和/或预测个体的眼部健康。
在另一个实施方案中,监测从受试者的房水和/或玻璃体液获得的细胞外囊泡样品中随时间推移的蛋白表达、基因表达和/或脂质含量的变化,作为跟踪眼部疾患进展(或没有进展)的手段。在另一个实施方案中,监测从受试者的房水和/或玻璃体液获得的细胞外囊泡样品中随时间推移的蛋白表达、基因表达和/或脂质含量的变化,作为跟踪或监测治疗性干预的有效性的手段。蛋白或基因表达或脂质含量随时间的变化可以表明治疗性干预的有效性。同样,蛋白或基因表达或脂质含量随时间的变化很小或没有变化可以作为所选治疗性干预在所监测个体中无效的早期指标。这样的发现可以证明需要修改治疗性干预以改善有效性和治疗。
为了诊断、预后或相关目的,除了跟踪和/或监测一种或多种分子性质,诸如蛋白表达、基因表达和/或脂质含量的变化以外,还可以连同所述一种或多种分子性质一起或作为其替代,监测源自玻璃体液和/或房水的细胞外囊泡的一种或多种物理性质。可以测量和监测的细胞外囊泡的合适物理性质包括但不限于细胞外囊泡大小、数量、形状和形态。本文描述了测量源自玻璃体液和/或房水样品的细胞外囊泡的此类物理性质的方法。
获得第一眼部细胞外囊泡样品与第二或任何其他后续眼部细胞外囊泡样品之间的时间可以是任何期望的时间段,例如数周、数月、数年,如由医师且基于眼部疾患的特性而确定为合适的。在一个实施方案中,第一样品在治疗前获得,第二样品在治疗后获得。替代性地,两个样品可以在一次或多次治疗后获得;第二样品是在晚于第一样品的某个时间点获得的。
实施例
以下实施例旨在举例说明本发明的实践,但决非旨在限制其范围。实施例的材料和方法
用于实施例的材料和方法
从死后样品进行组织制备和处理。获得没有疾病的死后人眼(theeye-bankforsightrestoration,newyork,ny)。从当地肉店获取牛眼(greenvillagepacking,greenvillage,newjersey)。对于解剖过程,将眼置于冰上的100mm塑料培养皿中以防止rna和蛋白降解。使用szx-16立体解剖显微镜(olympus)去除附着在眼球上的眶脂肪和眼外肌。在4℃下用5ml含有50mmtris-hcl、150mmnacl并且ph调至8.0的冰冷tris缓冲盐水(tbs)漂洗眼球1分钟。通过以下方式解剖玻璃体:使用16g针在角膜缘(分别为人眼和牛眼)后4mm或8mm产生巩膜切开术切口,然后用剪刀产生圆周矢状切口以将眼球分成前杯和后杯。使用剪刀切割并取出所形成的玻璃体并切断玻璃体与眼部结构之间的粘连。注意避免脉络膜黑素细胞和神经视网膜污染玻璃体。鉴定并解剖其他眼部组织,包括脉络膜、视网膜、睫状体、晶状体和角膜。将组织样品用tbs(ph8.0)在4℃下漂洗1分钟。如下所述,对采集用于电子显微镜检查和ev分离的样本立即进行处理,无需固定。将用于免疫组织化学、western印迹或edc-福尔马林固定的样品置于15ml离心管中,并在4℃下浸入10ml稀释于tbs(ph8.0)中的4%福尔马林(也称为甲醛、多聚甲醛或pfa)中至少24小时。在4℃下将“仅福尔马林”的组织在tbs(ph8.0)中洗涤3次,每次5分钟,不进一步处理或用edc固定。仅福尔马林的组织用于免疫组织化学、western印迹或核酸和蛋白成像。如下所述进一步处理edc-福尔马林固定的样本。
人类受试者手术玻璃体样本采集。从威尔康奈尔医学院(weillcomellmedicine)获得了机构审查委员会(irb)批准,并且方案符合nih指南、医疗保险流通与责任法案(healthcareinsuranceportabilityandaccountabilityact)以及赫尔辛基宣言(declarationofhelsinki)提出的原则。从所有受试者获得知情同意书。受试者是针对现有医学疾患进行玻璃体切除术的患者。先前描述了玻璃体活检的方法(malecaze等人,“detectionofvascularendothelialgrowthfactormessengerrnaandvascularendothelialgrowthfactor-likeactivityinproliferativediabeticretinopathy,”archophthalmol112:1476-1482(1994),其据此通过引用整体并入)。简而言之,在睫状体平坦部玻璃体切除术开始时,使用连接至用于抽吸的3ml无菌注射器的玻璃体切除术探针,采集0.5-1ml未稀释的玻璃体(其在出于医学目的的玻璃体切除手术期间取出)。将所有样品去标识并编码。将玻璃体样本立即置于冰上并转移到实验室进行如下所述的tem或玻璃体囊泡分离。
edc-福尔马林组织固定。edc-福尔马林固定的方法改编自先前的报道(valadi等人,“exosome-mediatedtransferofmrnasandmicrornasisanovelmechanismofgeneticexchangebetweencells,”natcellbiol9:654-659(2007);suzuki等人,“dnastainingforfluorescenceandlaserconfocalmicroscopy,”jhistochemcytochem45:49-53(1997),它们据此通过引用整体并入)。如所述分离一片玻璃体(1cmx1cm)并在显微镜下检查以确保样品不含污染组织如视网膜或脉络膜。将组织置于100mm塑料培养皿中,并在4℃下在5mltbs(ph8.0)中洗涤5分钟。将样品浸入5ml稀释于tbs(ph8.0)中的4%福尔马林中24小时,并储存在4℃的加湿腔室中。在4℃下将样品在冰冷的tbs(ph8.0)中洗涤5分钟。为了从组织中去除残留的磷酸盐,在4℃下将样品在10ml新制备的0.1m1-甲基咪唑缓冲溶液(0.1m1-甲基咪唑、300mmnacl,用12nnaoh将ph调至8.0)中温育30分钟。接下来,制备edc固定溶液。首先,制备9.6ml的0.1m1-甲基咪唑缓冲溶液,并添加130mg的5-(乙硫基)-1h-四唑(ett,sigmaaldrich,最终浓度为0.1m)。用12nnaoh将ph调至8.0。接下来,将192mg的1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)(sigmaaldrich,最终浓度0.10m)添加到1-甲基咪唑-ett溶液中。根据需要通过添加12mhcl将溶液的ph重新调至ph8.0。然后将该片玻璃体组织(1cmx1cm)转移到35mm塑料培养皿中,并添加2ml的edc固定溶液。然后将样品置于加湿腔室中,并将样本在37℃下温育3小时。温育后,去除edc-ett溶液,并将样本在5ml稀释于tbs(ph7.4)中的0.2%(w/v)甘氨酸中洗涤。将样品在tbs(ph7.4)中洗涤两次。最后,如下所述将样品针对dna、rna和蛋白进行染色。
dna、rna和蛋白染色。对用仅4%福尔马林或如上所述的edc-福尔马林固定的玻璃体组织进行染色。然后将组织浸入各种染料中以标记dna、rna或蛋白。为了标记dna,将一片解剖的玻璃体(1cmx1cm)置于35mm培养皿中,并浸入1ml0.5μg/ml的hoechst33342染剂溶液(sigmaaldrich)中。将样品在37℃下温育,在室温下保持15分钟,然后在室温下用5ml的1xtbs(ph7.4)将组织洗涤3分钟。洗涤步骤重复两次。用二级标记物对样品染色或封固用于成像。为了用单一染料标记dna和rna两者,使用碘化丙啶(pi,sigmaaldrich),其插入dna碱基之间并且还以较低的亲和力与rna结合(legoffandbishop,“adultvitreousstructureandpostnatalchanges,”eye(lond)22:1214-1222(2008),其据此通过引用整体并入)。据发现,50μg/ml稀释于tbs(ph7.4)中的pi溶液是用于对全封固的玻璃体样品中的dna和rna共染色的最佳pi浓度。因此,将组织置于35mm培养皿中,然后在加湿腔室中于37℃下浸入1ml50μg/ml的pi(稀释于tbs中)溶液中24小时。将样品用tbs(ph7.4)洗涤三次。用另一种标记物对样品染色或封固用于成像。为了区分dna与rna,用hoechst33342染剂溶液对所有组织进行共染色。hoechst对dna具有很强的亲和力,而不会标记rna。对于hoechst和pi染色的样品,通过排除hoechst信号来确定rna信号。为了标记全封固的玻璃体中的细胞和细胞外蛋白,使用细胞渗透性和电子致密染剂羧基荧光素琥珀酰亚胺酯(cfse,sigmaaldrich),其与细胞内胺共价连接(ikeda等人,“extractionandanalysisofdiagnosticallyusefulproteinsfromformalinfixed,paraffin-embeddedtissuesections,”jhistochemcytochem46:397-403(1998),以及tkach和thery,“communicationbyextracellularvesicles:whereweareandwhereweneedtogo.”cell164:1226-1232(2016),它们据此通过引用整体并入)。将玻璃体组织置于35mm塑料培养皿中,然后将组织浸入1ml稀释于tbs(ph7.4)中的500μmcfse中,并将样品在加湿腔室中在37℃下温育24小时。温育后,除去cfse溶液并将组织置于100mm塑料培养皿中。在室温下将组织在5ml稀释于tbs(ph7.4)中的0.2%(w/v)甘氨酸中洗涤30分钟。接下来,在室温下将组织在10mltbs(ph7.4)中洗涤5分钟,并重复洗涤步骤两次。最后,如所述用hoescht和/或pi对样品进行复染。在用相应的染料染色后,然后将样品安放在定制腔室中,用于在多光子、共聚焦或宽视野荧光显微镜上成像,如下所述。
rna酶原位消化细胞外rna。将玻璃体组织用edc-福尔马林固定,并用2ml含有100μg/mlrna酶a(sigmaaldrich)的rna酶缓冲液(由50mmtris-c1(ph8.0)、10mmedta组成)浸泡,然后在42℃下温育16小时。接下来,除去rna酶溶液,洗涤样品,并用pi染色(如上所述),且用宽视野荧光显微镜成像。
光学显微镜检查、共聚焦显微镜检查和图像处理。在配备有axiocam105彩色相机(zeiss)的nikoneclipse立式e600显微镜(nikon)上捕获彩色亮视野图像,并用zen软件(zeiss,版本4.3)处理图像。将组织安放在60mm玻璃底培养皿(20mm观察区,mattek)上进行荧光成像研究。axioobserverz1倒置显微镜(zeiss)与以下滤光镜套件一起使用:用于hoechst的ziess滤光镜套件49(ziess);用于alexa488、绿色荧光蛋白(gfp)和荧光素的ziess滤光镜套件38(ziess);以及用于pi的ziess滤光镜套件45(ziess)。用zeisslsm880显微镜,使用25x/0.8na镜头进行共聚焦成像。使用imagej软件捕获和处理图像。
多光子成像。如上所述解剖牛眼,并将玻璃体切成大约1cmx1cm的切片。如所述,用edc-福尔马林或仅福尔马林固定组织。如上所述,用hoechst、pi和/或csfe标记dna、rna和/或蛋白。将全封固的玻璃体组织安放在由硅酮和玻璃盖玻片制成的专用腔室上,并放置在该腔室的顶部。将盖玻片浸入1ml的1xtbs中,然后使用mpm(olympusfv1000mpe,使用专用25x/1.05na水浸物镜,weill-cornellmedicineimagingcorefacility)成像。然后在扇区中对玻璃体成像。捕获图像,组装z-堆叠,并构建二维重建(fiji软件(schneider等人,“nihimagetoimagej:25yearsofimageanalysis,”natmethods9:671-675(2012),其据此通过引用整体并入)和imaris软件(bitplane),每个玻璃体成像6个区域,n=3)。针对细胞外蛋白的染色,分析数据。对ev和玻璃体细胞进行测量并计数。
界定玻璃体细胞和细胞外血管。目标是鉴定玻璃体组织中的细胞外囊泡(ev)和细胞外rna。为此,通过以下方法区分玻璃体细胞(假定的透明细胞(hyalocyte))和ev。如上所述,获得用hoechst和cfse共染色的edc-福尔马林固定的牛玻璃体的多光子或共聚焦图像。使用这些图像,通过使用hoechst信号鉴定细胞核来鉴定玻璃体细胞,然后通过使用cfse信号来鉴定细胞体。然后使用imagej软件从超过100个细胞直径(n=3个生物样品,每个样品6个图像帧)测量细胞体的直径(schneider等人,“nihimagetoimagej:25yearsofimageanalysis,”natmethods9:671-675(2012),其据此通过引用整体并入)。计算玻璃体细胞体平均直径和标准偏差(sd),并以图表方式呈现数据。据发现,平均玻璃体细胞大小为10.5μm±1.77μm并且呈正态分布。因此,高于平均值(14μm)的2sd的上限直径将涵盖大约97.5%的细胞。因此,在imagej软件中,绘制了以细胞核为中心的14μm圆,并将该圆内的阳性信号视为细胞内蛋白。将该14μm圆外的信号视为是细胞外的。由两名独立的不知情的研究助理来对ev计数。ev计数的标准包括圆形,位于细胞半径之外,以及大小比100nm大而比细胞小。通过将每帧计数的ev数量除以帧中的细胞数量来对数据进行归一化。数据以图表方式表示。还使用类似技术测量牛玻璃体ev的大小(n=4,和3个生物学重复)。
玻璃体液、房水和眼部组织的电子显微镜检查。如上获得人或牛玻璃体组织。用低速离心清除样品中的细胞,用h和e染色及成像来测试全封固的样本,如下所述。对于玻璃体,取2μl移到方块上并在2.5%戊二醛、4%多聚甲醛、0.02%苦味酸于0.1m二甲胂酸钠缓冲液中的溶液中固定,且在室温下温育60分钟(raposo等人,“blymphocytessecreteantigen15presentingvesicles,”jexpmed183:1161-1172(1996),其据此通过引用整体并入)。在室温下用过量体积的缓冲液(ph7.3)洗涤样本各5分钟。将样品用1%oso4-1.5%铁氰化钾(水溶液)在室温下后固定60分钟(griffith和hay,“epithelial-mesenchymaltransformationduringpalatalfusion:carboxyfluoresceintracescellsatlightandelectronmicroscopiclevels,”development116:1087-1099(1992),其据此通过引用整体并入本文)。在室温下将样品用缓冲液洗涤3次,每次5分钟。将样品整体放置并在室温下用1.5%乙酸双氧铀染色60分钟。样品通过梯度乙醇系列脱水并通过乙腈转化。将样本浸润并包埋在embed812树脂(electronmicroscopysciences)中。在leicaultracutt超微切片机(leicamicrosystems)上使用diatome金刚石刀(diatome)切割60-65nm的组织切片。将切片用柠檬酸铅进行对比(dragovic等人,“sizingandphenotypingofcellularvesiclesusingnanoparticletrackinganalysis,”nanomedicine7:780-788(2011),其据此通过引用整体并入),并在100kv下运行的jem1400电子显微镜(jeol,usa,inc)上观察。在veleta2kx2kccd相机(olympus-sis)上捕获数字图像。记录电子显微镜图像并使用imagej软件分析大小和频率。
对于tem,在超速离心后获得来自人或牛玻璃体的细胞外囊泡的全封固样本的可视化,将细胞外囊泡重新悬浮在甲醛中,装载在formwar/碳包覆的em网格上,在1%戊二醛中后固定,并在2%乙酸双氧铀(ph7)和2%甲基纤维素/0.4%乙酸双氧铀(ph4)或吖啶橙或cfse中相继对比。
细胞外囊泡分离和纯化。改编从液体中分离细胞外囊泡的方法(vanderpol等人,“recentdevelopmentsinthenomenclature,presence,isolation,detectionandclinicalimpactofextracellularvesicles,”.jthrombhaemost14:48-56(2016),其据此通过引用整体并入)。对于该研究,目标是使玻璃体样本不含细胞。因此,将玻璃体通过一系列低速离心清除。将大约8ml玻璃体置于15ml管中,并在4℃下在sorvalllegendrt吊篮(sorvall)中以2,000g2500rpm)离心30分钟。然后将上清液转移到新的15ml管中。然后重复离心步骤。然后将上清液转移到新的管中,并在4℃下在sorvallrc-58离心机(sorvall)中使用ss-34转头(dupont)以10,000g离心30分钟。对于玻璃体液或房水的每个等分试样,进行全封固苏木精和伊红染色(h和e)以研究细胞,如下所述(图11)。然后对全封固的载玻片成像,并进一步处理所有无细胞样品。然后转移上清液并重复该步骤。将样品转移到超速离心管(beckman)和吊篮式转头(sw-41,beckman)中,并在4℃下在l7-55超速离心机(beckman)中以100,000g离心1小时。将上清液转移到新的管中。重复该步骤。使样品重新悬浮在50μl无菌磷酸盐缓冲盐水(pbs,ph7.5)中并置于硅化管中。立即处理用于成像的样品,并将剩余样品在-80℃下冷冻。
玻璃体组织化学染色以确认样品无细胞。为了优化玻璃体ev分离技术,在低速离心后施加组织化学染剂以排除被细胞污染的玻璃体样品。如上解剖并收集玻璃体样品。通过将离心后的玻璃体全封固到载玻片上,然后用苏木精和曙红(h和e)对样本进行组织化学染色来确认无细胞。将大约1ml玻璃体上清液置于superfrostplus载玻片(thermofisherscientific)上,然后在腔室内在4℃下干燥16小时。将干燥的载玻片用5ml1xtbs在室温下漂洗3分钟,然后再次洗涤。然后使用标准程序,用h和e对载玻片进行染色。安放盖玻片以保护载玻片,然后密封。如下所述用光学显微镜分析样品。使含有经苏木精染色的细胞的样品接受重复离心或将之丢弃。因此,用于进一步实验的所有细胞外级分都没有污染性玻璃体细胞。
纳米粒子跟踪分析。使用nanosightns300系统(malvem)进行纳米粒子跟踪分析,以表征溶液中30-800nm的粒子。将从牛玻璃体分离的细胞外囊泡重新悬在100μl磷酸盐缓冲盐水(pbs,ph7.0)中,浓度为每毫升约2.5μg蛋白,然后将样品在pbs中稀释到2ml的最终体积用于分析。装载粒子,将相机聚焦,捕获5个视频,每个60秒。记录视频,然后使用nanosight软件(版本3.0)进行分析,以确定ev的大小分布和粒子浓度。创建图表。跟踪帧间每个粒子的布朗运动(brownianmotion),从而最终允许通过应用斯托克斯-爱因斯坦方程(stokes-einsteinequation)计算大小。
从福尔马林固定的组织中分离细胞外囊泡。将如上所述显微解剖的全牛玻璃体置于50ml锥形管中,然后浸没在10ml稀释于tbs(ph7.4)中的4%福尔马林中,并在4℃下温育24小时。固定后,将组织在冰上解剖成大约1cmx1cm的切片,并记录玻璃体切片的重量。然后将组织置于15ml离心管中。将组织浸入250μl的tbs中,将样品和上覆的洗涤缓冲液(或上清液)在37℃下温育30分钟、1小时、3小时、6小时和24小时(n=3)。收集玻璃体组织和上清液并置于单独的1.5ml管中用于进一步的蛋白研究。对于福尔马林固定的玻璃体组织,将样本在4℃下匀化,然后在等体积的np-40裂解缓冲液中裂解。将裂解物转移到1.5ml管中,在4℃下以12,000g离心15分钟。将水相转移到无白色团块的新管中。通过在4℃下以12,000g离心15分钟收集蛋白团块,并除去上清液。然后将团块溶解在30μl水中并用于western印迹。对于上清液,通过在4℃下以12,000g离心15分钟来清除样品中的细胞碎片。收集蛋白上清液,用等体积的np-40裂解缓冲液裂解。裂解物用于western印迹。
western印迹。在指定的时间和温度下温育后收集玻璃体组织或玻璃体上清液(250μl)。将玻璃体上清液在4℃下以12,000g离心30分钟而预清除,然后在缓冲液(50mmtrisph8.0、250mmnacl、0.5%np-40、蛋白酶抑制剂,sigmaaldrich)中裂解。在sds-page凝胶上分离来自每个样品的等量蛋白(通过bio-rad蛋白测定法测定),转移到蛋白印迹膜(hybond,amershamgehealthcare)上,并按照标准程序进行印迹。使用的一抗包括:兔单克隆抗tsg101(systemsbioscience)。用二抗irdye680lt山羊抗兔(li-corinc.)对单克隆抗体进行印迹,然后根据制造商的推荐用荧光成像系统(odysseyclx,li-cor)检测。
玻璃体中外来体标记蛋白的免疫组织化学。对全封固的4%福尔马林固定的牛玻璃体进行免疫组织化学。为了防止福尔马林交联逆转并因而降低ev丢失率,除了显微镜成像外,实验持续期间所有操作都在4℃下进行。将牛玻璃体切成大约1cmx1cm的片,然后在4℃下将样本在5ml冰冷的tbs(ph7.4)中冲洗3分钟。洗涤步骤重复两次。然后用解剖显微镜(szx-16olympus)检查样本以除去可能污染的组织。然后在4℃下将样品浸入500μl封闭缓冲液(稀释于tbs中的10%山羊血清)中1小时。在4℃下将样品在5mltbs中短暂洗涤3分钟。在4℃下使用tsg-101的抗体(systembiosciences,1∶500稀释)对牛玻璃体进行免疫染色过夜。在4℃下将样品在5mltbs中洗涤3分钟。洗涤步骤重复两次。使用与alexafluor488(abcam)缀合的二抗即山羊抗兔igg使ihc染色可视化。将样品洗涤三次。用hoechst染剂(如上所述)对牛玻璃体进行复染以标记细胞核,然后在5mltbs中在4℃下洗涤两次,每次5分钟。然后立即对玻璃体成像并记录显微照片。对于阴性对照,用正常山羊血清(1∶1000稀释)代替一抗(仅二抗)。使用western印迹证实了抗体为tsg101特异性的,并观察到预期的45kd蛋白条带。
玻璃体蛋白组分析。使用上述方案清除牛玻璃体样品中的细胞,并且如上所述,通过全封固的h和e染色以及随后成像来确定全封固样品是无细胞的。然后选择不含细胞的样品用于蛋白组学分析。使来自细胞外囊泡级分或无细胞的玻璃体级分的蛋白在8m尿素中变性,并且在用碘乙酰胺(sigmaaldrich)烷基化之前用二硫苏糖醇(sigmaaldrich)还原半胱氨酸。用lysc(wakochemicals),接着用胰蛋白酶(promega)消化蛋白,并用emporec18stagetips(3m)脱盐(skog等人,“glioblastomamicrovesiclestransportrnaandproteinsthatpromotetumourgrowthandprovidediagnosticbiomarkers”natcellbiol10:1470-1476(2008),其据此通过引用整体并入)。进样1μg总蛋白用于纳米-lc-ms/ms分析(q-exactiveplus,thermoscientific)。使用12cmx75μmc18柱(nikkyotechnosco.,ltd.japan)以200nl/min的流量分离肽,以5-40%的梯度历时160分钟(缓冲液a:0.1%甲酸,缓冲液b:在乙腈中的0.1%甲酸)。q-exactiveplus以数据依赖模式,采用前20的方法运行。通过以下方式分析纳米-lc-ms/ms数据:使用maxquant(版本1.5)和perseus软件(版本1.4)(tyanova等人,“theperseuscomputationalplatformforcomprehensiveanalysisof(prote)omicsdata,”natmethods13(9):731-740(2016),其据此通过引用整体并入本文),搜索uniprotbostaurus数据库(7月14日下载),允许蛋氨酸氧化和蛋白n端乙酰化,以及在肽和蛋白水平上以1%错误发现率过滤。使用ibaq值对蛋白定量。比较玻璃体细胞外囊泡级分与无细胞的玻璃体级分之间的蛋白富集。
细胞培养。将人视网膜色素上皮细胞arpe-19(atcc)在补充有10%胎牛血清、青霉素和链霉素的dmem:f12培养基(thermofisherscientific)中培养。将所有细胞在37℃、95%空气和5%co2下温育,并使用标准无菌技术维持。
将重组蛋白装载到ev中。如上所述获得牛玻璃体ev并测量总蛋白浓度(piercetmbca蛋白测定试剂盒,thermofisherscientific)。将4μg玻璃体ev用于体外处理,将0.025μg牛玻璃体ev连同以下浓度的bsa-荧光素(3μg、1μg和0.5μg)或gfp(0.25μg、0.5μg和1μg)一起用于体内注射。将重组蛋白和ev在300μl电穿孔缓冲液(biorad)中混合,并在4mm比色杯中进行电穿孔。在以下条件下使用方波程序对ev进行电穿孔;电压为300v,脉冲时长为35ms,脉冲数为2且脉冲间隔为0.1秒。对于体外实验,将100μl电穿孔后的溶液添加到300μl温热培养基中,并将溶液转移到12孔板的每个孔中(n=3),在该板上apre-19细胞以70%的汇合度接种。将培养物温育24小时,然后将培养基替换为完全培养基。用4%多聚甲醛固定细胞,并在处理后48小时成像。对于体内研究,在300μl电穿孔缓冲液(biorad)中进行电穿孔,并在4mm比色皿中在300v下进行电穿孔。将样品在重新悬浮于5倍体积的平衡盐溶液中后脱盐,然后用离心尺寸排阻过滤器(amicon,milliporesigma)浓缩。在平衡盐溶液(bss)中的重新悬浮体积为75μl并且每次注射使用0.5μl。
向经培养的细胞体外施加ev。分离牛玻璃体ev或死后人玻璃体ev,并如上所述经由电穿孔为其装载重组蛋白。在12孔板上培养arpe-19细胞,在ev处理时汇合度为约70%。然后,将100μl经电穿孔的ev溶液添加到1ml完全培养基中。将细胞在标准培养条件下温育16小时,然后除去培养基并用完全培养基替换。在处理后48小时,除去细胞培养基并将培养物浸入1mlhoechst染剂中且在37℃下温育15分钟。除去染剂并用2ml磷酸盐缓冲盐水洗涤细胞,且在室温下用2ml稀释于pbs中的4%福尔马林固定10分钟。用2mlpbs洗涤细胞5分钟。重复洗涤两次。使用宽视野荧光显微镜术评价细胞的转染效率。
体内注射玻璃体ev。所有程序均按照nih指南进行,并得到威尔康奈尔医学院的实验动物管理和使用委员会(iacuc)批准。将雄性6周龄c57bl/6j小鼠(jacksonlabs)在威尔康奈尔医学院的研究动物资源中心(rarc)维持在12小时光照/黑暗循环下。在所有实验变量(n≥3)中,小鼠眼睛的玻璃体内注射均在8周龄时进行。根据nih动物福利指南,用氯胺酮和甲苯噻嗪混合物使动物镇静。用1滴2.5%去氧肾上腺素、1滴1%托品酰胺使瞳孔扩大,然后施加润滑眼膏。15分钟后,准备为动物注射。用棉签去除眼膏并用10滴1xtbs冲洗眼睛。在立体解剖显微镜(olympusszx50)下,通过将32号针头定位在角膜缘处,然后从巩膜穿过并进入后房,在眼睛中产生导向轨迹。注意避免破坏晶状体。接下来,取出导向针并将微量注射器(气动皮升微量注射泵(pneumaticpicopump),pv830,worldprecisioninstruments)定位到导向针轨迹中,避开视网膜将玻璃移液管尖端插入后房中。注入500nlev溶液或对照溶液。在注射完成后,在移除玻璃移液管之前保持10秒的间隔。移除玻璃移液管并在玻璃体内注射程序后立即将抗生素眼膏施加至注射的眼睛。然后监测动物麻醉恢复情况,再送回威尔康奈尔医学院的rarc设施。
评价啮齿动物眼睛中玻璃体内注射的ev或对照的生物分布。在注射后第3天、第1周和第2周分析玻璃体内注射的ev的生物分布(n≥3)。根据nih动物福利指南使动物镇静和安乐死。将眼摘出并在4℃下置于5ml在1xtbs中的4%福尔马林中16小时,然后在4℃下浸入5ml稀释于tbs中的0.5m蔗糖中12小时。将组织在oct化合物(tissue-tek)中封固,在cryomold(tissue-tek)中的干冰/乙醇浴中冷冻,立即用低温恒温器(leica3050s,leica)从5至40μm连续切片并安放在superfrostplus载玻片(thermofisherscientific)上。在室温下将样品用1mlhoechst染剂复染15分钟。在室温下将载玻片在5mltbs(ph7.4)中冲洗5分钟。洗涤步骤重复两次。然后添加300μl封固剂并放置盖玻片(vwrinternationalllc)。对于bsa荧光素,用宽视野荧光显微镜术对载玻片成像,对于h和e染色样品,使用亮视野显微镜术对载玻片成像。将未加工的样本或封固的载玻片储存在-80℃下。
房水ev分离。通过穿刺术采集房水。简而言之,将18号针头插入角膜中距角膜缘前方约2mm处,然后将250μl液体移入1ml注射器中。立即将液体转移到1.5ml硅化微量离心管中,并将样品置于冰上。如针对玻璃体ev所述,分离ev。
统计分析。图形可视化、计算使用excel(版本2011,microsoft)进行。除非另有说明,否则所有实验均以n≥3进行。对于纳米粒子跟踪分析,使用斯托克斯-爱因斯坦方程计算粒度、浓度和分布。对于所有研究而言,所有误差条均为标准偏差并且p值<0.05。
实施例1-细胞外囊泡(ev)逃离福尔马林固定的牛玻璃体组织并经1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)-福尔马林固定而保留
本文所述的研究集中于优化组织固定以将ev保留在细胞外间隙中。为了保持组织的组织学和形态结构,常规固定方法采用10%福尔马林来产生蛋白-蛋白交联。固定过程通常涉及在室温下或高于室温的处理步骤或温育;然而,已知高温会逆转福尔马林蛋白-蛋白交联(shi等人,“antigenretrievalinformalin-fixed,paraffin-embeddedtissues:anenhancementmethodforimmunohistochemicalstainingbasedonmicrowaveovenheatingoftissuesections,”jhistochemcytochem39:741-748(1991);ikeda等人,“extractionandanalysisofdiagnosticallyusefulproteinsfromformalin-fixed,paraffin-embeddedtissuesections,”jhistochemcytochem46:397-403(1998),其据此通过引用整体并入)和rna-蛋白交联(pena等人,“mirnainsituhybridizationinformaldehydeandedc-fixedtissues,”natmethods6:139-141(2009),其据此通过引用整体并入)。假设在室温下或高于室温的洗涤步骤期间,纳米级ev从福尔马林固定的组织样本中丢失,如图1a中的示意图所示。为了检查从福尔马林固定的组织中ev丢失的程度,将福尔马林固定的牛玻璃体组织浸入37℃的洗涤缓冲液中持续不同的时间点,然后收集上清液。使用透射电子显微术(tem)对上清液的超微结构内容物进行成像,并且发现大量ev存在于洗涤缓冲液中且早在30分钟时就已经从福尔马林固定的组织中泄漏(图1b-1c)。暴露于4℃以上的温度也导致rna逃逸(pena等人,“mirnainsituhybridizationinformaldehydeandedc-fixedtissues,”natmethods6:139-141(2009),其据此通过引用整体并入),并且可能导致蛋白逃逸。为了将这些纳米级ev永久保留在组织和周围细胞外间隙中,增加了另外的固定步骤,其中水溶性碳二亚胺edc在ev蛋白的带正电荷的氨基侧链与羧基之间产生不可逆的交联。因此,进行了两步固定,其涉及先将样品在福尔马林中固定,然后用edc进行后续交联。在edc-福尔马林固定后,将玻璃体组织置于不同温度的洗涤缓冲液中,并用tem对上清液进行成像(图1d)。在上清液中未检测到ev(图1e)。在edc-福尔马林上清液以及洗涤缓冲液对照中观察到颗粒物(图1f);因此ev并未逃离edc福尔马林固定的组织。为了定量玻璃体组织的ev丢失,使用western印迹检测已知的外来体标记物tsg-101。福尔马林固定的玻璃体的上清液在上清液中显示出大量的tsg-101信号(图1g)。这些数据表明,福尔马林固定的组织将大量ev丢失到洗涤缓冲液中。
实施例2-通过多焦点显微镜术(mpm)成像,与单独的福尔马林固定相比时,edc-福尔马林固定牛玻璃体保留了ev
目标是使正常玻璃体组织的细胞外间隙中的ev的结构关系可视化(图2a),因此将牛玻璃体的常规固定(单独的福尔马林)与edc-福尔马林进行比较,然后尝试在原位使ev可视化。已知ev含有蛋白;因此,在全封固的样品中标记总蛋白,然后用多光子显微镜术成像(图2b-2d)。为了标记蛋白,使用与胺共价连接的细胞渗透性荧光染料,即羧基荧光素琥珀酰亚胺酯(cfse)(bronner-fraser,m.,“alterationsinneuralcrestmigrationbyamonoclonalantibodythataffectscelladhesion,”jcellbiol101:610-617(1985),其据此通过引用整体并入)。据发现,福尔马林固定的组织在玻璃体细胞附近或内部显示出阳性蛋白信号,但未显示出细胞外蛋白信号的迹象(图2a-2b,n=4)。这些数据表明ev不存在于玻璃体组织中或是在处理福尔马林固定的玻璃体样本过程中丢失。相反,edc-福尔马林固定的样品在细胞外基质中显示出大小和形状与ev一致的稳健蛋白信号(图2c-2d)。而且,当与单独的福尔马林相比时,用cfse染色的edc-福尔马林固定的组织始终显示出显著更多的ev(120倍)(图2e,p<0.05)。
通过mpm成像的牛ev在大小上具有多形性,大小范围为约200至6000nm,平均直径为1513.0nm(标准误差708.8nm),模态尺寸为800-1400nm(图2f)。多光子显微镜的分辨率下限限制了分辨小于200nm的ev的能力。
实施例3-用edc-福尔马林固定牛玻璃体将ev和细胞外rna保留在原位
还已知ev含有细胞外rna(valadi等人,“exosome10mediatedtransferofmrnasandmicrornasisanovelmechanismofgeneticexchangebetweencells,”natcellbiol9:654-659(2007),其据此通过引用整体并入),因此力图将玻璃体组织中的细胞外rna可视化。尽管亲和力较低,但用使dna和rna染色的碘化丙啶(pi)标记牛玻璃体核酸(suzuki等人,“dnastainingforfluorescenceandlaserconfocalmicroscopy,”jhistochemcytochem45:49-53(1997),其据此通过引用整体并入)。用共聚焦显微镜术对edc-福尔马林固定的组织成像显示出细胞外rna和细胞外蛋白的阳性信号,但未检测到细胞外dna(图3a-3b)。发现细胞外rna的信号共定位于ev蛋白信号内(图3a),表明细胞外rna在囊泡内。相比之下,用单独的福尔马林固定产生明显更少的细胞外rna和蛋白信号(图3c)。还注意到,与常规固定相比时,在edc-福尔马林固定的组织中在玻璃体细胞的细胞质内保留了明显更多的rna。为了证实细胞外pi信号确实是rna,用rna酶处理edc-福尔马林固定的样品,并注意到细胞外信号显著减少(图4a-4b)。为了确定使用标准荧光显微镜是否可以观察到ev信号的改善,比较了用cfse和pi染色然后用宽视野荧光显微镜捕获的福尔马林和edc-福尔马林固定的玻璃体样品的图像。数据显示edc-福尔马林固定的样品展示出细胞外蛋白和rna的强信号,而福尔马林固定的样品未显示出细胞外蛋白信号(图5a-5b)。总之,这些数据表明对于保留组织中的ev蛋白和细胞外rna,edc福尔马固定优于单独的福尔马林固定。而且,该技术允许人们原位确定玻璃体组织内ev的空间关系。
实施例4-牛和人体玻璃体液含有ev
为了将在得自edc-福尔马林固定的组织的显微照片中观察到的结果与用于使ev可视化的其他方法相关联,用tem研究了玻璃体ev的超微结构(raposo等人,“blymphocytessecreteantigen-presentingvesicles,”jexpmed183:1161-1172(1996),其据此通过引用整体并入)。用乙酸双氧铀和柠檬酸铅对牛玻璃体样本进行负染,并且图像显示出大量在大小上具有多形性的ev(图6a)。接下来,用cfse标记从牛玻璃体分离的ev,cfse是与蛋白胺共价连接的电子致密染料(raposo等人,“blymphocytessecreteantigen-presentingvesicles,”jexpmed183:1161-1172(1996),其据此通过引用整体并入),并且图像显示出丰富的具有致密的囊泡内染色的ev(图6b)。因为已知ev含有rna(valadi等人,“exosome-mediatedtransferofmrnasandmicrornasisanovelmechanismofgeneticexchangebetweencells,”natcellbiol9:654-659(2007),其据此通过引用整体并入),所以在用电子致密的核酸选择性染料即吖啶橙(ao)染色后,对从牛玻璃体分离的ev成像,其在ev内显示出阳性信号(图6c)。用溴化乙锭(另一种电子致密核酸染剂)对全封固的牛玻璃体染色,也在ev内显示出阳性信号(图6d)。为了测定牛玻璃体ev的浓度和大小分布,使用纳米粒子跟踪分析(nta)(dragovic等人,“sizingandphenotypingofcellularvesiclesusingnanoparticletrackinganalysis,”nanomedicine7:780-788(2011),其据此通过引用整体并入),发现细胞外囊泡的浓度为至少2.98x107个粒子/ml(s.e.m±8.98x106个粒子/ml),相当于每只牛眼超过20亿个ev(图6e)。数据显示出不均匀的细胞外囊泡大小,平均值为212nm(s.e.m±10nm),众数为143nm(s.e.m±20.4nm),峰值为125nm和215nm,并且一些细胞外囊泡尺寸高达550nm(图6e)。通过nta测得的ev大小与通过多光子显微镜术观察到的ev大小不同,这可能是基于超速离心的分离方法除去了较大ev的结果(vanderpol等人,“recentdevelopmentsinthenomenclature,presence,isolation,detectionandclinicalimpactofextracellularvesicles,”.jthrombhaemost14:48-56(2016),其据此通过引用整体并入)。为了确定全眼中玻璃体ev的分布,对死后人眼进行了tem,并且在玻璃体基底部和睫状体附近显示出许多高浓度的玻璃体ev(图6f-6g)。从死后的人玻璃体样本中纯化并用ao染色的ev也显示出与ev一致的大小和形状(图6h-6i)。这些数据表明,玻璃体ev确实存在,数量丰富且大小不均匀,并且经cfse和核酸选择性染料阳性染色。
实施例5-正常牛玻璃体中ev特异性蛋白tgs-101的免疫组织化学染色
为了确定玻璃体ev是否表达ev相关蛋白,使用液相色谱质谱法(lc-ms)进行蛋白组学分析,并将牛玻璃体(用低速离心清除了细胞)与ev分离级分进行比较(n=6份牛玻璃体,合并样品)。玻璃体和ev分离级分显示出组合蛋白组学目录中的总共1686种蛋白,在全玻璃体级分或ev级分中分别富含682和464种蛋白,并且对于两者而言有540种蛋白的丰度相似。在下表3中提供了在ev和全玻璃体级分中检测到的1779种蛋白的详细列表。表3的列表通过蛋白名称(第1列)和蛋白标识符(包括其uniprotkb登录号和名称)来标识蛋白。对于表3中列出的每种蛋白,在第5列中列出了相比于无细胞的玻璃体级分而言ev级分中蛋白量的log2差值,其基于通过ev富集级分(第3列)和无细胞玻璃体级分(第4列)中的无标记定量(lfq)强度所定量的蛋白量。在ev级分中富集的蛋白表示为“仅ev级分”(第5列)。蛋白总强度由ibaq值表示(第6列)。
对蛋白组数据的进一步分析表明,几种已知的ev相关蛋白在ev级分中富集,包括tsg-101(代表蛋白丰度的ibaq值为2.30e+05)、cd-9(ibaq值,2.80e+06)、hsp90-β(ibaq值,3.00e+08)和膜联蛋白ii蛋白(ibaq值,9.40e+05),如表1中所示。
表1.与无细胞玻璃体相比时在牛玻璃体ev中存在并富集的外来体标记蛋白。
*tsg101=肿瘤易感基因101;
**表1的参考文献,它们据此通过引用整体并入:
1.conde-vancells,j.etal.jproteomeres7,5157-5166(2008).
2.thery,c.etal.jcellbiol147,599-610(1999).
3.vlassov,a.etal..biochimbiophysacta1820,940-948(2012).
4.higashiyama,s.etal.jcellbiol128,929-938(1995).
5.keerthikumar,s.etal.jmolbiol428,688-692(2016).
该分析还表明,与无细胞的玻璃体级分相比,ev中还富含几种眼特异性蛋白。下表2中列出了这些眼特异性蛋白。
表2:牛玻璃体ev中富含的眼特异性蛋白
表2的参考文献,它们据此通过引用整体并入
1.saarijc,bredbergdl.jbiolchem262,7618-7622(1987).
2.crabbetal.,proteinsci7.746-757(1998).
3.mawetal.,natgenet17,198-200(1997).
4.wheatleyetal.,archophthalmol113,103-109(1996).
5.faivreetal.,jmedgenet40,34-36(2003).
6.hubmacheretal.,investophthalmolvissci55,7934-7944(2014).
7.friedmanetal.,hummolgenet11,1333-1342(2002).
8.reardonetal.,jbiolchem275,2123-2129(2000).
9.sakumaetal.,gene224,87-95(1998).
10.lietal.,jbiolchem288,11395-11406(2013).
11.denhollanderetal,.investophthalmolvissci50,1864-1872(2009).
12.merdesetal.,jcellbiol123,1507-1516(1993).
13.carteretal.,biochembiophysrescommun270,432-436(2000).
14.yamamotoetal.,natgenet22,188-191(1999).
15.lidenetal.,.jbiolchem276,49251-49257(2001).
16.stoneetal.,nengljmed351,346-353(2004).
17.shenetal.,biochemistry33,13117-13125(1994).
18.morimuraetal.,natgenet23,393-394(1999).
19.nicolettietal.,.hummolgenetic4,641-649(1995).
20.moiseyevetal.,procnatlacadsci102,12413-12418(2005).
21.waldetal.,science111,179-181(1950).
22.dryjaetal.,nature343,354-366(1990).
23.dryjaetal.,.nengjmed323,1302-1307(1990).
为了证实在edc-福尔马林固定的玻璃体中观察到的蛋白信号确实是ev,进行了免疫组织化学(ihc)以使已知外来体蛋白tsg-101的分布原位可视化。edc-福尔马林固定组织与ihc染色不相容。而且,当在室温下进行实验时,在福尔马林固定的组织中无法可靠地检测到tsg-101信号,这可能是因为ev丢失到洗涤缓冲液中。然而,已知福尔马林交联的逆转具有温度依赖性(ikeda等人,“extractionandanalysisofdiagnosticallyusefulproteinsfromformalin-fixed,paraffin-embeddedtissuesections,”jhistochemcytochem46:397-403(1998),其据此通过引用整体并入),并且逆转在越冷的温度下以越慢的速率发生。因此,对于除了成像以外的所有处理步骤,均在4℃下对福尔马林固定的牛玻璃体样本进行ihc。ihc在细胞外间隙中显示出大量的点状tsg-101阳性信号(图7a),与用cfse染色的经edc-福尔马林固定的组织中的ev空间分布一致(图2c)。特异性对照未显示出细胞外信号(图7b)。据发现,在玻璃体细胞外间隙中发现tsg-101的可能性比在玻璃体细胞体内高136倍(图7c)。福尔马林固定的ihc样品也使用pi对rna进行共染,但是无法检测到细胞外rna(图7d),进一步表明edc-福尔马林固定对于保留ev相关rna是必需的。这些数据证明,玻璃体ev含有ev蛋白标记物,并且可以在低温条件下用ihc成像。
实施例6-玻璃体ev将内源性rna重组牛血清白蛋白(bsa)和绿色荧光蛋白(gfp)转移到培养的细胞中
研究了玻璃体ev是否具有与已知会将其rna和蛋白货物转移到靶细胞中的其他ev相似的生物活性。早期研究表明,在体外ev将mrna和微rna携带到细胞中(valadi等人,“exosomemediatedtransferofmrnasandmicrornasisanovelmechanismofgeneticexchangebetweencells,”natcellbiol9:654-659(2007);skog等人,“glioblastomamicrovesiclestransportrnaandproteinsthatpromotetumourgrowthandprovidediagnosticbiomarkers”natcellbiol10:1470-1476(2008),它们据此通过引用整体并入)。因此,测试了牛和死后人玻璃体ev将其内源性rna转移到培养的细胞中的能力。用ao荧光染料标记牛或人玻璃体evrna,纯化ev级分(图8a-8b),并将视网膜色素上皮细胞(arpe-19)暴露于大剂量的经标记的ev。对于牛ev-rna,在48小时时在培养的arpe-19细胞中观察到高达96.2%±01.9%的转染率(图9a-9c),其明显高于对照。也成功转染了人胚肾细胞(图9d-9f)。分离的死后人玻璃体ev也能够在24小时时在arpe-19细胞中以96%±3.8%转移标记的ev-rna,与对照相比明显更高(图9g-9i)。
还已知ev是能够将重组蛋白递送至靶细胞的载体。因此,将与荧光团(荧光素)缀合的牛血清白蛋白(bsa,66kd蛋白)经由在300v下的电渗透而装载到3μg牛玻璃体ev中,再次纯化装载有bsa-荧光素的ev,然后用载体处理经培养的arpe-19细胞。据观察,对于3μg、1μg和0.5μg的bsa-荧光素浓度而言,细胞分别转染97.6%±0.85%、95.3%±2.428%和88.9%±1.745%。对照,即单独的pbs或未经电穿孔的与bsa-荧光素混合的ev,未导致arpe-19细胞转染(图10a-10c),并且这些组与试验组存在显著性差异(p<0.05,n=3)。这些对照数据证明ev载体是arpe-19细胞摄取bsa-荧光素所必需的。为了评价玻璃体ev是否能够转染功能蛋白,功能蛋白必须保持其构象状态才能发荧光,将重组绿色荧光蛋白(gfp)装载到3μg玻璃体ev中。数据显示,对于0.25μg、0.5μg和1μg的gfp浓度而言,arpe-19细胞分别转染88.3%±4.2%、81.4%±4.8%和72.9%±3.9%(图10d-10f)。对照未显示信号,显著低于试验组(p<0.05,n=3)。这些数据表明,玻璃体ev能够在体外将其内源性rna以及外源性重组蛋白转移到细胞中。
牛玻璃体和房水ev能够将其内源性蛋白和rna转移到除眼部细胞之外的人类细胞,诸如皮肤细胞中。标记牛玻璃体ev内源性rna和内源性蛋白并以高效率转移到人皮肤细胞中,如图17a-17l所示。在对照条件下未观察到转移(图17m-17r)。这些数据表明,玻璃体ev具有广泛的趋向性,并且可以在多种多样的条件下用作全身的治疗性递送载体。
实施例7-在体内牛玻璃体ev靶向视网膜并递送重组蛋白
试图验证体内玻璃体ev转染效率并确定眼中的靶细胞。通过玻璃体内注射(用于眼内递送的常用技术)将稀释量的经由电穿孔载有0.5μgbsa-荧光素的ev(0.025μg)施用于啮齿动物眼睛。在治疗后第3天,ev未显示出穿过视网膜的迹象并且没有穿透内界膜(图11a)。在注射三周后,注意到在多个视网膜细胞层的细胞中的转染(图11b-11d)。对于特异性对照,用单独的pbs或未经电渗透的与bsa-荧光素混合的ev样品没有观察到转染的迹象。总之,这些数据表明玻璃体ev具有生物活性并且起到在体内递送重组蛋白的载体的作用。而且,玻璃体ev靶向视网膜细胞并维持持续转染长达3周。
实施例8-在体内牛玻璃体ev靶向角膜、睫状体和视网膜以递送重组蛋白
将通过电穿孔(300v)载有与荧光素缀合的重组牛血清白蛋白(bsa)(bsa-荧光素)的牛ev注射到小鼠眼睛中。在注射3周后,检查了小鼠眼切片中的bsa-荧光素递送情况,并在角膜中观察到从内皮细胞和角膜细胞的递送,如图12a的显微照片所示。注射3周后来自未进行电穿孔(0v)的与bsa-荧光素混合的牛ev的对照组的图像显示在内皮细胞和角膜细胞中都没有表达,但确实显示了角膜上皮的非特异性染色(图12b)。图12c是在注射通过电穿孔(300v)而载有bsa-荧光素的ev3周后来自小鼠眼睛的代表性共聚焦荧光显微照片,其显示出睫状体中非色素睫状上皮细胞中的信号。图12d的图像显示bsa-荧光素在光感受器、内网层(ipl)、视网膜色素上皮(rpe)细胞和脉络膜中的稳健表达。所有组织切片中的细胞核均用hoechst蓝染色,并且它们显示在图12a-12d中。合并的图像显示在图12a-12d最左侧的图中。图12e的图像显示bsa-荧光素在视网膜色素上皮细胞(rpe)和脉络膜中的表达。
实施例9-载有荧光标记的sirna的牛玻璃体囊泡体高效转染进人视网膜色素上皮细胞中
为了确定玻璃体囊泡体是否能够用外源性小干扰rna修饰,使用电穿孔将与花青3缀合的抗gapdhsirna引入囊泡体中。将arpe-19细胞暴露于在各种电穿孔电压下装载到囊泡体中的抗gapdhsirna-cy3,据发现,载有sirna的囊泡在越高的电压下以越高的效率转染细胞(图13a-13c)且在越低的电压下以越低的效率转染细胞(图13d-13f),并且在没有电穿孔的情况下无法检测到(图13g-13h)。图13i是按电穿孔电压显示转染效率的图表。
实施例10-牛睫状体非色素上皮产生丰富的释放到细胞内间隙中的囊泡体
接下来力图鉴定眼内液囊泡体的来源。假设囊泡体在睫状体中产生,原因是:1)玻璃体液胶原原纤维在玻璃体基底部附近的浓度最高,玻璃体基底部位于晶状体后面并与睫状体并置;以及2)已知睫状体具有高表面积并产生房水。因此,对用乙酸双氧铀染色的牛睫状体的组织切片进行tem,并且在非色素上皮中发现出芽囊泡进入细胞间隙内(图14a-14d)。在色素上皮中未观察到囊泡体出芽(图14e)。这些数据表明睫状体至少部分地为眼内囊泡体的来源。
实施例11-牛玻璃体囊泡体在不同电压下在人视网膜色素上皮细胞中高效递送蛋白
如上所述,牛囊泡体含有不同的蛋白组。有人认为这些囊泡可以装载外源性蛋白,并用作将蛋白递送至靶细胞的工具。因此,研究了玻璃体囊泡体是否能够用外源性蛋白修饰。在多种电压下使用电穿孔将与荧光素缀合的牛血清白蛋白(bsa荧光素)引入囊泡体中,并将arpe-19细胞暴露于载有bsa-荧光素的囊泡。据发现,当使用350v(图15a-15c)装载蛋白时,与使用100v装载蛋白时相比,载有bsa荧光素的囊泡以明显更高的效率转染arpe-19细胞(图15d-15f)。在没有电穿孔的情况下未观察到转染(图15g-15h)。
实施例12-牛房水含有丰富的囊泡体
高水平的玻璃体囊泡体导致了这样的假设:囊泡体也可能位于眼前房的房水中。因此,用tem成像检查房水并且发现了广泛的囊泡体分布(图16a-16c)。分离囊泡体级分,并用纳米粒子跟踪分析测定囊泡体大小和浓度,其显示浓度为至少1.10x108个粒子/ml(图16e,s.e.m±9.25x107个粒子/ml,n=10)并且每只眼每毫升总共2.7x108个粒子(图16e,n=10),平均大小为155nm(s.e.m±27.9nm)且众数为88.7nm(s.e.m±34.1nm)。有趣的是,房水中的囊泡体大小分布明显小于玻璃体囊泡体。
实施例讨论
总的来说,基于常规福尔马林固定的技术导致大量的ev从哺乳动物组织中逃逸,这导致原位ev可视化的不一致或阴性结果。然而,edc-福尔马林固定显著改善了组织中ev的保留并且可实现稳健的原位ev成像。该方法阐明了眼睛正常玻璃体液中之前未鉴定的ev网络,这种组织长期以来被认为几乎没有生物功能。而且,本文呈现的数据证明,可以将玻璃体ev作为载体进行操纵,以在体外和体内递送重组蛋白和核酸分子。总之,该方法为研究正常或疾病组织样本中ev的结构和功能开辟了新的可能性,所述疾病包括被认为是由ev介导的各种疾病,诸如眼科疾病、神经障碍和癌症。
虽然本文已经详细地描绘和描述了优选的实施方案,但是对于相关领域的技术人员来说显而易见的是,在不脱离本发明的精神的前提下可以进行各种修改、添加、替换等,并因此将它们视为在如权利要求书所限定的本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!