细胞测定方法与流程
本发明涉及一种细胞量的测定方法。
背景技术:
在针对上皮恶性肿瘤(epithelialmalignanttumor)或肉瘤(sarcoma)等的抗癌剂的敏感性试验中,通过将与抗癌剂接触的癌细胞和不与抗癌剂接触的癌细胞在相同条件下进行培养,将培养后的癌细胞的增殖度进行比较,来评价癌细胞对抗癌剂的敏感性。期待癌细胞的增殖越少、抗癌效果越高的抗癌剂。
关于癌细胞的培养法,专利文献1~专利文献5中记载有将癌细胞包埋于胶原凝胶中来培养的方法。已知所述胶原凝胶包埋培养法与在琼脂等的表面培养癌细胞的表面培养法相比,所述胶原凝胶包埋培养法的癌细胞增殖较为良好。
关于培养癌细胞的定量方法,专利文献1中记载有如下方法:利用tv照相机等来拍摄增殖的癌细胞,对所获得的图像信息进行电子性图像分析,算出癌细胞菌落的推定体积值。另外,专利文献3中记载有如下方法:将在胶原凝胶内培养的癌细胞以色素染色来拍摄,基于图像浓度来定量癌细胞。
现有技术文献
专利文献
专利文献1:日本专利特开平3-285696号公报
专利文献2:国际公开第95/18216号
专利文献3:日本专利特开平10-115612号公报
专利文献4:日本专利第3363445号公报
专利文献5:日本专利特开2008-11797号公报
技术实现要素:
发明所要解决的问题
专利文献1或专利文献3中记载的癌细胞的定量方法中,存在定量准确度不足的问题。一直以来抗癌剂的敏感性试验是从癌症患者体内摘除的外科手术材料作为起始材料来进行。另一方面,对于手术适应外而未能获得外科手术材料的进行再发症例、或近年来增加的术前化学疗法作为对象,使用穿刺针等来采集细胞的活检材料作为起始材料的抗癌剂敏感性试验的需求提高。但是,活检材料中,与手术材料相比,可采集的组织片小,在抗癌剂敏感性试验中,要求在现有的十分之一以下的细胞量下准确性良好地定量。专利文献1或专利文献3中,如此少量的癌细胞难以达到准确性良好地定量。
另外,癌细胞与纤维母细胞的混淆,为损及定量准确度的原因之一。其原因在于,纤维母细胞与癌细胞一并被色素染色。专利文献1中记载:通过图像分析,根据其形状及图像的浓淡来区分癌细胞与纤维母细胞。专利文献3中记载:利用纤维母细胞与癌细胞相比而言极其难以染色的特性,根据图像浓度来区分两者。但是,即便使用这些方法,在两者密集混合的情况下仍存在无法准确良好地判别的情况。
本发明是为了解决上述问题,提供一种定量准确度更高的细胞测定方法。
解决问题的技术手段
本发明的细胞测定方法包括:将靶细胞色素染色的工序;获取所述靶细胞图像的图像获取工序;通过对所述图像进行多阶段二值化处理来判别所述靶细胞与夹杂细胞的判别工序;基于所述判别工序的结果,自所述图像中将所述夹杂细胞的杂讯排除的工序;以及通过将排除了所述夹杂细胞图像的细胞量的指标进行积算来评价所述靶细胞量的工序。
此处,所谓靶细胞是指所欲测定的细胞。另外,所谓多阶段二值化处理,是指使阈值变化同时进行多次的二值化处理。另外,所谓杂讯是指并非因染色的靶细胞而来的,不必要的图像信息。另外,所谓细胞量的指标,是指图像的浓淡、或根据图像的浓淡来算出的吸光度等与细胞的多寡对应而增减的指标。通过所述方法,可排除由夹杂细胞引起的杂讯的影响,从而准确良好地测定细胞量。
优选为,所述判别工序包含如下工序:通过在既定的基准差以上不同的两个阈值进行两次的二值化处理中,岛状部分为大致圆形,则当所述两个阈值之间不论阈值的大小,均可推定所述岛状部分为大致圆形时,判断所述岛状部分为大致球形的细胞。
进而优选为,所述判别工序包含如下工序:通过在既定的基准差以上不同的两个阈值进行两次的二值化处理中,岛状部分的轮廓中圆弧所占的比例为既定的值以上,则两个阈值之间不论阈值的大小,均可推定所述岛状部分的轮廓中圆弧所占的比例为所述既定的值以上时,判断所述岛状部分为大致球形的细胞的集合。
所述判别工序优选为使阈值依次增加或减少,同时进行二值化处理。
所述靶细胞优选为癌细胞,所述夹杂细胞优选为纤维母细胞。
所述靶细胞优选为经三维培养的细胞,所述细胞更优选为包埋于胶原凝胶中来培养的细胞。
所述图像可为拍摄靶细胞而成的透射图像的明度图像。所述情况下,所述阈值为明度值。或者优选为,所述图像可为以拍摄靶细胞而成的透射图像为基础的吸光度图像。此处,所谓吸光度图像是指将明度图像的各像素的明度值换算为吸光度而量子化的图像。所述情况下,所述阈值为经量子化的吸光度。
所述细胞量的指标优选为吸光度,靶细胞量的评价优选为通过算出靶细胞的推定体积值来进行。
所述图像获取工序优选为包含以下工序:获取以对于所述色素的吸光度不同的第一光及第二光的透射图像为基础的第一图像及第二图像的工序;以及将所述第一图像及所述第二图像分别分割为多个分割区域,在每个所述分割区域将所述第一图像与所述第二图像进行比较,获取排除了杂讯的第一杂讯去除图像的工序。此处,所谓图像的分割区域是指图像上的包含一个以上的像素的区域。
优选为,所述第一图像及所述第二图像同时照射所述第一光及所述第二光,利用一台彩色照相机拍摄而成的透射图像为基础来获取。
或者优选为,所述第一图像及所述第二图像通过依次照射所述第一光与所述第二光,利用一台照相机每次拍摄而获得的透射图像为基础来获取。
发明的效果
通过本发明的细胞测定方法,即便相对于夹杂细胞或垃圾等杂讯成分而言,靶细胞相对为少量,也可准确良好地评价细胞量。尤其是在靶细胞与夹杂细胞密集混合存在的情况下,也可准确良好地判别两者,可准确良好地评价靶细胞量。
附图说明
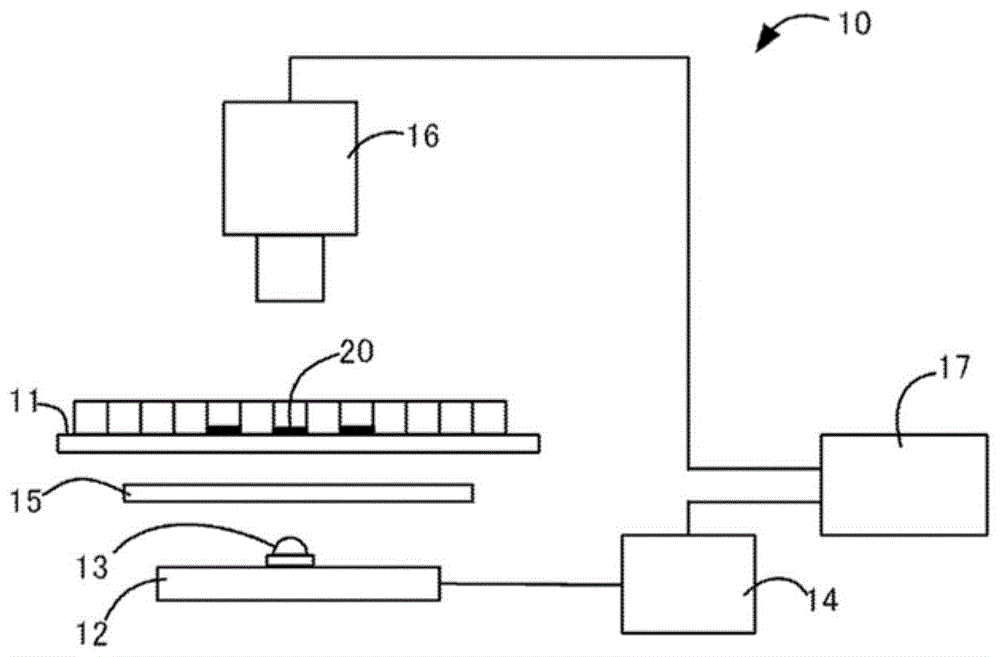
[图1]是表示本发明的第一实施方式中所使用的细胞测定装置的构成例的图。
[图2]是本发明的第一实施方式的癌细胞定量方法的流程图。
[图3]是用以对图像的明度进行说明的图。
[图4]是用以对利用本发明的第一实施方式的癌细胞定量方法所获得的原图像进行说明的图。
[图5]为中性红的吸收光谱。
[图6]为实验例中将癌细胞定量的试样的原图像。
[图7]为实验例中将癌细胞定量的试样的原图像。
[图8]是对图像上的岛状部分是否为大致圆形的判断方法进行说明的图。
[图9]是用以对互相重合的细胞的多阶段二值化处理进行说明的图。
[图10]是对球形细胞的集合即岛状部分的多阶段二值化处理进行说明的图。
[图11]是对球形细胞的集合即岛状部分的多阶段二值化处理进行说明的图。
[图12]为实施例的原图像(a)与吸光度图像的二值化图像(b)。
[图13]是表示实施例中的对于不同阈值的二值化处理的结果的图。
[图14]是表示实施例中岛状部分的轮廓中所占的圆弧的图。
[图15]是用以对多阶段二值化处理中的基准区间长度或者基准差进行说明的图。
具体实施方式
首先,基于图8~图11,对通过多阶段二值化处理来判别靶细胞与夹杂细胞的方法进行说明。此处,在经染色的细胞的明度图像(浓淡图像)中,将球形的癌细胞作为靶细胞,且将纺锤形的纤维母细胞作为夹杂细胞来进行说明。
图像上与其他分离的岛状部分(以下有时仅称为“岛”)的形状是否为“圆”、即大致圆形,可利用若干方法来判断。例如,参照图8,可根据岛的纵横比是否接近1(图8中的p)、长宽比(aspectratio)是否接近1(图8中的q)、面积是否接近外接矩形的面积的π/4(图8中的r)、周长的平方与面积的比是否接近4π(图8中的s)来判断。岛是否为圆,优选为将这些多种方法并用来判断。其原因在于降低将不圆的岛误认为圆的机率。例如,图8中的p及q的方法难以判别圆的岛与星形的岛,图8中的r及s的方法难以判别圆的岛与纺锤形的岛。
继而,参照图9,考虑细胞重叠的情况。第一段(c)为单独的癌细胞的岛,第二段(ff)为纺锤形的纤维母细胞彼此交叉的岛,第三段(cf)为癌细胞与纤维母细胞重叠的岛。列g0表示这些岛的明度图像(以下,将列g0的图像称为“图像g0”;其他也相同)。
将阈值设定为明度高(颜色淡)的水平(二值水平1),将图像g0进行二值化(列g1)。若对于所述图像g1,利用所述方法来判断二值化处理后的岛是否为圆,则岛c被判断为圆,岛ff被判断为不圆,从而正确地判别癌细胞与纤维母细胞。但是,岛cf被判断为不圆,从而忽略与纤维母细胞重叠的癌细胞。
将阈值设定为明度低(颜色浓)的水平(二值水平2),将图像g0进行二值化(列g2)。对于所述图像g2,判断岛是否为圆。岛c被判断为圆,结论未改变。岛cf被判断为圆,正确地判别出癌细胞。但是此次,岛ff也被判断为圆,将纤维母细胞的交叉部分误认为癌细胞。
将阈值设定为明度更低(颜色更浓)的水平(二值水平3),将图像g0进行二值化(列g3)。对于所述图像g3,判断岛是否为圆。岛c及岛ff消失。岛cf被判断为圆,正确地判别出癌细胞。
如上所述,若仅基于一个二值化图像来判断岛是否为圆,则存在将癌细胞与纤维母细胞误认的顾虑。但是,当使阈值阶段性地变化同时依次进行二值化处理(g1~g3),且在连续两次以上的二值化处理中岛为圆时,判断所述岛为癌细胞,由此对于岛c、岛ff、岛cf的任一者,均可正确地判别出癌细胞与纤维母细胞。
参照图10,在癌细胞某种程度地密集的情况下,也可利用所述方法来判别癌细胞与纤维母细胞。
进而,在多阶段二值化处理中,除了二值化处理后的各岛是否为圆的判断以外,优选为根据各岛的轮廓中所占的圆弧的比例来判断所述岛是否为癌细胞的集合。参照图11,在癌细胞较图10更为密集的情况下,即便使阈值变化,癌细胞也不分离,因而存在未能判断岛为圆形的情况。此处,在图11的图像g1与图像g2中,岛的轮廓外侧显示虚线的部分包含圆弧。如上所述,连续两次以上的二值化处理下,岛的轮廓中圆弧所占的比例为既定的值以上时,即可判断所述岛为癌细胞的集合。
可使用公开已知的方法,将轮廓抽出、与求出轮廓中所占的圆弧比例。例如可使用坂上胜彦·高木干雄的《透过反复演算将互相重合的粒子像分离》,信息处理学会会志,1983年9月第24卷第5期第561-567页中记载的方法。轮廓内,将可能近似于圆的部分判定为圆弧,算出判定为圆弧部分的轮廓长相对于岛整体的轮廓长的比例。
所述岛是否为癌细胞集合的判断基准的所述既定值(以下称为“基准比例”)若设定得过低,则将非癌细胞的集合误认为癌细胞集合的机率增加,因此优选为设为40%以上,更优选为设为50%以上。另一方面,若将基准比例设定得过高,则将癌细胞的集合误认为并非癌细胞集合的机率增加,因此优选为设为80%以下,更优选为设为70%以下。
作为本发明的细胞测定方法的第一实施方式,以下对抗癌剂敏感性试验中的癌细胞的定量方法进行说明。
对于从活体中采集的组织,在培养之前通过切碎、细胞分散酵素处理来进行细胞间质的消化等分散处理。视情况,然后进行在预备培养中去除血球等不需要的细胞,回收活细胞的分离处理。
培养试样的制作可使用多种公知的方法。其中,优选为使用三维培养法。更优选为可使用胶原凝胶包埋培养法。所述方法中,即便培养中使用的癌细胞的量少,仍可进行良好的培养以及其后的癌细胞的定量。
利用胶原凝胶包埋培养法的顺序如下所述。将经分离·分散处理的细胞混合于胶原溶液中。此时,在胶原溶液中,除了胶原以外也可预先添加培养所必需的各种成分。例如,可在胶原溶液中添加与目标细胞的生理条件相同或者近似的缓冲液。将所述包含癌细胞的胶原溶液滴加于培养容器内的支持面上而形成滴块状的胶原凝胶,在培养容器内添加液体培养基。同样地制备若干试样。一部分的试样中,在培养容器中添加抗癌剂,经过既定时间后将抗癌剂洗涤去除,再次进行培养。
培养结束后,在培养容器中添加色素,将作为靶细胞的癌细胞染色。染色方法可应用一般的癌细胞培养的染色方法。具体而言可列举:吉姆萨(giemsa)液染色法、结晶紫(crystalviolet)染色法、中性红(neutralred,nr)染色法、二乙酸荧光素酯(fluoresceindiacetate,fda)染色法或者使用其他荧光试剂的染色法。作为染色法,优选为可将癌细胞选择性地染色,且尽可能不将癌细胞以外的成分染色的方法。若使用将活细胞选择性地染色的活细胞染色法,则适合于测定抗癌剂的敏感性等。nr染色法作为可仅将癌细胞中的活细胞选择性地染色的方法而为优选。
染色完毕后,利用福尔马林将色素固定于细胞内,使其干燥。胶原凝胶干燥物从滴块状胶原凝胶中去除水分而成为平坦的面状。
继而,基于图1~图5,对包含靶细胞的试样的拍摄与图像处理的方法进行说明。图2中示出处理的流程图。
图1中,本实施方式的测定装置10包括:载置试样20的试样平台11、从下方照射试样的照明12、拍摄试样的透射图像的彩色照相机16、以及图像处理装置17。照明12具有一个发光二极管(lightemittingdiode,led)封装体13,连接于照明电源14上。在照明与试样平台之间插入光扩散板15。各led封装体中,组装有射出第一光的led芯片(未图示)、与射出第二光的led芯片(未图示)。
第一光及第二光对于将试样染色的色素的吸光度不同。本实施方式中,将第一光与第二光同时朝向试样照射,利用一台彩色照相机进行拍摄而获取一张原图像。通过将所述原图像进行分色,而获取对于第一光的透射图像即第一图像、以及对于第二光的透射图像即第二图像。
第一光及第二光的对于所述色素的吸光度的差异越大越好。为了获得充分的测定准确度,第一光及第二光透过试样时的衰减量的比优选为1.5倍以上,进而优选为2倍以上。为此,两者的吸光度的差优选为log1.5≒0.18以上,更优选为log2≒0.30以上。由于吸光度随着测定条件而变化,故而为了在实际的测定条件下获得如上的差,优选为选择第一光及第二光的波长。
作为例子,图5中示出中性红(nr)的ph=7.1时的吸收光谱(小畠理加(rikaobata)等,中和滴定与酸碱指示剂的可见吸收光谱,以庆应义塾大学日吉纪要自然科学、2011年9月第50期第77-102页为基础而制成)。nr在所述ph下在约380nm~600nm的范围内具有吸收带,且在462nm与518nm处具有吸收峰值。所述情况下,第一光中可选择波长分布与所述吸收带重叠的绿色光,第二光中可选择波长分布不与所述吸收带重叠的红色光。
照明的光源优选为使用led。其原因在于,led的波长分布狭窄,第一图像与第二图像的差异容易明确地出现。此外,照明的物理形态并无特别限定。例如,led封装体的数量并无特别限定。另外,例如,可如本实施方式所述,射出第一光的led芯片与射出第二光的led芯片组装于一个led封装体中,也可将射出第一光的led封装体与射出第二光的led封装体交替排列。
图像是作为多数的像素数据的集合而构成。各像素中包含表示与照相机的拍摄元件所捕捉的光的强度对应的明度的信息。例如若拍摄的取入阶度为8位,则明度是由0~255的256个数值所表示。若在光通过试样时具有吸收,则在透射图像上所述部分较暗,即明度小。
对于第一光的透射图像即第一图像由于nr的吸收大,故而若在培养试样中存在经nr染色的癌细胞,则所述部分的透过光强度变小。而且,癌细胞的厚度越大,透过光强度变得越小,图像的明度变得越小。另一方面,对于第二光的透射图像即第二图像不太反映癌细胞的存在量。
此处,将第一图像及第二图像分别利用相同的方法分割为多个分割区域。所谓利用相同方法来分割,是指分割为第一图像与第二图像的对应的分割区域彼此为相同大小,且映出试样的相同部位者。本实施方式中,将一个像素作为一个分割区域。第一图像及第二图像是由一个原图像所获得,因此各像素为利用相同方法将两图像分割而成的区域。
首先,将由不包含癌细胞的试样的图像信息所获得的空白图像明度w、以及由暗黑状态的图像信息所获得的暗图像明度b作为上下限,对每个像素求出相对于所述上下限值的明度的相对值,对第一图像及第二图像进行修正。空白图像是对除了不添加癌细胞以外,经过与癌细胞的培养试样相同的工序来处理的空白试样进行拍摄而获得的最明亮的状态的图像。但,由于存在胶原凝胶基质等,故而并非完全的白图像。暗图像是将摄影透镜的快门关闭等而使光不进入的最暗的状态下的图像。如图3所示,第一图像的明度t1与第二图像的明度t2位于空白图像的明度w与暗图像的明度b之间。
继而,将第一图像与第二图像进行比较,排除杂讯的影响。
在将第一图像与第二图像的各像素进行比较,明度的差或比小于既定的阈值的情况下,判断所述像素的区域不为癌细胞,将所述像素除外。更详细而言,将所述像素的资料从评价癌细胞量时的基础数据中排除。具体而言,例如,只要将第一图像进行修正,以所述空白图像的明度来替换所述像素的明度即可。由此,实质上被排除在外所述像素的明度,不会对癌细胞量的评价造成影响。
作为所述阈值,在将明度的差作为基准的情况下,例如可将阈值设为明度的阶度数的八分之一。即,当明度由8位元·256阶度来表示时,只要在第一图像与第二图像的明度的差小于32的情况下,将所述像素排除即可。或者,在将明度的比作为基准的情况下,只要在第一图像与第二图像的明度比小于既定阈值的情况下,将所述像素排除即可。更优选为这些阈值通过预备实验而求出。
不透明的垃圾不论波长如何,均不会透过光,因此在第一图像中及第二图像中均同样显得黑暗。另外,胶原凝胶干燥物中所含的气泡由于光的折射而在图像上显得黑暗,可以得知不论光源的波长如何,在第一图像中及第二图像中均同样显得黑暗。因此,在第一图像与第二图像中将明度无差异的区域排除后,即可排除这些的杂讯。
此外,在胶原凝胶包埋培养法中细胞量少的情况下,气泡尤其成为问题。因细胞量少,则有时在胶原凝胶干燥物中会残留气泡。其原因并不明确,但被认为是:在细胞量多的情况下,凝胶内的气体通过凝胶滴块中的细胞与基质的界面而去除至外部,与此相对,若细胞量变少,则凝胶内的气体不会完全去除而残留下来。
图4中显示经nr所染色的试样的透射图像(原图像)。第一光是主波长为528nm的绿色光,第二光是主波长为625nm的红色光。但,图4是将彩色图像的原图像转变为黑白图像者,分辨率也作转变。中央部的圆形的范围为试样(胶原凝胶干燥物)。在试样中多数散在的细小的暗点为癌细胞或者其菌落,在原图像中表现为红色,在第一图像中显得较暗,在第二图像中并未出现。但,由虚线包围的暗点为垃圾,在原图像中表现出灰色,在第一图像及第二图像中显得较暗。上方的实心的椭圆与下方的中空的椭圆为气泡引起的杂讯,在原图像中表现为灰色,在第一图像及第二图像中显得较暗。
杂讯的其他原因中有纤维母细胞的混入。纤维母细胞与癌细胞一并由nr等色素所染色,但与癌细胞相比极其难以被染色,所以图像的明度与癌细胞相比明显较高。因此,在第一图像中,某像素的明度超过既定的阈值的情况下,可判断所述像素的区域为纤维母细胞,即可将所述像素排除。具体而言,例如,只要将第一图像进行修正,以所述空白图像的明度来替换所述像素的明度即可。阈值可通过预备实验来求出。由此,试样中的纤维母细胞与癌细胞或其他纤维母细胞分离而存在的部分,即为由纤维母细胞引起的杂讯可将之排除。
以上的处理,遍及试样的全部范围,对每个分割区域反复进行处理,可排除并非由癌细胞的光吸收所引起的杂讯的影响。如此,通过第一图像与第二图像的比较而去除的杂讯称为“第一杂讯”。由此,获得第一杂讯的去除图像。
继而,对第一杂讯去除图像进行多阶段二值化处理。
多阶段二值化处理中,使阈值变化的同时,进行多次的二值化处理,来判断岛是否为圆、以及岛的轮廓中圆弧所占的比例是否大于既定的值(基准比例)。以下,将岛为圆的情况、与岛的轮廓中圆弧所占的比例大于基准比例的情况合并而称为“岛为圆形等”。
在多阶段二值化处理中使阈值变化的间隔(以下称为“阈值间隔”)、与在若干次的二值化处理中岛为圆形等则判断所述岛为癌细胞的次数(以下称为“基准次数”)相互关联。例如,使阈值阶段性地增加的同时进行二值化处理的情况下,若阈值间隔小,则基准次数必须增大,若阈值间隔大,则基准次数也可减小。二值化处理的阈值间隔与基准次数可以如下方式来决定。
图15中,横轴表示明度,横轴上的各点表示将所述明度作为阈值的二值化处理后的判定结果。假定使阈值阶段性地增加的同时,进行二值化处理,则在第一次的二值化处理(阈值为th1)中,岛不为圆形等,在第二~四次的二值化处理(阈值为th2、th3、th4)中,岛为圆形等。此时,若在明度直线上将th2与th4之间设为区间i24,则将区间i24的下限值th2与上限值th4作为阈值的二值化处理中,岛为圆形等,因此若将区间i24中所含的明度作为阈值而进行二值化,则不论所述阈值的大小,均可推定所述岛为圆形等。
因此,即便使阈值在某既定长度的区间内变化,二值化处理后的岛也为圆形等的情况下,判断所述岛为癌细胞。将所述既定长度称为“基准区间长度”,或者出于区间的上限值与下限值的差的含义而称为“基准差”。基准区间长度与基准差相等。于是,若利用在基准差以上不同的两个阈值的二值化处理中,岛均为圆形等,则在所述两个阈值之间不论阈值的大小,均可推定所述岛为圆形等,可判断为所述岛包含癌细胞。
在图15中,当阈值th2与th4的差大于基准差ir时,通过在基准差ir以上不同的两个阈值th2、th4进行的两次的二值化处理中,岛为圆形等,则在两个阈值th2、th4之间不论阈值的大小,均可推定所述岛在二值化处理后为圆形等。因此,由于即便使阈值在th2-th4间所含的基准区间长度ir的区间内变化,也可推定所述岛在二值化处理后为圆形等,故而可判断所述岛为癌细胞。
二值化处理的阈值间隔与基准次数可基于所述基准区间长度来决定。例如,可设定为阈值间隔δth=ir且基准次数为两次、阈值间隔δth=ir/2且基准次数为三次等。
在将明度以256阶度来表示基准区间长度的情况下,基准区间长度优选为设为70以下,更优选为设为40以下。其原因在于,若基准区间长度过于大,则忽略癌细胞的机率提高。另一方面,基准区间长度优选为设为5以上,更优选为设为10以上。其原因在于,若基准区间长度过于小,则将不为癌细胞的细胞误认为癌细胞的机率提高。例如,将图9的第二段(ff)中所示的纤维母细胞重叠部分误认为癌细胞的机率提高。在明度的阶度数不为256的情况下,能够以与其相同的比率,根据阶度数来决定基准区间长度的优选值。另外,进而优选为基准区间长度是通过预备实验来决定。进而,在对明度图像进行多阶段二值化处理的情况下,优选为在明度高的区域中将明度的基准区间长度设定得大,在明度低的区域中将明度的基准区间长度设定得小。
多阶段二值化处理,遍及试样的全部范围,对每个岛反复进行所述的形状判断。而且,将各岛的图像,以判断所述岛为圆形等的二值化处理中最小或最大的阈值者的形状以及所述阈值来置换。由此,获得排除了纤维母细胞引起的杂讯的第二杂讯去除图像。
继而,根据第二杂讯去除图像来定量癌细胞。
癌细胞量可通过将每个像素各自的细胞量的指标进行积算来评价。优选为通过推定体积值来评价癌细胞量。其原因在于,胶原凝胶包埋培养法中,癌细胞的菌落将三维地发展,考虑其厚度,可进行更准确的评价。推定体积值是根据各像素的明度来求出吸光度,遍及试样范围整体将吸光度积算而求出。其原因在于,各区域中,吸光度与细胞厚度呈线性相关。
根据朗伯-比尔定律(lambert-beer'slaw),若将对试样的入射光强度设为i0,将透过光强度设为i,则存在
i/i0=exp(-αl)
的关系。此处,α为经染色的癌细胞的吸光系数,l为光在癌细胞中通过的距离、即癌细胞的厚度。各像素的癌细胞的吸光度a是由
a=-log(i/i0)
=(αl)/2.303
所表示,因此吸光度a与癌细胞厚度l成比例。吸光度a为所述像素的细胞量的指标,可通过遍及试样的全部范围而将吸光度a积算来求出细胞的体积。此外,log为常用对数。
另一方面,吸光度a是根据第二杂讯去除图像,由
a=log(s/t)
来求出。此处,s为图像的阶度数,t为像素的明度。
根据以上,癌细胞量的推定体积值v是由
v=σl=cσa=cσ{log(s/t)}(式1)
来求出。此处,c为常数。如上所述,可通过根据各像素的明度来求出吸光度,遍及试样范围整体而将吸光度积算,从而求出细胞的推定体积值。
此外,关于某像素,当由于若干原因而明度t为0时(原图像的明度与暗图像的明度b相等时),式1的右边对数的真数的分母成为0,无法计算。针对于此,优选为,为了使试样图像不会变得过于暗而调节光源的明度等,并且进行适当的例外处理。
此外,为方便起见,也可将各像素的明度进行积算,根据其积算的数值来求出吸光度。推定体积值vp是由
vp=cpap=cplog(ns/σt)
所表示。此处,cp为常数,ap为吸光度,n为像素数(分割区域的数量)。所述式是将试样范围整体作为一个区域来求出吸光度,但若细胞量多,则例如在将手术材料作为起始材料的情况下,可获得充分的准确度。在使用所述式的情况下,也已经通过图像处理来排除由垃圾等所引起的杂讯的影响。
抗癌剂的敏感性试验中,通过利用未添加抗癌剂的对照试样与添加有抗癌剂的试样,将培养后的癌细胞量进行比较,来评价抗癌剂的敏感性。
重新叙述本实施方式的癌细胞定量方法的效果。
由垃圾或气泡引起的杂讯在现有技术中难以排除。依据本实施方式的方法,可通过使用第一光及第二光,来排除垃圾的混入或气泡的残存的影响,从而准确度良好地定量癌细胞。不透明的垃圾仅在第一图像中被误认为癌细胞,进而由于在图像中映出得暗而被误认为厚的癌细胞,因此大幅度损及定量准确度。气泡仅在第一图像中仍然被误认为癌细胞,与癌细胞的菌落相比而言大者多,因此大幅度损及定量准确度。
进而,通过多阶段二值化处理,即便试样中存在癌细胞与纤维母细胞密集混合存在的部分,也可排除纤维母细胞的影响而准确度良好地定量癌细胞。
进而,通过式1,若在试样图像的每个分割区域求出吸光度,将其积算,则可更正确地算出癌细胞的推定体积值。
继而,对本发明的细胞测定方法的第二实施方式进行说明。
本实施方式与第一实施方式同样,是涉及抗癌剂敏感性试验中的癌细胞的定量方法。本实施方式的方法的第一图像及第二图像的获取方法与第一实施方式不同。其他工序与第一实施方式相同。
本实施方式中,使发出第一光的第一光源与发出第二光的第二光源依次点亮,在各光源点亮时利用一台照相机随时进行拍摄。由此,通过第一光源点亮时的拍摄而获得第一图像,通过第二光源点亮时的拍摄而获得第二图像。此外,本实施方式中,光源的物理形态也并无特别限定。例如,作为第一光源的led芯片与作为第二光源的led芯片可组装于一个led封装体中,也可使用不同的led封装体作为第一光源与第二光源,使它们交替排列。
本实施方式中,可使用单色照相机。所述情况下,单色照相机较彩色照相机而言可获取更高分辨率者,因此可获得更精细的图像。
继而,对本发明的细胞测定方法的第三实施方式进行说明。
本实施方式与第一实施方式相同,是涉及抗癌剂敏感性试验中的癌细胞的定量方法。本实施方式的方法在如下方面与第一实施方式不同:使用吸光度图像作为第一图像及第二图像,对于所述吸光度图像进行垃圾等的杂讯去除以及通过多阶段二值化进行的纤维母细胞的杂讯去除。
首先,关于将原图像分色而获得的各图像,对每个像素,根据明度来求出吸光度,量子化为256阶度等,获得作为吸光度图像的第一图像及第二图像。将第一图像与第二图像的各像素进行比较,在吸光度的差或比小于既定的阈值的情况下,判断所述像素的区域不为癌细胞而除外。作为所述阈值,在将吸光度的差作为基准的情况下,例如可将阈值设为吸光度的阶度数的八分之一。或者在将吸光度的比作为基准的情况下,只要在第一图像与第二图像的吸光度的比小于既定的阈值的情况下将所述像素除外即可。更优选为这些阈值通过预备实验而求出。通过遍及试样的全部范围,对每个像素反复进行所述处理,从而获得第一杂讯去除图像。第一杂讯去除图像也为吸光度图像。
继而,对第一杂讯去除图像进行多阶段二值化处理。本实施方式中,以吸光度图像为对象来进行二值化,因此二值化的阈值也为经量子化的吸光度。由于与第一实施方式相同的原因,在将吸光度以8位(0~255阶段)进行量子化的情况下,吸光度的基准区间长度优选为设为50以下,更优选为设为40以下,且优选为设为10以上,更优选为设为20以上。此外,在吸光度的量子化位数不为8位的情况下,只要以与其相同的比率,根据量子化位数来决定阈值的优选间隔即可。
通过遍及试样的全部范围,对每个岛反复进行多阶段二值化处理,从而获得排除了由纤维母细胞引起的杂讯的第二杂讯去除图像。第二杂讯去除图像也为吸光度图像。
继而,根据第二杂讯去除图像来定量癌细胞。通过将第二杂讯去除图像的各像素的值积算,可算出癌细胞的推定体积值。
本实施方式在试样中存在癌细胞密集的部分的情况下,尤其具有优点。图像的明度与癌细胞的厚度不成比例。若癌细胞的重叠超出某程度,则较对于第一光的透射图像而言,对于第二光的透射图像的明度的下降幅度变大,两图像的明度的差倒是减少。因此,存在通过去除垃圾等的杂讯的工序而将癌细胞、而且将高度密集的癌细胞除外的顾虑。与此相对,吸光度与癌细胞的厚度成比例,因此若使用吸光度图像,则不存在如上所述的问题。
实施例
对所述实施方式的多阶段二值化处理的实施例进行说明。
将对从生物采集的胃癌组织进行细胞分离·分散处理而获得的初代培养癌细胞,利用胶原凝胶包埋法进行培养。作为包埋细胞的胶原凝胶溶液,在8体积的细胞基质(cellmatrix)typecd(仓敷纺织股份有限公司)中,添加1体积的10倍的哈姆(ham)f12培养液(不含碳酸氢钠)、1体积的再构成用缓冲溶液(包含260mm碳酸氢钠以及200mm-hepes的50mm-naoh溶液),保存于冰中。以最终密度成为2×104细胞/ml的方式,在胶原溶液中添加细胞,充分混合来制备胶原混合液。使用微量移液器(micro-pipette),将所述胶原混合液在24孔板的1孔中,以10μl为单位,隔开适当的间隔滴加于3处。然后,在co2恒温箱中以37℃加温1小时,制作包含细胞的胶原基质。在所获得的胶原凝胶基质中,添加1ml的含10%胎牛血清(fetalbovineserum,fbs)的df培养基,进行160小时培养。然后,在孔中注入nr染色剂,进行福尔马林固定·干燥,获得胶原凝胶干燥物。
将所获得的胶原凝胶干燥物载置于试样平台上,从下方以照明来照射,利用彩色照相机来拍摄透射图像。照明是使用一个led封装体(creeinc.、mc-ecolor)。led封装体中搭载有rgb3色的led芯片,仅使其中的r及g的芯片点亮来使用。第一光是主波长为528nm的绿色光,第二光是主波长为625nm的红色光。彩色照相机(索尼股份有限公司,xcl5005cr)是以像素数2448×2050、rgb各8位阶度,使用光学倍率为1.3倍的透镜。此时图像的分辨率约为2.7μm。
将所拍摄的原图像分色为rgb的3色,将g图像作为第一图像,将r图像作为第二图像。对于每个像素将第一图像与第二图像进行比较,在明度的差为36以上的情况下,判定为第一杂讯,从图像中去除。对于剩余的像素,根据g图像的像素值来算出吸光度,制成以将所获得的吸光度以8位进行量子化而得的值作为像素值的吸光度图像。对所述图像应用多阶段二值化处理,将基准区间长度(=基准差)设为30,在图像中的各岛为圆或者岛的轮廓中圆弧所占的比例为60%(基准比例)以上的情况下,判断所述岛包含癌细胞。
具体而言,多阶段二值化处理是使阈值以30、50、60、40、60、70、50、70、80、……的方式变化而进行,于在具有30以上的差的两个阈值进行两次的二值化处理中,岛状部分为大致圆形的情况下,判断所述岛包含癌细胞。其中,使阈值以所述方式不规则地变化是为了使本实施例的效果的分析容易,本来并不需要。一边使阈值依次增加或减少,一边进行二值化处理,由于处理的浪费少而优选。本实施例中,由于将基准区间长度设为30,故而即便例如在一边使阈值以10为单位而阶段性地增加或减少一边进行二值化处理,岛三次连续为圆形等的情况下,判断所述岛包含癌细胞,当然也可获得相同的结果。
图12a中示出原图像,图12b中示出从所述原图像中去除第一杂讯,将吸光度图像以阈值3进行二值化的图像。在图12的左下部存在癌细胞与纤维母细胞密集混合存在的部分。
图13示出将图12左下部的由四角包围的部分以不同的阈值进行二值化处理时的图像。图中的“th”为阈值的值。在阈值为3至130为止的任一个二值化图像中,所述岛均不圆。但是,在阈值为90、100、110、120、130的二值化图像中,岛的轮廓中所占的圆弧的比例均为60%以上。当阈值为90及120时,由于轮廓中圆弧所占的比例为基准比例以上,故而判断所述岛为癌细胞的集合。为了参考,图14中示出当阈值为90及120时的岛的轮廓中所占的圆弧。
此处,对获得第一杂讯去除图像为止的实验例进行说明。
使用由人类大肠癌而来的细胞株即hct-116作为癌细胞,利用胶原凝胶包埋法进行培养。作为包埋细胞的胶原凝胶溶液,在8体积的细胞基质typecd(仓敷纺织股份有限公司)中,添加1体积的10倍的哈姆(ham)f12培养液(不含碳酸氢钠)、1体积的再构成用缓冲溶液(包含260mm碳酸氢钠以及200mm-hepes的50mm-naoh溶液),保存于冰中。以最终密度成为4×104细胞/ml的方式,在胶原溶液中添加hct-116株,充分混合而制备胶原混合液。使用微量移液器,将所述胶原混合液在24孔板的1孔中,以10μl为单位,隔开适当的间隔而滴加于3处。然后,在co2恒温箱中以37℃加温1小时,制作包含癌细胞的胶原基质。在所获得的胶原凝胶基质中,添加1ml的含10%fbs的df培养基,进行16小时培养。然后,在孔中注入nr染色剂,进行福尔马林固定·干燥,获得胶原凝胶干燥物。
将所获得的胶原凝胶干燥物载置于试样平台上,从下方以照明来照射,利用彩色照相机来拍摄透射图像。照明是使用一个led封装体(creeinc.,mc-ecolor)。led封装体中搭载有rgb3色的led芯片,仅使其中的r及g的芯片点亮来使用。第一光是主波长为528nm的绿色光,第二光是主波长为625nm的红色光。彩色照相机(索尼股份有限公司,xcl5005cr)是以像素数2448×2050、rgb各8位阶度,使用光学倍率为1.3倍的透镜。此时图像的分辨率约为2.7μm。
将所拍摄的原图像转变为白黑图像者为图6(无气泡的试样)以及图7(气泡多的试样)。图6及图7中所示的试样中包含基本上为相同程度的量的癌细胞。此外,所述的图4也为利用与本实验例相同的方法而获得的图像。将原图像分色为rgb的3色,将g图像作为第一图像,将r图像作为第二图像。对于每个像素将第一图像与第二图像进行比较,在明度的差为35以内的情况下,判断为不为癌细胞。根据所述式1,对每个像素算出吸光度,遍及试样的全部范围进行积算,求出癌细胞的推定体积值。此时,式1的常数c的值使用2.0×10-4。
作为比较实验例,不利用第二图像,根据第一图像的明度来算出吸光度,遍及试样的全部范围进行积算,同样地求出癌细胞的推定体积值。
关于利用实验例的方法来获得的推定体积值,图6为0.42,图7为0.44。比较实验例的方法中,图6为0.47,图7为1.54。在无气泡的图6中,实验例与比较实验例中获得相同程度的推定体积值。另一方面,在气泡多的图7中,比较实验例的推定体积值为实验例的推定体积值的约3倍。这是由气泡引起的杂讯的影响,实验例中可排除由气泡引起的杂讯。
本发明的细胞测定方法并不限定于所述的实施方式或实施例,可在其技术思想的范围内进行多种变形。
例如,所述实施方式中,以明度的相对化(空白修正)、通过第一图像与第二图像的比较的垃圾·气泡等的杂讯排除、纤维母细胞的杂讯排除的顺序来实施,但这些也可分别调换顺序来实施。
另外,例如可使用白色照明,将设置于照相机前方的彩色滤光片依次切换来摄影,获取第一图像及第二图像。
另外,例如也可在照明中使用具有连续光谱的白色光源,利用彩色照相机来拍摄,进行分色,由此获得第一图像与第二图像。但,彩色照相机的拍摄元件通常由于感度光谱广而一部分重复,故而使用波长不同的两个光源者可清晰地获得第一图像与第二图像的差异。
符号的说明
10:测定装置
11:试样平台
12:照明
13:led封装体
14:照明电源
15:光扩散板
16:彩色照相机
17:图像处理装置
20:试样
a:吸光度
b:暗图像明度
ir:基准区间长度、或者基准差
s:阶度数
t:明度
th:阈值
v:推定体积值
w:空白图像明度
- 还没有人留言评论。精彩留言会获得点赞!