细胞处理系统及细胞处理装置的制作方法
本发明涉及细胞技术,涉及细胞处理系统及细胞处理装置。
背景技术:
胚胎干细胞(embryonicstemcell,es细胞)是由人类或小鼠的早期胚胎而确立的干细胞。es细胞具备可分化为生物体内所存在的所有细胞的多能性。现在,人类es细胞可以在帕金森病、幼年型糖尿病、及白血病等众多疾病的细胞移植疗法中利用。然而,在es细胞的移植中也存在障碍。特别是es细胞的移植可能引起与不成功的器官移植后所产生的排斥反应同样的免疫排斥反应。而且,对于利用破坏人类胚胎而确立的es细胞,来自伦理性观点的批判或反对意见较多。
在此种背景的状况下,京都大学的山中伸弥教授通过将4种基因:oct3/4、klf4、c-myc、及sox2导入至体细胞而成功地确立诱导多能干细胞(ips细胞)。因此,山中教授获得了2012年的诺贝尔生理学或医学奖(例如参照专利文献1、2)。ips细胞是并无排斥反应或伦理问题的理想的多能性细胞。因此,期待将ips细胞应用于细胞移植疗法中。
现有技术文献
专利文献
专利文献1:日本专利第4183742号公报
专利文献2:日本专利特开2014-114997号公报
技术实现要素:
发明所欲解决的课题
ips细胞这样的诱导干细胞可通过于细胞中导入基因等诱导因子而确立,从而进行扩增培养、冻结保存。目前,干细胞由人在洁净室内手工作业来制造。此时,必须防止制造干细胞时使用的血液或诱导因子与人接触。而且,存在细胞感染病毒或病原体的可能性,因此必须将细胞封入以使其不露出到外部。例如,如果感染了肝炎病毒或人类免疫缺陷病毒(hiv)的细胞扩散到外部,则对人类或动物产生致命的影响。因此,还必须防止血液、诱导因子、诱导前的细胞、及所诱导的细胞释放到洁净室外。另外,为了防止与其他人的ips细胞交叉污染,要花费规定时间在洁净室内制作仅仅源自一个人的ips细胞。
对此,本发明的目的之一在于提供能够不对周围造成污染地处理细胞的细胞处理系统及细胞处理装置。
解决问题的手段
根据本发明的实施方式而提供一种细胞处理系统,其具备:壳体;外侧壳体,对壳体进行内包;吸气净化过滤器,设于壳体,对自壳体外吸引的气体进行净化;循环装置,以将外侧壳体内的气体经由吸气净化过滤器而吸引至壳体内,将壳体内的气体排出至外侧壳体内的方式,使气体在外侧壳体内,在壳体内外循环;细胞处理装置,配置在壳体内,用以对细胞进行处理。
在上述细胞处理系统中,可以在外侧壳体设有压力调整孔。
在上述细胞处理系统中,循环装置可以具备气体排出装置,其设于壳体,自壳体内吸引气体,且将所净化的气体排出至壳体外。
在上述细胞处理系统中,气体排出装置可以具备:排气装置,将壳体内的气体排出至壳体外;排气净化过滤器,对排气装置所吸引的气体进行净化。
在上述细胞处理系统中,排气净化过滤器可以配置在排气装置的上游侧。
在上述细胞处理系统中,可以进一步具备遮蔽构件,能够以遮蔽排气净化过滤器的方式安装于排气净化过滤器上。
在上述细胞处理系统中,遮蔽构件可以具备:壳体侧遮蔽构件,能够以从壳体内遮蔽排气净化过滤器的方式安装于排气净化过滤器上;排气装置侧遮蔽构件,能够以从排气装置侧遮蔽排气净化过滤器的方式安装于排气净化过滤器上。
在上述细胞处理系统中,可以进一步具备杀菌装置,对排气净化过滤器进行杀菌。
在上述细胞处理系统中,可以进一步具备第2排气净化过滤器,配置在排气装置的下游侧。
在上述细胞处理系统中,可以进一步具备遮蔽构件,能够以遮蔽第2排气净化过滤器的方式安装于第2排气净化过滤器上。
在上述细胞处理系统中,遮蔽构件可以具备排气装置侧遮蔽构件,能够以从排气装置侧遮蔽第2排气净化过滤器的方式安装于第2排气净化过滤器上。
在上述细胞处理系统中,可以进一步具备杀菌装置,对第2排气净化过滤器进行杀菌。
在上述细胞处理系统中,循环装置可以具备导入装置,设于壳体,自壳体外吸引被吸气净化过滤器净化的气体。
在上述细胞处理系统中,吸气净化过滤器可以配置于导入装置的下游侧。
在上述细胞处理系统中,可以进一步具备遮蔽构件,能够以遮蔽吸气净化过滤器的方式安装于吸气净化过滤器上。
在上述细胞处理系统中,遮蔽构件可以具备:壳体侧遮蔽构件,能够以从壳体内遮蔽吸气净化过滤器的方式安装于吸气净化过滤器上;导入装置侧遮蔽构件,能够以从导入装置侧遮蔽吸气净化过滤器的方式安装于吸气净化过滤器上。
在上述细胞处理系统中,可以进一步具备杀菌装置,对吸气净化过滤器进行杀菌。
在上述细胞处理系统中,与壳体外相比而言,壳体内可以成为负压。
在上述细胞处理系统中,可以于细胞处理装置中培养干细胞。
在上述细胞处理系统中,可以进一步具备杀菌装置,对壳体内的配置细胞处理装置的空间进行杀菌。
在上述细胞处理系统中,可以进一步具备温度管理装置,管理壳体内的配置细胞处理装置的空间的温度。
在上述细胞处理系统中,可以进一步具备二氧化碳浓度管理装置,管理壳体内的配置细胞处理装置的空间的二氧化碳浓度。
在上述细胞处理系统中,壳体内可以被划分为多个区域。
在上述细胞处理系统中,细胞处理装置可以具备:导入前细胞送液通路,使含有细胞的溶液通过;因子导入装置,与导入前细胞送液通路连接,于细胞中导入多能性诱导因子而制作诱导因子导入细胞;细胞团制作装置,对诱导因子导入细胞进行培养而制作由干细胞构成的多个细胞魂。
在上述细胞处理系统中,可以具备:壳体;吸气净化过滤器,设于壳体,对自壳体外吸引的气体进行净化;送回构件,用以将从壳体排出的气体送回至吸气净化过滤器;循环装置,以将壳体内的气体排出至送回构件内,将送回构件内的气体经由吸气净化过滤器而吸引至壳体内的方式,使气体在壳体与送回构件之间循环;细胞处理装置,配置在壳体内,用以对细胞进行处理。
在上述细胞处理系统中,送回构件可以具备与壳体嵌合的形状。
在上述细胞处理系统中,送回构件可以具备:内部为空洞的基部,与壳体的底面相接;第1盖,使设于基部的第1开口与设于壳体的第1端面的通风部连通;第2盖,使设于基部的第2开口与设于壳体的第2端面的通风部连通。
在上述细胞处理系统中,送回构件可以是管道。
在上述细胞处理系统中,循环装置可以具备气体排出装置,其设于壳体,自壳体内吸引气体,且将所净化的气体排出至送回构件内。
在上述细胞处理系统中,气体排出装置可以具备:排气装置,将壳体内的气体排出至送回构件内;排气净化过滤器,对排气装置所吸引的气体进行净化。
在上述细胞处理系统中,排气净化过滤器可以配置在排气装置的上游侧。
在上述细胞处理系统中,可以进一步具备遮蔽构件,能够以遮蔽排气净化过滤器的方式安装于排气净化过滤器上。
在上述细胞处理系统中,遮蔽构件可以具备:壳体侧遮蔽构件,能够以从壳体内遮蔽排气净化过滤器的方式安装于排气净化过滤器上;排气装置侧遮蔽构件,能够以从排气装置侧遮蔽排气净化过滤器的方式安装于排气净化过滤器上。
在上述细胞处理系统中,可以进一步具备杀菌装置,对排气净化过滤器进行杀菌。
在上述细胞处理系统中,可以进一步具备第2排气净化过滤器,配置在排气装置的下游侧。
在上述细胞处理系统中,可以进一步具备遮蔽构件,能够以遮蔽第2排气净化过滤器的方式安装于第2排气净化过滤器上。
在上述细胞处理系统中,遮蔽构件可以具备排气装置侧遮蔽构件,能够以从排气装置侧遮蔽第2排气净化过滤器的方式安装于第2排气净化过滤器上。
在上述细胞处理系统中,可以进一步具备杀菌装置,对第2排气净化过滤器进行杀菌。
在上述细胞处理系统中,循环装置可以进一步具备导入装置,设于壳体,自送回构件内吸引被吸气净化过滤器净化的气体。
在上述细胞处理系统中,吸气净化过滤器可以配置于导入装置的下游侧。
在上述细胞处理系统中,可以进一步具备遮蔽构件,能够以遮蔽吸气净化过滤器的方式安装于吸气净化过滤器上。
在上述细胞处理系统中,遮蔽构件可以具备:壳体侧遮蔽构件,能够以从壳体内遮蔽吸气净化过滤器的方式安装于吸气净化过滤器上;导入装置侧遮蔽构件,能够以从导入装置侧遮蔽吸气净化过滤器的方式安装于吸气净化过滤器上。
在上述细胞处理系统中,可以进一步具备杀菌装置,对吸气净化过滤器进行杀菌。
在上述细胞处理系统中,与送回构件内相比而言,壳体内可以成为负压。
可以于上述细胞处理系统的细胞处理装置中培养干细胞。
在上述细胞处理系统中,可以进一步具备杀菌装置,对壳体内的配置细胞处理装置的空间进行杀菌。
在上述细胞处理系统中,可以进一步具备温度管理装置,管理壳体内的配置细胞处理装置的空间的温度。
在上述细胞处理系统中,可以进一步具备二氧化碳浓度管理装置,管理壳体内的配置细胞处理装置的空间的二氧化碳浓度。
在上述细胞处理系统中,壳体内可以被划分为多个区域。
在上述细胞处理系统中,细胞处理装置可以具备:导入前细胞送液通路,使含有细胞的溶液通过;因子导入装置,与导入前细胞送液通路连接,于细胞中导入多能性诱导因子而制作诱导因子导入细胞;细胞团制作装置,对诱导因子导入细胞进行培养而制作由干细胞构成的多个细胞魂。
而且,根据本发明的实施方式而提供一种细胞处理装置,其具备细胞处理器具,对细胞进行处理;包埋构件,对细胞处理器具进行包埋;连通送液通路,使包埋构件外与包埋构件内的细胞处理器具连通。
于上述细胞处理装置中,包埋构件可以由玻璃或树脂形成。
于上述细胞处理装置中,包埋构件可以由金属形成。
于上述细胞处理装置中,可以进一步具备驱动部,用以对连通送液通路内的液体进行送液,配置于包埋构件的外部。
于上述细胞处理装置中,驱动部可以与包埋构件的外壁连接。
于上述细胞处理装置中,可以在包埋构件内设有从驱动部传递驱动力的从动部,该从动部与连通送液通路连接。
于上述细胞处理装置中,细胞处理器具可以具备单核细胞分离部,自血液分离单核细胞,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备血液保存部,配置于包埋构件的外部,保存血液及血液细胞的至少任一者;连通送液通路具备使血液保存部与单核细胞分离部连通的血液送液通路。
于上述细胞处理装置中,可以进一步具备分离剂保存部,配置于包埋构件的外部,保存用以分离单核细胞的分离剂;连通送液通路具备使分离剂保存部与单核细胞分离部连通的分离剂送液通路。
于上述细胞处理装置中,细胞处理器具可以具备过滤器,对细胞进行离析,配置于包埋构件的内部。
于上述细胞处理装置中,细胞处理器具可以具备单核细胞纯化过滤器,配置于包埋构件的内部。
于上述细胞处理装置中,细胞处理器具可以具备:单核细胞分离部,自血液分离单核细胞,配置于包埋构件的内部;单核细胞纯化过滤器,配置于包埋构件的内部;单核细胞送液通路,使单核细胞分离部与单核细胞纯化过滤器连通,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备驱动部,用以对单核细胞送液通路内的液体进行送液,配置于包埋构件的外部。
于上述细胞处理装置中,驱动部可以与包埋构件的外壁连接。
于上述细胞处理装置中,可以在包埋构件内设有从驱动部传递驱动力的从动部,该从动部与单核细胞送液通路连接。
于上述细胞处理装置中,细胞处理器具可以具备因子导入部,于细胞中导入多能性诱导因子而制作诱导因子导入细胞,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备因子保存部,配置于包埋构件的外部,保存多能性诱导因子,连通送液通路具备使因子保存部与因子导入部连通的因子送液通路。
于上述细胞处理装置中,可以在因子导入部中,利用rna脂质转染而于细胞中导入多能性诱导因子。
于上述细胞处理装置中,多能性诱导因子可以是dna、rna、或蛋白质。
于上述细胞处理装置中,多能性诱导因子可以植入至载体中。
于上述细胞处理装置中,载体可以是仙台病毒载体。
于上述细胞处理装置中,细胞处理器具可以具备:单核细胞分离部,自血液分离单核细胞,配置于包埋构件的内部;因子导入部,于细胞中导入多能性诱导因子而制作诱导因子导入细胞,配置于包埋构件的内部;导入前细胞送液通路,使单核细胞分离部与因子导入部连通,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备驱动部,用以对导入前细胞送液通路内的液体进行送液,配置于包埋构件的外部。
于上述细胞处理装置中,驱动部可以与包埋构件的外壁连接。
于上述细胞处理装置中,可以在包埋构件内设有从驱动部传递驱动力的从动部,该从动部与导入前细胞送液通路连接。
于上述细胞处理装置中,细胞处理器具可以具备:单核细胞纯化过滤器,配置于包埋构件的内部;因子导入部,于细胞中导入多能性诱导因子而制作诱导因子导入细胞,配置于包埋构件的内部;导入前细胞送液通路,使单核细胞纯化过滤器与因子导入部连通,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备驱动部,用以对导入前细胞送液通路内的液体进行送液,配置于包埋构件的外部。
于上述细胞处理装置中,驱动部可以与包埋构件的外壁连接。
于上述细胞处理装置中,可以在包埋构件内设有从驱动部传递驱动力的从动部,该从动部与导入前细胞送液通路连接。
于上述细胞处理装置中,细胞处理器具可以具备初始化培养器,对导入了多能性诱导因子的诱导因子导入细胞进行培养,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备血液细胞培养基保存部,配置于包埋构件的外部,保存血液细胞培养基;连通送液通路具备使血液细胞培养基保存部与初始化培养器连通的培养基送液通路。
于上述细胞处理装置中,可以对初始化培养器连续地补给血液细胞培养基。
于上述细胞处理装置中,可以以规定时机对初始化培养器补给血液细胞培养基。
于上述细胞处理装置中,可以进一步具备冷藏保存部,对血液细胞培养基进行冷藏保存,配置于包埋构件的外部。
于上述细胞处理装置中,可以进一步具备干细胞培养基保存部,配置于包埋构件的外部,保存干细胞培养基;连通送液通路具备使干细胞培养基保存部与初始化培养器连通的培养基送液通路。
于上述细胞处理装置中,可以对初始化培养器连续地补给干细胞培养基。
于上述细胞处理装置中,可以以规定时机对初始化培养器补给干细胞培养基。
于上述细胞处理装置中,可以进一步具备冷藏保存部,对干细胞培养基进行冷藏保存,配置于包埋构件的外部。
于上述细胞处理装置中,可以进一步具备保管废液的废液保管部,配置于包埋构件的外部;连通送液通路具备使初始化培养器与废液保管部连通的废液送液通路。
于上述细胞处理装置中,初始化培养器可以具备悬浮培养器,悬浮培养器具备:透析管,装有诱导因子导入细胞与培养基;容器,放入了透析管,于透析管的周围装有培养基。
于上述细胞处理装置中,细胞处理器具可以具备:因子导入部,于细胞中导入多能性诱导因子而制作诱导因子导入细胞,配置于包埋构件的内部;初始化培养器,对诱导因子导入细胞进行培养,配置于包埋构件的内部;导入细胞送液通路,使因子导入部与初始化培养器连通,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备驱动部,用以对导入细胞送液通路内的液体进行送液,配置于包埋构件的外部。
于上述细胞处理装置中,驱动部可以与包埋构件的外壁连接。
于上述细胞处理装置中,可以在包埋构件内设有从驱动部传递驱动力的从动部,该从动部与导入细胞送液通路连接。
于上述细胞处理装置中,驱动部与从动部可以通过磁力来连接。
于上述细胞处理装置中,细胞处理器具可以具备扩增培养器,对确立的由干细胞构成的多个细胞团进行扩增培养,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备干细胞培养基保存部,配置于包埋构件的外部,保存干细胞培养基;连通送液通路具备使干细胞培养基保存部与扩增培养器连通的培养基送液通路。
于上述细胞处理装置中,可以对扩增培养器连续地补给干细胞培养基。
于上述细胞处理装置中,可以以规定时机对扩增培养器补给干细胞培养基。
于上述细胞处理装置中,可以进一步具备冷藏保存部,对干细胞培养基进行冷藏保存,配置于包埋构件的外部。
于上述细胞处理装置中,可以进一步具备保管废液的废液保管部,配置于包埋构件的外部;连通送液通路具备使扩增培养器与废液保管部连通的废液送液通路。
于上述细胞处理装置中,扩增培养器可以具备悬浮培养器,悬浮培养器具备:透析管,装有诱导因子导入细胞与培养基;容器,放入了透析管,于透析管的周围装有培养基。
于上述细胞处理装置中,细胞处理器具可以具备:初始化培养器,对诱导因子导入细胞进行培养,配置于包埋构件的内部;扩增培养器,对所确立的由干细胞构成的多个细胞团进行扩增培养,配置于包埋构件的内部;导入细胞送液通路,使初始化培养器与扩增培养器连通,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备驱动部,用以对导入细胞送液通路内的液体进行送液,配置于包埋构件的外部。
于上述细胞处理装置中,驱动部可以与包埋构件的外壁连接。
于上述细胞处理装置中,可以在包埋构件内设有从驱动部传递驱动力的从动部,该从动部与导入细胞送液通路连接。
于上述细胞处理装置中,细胞处理器具可以进一步具备细胞分割器,设于导入细胞送液通路,用以对细胞团进行分割,配置于包埋构件的内部。
于上述细胞处理装置中,细胞处理器具可以具备溶液置换器,对细胞周围的溶液进行置换。
于上述细胞处理装置中,可以进一步具备包含冻结保存液的冻结保存液保存部,配置于包埋构件的外部;连通送液通路具备使冻结保存液保存部与溶液置换器连通的冻结保存液送液通路。
于上述细胞处理装置中,可以进一步具备冻结保存容器,配置于包埋构件的外部,用以保存分散有细胞团的冻结保存液;连通送液通路具备使溶液置换器与冻结保存容器连通的冻结用细胞送液通路。
于上述细胞处理装置中,细胞处理器具可以具备:扩增培养器,对所确立的由干细胞构成的多个细胞团进行扩增培养,配置于包埋构件的内部;溶液置换器,对细胞周围的溶液进行置换;导入细胞送液通路,使扩增培养器与溶液置换器连通,配置于包埋构件的内部。
于上述细胞处理装置中,可以进一步具备驱动部,用以对导入细胞送液通路内的液体进行送液,配置于包埋构件的外部。
于上述细胞处理装置中,驱动部可以与包埋构件的外壁连接。
于上述细胞处理装置中,可以在包埋构件内设有从驱动部传递驱动力的从动部,该从动部与导入细胞送液通路连接。
于上述细胞处理装置中,细胞处理器具可以进一步具备细胞分割器,设于导入细胞送液通路,用以对细胞团进行分割,配置于包埋构件的内部。
于上述细胞处理装置中,细胞处理器具可以具备细胞团分割器,对细胞团进行分割。
发明的效果
根据本发明,可提供能够不对周围造成污染地处理细胞的细胞处理系统及细胞处理装置。
附图说明
图1是实施方式的细胞处理系统的示意性透视图。
图2是实施方式的细胞处理系统的示意性透视图。
图3是实施方式的细胞处理系统的示意性透视截面图。
图4是实施方式的细胞处理系统的示意性截面图。
图5是实施方式的细胞处理系统的示意性透视截面图。
图6是实施方式的细胞处理系统的示意性截面图。
图7是实施方式的细胞处理系统的示意性透视截面图。
图8是实施方式的细胞处理系统的示意性截面图。
图9是实施方式的细胞处理系统的示意性透视图。
图10是实施方式的细胞处理系统的示意性透视图。
图11是实施方式的细胞处理系统的示意性透视截面图。
图12是实施方式的细胞处理系统的示意性透视图。
图13是实施方式的细胞处理系统的示意性透视图。
图14是实施方式的细胞处理系统的示意性透视图。
图15是实施方式的细胞处理系统的示意性截面图。
图16是实施方式的细胞处理装置的示意图。
图17是实施方式的细胞处理装置的导入细胞送液通路的一例的示意性截面图。
图18是实施方式的细胞处理装置的导入细胞送液通路的一例的示意性截面图。
图19是实施方式的细胞处理装置中所使用的培养袋的示意图。
图20是实施方式的悬浮培养器的示意图。
图21是实施方式的补给培养基送液泵与悬浮培养器的示意图。
图22是实施方式的补给培养基送液泵与悬浮培养器的示意图。
图23是实施方式的悬浮培养器与摄影装置的示意图。
图24是实施方式的悬浮培养器与摄影装置的示意图。
图25是实施方式的细胞的图像的一例。
图26是实施方式的中央处理器的示意图。
图27是实施方式的细胞团的图像的一例。
图28是实施方式的进行了二值化处理的细胞团的图像的一例。
图29是实施方式的应用了高通滤波的细胞团的图像的一例。
图30是实施方式的应用了分水岭算法的细胞团的图像的一例。
图31是实施方式的应用了距离变换法的细胞团的图像的一例。
图32是实施方式的应用了分水岭算法的细胞团的图像的一例。
图33是实施方式的分割为多个区域的细胞团的图像的一例。
图34是实施方式的抽出了轮廓的细胞团的图像的一例。
图35是实施方式的抽出了轮廓的细胞团的图像的一例。
图36是实施方式的细胞的尺寸的直方图的一例。
图37是实施方式的悬浮培养器与摄影装置的示意图。
图38是表示实施方式的培养基的ph与培养基的色相的关系的图表的一例。
图39是实施方式的细胞团分割器的示意图。
图40是实施方式的细胞团分割器的示意图。
图41是实施方式的细胞团分割器的示意图。
图42是实施方式的细胞团分割器的示意图。
图43是实施方式的细胞团分割器的示意图。
图44是实施方式的细胞团分割器的示意图。
图45是实施方式的细胞团分割器的示意图。
图46是实施方式的细胞团分割器的示意图。
图47是实施方式的被分割的细胞团的图像的一例。
图48是实施方式的溶液置换器的示意图。
图49是实施方式的细胞处理装置的示意图。
图50是实施方式的细胞处理装置的示意性透视图。
图51是实施方式的细胞处理装置的示意性透视图。
图52是实施方式的细胞处理装置的示意性透视图。
图53是实施方式的细胞处理装置的驱动部的示意性透视图。
图54是实施方式的细胞处理装置的驱动部的示意性透视图。
图55是实施例1的荧光显微镜照片。
图56是表示实施例1的荧光激活流式细胞仪的分析结果的图表。
图57是实施例2的ips细胞集落的照片。
图58是实施例2的ips细胞集落的照片。
图59是实施例2的ips细胞集落的照片。
图60是表示实施例2的ips细胞集落的分化状态的图表。
图61是实施例3的ips细胞集落的照片。
图62是表示实施例4的结果的图表。
图63是实施例5的ips细胞团的照片。
图64是表示实施例5的结果的图表。
具体实施方式
以下,对本发明的实施方式加以说明。在以下附图的记载中,以同一或类似符号表示同一或类似部分。但附图是示意性附图。因此,具体的尺寸等应对照以下的说明来判断。而且,在附图相互之间,当然包含相互的尺寸关系或比率不同的部分。
另外,本公开包含在美国临时提交申请(62/356,199),并且已经签发了外国申请许可的发明。
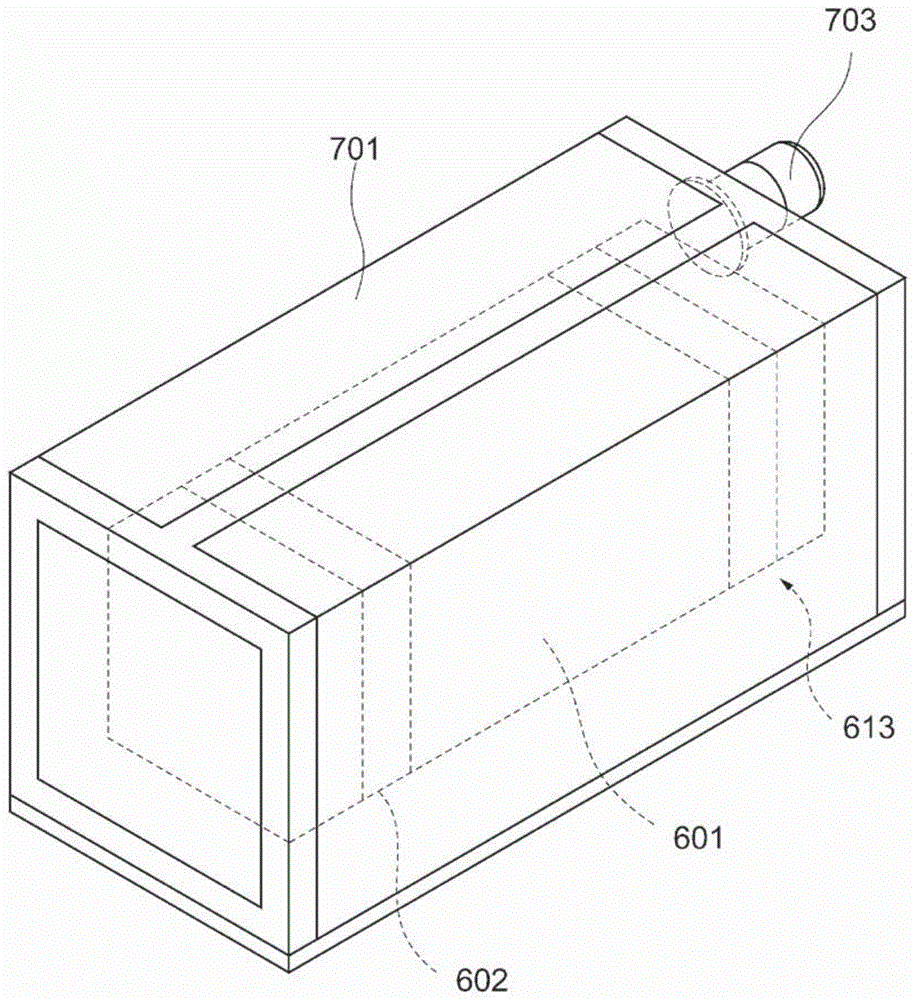
实施方式的细胞处理系统如图1至图3所示那样具备:壳体601;外侧壳体701,对壳体601进行内包;吸气净化过滤器602,设于壳体601,对自壳体601外吸引的气体进行净化;循环装置,以将外侧壳体701内的气体经由吸气净化过滤器602而吸引至壳体601内,将壳体601内的气体排出至外侧壳体701内的方式,使气体在外侧壳体701内,在壳体601内外循环;细胞处理装置,配置在壳体601内,用以对细胞进行处理。
壳体601例如具有长方体形状,但并不特别限定于此。
壳体601例如由可耐受热杀菌或紫外线杀菌的材料形成,但并不特别限定于这些材料。壳体601的至少一部分也可以为透明以能够自外部观察内部。壳体601具有可打开关闭的结构,以使配置于内部的细胞处理装置取出放入。
循环装置例如具备气体排出装置613,其设于壳体601,自壳体601内吸引气体,且将所净化的气体排出至壳体601外。吸气净化过滤器602与气体排出装置613以例如面对的方式进行配置。吸气净化过滤器602例如可使用hepa(highefficiencyparticulateair,高效微粒空气)过滤器及urpa(ultralowparticulateair,超低微粒空气)过滤器,但并不限定于此。根据使用环境,吸气净化过滤器602例如可使用mepa(mediumefficiencyparticulateair,中效微粒空气)过滤器。通过吸气净化过滤器602对自壳体601外部吸引至壳体601中的气体进行净化。
如图3所示,气体排出装置613例如具备:排气装置605,将壳体601内的气体排出到壳体601外;及排气净化过滤器603,对排气装置605所吸引的气体进行净化。排气装置605例如具备风扇。排气净化过滤器603也可以面向排气装置605的上游侧的壳体601内而配置。有难以对作为电气装置的排气装置605进行杀菌的情况。对此,通过在排气装置605的上游侧配置排气净化过滤器603,可抑制排气装置605受污染。气体排出装置613还可以进一步具备配置在排气装置605的下游侧的第2排气净化过滤器606。
排气净化过滤器603及第2排气净化过滤器606的材料例如与吸气净化过滤器602相同。假设壳体601内由于细胞处理装置而被污染,气体被排气净化过滤器603及第2排气净化过滤器606净化后而排出到壳体601外。例如,即便在壳体601内的气体中含有血液成分或病毒,这些杂质也被排气净化过滤器603捕获。而且,即便由于排气装置605而在气体中混入粉尘等,粉尘等也被第2排气净化过滤器606捕获。
如图1至图3所示,外侧壳体701例如具有长方体形状,但并不特别限定于此。外侧壳体701例如由可耐受热杀菌或紫外线杀菌的材料形成,但并不特别限定于这些材料。外侧壳体701的至少一部分也可以为透明以能够自外部观察内部。外侧壳体701具有可打开关闭的结构,以使配置于内部的壳体601取出放入。其中,外侧壳体701优选为可开闭的结构、及在后述的压力调整孔702关闭的状态下,内部完全封闭。
如图3所示,也可以在外侧壳体701设置压力调整孔702,用以调整外侧壳体701内的压力。而且,还可以在外侧壳体701上安装可堵塞压力调整孔702的堵塞构件703。在压力调整孔702上配置过滤器。配置于压力调整孔702的过滤器的材料例如与吸气净化过滤器602相同。
例如,在使外侧壳体701内的气压与外侧壳体701外相同的情况下,可使气体流过压力调整孔702。经由压力调整孔702,自外侧壳体701中通到外部的气体被配置在压力调整孔702上的过滤器净化。而且,经由压力调整孔702,自外侧壳体701外流到内部的气体也被配置于压力调整孔702上的过滤器净化。
如图4所示,外侧壳体701内的气体经由吸气净化过滤器602而被吸引至壳体601内。而且,壳体601内的气体被气体排出装置613排出至外侧壳体701内。因此,在外侧壳体701内,气体在壳体601内外循环。气体在外侧壳体701中,在壳体601内外循环,因此通过吸气净化过滤器602、排气净化过滤器603及第2排气净化过滤器606,不仅对壳体601内的气体进行净化,而且还对壳体601外的外侧壳体701内部的气体进行净化。例如,能够以壳体601内及外侧壳体701内的空气的清洁度成为iso基准14644-1中的iso1至iso6的等级的方式构成细胞处理系统。
如图5及图6所示,可以根据使用环境而省略第2排气净化过滤器606。而且,循环装置还可以进一步具备导入装置608,其设于壳体601,自壳体601外吸引被吸气净化过滤器602净化的气体。导入装置608例如具备风扇。吸气净化过滤器602可以配置在导入装置608的下游侧,面向壳体601内而配置。
另外,如图7及图8所示,细胞处理系统可以同时具备导入装置608及第2排气净化过滤器606。循环装置可以同时具备导入装置608及气体排出装置613,也可以具备其中任一者。
排气装置605及导入装置608的至少一者以如下方式使气体流动:与壳体601外相比而言,壳体601内成为负压。由此可抑制壳体601内的杂质扩散到壳体601外。但也可以根据使用环境,使壳体601内与壳体601外相比而言成为正压。
细胞处理系统还可以具备清洁度传感器,监视壳体601内的气体的清洁度。
细胞处理系统还可以具备二氧化碳浓度管理装置,管理壳体601内的二氧化碳(co2)的浓度。例如,二氧化碳浓度管理装置以使壳体601内的二氧化碳浓度成为规定值、例如管理二氧化碳浓度使其为5%。二氧化碳浓度管理装置还可以具备二氧化碳浓度传感器,监视壳体601内的气体的二氧化碳浓度。
细胞处理系统还可以具备氧浓度管理装置,管理壳体601内的氧(o2)的浓度。例如,氧浓度管理装置可以管理氧浓度以使壳体601内的氧浓度成为20%以下的低氧状态。氧浓度管理装置还可以具备氧浓度传感器,监视壳体601内的气体的氧浓度。
细胞处理系统还可以具备温度管理装置,管理壳体601内的温度。例如,温度管理装置以使壳体601内的温度成为规定值、例如37℃的方式管理温度。温度管理装置例如具备帕尔贴元件。温度管理装置还可以具备温度传感器,监视壳体601内的气体温度。
细胞处理系统还可以进一步具备对壳体601内进行杀菌的杀菌装置。杀菌装置可以是干热杀菌装置。或者,杀菌装置还可以将臭氧气体、过氧化氢气体、或福尔马林气体等杀菌气体或者乙醇等杀菌溶液喷雾或放出至壳体601内,对壳体601内进行杀菌。再或者,杀菌装置还可以对壳体601内照射紫外线(uv)或电子束而对壳体601内进行杀菌。通过对壳体601内进行杀菌,可以在壳体601内反复培养细胞。而且,可以抑制壳体601外被污染,操作者受感染的现象。另外,细胞处理系统还可以进一步具备对外侧壳体701进行杀菌的杀菌装置。
壳体601内可以利用隔板604等划分为多个区域。
如图9、图10及图11所示,细胞处理系统还可以进一步具备遮蔽构件800,能够以遮蔽排气净化过滤器603的方式安装于排气净化过滤器603上。例如,遮蔽构件800具备:壳体侧遮蔽构件801,能够以从壳体601内遮蔽排气净化过滤器603的方式安装于排气净化过滤器603上;排气装置侧遮蔽构件802,能够以从排气装置605侧遮蔽排气净化过滤器603的方式安装于排气净化过滤器603上。
细胞处理系统还可以进一步具备杀菌装置,对被遮蔽构件800遮蔽的排气净化过滤器603进行杀菌。杀菌装置通过与对壳体601内进行杀菌的方法同样的方法,对被遮蔽构件800遮蔽的排气净化过滤器603进行杀菌。通过利用杀菌装置对排气净化过滤器603进行杀菌,可以抑制在更换排气净化过滤器603时,操作者被污染的现象。
通过对被遮蔽构件800遮蔽的排气净化过滤器603进行杀菌,可抑制排气装置605暴露于杀菌环境中,从而造成排气装置605受到损伤的现象。在杀菌装置为干热杀菌装置的情况下,遮蔽构件800例如可以由隔热材料形成。遮蔽构件800的形状并无特别限定,可以是板状,也可以是。
如图10及图11所示,壳体侧遮蔽构件801可以通过导轨811而移动。例如,壳体侧遮蔽构件801可以沿着导轨811,在并未遮蔽排气净化过滤器603的位置与遮蔽排气净化过滤器603的位置之间往返。
排气装置侧遮蔽构件802可以通过导轨812而移动。例如,排气装置侧遮蔽构件802可以沿着导轨812,在并未遮蔽排气净化过滤器603的位置与遮蔽排气净化过滤器603的位置之间往返。
壳体侧遮蔽构件801及排气装置侧遮蔽构件802可以相对于壳体601而在横向方向上移动,也可以如图12所示那样相对于壳体601而在纵向方向上移动。
而且,细胞处理系统还可以进一步具备遮蔽构件,能够以遮蔽第2排气净化过滤器606的方式安装于第2排气净化过滤器606上。例如,可安装于第2排气净化过滤器606上的遮蔽构件具备排气装置侧遮蔽构件,能够以从排气装置605侧遮蔽第2排气净化过滤器606的方式,安装于第2排气净化过滤器606上。
细胞处理系统还可以进一步具备杀菌装置,对被遮蔽构件遮蔽的第2排气净化过滤器606进行杀菌。杀菌装置通过与对壳体601内进行杀菌的方法同样的方法,对被遮蔽构件遮蔽的第2排气净化过滤器606进行杀菌。通过利用杀菌装置对第2排气净化过滤器606进行杀菌,可以抑制在更换第2排气净化过滤器606时,操作者被污染的现象。
通过对被遮蔽构件遮蔽的第2排气净化过滤器606进行杀菌,可抑制排气装置605暴露于杀菌环境中,从而造成排气装置605受到损伤的现象。在杀菌装置为干热杀菌装置的情况下,遮蔽第2排气净化过滤器606的遮蔽构件例如可以由隔热材料形成。遮蔽第2排气净化过滤器606的遮蔽构件的形状并无特别限定,可以是板状,也可以是薄膜状。
遮蔽第2排气净化过滤器606的遮蔽构件可以通过导轨而移动。例如,遮蔽构件可以沿着导轨,在并未遮蔽第2排气净化过滤器606的位置与遮蔽第2排气净化过滤器606的位置之间往返。
而且,细胞处理系统还可以进一步具备遮蔽构件,能够以遮蔽吸气净化过滤器602的方式安装于吸气净化过滤器602上。例如,可安装于吸气净化过滤器602上的遮蔽构件具备:壳体侧遮蔽构件,能够以从壳体601内遮蔽吸气净化过滤器602的方式安装于吸气净化过滤器602上;导入装置侧遮蔽构件,能够以从导入装置608侧遮蔽吸气净化过滤器602的方式安装于吸气净化过滤器602上。
细胞处理系统还可以进一步具备杀菌装置,对被遮蔽构件遮蔽的吸气净化过滤器602进行杀菌。杀菌装置通过与对壳体601内进行杀菌的方法同样的方法,对被遮蔽构件遮蔽的吸气净化过滤器602进行杀菌。通过利用杀菌装置对吸气净化过滤器602进行杀菌,可以抑制在更换吸气净化过滤器602时,操作者被污染的现象。
通过对被遮蔽构件遮蔽的吸气净化过滤器602进行杀菌,可抑制导入装置608暴露于杀菌环境中,从而造成导入装置608受到损伤的现象。在杀菌装置为干热杀菌装置的情况下,遮蔽吸气净化过滤器602的遮蔽构件例如可以由隔热材料形成。遮蔽吸气净化过滤器602的遮蔽构件的形状并无特别限定,可以是板状,也可以是薄膜状。
遮蔽吸气净化过滤器602的遮蔽构件可以通过导轨而移动。例如,遮蔽构件可以沿着导轨,在并未遮蔽吸气净化过滤器602的位置与遮蔽吸气净化过滤器602的位置之间往返。
或者,实施方式的细胞处理系统如图13至图15所示那样具备:壳体601;吸气净化过滤器602,设于壳体601,对自壳体601外吸引的气体进行净化;内部为空洞的送回构件651,用以将从壳体601排出的气体送回至吸气净化过滤器602;循环装置,以将壳体601内的气体排出至送回构件651内,将送回构件651内的气体经由吸气净化过滤器602而吸引至壳体601内的方式,使气体在壳体与送回构件之间循环;细胞处理装置,配置于壳体601内,用以对细胞进行处理。
如图13至图15所示的壳体601可以具备与图1至图9中所说明的壳体601同样的结构。因此,壳体601例如具有长方体形状,但并不特别限定于此。壳体601例如由上述的可耐受杀菌的材料形成,但并不特别限定于这些材料。壳体601的至少一部分也可以为透明以能够自外部观察内部。壳体601具有可打开关闭的结构,以使配置于内部的细胞处理装置取出放入。
循环装置例如具备气体排出装置613,其设于壳体601,自壳体601内吸引气体,且将所净化的气体排出至壳体601外。吸气净化过滤器602与气体排出装置613以例如面对的方式配置。吸气净化过滤器602例如可使用hepa(highefficiencyparticulateair,高效微粒空气)过滤器及urpa(ultralowparticulateair,超低微粒空气)过滤器,但并不限定于此。根据使用环境,吸气净化过滤器602例如可使用mepa(mediumefficiencyparticulateair,中效微粒空气)过滤器。通过吸气净化过滤器602对自壳体601外部吸引至壳体601中的气体进行净化。
在图13至图15所示的细胞处理系统中,也如图3所示那样,气体排出装置613例如具备:排气装置605,将壳体601内的气体排到送回构件651内;及排气净化过滤器603,对排气装置605所吸引的气体进行净化。排气装置605例如具备风扇。排气净化过滤器603也可以面向排气装置605的上游侧的壳体601内而配置。有难以对作为电气装置的排气装置605进行杀菌的情况。对此,通过在排气装置605的上游侧配置排气净化过滤器603,可抑制排气装置605受污染。气体排出装置613还可以进一步具备配置在排气装置605的下游侧的第2排气净化过滤器606。
排气净化过滤器603及第2排气净化过滤器606的材料例如与吸气净化过滤器602相同。假设壳体601内由于细胞处理装置而被污染,气体被排气净化过滤器603及第2排气净化过滤器606净化后而排出到送回构件651内。例如,即便在壳体601内的气体中含有血液成分或病毒,这些杂质也被排气净化过滤器603捕获。而且,即便由于排气装置605而在气体中混入粉尘等,粉尘等也被第2排气净化过滤器606捕获。
如图13至图15所示,送回构件651例如具有与壳体601嵌合的形状,但并不特别限定于此。送回构件651例如具备:内部为空洞的基部652,与壳体601底面相接;第1盖654,使设于基部652的第1开口653与设于壳体601的第1端面的通风部连通;第2盖656,使设于基部652的第2开口655与设于壳体601的通风部连通。
第1盖654例如覆盖作为设于第1端面的通风部的吸气净化过滤器602。第2盖656例如覆盖作为设于第2端面通风部的气体排出装置613。
送回构件651例如与壳体601同样地由可耐受杀菌的材料形成,但并不特别限定于这些材料。送回构件可以是管道。
如图15所示,壳体601内的气体被气体排出装置613排出到送回构件651内。而且,送回构件651内的气体经由吸气净化过滤器602而被吸引至壳体601内。因此,气体在壳体601与送回构件651之间循环。由于气体在壳体601与送回构件651之间循环,因此通过吸气净化过滤器602、排气净化过滤器603及第2排气净化过滤器606,不仅对壳体601内的气体进行净化,而且还对壳体601外的送回构件651的内部气体进行净化。例如,能够以壳体601内及送回构件651内的空气的清洁度成为iso基准14644-1中的iso1至iso6的等级的方式构成细胞处理系统。
在图13至图15所示的细胞处理系统中,也如图5及图6所示那样,可以根据使用环境而省略第2排气净化过滤器606。而且,循环装置还可以进一步具备导入装置608,其设于壳体601,自送回构件651内吸引被吸气净化过滤器602净化的气体。导入装置608例如具备风扇。吸气净化过滤器602可以配置在导入装置608的下游侧,面向壳体601内而配置。
在图13至图15所示的细胞处理系统中,也如图7及图8所示那样,可以同时具备导入装置608及第2排气净化过滤器606。循环装置可以同时具备导入装置608及气体排出装置613,也可以具备其中任一者。
排气装置605及导入装置608的至少一者以如下方式使气体流动:与壳体601外相比而言,壳体601内成为负压。由此可抑制壳体601内的杂质扩散到壳体601外。但也可以根据使用环境,使壳体601内与壳体601外相比而言成为正压。
与图1至图9中所说明的细胞处理系统同样地,图13至图15所示的细胞处理系统可以具备监视壳体601内的气体清洁度的清洁度传感器、管理壳体601内的二氧化碳(co2)浓度的二氧化碳浓度管理装置、管理壳体601内的氧(o2)浓度的氧浓度管理装置、管理壳体601内的温度的温度管理装置、及对壳体601内进行杀菌的杀菌装置的至少任一种。
壳体601内可以利用隔板604等划分为多个区域。
在图13至图15所示的细胞处理系统中,也如图9、图10及图11所示那样,还可以进一步具备遮蔽构件800,能够以遮蔽排气净化过滤器603的方式安装于排气净化过滤器603上。例如,遮蔽构件800具备:壳体侧遮蔽构件801,能够以从壳体601内遮蔽排气净化过滤器603的方式安装于排气净化过滤器603上;排气装置侧遮蔽构件802,能够以从排气装置605侧遮蔽排气净化过滤器603的方式安装于排气净化过滤器603上。
在图13至图15所示的细胞处理系统中,也如图9、图10及图11所示那样,还可以进一步具备杀菌装置,对被遮蔽构件800遮蔽的排气净化过滤器603进行杀菌。杀菌装置通过与对壳体601内进行杀菌的方法同样的方法,对被遮蔽构件800遮蔽的排气净化过滤器603进行杀菌。通过利用杀菌装置对排气净化过滤器603进行杀菌,可以抑制在更换排气净化过滤器603时,操作者被污染的现象。
通过对被遮蔽构件800遮蔽的排气净化过滤器603进行杀菌,可抑制排气装置605暴露于杀菌环境中,从而造成排气装置605受到损伤的现象。在杀菌装置为干热杀菌装置的情况下,遮蔽构件800例如可以由隔热材料形成。遮蔽构件800的形状并无特别限定,可以是板状,也可以是薄膜状。
在图13至图15所示的细胞处理系统中,也如图10及图11所示那样,壳体侧遮蔽构件801可以通过导轨811而移动。例如,壳体侧遮蔽构件801可以沿着导轨811,在并未遮蔽排气净化过滤器603的位置与遮蔽排气净化过滤器603的位置之间往返。
排气装置侧遮蔽构件802可以通过导轨812而移动。例如,排气装置侧遮蔽构件802可以沿着导轨812,在并未遮蔽排气净化过滤器603的位置与遮蔽排气净化过滤器603的位置之间往返。
壳体侧遮蔽构件801及排气装置侧遮蔽构件802可以相对于壳体601而在横向方向上移动,也可以如图12所示那样相对于壳体601而在纵向方向上移动。
而且,在图13至图15所示的细胞处理系统中,还可以进一步具备遮蔽构件,能够以遮蔽图12所示的第2排气净化过滤器606的方式安装于第2排气净化过滤器606上。
例如,可安装于第2排气净化过滤器606上的遮蔽构件具备排气装置侧遮蔽构件,能够以从排气装置605侧遮蔽第2排气净化过滤器606的方式安装于第2排气净化过滤器606上。
在图13至图15所示的细胞处理系统中,也如图12所示那样,还可以进一步具备杀菌装置,对被遮蔽构件遮蔽的第2排气净化过滤器606进行杀菌。杀菌装置通过与对壳体601内进行杀菌的方法同样的方法,对被遮蔽构件遮蔽的第2排气净化过滤器606进行杀菌。通过利用杀菌装置对第2排气净化过滤器606进行杀菌,可以抑制在更换第2排气净化过滤器606时,操作者被污染的现象。
通过对被遮蔽构件遮蔽的第2排气净化过滤器606进行杀菌,可抑制排气装置605暴露于杀菌环境中,从而造成排气装置605受到损伤的现象。在杀菌装置为干热杀菌装置的情况下,遮蔽第2排气净化过滤器606的遮蔽构件例如可以由隔热材料形成。遮蔽第2排气净化过滤器606的遮蔽构件的形状并无特别限定,可以是板状,也可以是薄膜状。
遮蔽第2排气净化过滤器606的遮蔽构件可以通过导轨而移动。例如,遮蔽构件可以沿着导轨,在并未遮蔽第2排气净化过滤器606的位置与遮蔽第2排气净化过滤器606的位置之间往返。
而且,在图13至图15所示的细胞处理系统中,也如图12所示那样,还可以进一步具备遮蔽构件,能够以遮蔽吸气净化过滤器602的方式安装于吸气净化过滤器602上。例如,可安装于吸气净化过滤器602上的遮蔽构件具备:壳体侧遮蔽构件,能够以从壳体601内遮蔽吸气净化过滤器602的方式安装于吸气净化过滤器602上;导入装置侧遮蔽构件,能够以从导入装置608侧遮蔽吸气净化过滤器602的方式安装于吸气净化过滤器602上。
在图13至图15所示的细胞处理系统中,还可以进一步具备杀菌装置,对被遮蔽构件遮蔽的吸气净化过滤器602进行杀菌。杀菌装置通过与对壳体601内进行杀菌的方法同样的方法,对被遮蔽构件遮蔽的吸气净化过滤器602进行杀菌。通过利用杀菌装置对吸气净化过滤器602进行杀菌,可以抑制在更换吸气净化过滤器602时,操作者被污染的现象。
通过对被遮蔽构件遮蔽的吸气净化过滤器602进行杀菌,可抑制导入装置608暴露于杀菌环境中,从而造成导入装置608受到损伤的现象。在杀菌装置为干热杀菌装置的情况下,遮蔽吸气净化过滤器602的遮蔽构件例如可以由隔热材料形成。遮蔽吸气净化过滤器602的遮蔽构件的形状并无特别限定,可以是板状,也可以是薄膜状。
遮蔽吸气净化过滤器602的遮蔽构件可以通过导轨而移动。例如,遮蔽构件可以沿着导轨,在并未遮蔽吸气净化过滤器602的位置与遮蔽吸气净化过滤器602的位置之间往返。
壳体601内所配置的细胞处理装置如图16所示那样,例如具备:分离装置10,自血液中分离细胞;导入前细胞送液通路20,使含有分离装置10中所分离的细胞的溶液通过;诱导因子送液机构21,将多能性诱导因子送至导入前细胞送液通路20内;因子导入装置30,与导入前细胞送液通路20连接,于细胞中导入多能性诱导因子而制作诱导因子导入细胞;细胞团制作装置40,对诱导因子导入细胞进行培养而制作由干细胞构成的多个细胞魂;封装装置100,依序对多个细胞团的各个进行封装。
分离装置10接收例如装有人类血液的小瓶。分离装置10包含抗凝聚剂罐,保存例如乙二胺四乙酸(edta)、肝素、及生物学制剂基准血液保存液a液(acd-a液、泰尔茂株式会社)等抗凝聚剂。分离装置10使用泵等,将抗凝聚剂自抗凝聚剂罐添加至人类血液中。
而且,分离装置10具备分离用试剂罐,保存例如ficoll-paquepremium(注册商标、日本通用电气医疗株式会社)等单核细胞分离用试剂。分离装置10使用泵等,将单核细胞分离用试剂自分离用试剂罐每次5ml地分注于例如2根15ml的试管中。另外,还可以使用树脂袋而替代试管。
另外,分离装置10具备缓冲液罐,保存磷酸盐缓冲生理盐水(phosphatebufferedsaline,pbs)等缓冲液。分离装置10使用泵等,将5ml缓冲液自缓冲液罐加入至例如5ml人类血液中而进行稀释。而且,进一步而言,分离装置10使用泵等,将所稀释的人类血液以每次5ml地加入至试管中的单核细胞分离用试剂上。
分离装置10进一步具备可设定温度的离心机。离心机设定为例如18℃。分离装置10使用移动装置等,将装有单核细胞分离用试剂及人类血液等的试管放到离心机的固定器上。离心机以例如400×g对试管中的溶液进行30分钟的离心。还可以对树脂袋进行离心而替代试管。
在离心后,分离装置10用泵等回收试管中溶液的单核细胞的白色浑浊的中间层。分离装置10使用泵等,将所回收的单核细胞的悬浮液送出至导入前细胞送液通路20。或者,进一步而言,分离装置10将2ml所回收的单核细胞溶液加入至例如12ml的pbs中,将试管放到离心机的固定器上。离心机以例如200×g对管中的溶液进行10分钟的离心。
在离心后,分离装置10使用泵等,将试管中的溶液的上清液吸引除去,将x-vivo10(注册商标、日本龙沙株式会社)等单核细胞培养基3ml加入至试管中的单核细胞溶液中而使其悬浮。分离装置10使用泵等,将单核细胞悬浮液送出至导入前细胞送液通路20。另外,分离装置10还可以使用透析膜,自血液中分离单核细胞。而且,在使用自皮肤等预先分离的纤维母细胞等体细胞的情况下,也可以不使用分离装置10。
分离装置10还可以利用离心分离以外的方法而分离适合诱导的细胞。例如,如果需分离的细胞是t细胞,则可利用淘选(panning)而分离cd3、cd4、cd8的任意一者为阳性的细胞。如果需分离的细胞是血管内皮前体细胞,则可利用淘选而分离cd34为阳性的细胞。如果需分离的细胞是b细胞,则可利用淘选而分离cd10、cd19、cd20的任意一者为阳性的细胞。而且,并不限定于淘选,还可以利用磁性细胞分离方法(macs)或流式细胞仪等进行分离。而且,适合诱导的细胞并不限定于源自血液的细胞。
诱导因子送液机构21具备诱导因子导入试剂罐,保存诱导因子导入试剂溶液等。基因导入试剂溶液等诱导因子导入试剂溶液例如包含人类t细胞nucleofector(humantcellnucleofector)(注册商标、日本龙沙株式会社)溶液等电穿孔溶液、增补物溶液、及质粒套装(plasmidset)。质粒套装例如包含pcxle-hoct3/4-shp53-f0.83μg、pcxle-hsk0.83μg、pce-hul0.83μg、及pcxwb-ebna10.5μg。诱导因子送液机构21使用微泵等,以单核细胞悬浮液悬浮于诱导因子导入试剂溶液中的方式,将诱导因子导入试剂溶液送出至导入前细胞送液通路20。
还可以在导入前细胞送液通路20的内壁涂层细胞不会附着的聚甲基丙烯酸-2-羟基乙酯(poly2-hydroxyethylmethacrylate,poly-hema),使其成为细胞非附着性。或者,导入前细胞送液通路20的材料还可以使用细胞难以附着的材料。而且,导入前细胞送液通路20的材料使用导热率良好、二氧化碳透过性的材料,由此使导入前细胞送液通路20内的条件变得与壳体601内所管理的温度及二氧化碳浓度相同。进一步而言,自防止污染的观点考虑,还可以在导入前细胞送液通路20设有逆流防止阀。
与导入前细胞送液通路20连接的因子导入装置30例如为电穿孔器,接收诱导因子导入试剂溶液与单核细胞悬浮液的混合液,对单核细胞实施质粒的电穿孔。因子导入装置30在实施电穿孔后,在含有对质粒进行了电穿孔的单核细胞的溶液中加入单核细胞培养基。因子导入装置30使用泵等,将含有对质粒进行了电穿孔的单核细胞(以下称为“诱导因子导入细胞”)的溶液送出至导入细胞送液通路31。
另外,因子导入装置30并不限定于电穿孔器。因子导入装置30还可以利用脂转染(lipofection)法将编码的启动因子的rna导入至细胞中。所谓脂转染法是利用电性相互作用而形成作为阴性荷电物质的核酸与阳性荷电脂质的复合物,利用内吞作用(endocytosis)或膜融合而将复合物取入至细胞内的方法。脂转染法具备如下优点:对细胞的损伤少,导入效率优异,操作简单,并不花费时间等。而且,在脂转染法中,并无在细胞的基因组(genome)中插入启动因子的可能性,因此将所获得的干细胞作为全基因组序列,无需确认有无插入外来基因。作为多能性诱导因子的启动因子rna例如包含oct3/4的mrna、sox2的mrna、klf4的mrna、及c-myc的mrna。
在启动因子rna的脂质转染中使用例如小分子干扰rna(sirna)或脂质转染试剂。rna的脂质转染试剂可使用sirna的脂质转染试剂及mrna的脂质转染试剂。更具体而言,rna的脂质转染试剂可使用lipofectamine(注册商标)rnaimax(赛默飞世尔科技,thermofisherscientific)、lipofectamine(注册商标)messengermax(赛默飞世尔科技)、lipofectamin(注册商标)2000、lipofectamin(注册商标)3000、neontransfectionsystem(赛默飞世尔科技)、stemfectrna转染试剂(stemfect)、nextfect(注册商标)rna转染试剂(bioosientific)、amaxa(注册商品)人类t细胞nucleofector(注册商品)试剂盒(龙沙(lonza)公司、vapa-1002)、amaxa(注册商品)人类cd34细胞nucleofector(注册商品)试剂盒(龙沙公司、vapa-1003)、及reprorna(注册商标)转染试剂(干细胞技术有限公司,stemcelltechnologies)等。
因子导入装置30在利用脂转染法将启动因子导入至细胞的情况下,通过诱导因子送液机构21将启动因子rna及试剂等送出至导入前细胞送液通路20。
也可以在导入细胞送液通路31的内壁涂层细胞不会附着的poly-hema而使其成为非附着性。或者,导入细胞送液通路31的材料还可以使用细胞难以附着的材料。而且,导入细胞送液通路31的材料使用导热率良好、二氧化碳透过性的材料,由此使导入细胞送液通路31内的条件变得与壳体601内所管理的温度及二氧化碳浓度相同。进一步自防止污染的观点考虑,还可以在导入细胞送液通路31设有逆流防止阀。而且,在电穿孔后,会产生许多细胞将死、已死的细胞的细胞团。因此,还可以在导入细胞送液通路31设置除去死细胞团的过滤器。或者,还可以如图17所示那样,在导入细胞送液通路31内部设置使内径断续地变化的一个或多个皱襞。再或者,还可以如图18所示那样,使导入细胞送液通路31的内径断续地变化。
如图16所示,与导入细胞送液通路31连接的细胞团制作装置40包含:初始化培养装置50,对在因子导入装置30中制作的诱导因子导入细胞进行培养;第1分割机构60,将在初始化培养装置50中确立的由干细胞构成的细胞团(细胞集落)分割为多个细胞团;扩增培养装置70,对在第1分割机构60中分割的多个细胞团进行扩增培养;第2分割机构80,将在扩增培养装置70中扩增培养的由干细胞构成的细胞团分割为多个细胞团;细胞魂搬送机构90,将多个细胞魂依序送至封装装置100。
初始化培养装置50可以在内部容纳孔板。而且,初始化培养装置50包含移液机。初始化培养装置50自导入细胞送液通路31接收含有诱导因子导入细胞的溶液,利用移液机将溶液分配至孔中。初始化培养装置50在将诱导因子导入细胞分配至孔中之后,在例如第3、5、7日加入stemfit(注册商标、味之素株式会社)等干细胞培养基。还以在培养基中添加碱性的纤维母细胞生长因子(basicfgf)作为增补物。另外,还可以将stembeadsfgf2(funakoshi)这样的将fgf-2(basicfgf、bfgf、fgf-b)持续供给至培养基的缓释性珠粒添加于培养基中。而且,由于存在fgf不稳定的情况,因此还可以使类肝素化聚合物与fgf共轭,从而使fgf稳定化。进一步而言,还可以在培养基中添加转移生长因子β(tgf-β)或激活素(activin)等。初始化培养装置50在将诱导因子导入细胞分配至孔中后,例如在第9日进行培养基更换,以后每隔2日进行培养基更换直至ips细胞的细胞团(集落)超过1mm的程度。另外,所谓更换培养基还包含置换一部分培养基或者补给培养基。
如果形成细胞团,则初始化培养装置50利用移液机回收细胞团,在所回收的细胞团中添加trypleselect(注册商标、生命技术公司)等胰蛋白酶替代重组酶。进一步而言,初始化培养装置50将装有所回收的细胞团的容器放到培养箱中,在37℃、二氧化碳为5%下使细胞团与胰蛋白酶替代重组酶进行10分钟的反应。另外,在使细胞团物理性破碎的情况下,也可以使用胰蛋白酶替代重组酶。例如,初始化培养装置50利用移液机的移液(pipetting)而使细胞团破碎。再或者,初始化培养装置50还可以使细胞团通过设有过滤器的导管(pipe),或使细胞团通过与如图17或图18所示的导入细胞送液通路31同样地使内径断续地变化的导管,从而使细胞团破碎。其后,初始化培养装置50在装有破碎的细胞团的溶液中加入stemfit(注册商标、味之素株式会社)等多能性干细胞用培养基。
另外,初始化培养装置50中的培养还可以不在孔板中进行,而是在二氧化碳透过性袋中进行。而且,培养可以是附着培养,还可以是悬浮培养。在悬浮培养的情况下,还可以进行搅拌培养。而且,培养基还可以是琼脂状。琼脂状的培养基可列举结冷胶(gellangum)聚合物及脱酰化结冷胶聚合物。如果使用琼脂状的培养基,则并无细胞沉淀、或附着的现象,因此虽然是悬浮培养,但可以无需搅拌地制作源自一种细胞的单一细胞团,进一步而言,初始化培养装置50中的培养还可以是悬滴培养。
初始化培养装置50还可以具备第1培养基补给装置,将含有培养液的培养基补给至孔板或二氧化碳透过性袋。第1培养基补给装置还可以回收孔板或二氧化碳透过性袋内的培养液,使用过滤器或透析膜对培养液进行过滤,再利用所净化的培养液。而且,此时还可以在再利用的培养液中添加生长因子等。而且,初始化培养装置50还可以进一步具备管理培养基的温度的温度管理装置、及管理培养基附近的湿度的湿度管理装置等。
在初始化培养装置50中,例如还可以将细胞放入至如图19所示的透析膜等培养液透过性袋301中,将培养液透过性袋301放入至培养液非透过性的二氧化碳透过性袋302中,在袋301、302中放入培养液。初始化培养装置50还可以预先准备多个装有新鲜培养液的袋302,每隔规定的时间将放入了装有细胞的袋301的袋302,更换为装有新鲜培养液的袋302。
而且,初始化培养装置50中的培养方法并不限定于上述方法,还可以使用如图20所示的悬浮培养器。如图20所示的悬浮培养器具备:透析管75,装有诱导因子导入细胞与凝胶培养基;容器76,放入了透析管75,且于透析管75的周围装有凝胶培养基。而且,悬浮培养器还可以在透析管75的周围具备测定凝胶培养基的氢离子指数(ph)的ph传感器。
透析管75由半透膜形成,例如使rock抑制剂透过。透析管75的截留分子量为0.1kda以上、10kda以上、或50kda以上。透析管75例如由纤维素酯、乙基纤维素、纤维素酯类、再生纤维素、聚砜、聚丙烯腈、聚甲基丙烯酸甲酯、乙烯-乙烯醇共聚物、聚酯系聚合物合金、聚碳酸酯、聚酰胺、纤维素乙酸酯、二乙酸纤维素、三乙酸纤维素、铜铵人造丝、碱化纤维素、血仿膜、磷脂酰胆碱膜、及维生素e涂层膜等而形成。
容器76可使用如离心管这样的圆锥管。容器76例如由聚丙烯形成。容器76可以是二氧化碳透过性。二氧化碳透过性的容器76可使用g-rex(注册商标、wilsonwolf)。
诱导因子导入细胞进入至透析管75内。并不对凝胶培养基进行搅拌。而且,凝胶培养基不含饲养细胞。在透析管75上还可以连接用以将含有细胞的培养基送液至透析管75内的送液通路。而且,在透析管75上还可以连接用以将透析管75内的含有细胞的培养基送液至容器外部的送液通路。
凝胶培养基例如通过如下方式而制备:在血液细胞培养基或干细胞用培养基中添加脱酰化结冷胶以使最终浓度成为0.5重量%~0.001重量%、0.1重量%~0.005重量%、或0.05重量%~0.01重量%。例如在初始化培养的开始使用由血液细胞培养基制作的凝胶培养基,其后使用由干细胞用培养基制作的凝胶培养基。
干细胞用培养基例如可使用primateescellmedium(灵长类动物胚胎干细胞培养基)(reprocell)等人类es/ips培养基。
但干细胞用培养基并不限定于此,可使用各种干细胞培养基。例如可利用primateescellmedium、reprostem、reproff、reproff2、reproxf(reprocell)、mtesr1、tesr2、tesre8、reprotesr(干细胞技术公司)、pluristem(注册商标)人类es/ips培养基(merck)、nutristem(注册商标)xf/ff人类ips/es细胞培养基(culturemediumforhumanipsandescells)、pluriton重编程培养基(reprogrammingmedium)(stemgent)、pluristem(注册商标)、stemfitak02n、stemfitak03(味之素)、esc-sure(注册商标)hesc/ips无血清/饲养培养基(serumandfeederfreemediumforhesc/ips)(appliedstemcell)、及l7(注册商标)hpsc培养系统(culturesystem)(龙沙)等。
凝胶培养基可以包含选自由结冷胶、透明质酸、鼠李聚糖胶(rhamsangum)、定优胶(diutangum)、黄原胶、卡拉胶、褐藻糖胶、果胶、果胶酸、果胶酯酸、硫酸乙酰肝素(heparansulfate)、肝素、硫酸乙酰肝素(heparitinsulfate)、硫酸角质素、硫酸软骨素、硫酸皮肤素、硫酸鼠李聚糖、及这些化合物的盐所构成的群的至少一种高分子化合物。而且,凝胶培养基还可以含有甲基纤维素。通过含有甲基纤维素而进一步抑制细胞彼此的凝聚。
或者凝胶培养基还可以含有选自聚(甘油单甲基丙烯酸酯)(pgma)、聚(甲基丙烯酸-2-羟基丙酯)(phpma)、聚(n-异丙基丙烯酰胺)(pnipam)、胺端基、羧酸端基、马来酰亚胺端基、n-羟基丁二酰亚胺(nhs)酯端基、三乙氧基硅烷端基、聚(n-异丙基丙烯酰胺-共-丙烯酰胺)、聚(n-异丙基丙烯酰胺-共-丙烯酸)、聚(n-异丙基丙烯酰胺-共-丙烯酸丁酯)、聚(n-异丙基丙烯酰胺-共-甲基丙烯酸)、聚(n-异丙基丙烯酰胺-共-甲基丙烯酸-共-丙烯酸十八酯)、及n-异丙基丙烯酰胺的至少一种的温度敏感性凝胶。
进入至透析管75内的凝胶培养基也可以不含rock抑制剂。在进入至容器76内的透析管75的周围的凝胶培养基中,例如每日添加rock抑制剂以使最终浓度成为1000μmol/l以上0.1μmol/l以下、100μmol/l以上1μmol/l以下、或5μmol/l以上20μmol/l以下。通过将rock抑制剂添加至透析管75的周围的凝胶培养基中,使rock抑制剂渗透至透析管75内,促进细胞的集落形成。
凝胶培养基例如可以含有碱性成纤维细胞生长因子(basicfibroblastgrowthfactor,bfgf)或tgf-β等生长因子,也可以不含有。
在透析管75内对细胞进行悬浮培养的期间,更换容器76内的透析管75的周围的凝胶培养基。另外,所谓更换培养基,还包括置换一部分培养基或者补充培养基。在这种情况下,也可以不向透析管75内补给凝胶培养基。或者,在透析管75内对细胞进行悬浮培养的期间,向透析管75内补给凝胶培养基。在这种情况下,也可以不向容器76内的透析管75的周围补给凝胶培养基。
实施方式的细胞处理装置如图21所示那样,使用作为培养基补给装置的补给培养基送液泵77,对容器76内的透析管75周围的凝胶培养基进行更换或补给。补给培养基送液泵77可使用在点滴中所使用的泵等。补给培养基送液泵77与悬浮培养器的容器76通过送液管78而连接。补给培养基送液泵77经由送液管78而向悬浮培养器的容器76内送液凝胶培养基。在悬浮培养器的容器76上连接有废液管79。悬浮培养器的容器76内的凝胶培养基经由废液管79而排出。悬浮培养器的容器76内的凝胶培养基例如可通过由补给培养基送液泵77所补给的新鲜的凝胶培养基的压力而排出,也可以利用重力而排出,还可以利用排出泵而排出。
例如以培养器中的凝胶培养基的温度并不急遽变化的方式设定自补给培养基送液泵77送液至培养器的凝胶培养基的温度。例如,在培养器中的凝胶培养基的温度为37℃的情况下,送液至培养器的凝胶培养基的温度也设定为37℃。但是送液至培养器之前的培养基也可以在冷藏保存部,在例如4℃等的低温下进行冷藏保存。
例如,补给培养基送液泵77以如下方式进行控制:使由补给培养基送液泵77送液至悬浮培养器的容器76内的凝胶培养基的量与自悬浮培养器的容器76排出的凝胶培养基的量相同。补给培养基送液泵77可以将凝胶培养基即时送液至悬浮培养器的容器76内,也可以将凝胶培养基以适宜间隔送液至悬浮培养器的容器76内。
在即时送液凝胶培养基的情况下,所送液的凝胶培养基的流量可以固定,也可以不固定。例如,可以如后述那样利用摄影装置监视培养基及培养基中的细胞团,根据培养基及培养基中的细胞团的状态,使所送液的凝胶培养基的流量增加或减少。
而且,也可以并不即时送液凝胶培养基,根据培养基及培养基中的细胞团的状态而进行凝胶培养基的送液的开始及结束。在这种情况下,还可以根据培养基及培养基中的细胞团的状态而使所送液的凝胶培养基的流量增加或减少。
另外,如果送液至培养器的凝胶培养基的流量过大,则存在培养器内的细胞由于凝胶培养基的压力而受到损伤的情况。因此,以细胞不会受到损伤的方式设定送液至培养器的凝胶培养基的流量。
如果不更换培养基地继续细胞的培养,则细胞所排出的乳酸等废弃物的蓄积或ph的变化会对细胞培养造成不良影响。而且,培养基中所含的bfgf或重组蛋白质等各种蛋白质分解,细胞培养所需的成分可能由于培养基而受损。
相对于此,可以通过利用补给培养基送液泵77将新鲜的培养基送液至培养器中,将旧的培养基自培养器中排出,从而自培养器中除去废弃物,将培养基中的ph保持为适宜的范围内,补给细胞的培养中所需的成分。由此可将培养基的状态保持为接近一定的状态。
另外,在图21中显示利用送液管78连接补给培养基送液泵77与悬浮培养器的容器76的例子。相对于此,还可以如图22所示那样,利用送液管78将补给培养基送液泵77与悬浮培养器的容器76内的透析管75内连接。通过将新鲜的凝胶培养基送液至透析管75内,将透析管75内的培养基中所含的废弃物排出至透析管75外。而且,可以将透析管75内的培养基的ph保持为适宜的范围内,对透析管75内的培养基补给细胞培养所需的成分。
细胞处理系统还可以进一步具备对图16所示的初始化培养装置50中的培养进行摄影的照相机或摄像机等初始化培养摄影装置。此处,如果在初始化培养装置50中所使用的培养基中使用无色的培养基,则变得可抑制在使用有色培养基的情况下所可能产生的漫反射或自体荧光。但是,为了确认培养基的ph,还可以含有酚红等ph指示剂。而且,在被诱导的细胞与未被诱导的细胞中,细胞的形状及大小等不同,因此细胞处理系统还可以进一步具备诱导状态监视装置,通过对初始化培养装置50中的细胞进行摄影,算出被诱导的细胞的比率。或者,诱导状态监视装置还可以利用抗体免疫染色法或rna抽出法而确定被诱导的细胞的比率。进一步而言,细胞处理系统还可以具备未诱导细胞除去装置,利用磁性细胞分离方法或流式细胞仪等将未被诱导的细胞除去。
此处,在如培养皿这样的平坦的皿上培养细胞的情况下,细胞的存在范围平面性地扩大。因此,如果以摄影装置的透镜的光轴与皿面正交的方式配置摄影装置与培养皿,则可以聚焦于培养皿上的几乎所有细胞上。
然而,在使细胞在培养基中浮动而进行悬浮培养的情况下,细胞的存在范围会三维地扩大,因此在自摄影装置至各细胞的光轴方向的距离上产生偏差。因此,不使用透镜可能变得难以聚焦于所有细胞上。
对此,可以通过如下方式使景深变深:使用明亮的透镜(f值小的透镜),或者对被测定对象物照射明亮的照明,尽可能地缩小透镜的光圈而进行拍摄。
或者,还可以一面使透镜的焦点位置每次稍许地变化,一面拍摄多张图像,对所拍摄的多张图像进行合成,模拟地获得较深地聚焦的图像。而且,多张图像的各个成为聚焦的细胞的与并未聚焦的模糊的细胞混杂的图像。因此,可以自多张图像收集聚焦的部分图像而合成1枚合成图像。
或者,还可以如图23所示那样,在初始化培养摄影装置171与悬浮培养器内的细胞等被拍摄体之间配置焦阑透镜172。焦阑透镜172使自细胞等被拍摄体通过透镜光圈中心的主光线与透镜光轴平行,因此即使自初始化培养摄影装置171至悬浮培养器内的多个细胞的各个的距离不一样,所拍摄的细胞的大小也不根据距离而变化。
图24是自上方观看图23所示的悬浮培养器等的示意图。另外,在图24中,省略图23中所示的容器76。在利用初始化培养摄影装置171对细胞进行拍摄的情况下,还可以使用散射光照明法,即在相对于初始化培养摄影装置171的光轴垂直的方向、或自垂直的方向接近摄影装置的方向配置细胞观察用照明光源173,自细胞观察用照明光源173对细胞照射照明光。因此,与细胞接触的照明光的散射光到达初始化培养摄影装置171,但并不与细胞接触的照明光透过培养基而变得并未到达初始化培养摄影装置171。
因此,在图像中,培养基的部分相对地变暗,细胞的部分相对地变亮。但是,如果可以在图像中识别细胞,则照明法并不限定于此。图25是利用散射光照明法所拍摄的细胞的图像的一例。培养基的部分相对地变暗,细胞的部分相对地变亮。
实施方式的细胞处理系统还可以如图26所示那样具备中央处理器(centralprocessingunit,cpu)500,该cpu500具备对初始化培养摄影装置171所拍摄的图像进行图像处理的图像处理部501。还可以在cpu500上连接键盘及鼠标等输入装置401、以及显示器等输出装置402。cpu500经由总线及图像接口等而自初始化培养摄影装置171接收图像。
图像处理部501还可以具备轮廓定义部511,其在细胞的图像中,定义细胞或细胞团的轮廓。图27是经由微距变焦透镜等而放大拍摄的ips细胞团的图像的一例。在图27所示的图像中,看上去为白块的部分是ips细胞团,背景暗的部分是培养基。
此处,在图27所示的图像为8位的灰度图像的情况下,如果对图像施加二值化处理,即为将具有规定阈值以上的亮度值的像素的亮度值设为例如255这样的最高亮度值,将具有不足规定阈值的亮度值的像素的亮度值置换为例如0这样的最低亮度值,则如图28所示那样,不仅培养基的部分,而且细胞团的内部也成为最低亮度的黑色,可能产生细胞团的内部与培养基的部分连结的部分。因此,在二值化处理中,存在无法抽出细胞或细胞团的情况。
对此,图26中所示的实施方式的细胞处理系统的轮廓定义部511对细胞的图像应用高通滤波,即为使空间频率中所含的规定频率以上的高频成分通过,阻挡不足规定频率的低频成分,将亮度值设为例如0这样的最低值。在细胞的图像中,在细胞或细胞团的部分中,空间频率中所含的高频成分多,在培养基的部分中,空间频率中所含的高频成分少。因此,如图29所示那样,在应用高通滤波的细胞的图像中,培养基部分的亮度值成为例如0这样的最低值,在细胞或细胞团的部分中,亮度值成为原来的值。因此,可以将亮度未成为最低值的部分视为细胞或细胞团。
此处,在图29所示的图像中,即是将亮度未成为最低值的部分作为斑点(blob),利用斑点分析进行检测,也存在例如将相互相接的2个细胞团识别为1个细胞团的情况。
对此,图26中所示的实施方式的细胞处理系统的轮廓定义部511对应用了高通滤波的图像应用分水岭算法。分水岭算法以如下方式进行图像的分割:将图像的亮度梯度视为山的起伏,将自山高的位置(亮度值大的位置)向较低的位置(亮度值小的位置)流入的水所形成的区域作为1个区域。
例如,实施方式的细胞处理系统的轮廓定义部511在对图像应用分水岭算法之前,用距离变换法对图像进行转换。所谓距离变换法是根据到最近的背景像素的距离而对图像的各像素的亮度值进行置换的图像转换的方法。例如,如图30(a)所示那样,在应用高通滤波的图像中,将培养基区域的亮度值一次性转化为最高亮度值255,如图30(b)所示那样设为白的背景。进一步将细胞区域内部的各像素的亮度值,根据到最近的背景像素的距离而转换为0以上、不足255。例如,越远离最近的背景像素,亮度值越变低。
其次,实施方式的细胞处理系统的轮廓定义部511对利用距离变换法进行了转换的图像应用分水岭算法。在图30(b)所示的图像中,将亮度低的较暗的部分视为山峰,相对于图像而自垂直方向上使水落下时,如图30(c)的箭头所示那样,推测水如何向前流动,如图30(c)的虚线所示那样,将自各种方向流来的水碰撞的部位视为谷,在该谷底中对细胞区域进行分割。
如果利用距离变换法对图29中所示的图像的细胞区域的像素进行转换,则获得图31所示的图像。如果对图31所示的图像应用分水岭算法,则获得图32所示的图像。如果使所获得的分割线与图27所示的原来的图像重叠,则获得图33所示的图像。
在图33中,存在于由分割线所分割的各区域的细胞团并非多个细胞团相接而成的团,可视为1个细胞团。
因此,在各区域中,如图34所示那样抽出细胞团的轮廓,由此变得可正确地抽出1个细胞团。
图26所示的实施方式的细胞处理系统的图像处理部501还可以进一步具备细胞评价部512。细胞评价部512对轮廓定义部511所抽出的1个细胞团的大小等进行评价。例如,细胞评价部512算出轮廓定义部511所抽出的1个细胞团的面积。
进一步而言,例如在将1个细胞团的形状视为圆形的情况下,细胞评价部512使用下述式(1),根据面积而算出1个细胞团的直径。
d=2(s/π)1/2(1)
此处,d表示直径,s表示面积。
如果细胞团生长得过大,则存在培养基中所含的营养或激素并未到达内部,造成细胞分化的情况。而且,如果以细胞团过小的状态移动至并未使用rock抑制剂的扩增培养中,则存在有细胞死亡或核型异常的情况。因此,细胞评价部512还可以在各个细胞团的大小成为适宜的范围外的情况下发出警告。而且,细胞评价部512还可以在各个细胞团的大小成为规定阈值以上的情况下,输出此时是移动至扩增培养的时机。进一步而言,还可以根据所算出的细胞团的大小,使初始化培养装置50中的培养基的供给速度发生变化。例如,可以使培养基的供给速度随着细胞团的大小变大而上升。
实施方式的细胞处理系统的图像处理部501还可以进一步具备统计处理部513,对由进行了图像处理的图像所获得的信息进行统计处理。图35是对图25所示的图像进行图像处理,抽出细胞团部分而赋予轮廓的例子。图36是基于图35所示的图像而制作的细胞团尺寸的直方图的一例。如上所述,连续且定期地获得细胞的信息,由此可定量地掌握细胞团的生长度、数量、及密集度等,可使培养结果稳定化。而且,还可以根据所算出的细胞团的数量而使初始化培养装置50中的培养基的供给速度变化。例如,可以使培养基的供给速度随着细胞团数量的增加而上升。
图26中所示的实施方式的细胞处理系统的图像处理部501还可以进一步具备密度算出部514,根据培养基的图像算出培养基的浊度,基于培养基的浊度而算出培养基中的细胞团的密度。
例如,在cpu500上连接有具备挥发性存储器、或非挥发性存储器等关系储存装置403。关系储存装置403保存例如预先获得的培养基的浊度与培养基中的细胞团的密度的关系。密度算出部514自关系储存装置403读取浊度与密度的关系。进一步而言,密度算出部514基于根据培养基的图像而算出的培养基的浊度值、浊度与密度的关系,算出培养基中的细胞团的值的密度。由此,能够无需自培养基选取细胞团,非破坏性地测定细胞团的密度。
而且,密度算出部514还可以在细胞团的密度成为规定阈值以上的情况下,输出此时是移动至扩增培养的时机。进一步而言,密度算出部514还可以经时性算出培养基中的细胞团的密度,从而算出细胞团的增殖速度。异常的增殖速度有时表示细胞异常。例如密度算出部514在算出异常的增殖速度的情况下,发出警告。在这种情况下,可以中止细胞的培养。
如果培养基中的细胞团的密度变高,细胞团彼此的距离变得过近,则存在多个细胞团彼此附着而成为一个大的细胞团的情况。在大的细胞团中,培养基中所含的营养或激素并未到达内部,造成内部的细胞分化的情况。另一方面,如果培养基中的细胞团的密度低于适宜的范围,则存在细胞团的生长速度、及细胞团的形成能力显著降低的情况。
对此,如果利用密度算出部514,则可以算出细胞团的密度,因此可以容易地判断细胞团的密度是否为适宜的范围内。在细胞团的密度低于适宜的范围的情况下,例如可以作出中止培养的判断。进一步而言,可以根据所算出的细胞团的密度而使初始化培养装置50中的培养基的供给速度发生变化。例如,可以使培养基的供给速度随着细胞团的密度增加而上升。
而且,为了观察细胞代谢等所伴随的培养基的颜色的变化,可以如图37所示那样,在夹着悬浮培养器而与初始化培养摄影装置171面对的位置配置培养基观察用照明光源174。培养基观察用照明光源174例如可使用面光源,培养基观察用照明光源174例如发出白色平行光。培养基观察用照明光源174所发出的照明光透过培养基而射入至初始化培养摄影装置171,因此可利用初始化培养摄影装置171而拍摄培养基的颜色。
通常在进行细胞培养的情况下,培养基的ph设为6.8至7.2附近的固定值。在测定培养基的ph时,在培养基中添加酚红等ph试剂。酚红由于培养基的ph而变化。在与培养基相接的气体中的二氧化碳浓度不充分的情况下,培养基中所含的源自重碳酸的二氧化碳与气体中的二氧化碳变得并不平衡,因此培养基成为碱性,培养基的颜色成为红紫色。而且,如果蓄积了以细胞所排出的乳酸为主的废弃物,培养基成为酸性,培养基的颜色成为黄色。培养基成为酸性表示培养基中的营养成分枯竭。
图26所示的实施方式的细胞处理系统的图像处理部501还可以进一步具备培养基评价部515,基于利用培养基观察用照明光源而照明的培养基的图像,进行培养基的评价。培养基评价部515例如对培养基的图像进行图像处理,根据hsv而以色相(hue)、色度(saturation)、明度(value)这3个参数表现培养基的颜色。其中,色相一般是与“色调”或“色泽”的概念对应的参数。色相一般用角度的单位来表示。
图38是表示并未更换培养基而长时间培养细胞的情况下的培养基的色相变化与培养基的ph变化的关系的图表的一例。在培养开始之后,培养基的ph为7.7附近,但随着时间的经过,培养基的ph减低至7.1附近。伴随于此,培养基的色相虽然在培养开始之后为40附近,但随着时间的经过,上升至60附近。
如上所述,培养基的色相与培养时间、及培养基的ph相关。因此,图26所示的培养基评价部515通过监视培养基的色相而判断培养基的状态。
例如,关系储存装置403保存预先获得的培养基的色相与培养基的ph。培养基评价部515自关系储存装置403读取色相与ph的关系。进一步而言,培养基评价部515基于根据培养基的图像而算出的培养基的色相的值、色相与ph的关系,算出所摄影的培养基的ph值。例如,培养基评价部515还可以经时性地获得培养基的图像,算出培养基的ph值。
另外,还可以如图22所示那样利用ph传感器271测定培养基的ph。而且,还可以利用温度计272测定培养基的温度。在这种情况下,培养基评价部515可以自ph传感器271接收培养基的ph值,还可以自温度计272接收培养基的温度值。
培养基评价部515在培养基的色相或培养基的ph成为规定范围以外的情况下,可以判断为促进培养基的更换,或判断为在培养基中产生污染。另外,所谓更换培养基,还包括置换一部分培养基或者补充培养基。
对培养基的成分进行化学分析的方法存在如下的可能:消耗成本,而且为了对培养基进行化学分析而将培养基取出至系统的外部,无法保持培养基的无菌状態。相对于此,通过监视培养基的色相而监视培养基的状态的方法的,其成本低,而且不会对培养基的无菌状态造成影响。
在培养基评价部515判断培养基的色相或培养基的ph为规定的范围以外的情况下,利用例如图21所示的补给培养基送液泵77更换悬浮培养器的透析管75的周围的培养基。或者,在一直进行培养基的更换的情况下,利用补给培养基送液泵77的悬浮培养器的透析管75的周围的培养基的更换速度上升,所更换的培养基的流量上升。由此可将培养基的ph维持为适合细胞培养的范围,可对培养基补给充分的营养成分。
进一步而言,培养基评价部515可以根据培养基的色相的变化速度而算出细胞的增殖速度。例如,关系储存装置403保存预先获得的培养基的色相的变化速度与细胞的增殖速度的关系。培养基评价部515自关系储存装置403读取色相的变化速度与增殖速度的关系。进一步而言,培养基评价部515基于所算出的色相的变化速度的值、色相的变化速度与增殖速度的关系,算出细胞的增殖速度的值。
而且,在培养基评价部515判断培养基的温度为规定的范围以外的情况下,还可以以变更培养器的周围的温度、或所供给的培养基的温度的方式控制温度管理装置。例如,在培养基的温度低于规定的范围的情况下,培养基评价部515以提高培养基的温度的方式控制温度管理装置。而且,在培养基的温度高于规定的范围的情况下,培养基评价部515以降低培养基的温度的方式控制温度管理装置。
在图16所示的初始化培养装置50上连接第1细胞团送液通路51。初始化培养装置50使用泵等将含有胰蛋白酶替代重组酶与细胞团的液体送出至第1细胞团送液通路51。另外,在使细胞团物理性破碎的情况下,也可以不使用胰蛋白酶替代重组酶。
而且,第1细胞团送液通路51与分支流路连接,该分支流路具有仅仅使不足规定大小的被诱导的细胞通过的内径,将规定大小以上的未被诱导的细胞除去。如上所述,在使用凝胶培养基的情况下,可以通过抽出凝胶培养基来回收细胞团。
还可以在例如图26所示的细胞评价部512所算出的细胞团的大小的值成为规定阈值以上的情况下,驱动泵,使其将含有细胞团的溶液送出至第1细胞团送液通路51。或者,还可以在例如图26所示的密度算出部514所算出的细胞团的密度的值成为规定阈值以上的情况下,驱动泵,使其将含有细胞团的溶液送出至图16所示的第1细胞团送液通路51。
还可以在图16所示的第1细胞团送液通路51的内壁涂层细胞不会附着的poly-hema而使其成为细胞非附着性。或者,第1细胞团送液通路51的材料还可以使用细胞难以附着的材料。而且,第1细胞团送液通路51的材料使用导热率良好、二氧化碳透过性的材料,由此使第1细胞团送液通路51内的条件变得与壳体601内所管理的温度及二氧化碳浓度相同。进一步自防止污染的观点考虑,还可以在第1细胞团送液通路51设有逆流防止阀。
第1细胞团送液通路51与第1分割机构60连接。第1分割机构60例如具备筛网。溶液中所含的细胞团由于水压而通过筛网时,被分割为筛网的各孔大小的多个细胞团。例如,如果筛网的各孔大小均一,则分割后的多个细胞团的大小也变得基本均一。或者,第1分割机构60还可以具备管嘴。例如,通过将略圆锥状的管嘴的内部微细加工为阶梯状,在溶液中所含的细胞团通过管嘴时,被分割为多个细胞团。
再或者,第1分割机构60还可以具备细胞团分割器,该细胞团分割器如图39所示那样具备末端区块61、连结区块62、及前端区块63。末端区块61、连结区块62、及前端区块63分别在内部设有贯通孔,使含有细胞团的培养基流过该贯通孔。如图40及图41所示那样,末端区块61、连结区块62、及前端区块63互相连结。细胞团分割器可以具备一个连结区块62,也可以具备多个连结区块62。
如图39所示,在连结区块62的第1端部设有凹部62a,在与连结区块62的第1端部对面对的第2端部设有凸部62b。凸部62b例如为圆柱状。如图40及图41所示,在具备多个连结区块62的情况下,凸部62b与邻接的连结区块62的凹部62a嵌合。图39所示的凸部62b的侧壁可以是平滑的,也可以设有外螺纹。凹部62a的内壁可以是平滑的,也可以设有内螺纹。
在连结区块62上所设的贯通孔具有:第1大孔径部62c,与凹部62a连通;小孔径部62d,与第1大孔径部62c连通,孔径比第1大孔径部62c小;第2大孔径部62e,与小孔径部62d连通,孔径比小孔径部62d大,在凸部62b的前端具有开口。
第1大孔径部62c、小孔径部62d、及第2大孔径部62e的各个的剖面形状例如为圆形。第1大孔径部62c的孔径与第2大孔径部62e的孔径例如相同。由此在如图40及图41所示那样具有多个连结区块62,多个连结区块62连结的情况下,第2大孔径部62e与所邻接的连结区块62的第1大孔径部62c可以平滑地连通。
图39所示的第1及第2大孔径部62c、62e的孔径例如为2.0mm以上4.0mm以下,但并无特别限定。小孔径部62d的孔径例如为0.4mm以上1.2mm以下,但并无特别限定。在第1大孔径部62c至小孔径部62d中连续的部分形成台阶。而且,在小孔径部62d至第2大孔径部62e中连续的部分形成有台阶。台阶的侧壁可以相对于贯通孔的中心轴而垂直,也可以倾斜为不足90°。
连结区块62的第1及第2大孔径部62c、62e的中心轴与小孔径部62d的中心轴可以一致。或者,可以如图42所示那样,连结区块62的第1及第2大孔径部62c、62e的中心轴与小孔径部62d的中心轴偏移。
在图39所示的前端区块63的第1端部设有凹部63a,在与前端区块63的第1端部面对的第2端部设有管嘴部63b。在将前端区块63与连结区块62连结时,前端区块63的凹部63a与连结区块62的凸部62b嵌合。凹部63a的内壁可以是平滑的,也可以设有内螺纹。
设于前端区块63的贯通孔包具有:大孔径部63c,与凹部63a连通;小孔径部63d,与大孔径部63c连通,孔径小于大孔径部63c,在管嘴部63b的前端具有开口。
大孔径部63c及小孔径部63d的各个的剖面形状例如为圆形。前端区块63的大孔径部63c的孔径与连结区块62的第2大孔径部62e的孔径例如相同。由此,在如图40及图41所示那样将连结区块62与前端区块63连结的情况下,连结区块62的第2大孔径部62e与邻接的前端区块63的大孔径部63c可以平滑地连通。
图39所示的大孔径部63c的孔径例如为2.0mm以上4.0mm以下,但并无特别限定。小孔径部63d的孔径例如为0.4mm以上1.2mm以下,但并无特别限定。在大孔径部63c至小孔径部63d中连续的部分中形成台阶。台阶的侧壁可以相对于贯通孔的中心轴而垂直,也可以倾斜为不足90°。
在末端区块61的第1端部设有凹部61a,在与末端区块61的第1端部面对的第2端部设有凸部61b。在将末端区块61与连结区块62连结时,末端区块的凸部61b与连结区块62的凹部62a嵌合。末端区块的凸部61b的侧壁可以是平滑的,也可以设有外螺纹。
设于末端区块61的贯通孔至少具有与凹部61a连通,于凸部61b的前端具有开口的大孔径部61c。
凹部61a及大孔径部61c的各个的剖面形状例如为圆形。末端区块61的大孔径部61c的孔径与连结区块62的第2大孔径部62e的孔径例如相同。由此,在如图40及图41所示那样将末端区块61与连结区块62连结的情况下,末端区块61的大孔径部61c与邻接的连结区块62的大孔径部62c可以平滑地连通。
图39所示的大孔径部61c的孔径例如为2.0mm以上4.0mm以下,但并无特别限定。
末端区块61、连结区块62、及前端区块63的各个的材料可列举聚丙烯等树脂,但并不限定于此。
如图40、图41、及图42所示那样,在末端区块61的凹部61a插入例如插入管嘴64。在插入管嘴64上,直接或经由管等而连接有吸引排出器,将含有细胞团的培养基吸引排出。将末端区块61、连结区块62、及前端区块63连结,将前端区块63的管嘴部63b刺入至含有细胞团的培养基,利用吸引排出器进行1次培养基的吸引排出,或者反复进行培养基的吸引排出,含有细胞团的培养基在连结区块62、及前端区块63内的贯通孔内往返。在连结区块62、及前端区块63内的贯通孔设有台阶,因此可将培养基中的细胞团有效地分割为小的细胞团。
目前,细胞团的分割是技术人员使用吉尔森p型移液器(pipetman)等而进行。然而,如图47(a)所示那样,在现有的方法中,所分割的细胞团的大小不均一。而且,由于技术人员,所获得的细胞团的大小就会不一样。如果分割后的细胞团过大,则存在培养基中所含的营养或激素未能到达内部,造成细胞分化的情况。而且,如果细胞团过小,则在并未使用rock抑制剂的情况下,存在有细胞死亡或核型异常的情况。相对于此,如果使用如图40、图41、及图42中所示的细胞团分割器,则可以如图47(b)所示那样将细胞团分割为均一大小的细胞团。另外,在使用细胞团分割器而对细胞团进行分割时,培养基还可以含有胰蛋白酶、或trypleexpress(注册商标、赛默飞世尔科技)、trypleselect(注册商标、赛默飞世尔科技)、或trypleselect(注册商标、赛默飞世尔科技)等酶。而且,还可以通过增加连结区块62,或使吸引排出培养基时的压力上升而使细胞团分解至单细胞。
另外,在决定大孔径部与小孔径部的适当的重复数、长度等的情况下,细胞团分割器也可以不包含多个区块。例如,细胞团分割器具备如图43中所示的在内部具有贯通孔的一体式柱状形状,含有细胞团的培养基流过的贯通孔可以交互具有大孔径部65a、65c、65e、65g与小孔径部65b、65d、65f,所述小孔径部65b、65d、65f与大孔径部65a、65c、65e、65g连通,孔径比大孔径部65a、65c、65e、65g小。在这种情况下,也如图44所示那样,大孔径部65a、65c、65e、65g的中心轴可以与小孔径部65b、65d、65f的至少一部分的中心轴偏移。
而且,可以使培养基仅通过1次细胞团分割器而将培养基中的细胞团分割为小的细胞团。在这种情况下,可以如图45所示那样,在细胞团分割器的两端设置可插入管等的插入部66a、66b。培养基自插入部66a起经过贯通孔而从插入部66b排出,其间培养基中所含的细胞团被分割。在这种情况下,也如图46所示那样,大孔径部65a、65c、65e、65g的中心轴可以与小孔径部65b、65d、65f的至少一部分的中心轴偏移。
在图16中所示的第1分割机构60上连接有扩增培养装置70。被第1分割机构60分割的含有细胞团的溶液被送至扩增培养装置70。
扩增培养装置70可以在内部容纳孔板。而且,扩增培养装置70具备移液机。扩增培养装置70自第1分割机构60接收含有多个细胞团的溶液,利用移液机而将溶液分配至孔中。扩增培养装置70在将细胞团分配至孔中后,在37℃、二氧化碳为5%下对细胞团进行例如8日左右的培养。
而且,扩增培养装置70适宜地进行培养基更换。
其后,扩增培养装置70对细胞团添加trypleselect(注册商标、生命技术公司)等胰蛋白酶替代重组酶。进一步而言,扩增培养装置70将装有细胞团的容器放到培养箱中,在37℃、二氧化碳为5%下使细胞团与胰蛋白酶替代重组酶进行1分钟的反应。另外,在使细胞团物理性破碎的情况下,也可以并不使用胰蛋白酶替代重组酶。例如,扩增培养装置70利用移液机的移液而使细胞团破碎。再或者,扩增培养装置70还可以使细胞团通过设有过滤器的导管,或与图17或图18所示的导入细胞送液通路31同样地使内径断续地变化的导管,从而使细胞团破碎。其后,扩增培养装置70在进入有细胞团的溶液中加入维持培养的培养基等培养基。进一步而言,扩增培养装置70在附着培养的情况下,用自动细胞刮刀等而自容器剥下细胞团,将含有细胞团的溶液经由扩增培养送液通路71送至第1分割机构60。
另外,扩增培养装置70中的培养还可以并不在孔板中进行,而是在二氧化碳透过性袋中进行。而且,培养可以是附着培养,也可以是悬浮培养,还可以是悬滴培养。在悬浮培养的情况下,还可以进行搅拌培养。而且,培养基还可以是琼脂状。琼脂状的培养基可列举结冷胶(gellangum)聚合物及脱酰化结冷胶聚合物。如果使用琼脂状的培养基,则并无细胞沉淀、或附着的现象,因此虽然是悬浮培养,但无需搅拌。
扩增培养装置70还可以具备第2培养基补给装置,将培养液补给至孔板或二氧化碳透过性袋。第2培养基补给装置还可以回收孔板或二氧化碳透过性袋内的培养液,使用过滤器或透析膜对培养液进行过滤,再利用所净化的培养液。而且,此时还可以在再利用的培养液中添加生长因子等。而且,扩增培养装置70还可以进一步具备管理培养基的温度的温度管理装置、及管理培养基附近的湿度的湿度管理装置等。
在扩增培养装置70中,例如还可以将细胞放入至如图19所示的透析膜等培养液透过性袋301中,将培养液透过性袋301放入至培养液非透过性的二氧化碳透过性袋302中,在袋301、302中放入培养液。初始化培养装置50还可以预先准备多个装有新鲜培养液的袋302,每隔规定的时间将装有加入细胞的袋301的袋302,更换为装有新鲜培养液的袋302。
而且,扩增培养装置70中的培养方法并不限定于上述方法,可以与初始化培养装置50中的培养方法同样地使用如图20中所示的悬浮培养器。在扩增培养装置70中,在图20中所示的悬浮培养器的透析管75中放入多个细胞团。悬浮培养器的详细如上所述。而且,在扩增培养装置70中,也如图21所示那样,使用补给培养基送液泵77而对容器76内的透析管75的周围的凝胶培养基进行更换或补给。或者,还可以如图22所示那样,利用送液管78将补给培养基送液泵77与悬浮培养器的容器76内的透析管75内连接,对透析管75内的培养基补给细胞培养所需的成分。
细胞处理系统可以进一步具备对图16所示的扩增培养装置70中的培养进行摄影的扩增培养摄影装置。此处,如果在扩增培养装置70中所使用的培养基中使用无色的培养基,则可以抑制在使用有色培养基的情况下所可能产生的漫反射或自体荧光。但是,为了确认培养基的ph,还可以含有酚红等ph指示剂。
而且,在被诱导的细胞与未被诱导的细胞中,细胞的形状及大小等不同,因此细胞处理系统还可以进一步具备诱导状态监视装置,通过对扩增培养装置70中的细胞进行摄影,算出被诱导的细胞的比率。或者,诱导状态监视装置还可以利用抗体免疫染色法或rna抽出法来确定被诱导的细胞的比率。进一步而言,细胞处理系统还可以具备未诱导细胞除去装置,利用磁性细胞分离方法或流式细胞仪等将未被诱导的细胞除去。
扩增培养摄影装置与图23中所示的初始化培养摄影装置171同样,可以经由焦阑透镜172而对扩增培养装置70中的培养摄影。扩增培养摄影装置进行摄影时的照明方法等也和初始化培养摄影装置171进行摄影时的照明方法等同样,如上所述。
扩增培养摄影装置还与图26中所示的具备图像处理部501的cpu500连接。图像处理部501,其具备轮廓定义部511、细胞评价部512、统计处理部513、密度算出部514、及培养基评价部515,与初始化培养摄影装置171所拍摄的图像同样地,对扩增培养摄影装置所拍摄的图像进行图像处理。图像处理部501的详细如上所述。
例如,在扩增培养中,如果细胞团生长得过大,则存在培养基中所含的营养或激素并未到达内部,造成细胞分化的情况。而且,如果在细胞团过小的状态下直接进行继代,则在并未使用rock抑制剂的情况下,存在有细胞死亡或核型异常的情况。因此,细胞评价部512还可以在各个细胞团的大小成为适宜的范围外的情况下发出警告。而且,细胞评价部512还可以在各个细胞团的大小成为规定阈值以上的情况下,输出此时是进行继代的时机。在这种情况下,还可以对细胞团进行粉碎而使各个细胞团变小,再次在培养器中进行继代,以重新进行培养。进一步而言,还可以在继代中使细胞团破碎后,算出各个细胞团的大小,由此判断是否适宜地进行了破碎。而且,可以进一步根据所算出的细胞团的大小,使扩增培养装置70中的培养基的供给速度变化。例如,可以使培养基的供给速度随着细胞团的大小变大而上升。
而且,还可以根据统计处理部513所算出的细胞团的数量而使扩增培养装置70中的培养基的供给速度变化。例如,可以使培养基的供给速度随着细胞团的数量增加而上升。
密度算出部514还可以在细胞团的密度成为规定阈值以上的情况下,输出此时是进行继代的时机。在细胞团的密度变得比适宜的范围高的情况下,例如可通过进行继代而将细胞团的密度调整为适宜的范围内。进一步而言,还可以在继代中使细胞团破碎后而算出细胞团的密度,由此判断是否适宜地进行了破碎。进一步而言,还以根据所算出的细胞团的密度而使扩增培养装置70中的培养基的供给速度变化。例如,可以使培养基的供给速度随着细胞团的密度增加而上升。
在培养基评价部515判断培养基的色相或培养基的ph为规定范围以外的情况下,在扩增培养装置70中也利用例如图21中所示的补给培养基送液泵77来更换悬浮培养器的透析管75的周围的培养基。或者,在一直进行培养基的更换的情况下,利用补给培养基送液泵77的悬浮培养器的透析管75的周围的培养基的更换速度上升,所更换的培养基的流量上升。由此可将培养基的ph维持在适合细胞培养的范围,可对培养基补给充分的营养成分。
将图16中所示的第1分割机构60所分割的细胞团再次于扩增培养装置70内进行培养。反复进行第1分割机构60中的细胞团的分割与在扩增培养装置70内的细胞团的培养直至获得所需的细胞量。
还可以在例如图26所示的细胞评价部512所算出的细胞团的大小的值成为规定阈值以上的情况下,驱动泵,使其将扩增培养装置70中的含有细胞团的溶液经由扩增培养送液通路71而送出至第1分割机构60。或者,还可以在例如图26所示的密度算出部514所算出的细胞团的密度的值成为规定阈值以上的情况下,驱动泵,使其将含有细胞团的溶液送出至图16所示的第1细胞团送液通路51。
在扩增培养装置70上连接着第2细胞团送液通路72。扩增培养装置70使用泵等将扩增培养的自容器剥离的细胞团含有液,送出至第2细胞团送液通路72。其中,在悬浮培养的情况下无需剥离。第2细胞团送液通路72与分支流路连接,该分支流路具备仅仅使不足规定大小的被诱导的细胞通过的内径,将规定大小以上的未被诱导的细胞除去。
还可以在第2细胞团送液通路72的内壁涂层细胞不会附着的poly-hema而使其成为细胞非附着性。或者,第2细胞团送液通路72的材料还可以使用细胞难以附着的材料。而且,第2细胞团送液通路72的材料使用导热率良好、二氧化碳透过性的材料,由此使第2细胞团送液通路72内的条件变得与壳体601内所管理的温度及二氧化碳浓度相同。进一步自防止污染的观点考虑,还可以在第2细胞团送液通路72设有逆流防止阀。
第2细胞团送液通路72与第2分割机构80连接。第2分割机构80例如具备筛网。溶液中所含的细胞团由于水压而通过筛网时,被分割为筛网的各孔大小的多个细胞团。例如,如果筛网的各孔大小均一,则分割后的多个细胞团的大小也变得基本均一。或者,第2分割机构80还可以具备管嘴。例如,通过将略圆锥状的管嘴的内部微细加工为阶梯状,在溶液中所含的细胞团通过管嘴时,被分割为多个细胞团。
或者,第2分割机构80还可以与第1分割机构60同样地具备如图39至图42中所示的具备末端区块61、连结区块62、及前端区块63的细胞团分割器,或者如图43至图46中所示的一体式细胞分割器。细胞团分割器的详细如上所述。
在图16中所示的第2分割机构80上连接有细胞魂搬送机构90,将多个细胞魂依序送至封装装置100。在细胞魂搬送机构90与封装装置100之间连接有封装前细胞流路91。细胞魂搬送机构90使用泵等,将第2分割机构80所分割的的各个细胞团经由封装前细胞流路91而依序送至封装装置100。
还可以在封装前细胞流路91上涂层细胞并不会附着的poly-hema。或者,封装前细胞流路91的材料还可以使用细胞难以附着的材料。而且,封装前细胞流路91的材料使用导热率良好、二氧化碳透过性的材料,由此使封装前细胞流路91内的条件变得与壳体601内所管理的温度及二氧化碳浓度相同。自防止污染的观点考虑,还可以在封装前细胞流路91设有逆流防止阀。
在封装前细胞流路91上连接着冻结保存液送液机构110。冻结保存液送液机构110将细胞冻结保存液送入至封装前细胞流路91。因此,在封装前细胞流路91内,细胞团悬浮于细胞冻结保存液中。
封装装置100依序对经由封装前细胞流路91而送达的多个细胞团的各个进行冻结。例如,封装装置100在接收细胞团时将细胞团放入至低温保存管等冻结保存容器中,将细胞团溶液瞬间冻结至例如-80℃以下。如果使用单位体积的表面积小的冻结保存容器,则存在冻结会较花时间的倾向,因此优选使用单位体积的表面积大的冻结保存容器。通过使用单位体积的表面积大的冻结保存容器,变得可提高解冻后的细胞的生存率。冻结保存容器的形状可列举毛细管状及球状,但并不限定于这些形状。而且,根据所需的解冻后的细胞的生存率,也可以不必瞬间冻结。
冻结例如使用玻璃化(vitrification)法。在这种情况下,细胞冻结保存液可使用dap213(cosmobio株式会社)及freezingmedium(reprocell株式会社)。冻结可以利用玻璃化法以外的通常方法而进行。在这种情况下,细胞冻结保存液可使用cryodefend-stemcell(r&dsystems公司)、或stem-cellbanker(注册商标、日本全药工业株式会社)等。冻结可以利用液氮而进行,也可以利用帕尔贴元件而进行。如果使用帕尔贴元件,则变得可控制温度变化、抑制温度不均。在冻结细胞为临床用途的情况下,冻结保存容器优选为全封闭系统。但是,封装装置100也可以不对干细胞进行冻结而将其封装于保存容器内。
或者可以于封装装置100中,使用图48中所示的溶液置换器101,将细胞团的溶液自培养基置换为冻结保存液。在溶液置换器101的内部设有过滤器102,所述过滤器102在底面上设有细胞团无法透过的细孔。而且,在溶液置换器101上设有:细胞团导入孔,在内部的过滤器102上连接对含有细胞团的培养基进行送液的第1送液流路103;置换溶液导入孔,在内部的过滤器102上连接对不含细胞团的冻结液进行送液的第2送液流路104;细胞团流出孔,在内部的过滤器102上连接将含有细胞团的冻结液排出的第1排出流路105。进一步在溶液置换器101上设有废液流出孔,连接着将透过过滤器102的溶液排出的第2排出流路106。第1送液流路103、第2送液流路104、第1排出流路105、及第2排出流路106的各个可使用管等。
首先,如图48(a)及图48(b)所示那样,在使第2排出流路106中的溶液流动停止的状态下,将含有细胞团的培养基自第1送液流路103放入至溶液置换器101内部。其次,如图48(c)所示那样,设为容许第2排出流路106中的溶液流动的状态,将培养基自溶液置换器101排出。此时,如图48(d)所示那样,细胞团残留于过滤器102上。进一步如图48(e)及图48(f)所示那样,在使第2排出流路106中的溶液流动停止的状态下,将冻结保存液自第2送液流路104放入至溶液置换器101内部,使细胞团分散于冻结保存液中。其后,如图48(g)所示那样,将含有细胞团的冻结保存液自第1排出流路105排出。
将含有细胞团的冻结保存液经由第1排出流路105送至冻结保存容器等中。
另外,图48中所示的溶液置换器101不仅可用于自培养基向冻结保存液的置换,而且可用于自旧的培养基向新的培养基的置换。在这种情况下,第2送液流路104送液新的培养基。或者,溶液置换器101还可以在对细胞团进行分割时,将培养基置换为含有细胞团分割酶的溶液。作为细胞团分割酶的例子,例如可列举胰蛋白酶、或trypleselect(注册商标、生命技术公司)等胰蛋白酶替代重组酶。在这种情况下,第2送液流路104送液含有细胞团分割酶的溶液。
细胞处理系统还可以进一步具备封装步骤摄影装置,对如图16所示的封装装置100中的封装步骤进行摄影。
细胞处理系统还可以通过有线或无线将分离装置10、导入前细胞送液通路20、诱导因子送液机构21、因子导入装置30、细胞团制作装置40、及封装装置100等的运作记录、以及摄影装置所摄影的图像发送至外部服务器。而且,在外部服务器中,还可以通过神经网络对例如诱导因子导入条件、培养条件、及冻结条件等条件与干细胞的不完全的初始化、干细胞的分化及增殖的失败、及染色体异常等结果的关联进行分析,抽出导致结果的条件,对结果进行预测。进一步而言,外部服务器还可以基于标准作业程序(sop)而控制细胞处理系统的分离装置10、诱导因子送液机构21、因子导入装置30、细胞团制作装置40、及封装装置100等,基于sop而监视各装置是否运转,自动生成各装置的运转记录。
利用以上所说明的细胞处理系统,变得可全自动地总括进行ips细胞等干细胞的诱导、确立、扩增培养、及冻结保存。
另外,实施方式的细胞处理系统所具备的细胞处理装置并不限定于图16中所示的结构。例如,在图49所示的细胞处理装置,经由血液送液通路202而自血液保存部201向单核细胞分离部203送液血液。血液保存部201及单核细胞分离部203例如可使用管。血液送液通路202例如是树脂管或硅管等。后述的其他送液通路也是同样的。还可以在血液保存部201上附上条形码等标识符,管理血液的信息。在送液中使用泵204。泵204可使用容积式泵。作为容积式泵的例子,可列举:包含活塞泵、柱塞泵、及隔膜泵的往复泵,或包含齿轮泵、叶片泵、及螺杆泵的旋转泵。作为隔膜泵的例子,可列举管式泵及压电(piezo)泵。作为管式泵的例子,可列举蠕动泵(注册商标、atto株式会社)、以及rp-q1及rp-tx(高砂电气工业株式会社)。作为压电泵的例子,可列举sdmp304、sdp306、sdm320、及app-20kg(高砂电气工业株式会社)。而且,还可以使用组合有各种泵的微流体芯片模块(高砂电气工业株式会社)。如果使用蠕动泵(注册商标)、管式泵、及隔膜泵等密闭型泵,则可使泵并不直接接触血液送液通路202内部的血液地进行送液。在后述的其他泵中也是同样的。或者,泵204、以及后述的泵207、泵216、泵222、泵225、泵234、泵242、及泵252还可以使用注射泵。即使是密闭型泵以外的泵,也可以通过加热杀菌处理等而再利用。
将红血球凝聚剂自分离剂保存部205,经由送液通路206及泵207送至单核细胞分离部203。分离剂保存部205例如可使用管。还可以对分离剂保存部205附上条形码等标识符来管理分离剂的信息。红血球凝聚剂例如可使用hetasep(注册商标、干细胞技术公司)或红血球凝聚剂(尼普洛(nipro)公司)等。在单核细胞分离部203内,由于红血球凝聚剂而使红血球沉降,从而分离单核细胞。将单核细胞分离部203内的含有单核细胞的上清液经由单核细胞送液通路208及泵209送至单核细胞纯化过滤器210。
在单核细胞纯化过滤器210中,将单核细胞以外的成分除去,获得含有单核细胞的溶液。单核细胞纯化过滤器210可使用purecell(注册商标、pall)、cellsorbae(旭化成株式会社)、sepacellpl(旭化成株式会社)、adacolumn(注册商标、jimro)、及分离袋(尼普洛株式会社)等。
在图49中,单核细胞分离部203、分离剂保存部205、单核细胞纯化过滤器210、及泵204、207、209等构成分离装置。
将含有单核细胞的溶液经由导入前细胞送液通路211及泵212送至因子导入部213。因子导入部213例如可使用管。将多能性诱导因子自包含多能性诱导因子的因子保存部214,经由因子送液通路215及泵216送至因子导入部213。因子保存部214例如可使用管。还可以在因子保存部214上附上条形码等标识符,管理多能性诱导因子的信息。因子保存部214及泵216等构成诱导因子送液机构。在作为因子导入装置的因子导入部213中,利用例如rna脂转染法将多能性诱导因子导入至细胞中,制作诱导因子导入细胞。然而,诱导因子的转染方法并不限定于rna脂质转染法。例如还可以使用含有多能性诱导因子的仙台病毒载体。或者,多能性诱导因子还可以是蛋白质。
将诱导因子导入细胞经由导入细胞送液通路217及泵218送至作为细胞团制作装置的一部分的初始化培养器219。导入细胞送液通路217例如为温度透过性且为二氧化碳透过性。初始化培养器219还可以使用图20中所示的悬浮培养器。在这种情况下,诱导因子导入细胞进入至透析管内。在将多能性诱导因子导入至细胞后的最初数日,自包含血液细胞培养基的血液细胞培养基保存部220,经由培养基送液通路221及泵222,而对图49中所示的初始化培养器219补给血液细胞培养基。培养基送液通路221例如为温度透过性且为二氧化碳透过性。还可以在血液细胞培养基保存部220上附上条形码等标识符,管理血液细胞培养基的信息。血液细胞培养基保存部220、培养基送液通路221、及泵222构成培养基补给装置。泵222可以依照图26中所示的cpu500的指示而连续地补给血液细胞培养基,还可以以规定时机补给血液细胞培养基。
其后,将干细胞培养基自包含干细胞培养基的干细胞培养基保存部223,经由培养基送液通路224及泵225而补给至图49中所示的初始化培养器219。还可以在干细胞培养基保存部223上附上条形码等标识符,管理干细胞培养基的信息。培养基送液通路224例如为温度透过性且为二氧化碳透过性。干细胞培养基保存部223、培养基送液通路224、及泵225构成培养基补给装置。泵225可以依照图26中所示的cpu500的指示,连续地补给干细胞培养基,还可以以规定时机补给干细胞培养基。
血液细胞培养基保存部220及干细胞培养基保存部223可以在例如冷藏保存部260中以4℃等的低温进行冷藏保存。自血液细胞培养基保存部220及干细胞培养基保存部223送来的培养基可以利用例如冷藏保存部260以外的加热器升温至37℃后送至培养器中。或者,低温保存的培养基还可以以通过送液通路的时间内升温至37℃的方式设定送液通路周围的温度。将初始化培养器219内变旧的培养基经由废液送液通路226及泵227送至废液保管部228。还可以在废液保管部228附上条形码等标识符来管理废液的信息。
将在初始化培养器219中培养的细胞团,经由导入细胞送液通路229、泵230、及细胞团分割器231送至作为细胞团制作装置的一部分的第1扩增培养器232中。细胞团分割器231可以具备例如图45或图46中所示的结构。使其通过细胞团分割器231,由此将细胞团分割为更小的细胞团。图49中所示的第1扩增培养器232可使用图20中所示的悬浮培养器。在这种情况下,细胞团进入至透析管内。将干细胞培养基,自包含干细胞培养基的干细胞培养基保存部223,经由培养基送液通路233及泵234而补给至图49中所示的第1扩增培养器232。导入细胞送液通路229及培养基送液通路233例如为温度透过性且为二氧化碳透过性。干细胞培养基保存部223、培养基送液通路233、及泵234构成培养基补给装置。泵234可以依照图26中所示的cpu500的指示,连续地补给干细胞培养基,还可以以规定时机补给干细胞培养基。
将图49中所示的第1扩增培养器232内变旧的培养基经由废液送液通路235及泵236送至废液保管部228。
将在第1扩增培养器232中培养的细胞团,经过导入细胞送液通路237、泵238、细胞团分割器239送至作为细胞团制作装置的一部分的第2扩增培养器240中。细胞团分割器239可以具备例如图45或图46中所示的结构。使其通过细胞团分割器239,由此将细胞团分割为更小的细胞团。图49中所示的第2扩增培养器240可使用图20中所示的悬浮培养器。
在这种情况下,细胞团进入至透析管内。将干细胞培养基,自包含干细胞培养基的干细胞培养基保存部223,经由培养基送液通路241及泵242补给至图49中所示的第2扩增培养器240。导入细胞送液通路237及培养基送液通路241例如为温度透过性且为二氧化碳透过性。干细胞培养基保存部223、培养基送液通路241、及泵242构成培养基补给装置。泵242可以依照图26中所示的cpu500的指示,连续地补给干细胞培养基,还可以以规定时机补给干细胞培养基。
将图49中所示的第2扩增培养器240内变旧的培养基经由废液送液通路243及泵244送至废液保管部228。
将在第2扩增培养器240中培养的细胞团,经过导入细胞送液通路245及泵246送至溶液置换器247中。溶液置换器247还可以具备例如图48所示的结构。在图49中所示的溶液置换器247内,由过滤器而保持细胞团,将培养基经由废液送液通路248及泵249送至废液保管部228。
在通过停止泵249的驱动而停止废液送液通路248内的溶液流动之后,或者用阀等将废液送液通路248关闭后,冻结保存液自包含冻结保存液的冻结保存液保存部250,经由送液通路251及泵252进入至溶液置换器247。由此在冻结保存液中分散细胞团。
将分散有细胞团的冻结保存液,经由作为封装装置的一部分的送液通路253及泵254送至冻结保存容器255内。将冻结保存容器255放入至低温保管库256中。将例如-80℃的液氮,自液氮保管库257经由送液通路258送至低温保管库256。由此使冻结保存容器255内的细胞团冻结。然而,细胞团的冻结也可以不利用液氮。例如,低温保管库256可以是压缩式冷冻库、吸收式冷冻库、或帕尔贴式冷冻库等冷冻库。
在上述的送液通路中还可以适宜设置逆流防止阀。将上述的送液通路、单核细胞分离部203、单核细胞纯化过滤器210、因子导入部213、初始化培养器219、第1扩增培养器232、第2扩增培养器240、及溶液置换器247等配置于构件259中。构件259的材料例如为树脂,但并不限定于此。构件259例如由可杀菌处理的耐热性材料形成。构件259的形状可以是板状,也可以是盒状。而且,构件259例如可以是柔性袋。培养基流过的送液通路例如由二氧化碳透过性材料形成。而且,上述的送液通路、单核细胞分离部203、单核细胞纯化过滤器210、因子导入部213、初始化培养器219、第1扩增培养器232、第2扩增培养器240、及溶液置换器247等还可以分割容纳于多个盒体中。
构件259与图1所示的壳体601例如具备相互嵌合的嵌合部。因此,图49所示的构件259配置于图1所示的壳体601内的规定位置。而且,在壳体601内,图49中所示的泵、血液保存部201、分离剂保存部205、因子保存部214、血液细胞培养基保存部220、干细胞培养基保存部223、废液保管部228、冻结保存容器255、低温保管库256、及液氮保管库257配置于规定位置。如果构件259配置于图1所示的壳体601内的规定位置,则图49所示的构件259内的送液通路与泵、血液保存部201、分离剂保存部205、因子保存部214、血液细胞培养基保存部220、干细胞培养基保存部223、废液保管部228、冻结保存容器255、低温保管库256、及液氮保管库257相接。
例如,构件259及构件259中所设的流路等为一次性的,在细胞团的冻结完成后,可以废弃而更换为新的。或者,在再利用构件259及构件259中所设的流路等的情况下,还可以在构件259上附上条形码等标识符来管理使用次数等。
利用以上所说明的实施方式的细胞处理系统,可以并不经由人地由血液而自动地处理ips细胞等干细胞的冷冻保存物。
而且,例如细胞处理装置可以如图50、图51及图52所示那样具备:细胞培养器具900、包埋细胞培养器具900的包埋构件2000、使包埋构件2000外部与包埋构件2000内的细胞培养器具900连通的连通送液通路。另外,在图51及图52中省略了包埋构件2000。
包埋构件2000的材料可使用树脂、玻璃及金属等。如果包埋构件2000是透明的,则可观察配置在包埋构件2000内部的细胞培养器具900,但包埋构件2000也可以是不透明的。
例如,在细胞处理装置中,经由血液送液通路1202,而自配置在包埋构件2000外部的保存血液的血液保存部1201,向配置在包埋构件2000内部的单核细胞分离部1203送液血液。血液保存部1201及单核细胞分离部1203例如可使用管。血液送液通路1202例如是树脂管或硅管等。后述的其他送液通路也是同样的。还可以在血液保存部1201上附上条形码等标识符,管理血液的信息。
在送液中使用可安装在包埋构件2000外壁的泵等驱动部1204。驱动部1204可使用容积式泵。作为容积式泵的例子,可列举:包含活塞泵、柱塞泵、及隔膜泵的往复泵,或包含齿轮泵、叶片泵、及螺杆泵的旋转泵。作为隔膜泵的例子,可列举管式泵及压电(piezo)泵。作为管式泵的例子,可列举蠕动泵(注册商标、atto株式会社)、以及rp-q1及rp-tx(高砂电气工业株式会社)。作为压电泵的例子,可列举sdmp304、sdp306、sdm320、及app-20kg(高砂电气工业株式会社)。
而且,还可以使用组合有各种泵的微流体芯片模块(高砂电气工业株式会社)。如果使用蠕动泵(注册商标)、管式泵、及隔膜泵等密闭型泵,则可使泵并不直接接触血液送液通路1202内部的血液地进行送液。在后述的其他泵中也是同样的。或者,还可以使用注射泵作为驱动部1204及后述的驱动部。即使是密闭型泵以外的泵,也可以通过加热杀菌处理等而再利用。
例如,在包埋构件2000的内部设有如图53及图54所示的从动部2204,从驱动部1204传递驱动力,从动部2204可以连接于血液送液通路1202上。驱动部1204与从动部2204可以通过磁力来连接。驱动部1204可以具备产生磁力的电磁铁。在驱动部1204以外的驱动部中也是同样的。
将红血球凝聚剂等用以分离单核细胞的分离剂,自配置于包埋构件2000外部的分离剂保存部1205,经由分离剂送液通路1206及可安装于包埋构件2000外壁的驱动部1207送至单核细胞分离部1203,其配置于图50、图51及图52所示的包埋构件2000内部。分离剂保存部1205例如可使用管。还可以对分离剂保存部1205附上条形码等标识符来管理分离剂的信息。红血球凝聚剂例如可使用hetasep(注册商标、干细胞技术公司)或红血球凝聚剂(尼普洛(nipro)公司)等。
在单核细胞分离部1203内,由于红血球凝聚剂而使红血球沉降,从而分离单核细胞。将单核细胞分离部1203内的含有单核细胞的上清液,经由配置在包埋构件2000内部的单核细胞送液通路1208及可安装于包埋构件2000外壁的驱动部1209送至单核细胞纯化过滤器1210。将在单核细胞分离部1203中产生的沉降成分等,经由自包埋构件2000中与外部连通的废液送液通路,送至配置在包埋构件2000外部的废液保管部4228。
在单核细胞纯化过滤器1210中,将单核细胞以外的成分除去,获得含有单核细胞的溶液。单核细胞纯化过滤器1210可使用purecell(注册商标、pall)、cellsorbae(旭化成株式会社)、sepacellpl(旭化成株式会社)、adacolumn(注册商标、jimro)、及分离袋(尼普洛株式会社)等。
在图52中,单核细胞分离部1203、分离剂保存部1205、单核细胞纯化过滤器1210、及驱动部1204、1207、1209等构成分离装置。可将在单核细胞纯化过滤器1210中分离出的含有单核细胞的溶液,经由与单核细胞纯化过滤器1210连接的、配置在包埋构件2000内部的单核细胞流路2001,送至单核细胞保存部2002,其与单核细胞流路2001连接且配置在包埋构件2000内部。可将在单核细胞纯化过滤器1210中分离出的含有单核细胞以外成分的溶液,经由与单核细胞纯化过滤器1210连接的、配置在包埋构件2000内部的其他成分流路2003,送至其他成分保存部2004,其与其他成分流路2003连接且配置在包埋构件2000内部。
将含有单核细胞的溶液,经由配置在包埋构件2000内部的导入前细胞送液通路1211及可安装于包埋构件2000外壁的驱动部1212,送至配置在包埋构件2000内部的因子导入部1213。另外,也可以将单核细胞分离部1203中所分离的单核细胞,并不经由单核细胞纯化过滤器1210,送至因子导入部1213。因子导入部1213例如可使用管。将多能性诱导因子,自配置在包埋构件2000外部的、包含多能性诱导因子的因子保存部1214,经由至少一部分设于包埋构件2000内部的因子送液通路1215、及配置于包埋构件2000外部的驱动部1216,送至因子导入部1213。因子保存部1214例如可使用管。还可以在因子保存部1214上附上条形码等标识符,管理多能性诱导因子的信息。因子保存部1214及驱动部1216等构成诱导因子送液机构。
在作为因子导入装置的至少一部分的因子导入部1213中,利用例如rna脂转染法而将多能性诱导因子导入至细胞中,制作诱导因子导入细胞。然而,诱导因子的转染方法并不限定于rna脂质转染法。例如还可以使用含包含多能性诱导因子的仙台病毒载体。或者,多能性诱导因子还可以是蛋白质。另外,转染的方法可列举使用附加体质粒的转染法、电穿孔法。将在因子导入部1213中产生的废液,经由自包埋构件2000中连通至外部的废液送液通路,送至配置于包埋构件2000外部的废液保管部5228。
将诱导因子导入细胞,经由设于包埋构件2000内部的导入细胞送液通路1217、及配置于包埋构件2000外部的驱动部1218,送至作为细胞团制作装置的一部分的初始化培养器1219。初始化培养器1219包埋于包埋构件2000中。初始化培养器1219还可以使用图20中所示的悬浮培养器。在这种情况下,诱导因子导入细胞进入至透析管内。在将多能性诱导因子导入至细胞后的最初数日,自配置于包埋构件2000外部的包含血液细胞培养基的血液细胞培养基保存部1220,经由至少一部分设于包埋构件2000内部的培养基送液通路1221、及配置于包埋构件2000外部的驱动部1254,而对图52中所示的初始化培养器1219补给血液细胞培养基。还可以在血液细胞培养基保存部1220上附上条形码等标识符,管理血液细胞培养基的信息。血液细胞培养基保存部1220、培养基送液通路1221、及驱动部1254构成培养基补给装置。驱动部1254可以依照图26中所示的cpu500的指示而连续地补给血液细胞培养基,还可以以规定时机补给血液细胞培养基。
其后,自配置于包埋构件2000外部的包含干细胞培养基的干细胞培养基保存部1223,经由设于包埋构件2000内部的培养基送液通路、及配置于包埋构件2000外部的驱动部,而对图52中所示的初始化培养器1219补给干细胞培养基。还可以在干细胞培养基保存部1223上附上条形码等标识符,管理干细胞培养基的信息。干细胞培养基保存部1223、培养基送液通路、及驱动部构成培养基补给装置。驱动部可以依照图26中所示的cpu500的指示而连续地补给干细胞培养基,还可以以规定时机补给干细胞培养基。
血液细胞培养基保存部1220及干细胞培养基保存部1223可以在例如冷藏保存部内以4℃等的低温进行冷藏保存。自血液细胞培养基保存部1220及干细胞培养基保存部1223送出的培养基可以利用例如冷藏保存部以外的加热器升温至37℃后送至培养器中。或者,低温保存的培养基还可以以通过送液通路的时间内升温至37℃的方式设定送液通路周围的温度。将在初始化培养器1219内变旧的培养基,经由自包埋构件2000中连通至外部的废液送液通路1226,送至配置于包埋构件2000外部的废液保管部1228。还可以在废液保管部1228附上条形码等标识符来管理废液的信息。
将初始化培养器1219中培养的细胞团,经由设于包埋构件2000内部的导入细胞送液通路1229、配置于包埋构件2000外部的驱动部1230、设于包埋构件2000内部的细胞团分割器1231、配置于包埋构件2000外部的驱动部1218、设于包埋构件2000内部的导入细胞送液通路2229,送至作为细胞团制作装置的一部分的扩增培养器1232。设于包埋构件2000内部的细胞团分割器1231例如可具备图45或图46所示的结构。使其通过细胞团分割器1231,由此将细胞团分割为更小的细胞团。
图52中所示的扩增培养器1232可使用图20中所示的悬浮培养器。在这种情况下,细胞团被放入至透析管内。自配置于包埋构件2000外部的、包含干细胞培养基的干细胞培养基保存部1223,经由自包埋构件2000外部连通至其中的培养基送液通路1224、及配置在包埋构件2000外部的驱动部1222,对图52所示的扩增培养器1232补给干细胞培养基。干细胞培养基保存部1223、培养基送液通路1224、及驱动部1222构成培养基补给装置。驱动部可以依照图26中所示的cpu500的指示而连续地补给干细胞培养基,还可以以规定时机补给干细胞培养基。
将在图52所示的扩增培养器1232内变旧的培养基,经由自包埋构件2000中连通至外部的废液送液通路1235,送至配置于包埋构件2000外部的废液保管部2228。
将扩增培养器1232中培养的细胞团,经由设于包埋构件2000内部的导入细胞送液通路1245、可安装于包埋构件2000外壁的驱动部1246、设于包埋构件2000内部的细胞团分割器2231,送至设于包埋构件2000内部的溶液置换器1247。溶液置换器1247还可以具备例如图48所示的结构。在图52所示的溶液置换器1247内,细胞团被过滤器保持,将培养基经由自包埋构件2000中连通至外部的废液送液通路1248,送至配置于包埋构件2000外部的废液保管部3228。
在用阀等关闭废液送液通路1248后,将冻结保存液,自配置在包埋构件2000外部的、包含冻结保存液的冻结保存液保存部1250,经由自包埋构件2000外部连通至其中的冻结保存液送液通路1251及可安装于包埋构件2000外壁的驱动部1252,送至溶液置换器1247。由此在冻结保存液中分散细胞团。
将分散有细胞团的冻结保存液,经由自包埋构件2000中连通至外部的冻结用细胞送液通路1253及可安装于包埋构件2000外壁的驱动部1209,送至冻结保存容器1255内。送液通路1253、驱动部1254、及冻结保存容器1255成为封装装置的一部分。其后,将冻结保存容器1255移动至低温保管库内。
图50至图52所示的细胞处理装置在将上述的细胞培养器具900所具备的因子导入部1213、初始化培养器1219、及扩增培养器1232等连接后,以包埋这些构件的方式成形包埋构件2000并进行处理。或者,细胞处理装置还可以利用3d打印机等装置,在包埋构件2000内部,形成细胞培养器具900所具备的因子导入部1213、初始化培养器1219、及扩增培养器1232等。通过用包埋构件2000包埋细胞培养器具900所具备的因子导入部1213、初始化培养器1219、及扩增培养器1232等,可抑制所处理的细胞、或导入至细胞的诱导因子等扩散到外部。而且,相反地可抑制外部的污染物质与所处理的细胞接触。
如上所述地利用实施方式而记载本发明,但不应理解为进行该揭示的一部分的记述及附图限定本发明。根据该揭示,本领域技术人员应明白各种替代实施方式、实施方式及运用技术。例如,因子导入装置30也可以不通过电穿孔或rna脂质转染,而是通过使用逆转录病毒、慢病毒、及仙台病毒等病毒载体或质粒的转染,或者蛋白质转染而对细胞进行诱导。而且,也可以通过导入作为因子的化合物来诱导细胞。导入前细胞送液通路20、导入细胞送液通路31、细胞团送液通路51、扩增培养送液通路71、细胞团送液通路72、及封装前细胞流路91也可以利用微流体技术而设于基板上。如上所述,应理解本发明包含此处并未记载的各种实施方式等。
(实施例1)
(准备)
自健康的成年男性获得人类血液细胞。而且,准备修饰化mrna(trilink公司)、非附着皿、15ml的试管、50ml的试管、聚蔗糖、旁通流量计(bd)、对于cd34的抗体(美天旎生物公司)、对于cd3的抗体(美天旎生物公司)、macs(注册商标)缓冲液(美天旎生物公司)、t细胞培养基、低血清培养基(opti-mem(注册商标)、gibco)、sirna导入试剂(lipofectamine(注册商标)rnaimax、赛默飞世尔科技)、及对于tra-1-60的抗体(bd)。
t细胞(cd3阳性细胞)培养基是以下a培养基与b培养基的混合液。a培养基是15ml的xvivo-10(龙沙公司、04-743q)及il-2(10μg/ml)的混合液。b培养基是在1.5ml的试管中将xvivo-10及戴诺磁珠(dynabeads)cd3/cd28(生命技术公司,111-31d)50μl加以混合,进行5秒的涡旋后,进行旋转下降,在dynamag-2(赛默飞世尔科技)中进行静置,静置一分钟后除去上清液而成的培养基。
而且,在10ml无血清培养基(stemspanh3000、干细胞技术公司)中加入10μlil-6(100μg/ml)、10μlscf(300μg/ml)、10μltpo(300μg/ml)、10μlflt3配体(300μg/ml)、及10μlil-3(10μg/ml)而制备血球培养基(血液干/前驱细胞培养基)。
而且,分别准备浓度为100ng/μl的oct3/4的mrna含有液、sox2的mrna含有液、klf4的mrna含有液、c-myc的mrna含有液、lin28a的mrna含有液、及绿色荧光蛋白质(gfp)的mrna含有液。其次,将385μloct3/4的mrna含有液、119μlsox2的mrna含有液、156μlklf4的mrna含有液、148μlc-myc的mrna含有液、83μllin28a的mrna含有液、及110μlgfp的mrna含有液加以混合而获得启动因子混合液。将所获得的启动因子混合液每次50μl地分注于容量为1.5ml的rnase-free的管(艾本德管(eppendorftube)(注册商标)、艾本德公司)中,保存于-80℃的冷冻库中。
(单核细胞的制备)
将离心机设定为18℃。采集5ml至50ml的血液,在血液中加入edta而充分混合。而且,将人类淋巴球分离用介质(ficoll-paquepremium、日本通用电气医疗)每次5ml地分注于2根15ml的试管中。将5mlpbs加入至血液中而进行稀释,每次5ml地重层于试管中的人类淋巴球分离用介质上。此时,以不使界面变乱的方式,使稀释血液沿着试管的管壁缓缓地加于介质上。
在400×g、18℃下对试管中的溶液进行30分钟的离心。此时,加速、减速均缓缓地进行。在离心后,在试管中出现白色浑浊的中间层。该白色浑浊的中间层包含单核细胞。利用吉尔森p型移液器缓缓地回收试管中的白色浑浊的中间层,移到新的15ml的试管中。此时,并不吸取下层。白色浑浊的中间层可自1根试管中回收1ml左右。将2根试管的中间层汇总移到1根试管中。
对于所回收的单核细胞,加入12mlpbs,进一步在200×g、18℃下对溶液进行10分钟离心。其后,使用吸引器将溶液的上清液吸引除去,加入3ml组成已知的无血清造血细胞培养基(x-vivo(注册商标)10、龙沙)而进行悬浮,获得单核细胞悬浮液。用台盼蓝对其中10μl的单核细胞悬浮液进行染色,用血球计进行计数。
(cd34或cd3阳性细胞的分离)
使1×107个单核细胞与cd34抗体或cd3抗体在4℃的溶液100μl中进行15分钟反应。于反应后,在溶液中加入5mlmacs(注册商标)缓冲液(美天旎生物公司),以270g进行离心。于离心后将上清液除去,添加1mlmacs缓冲液。其后,利用自动磁性细胞分离装置(automacs、美天旎生物公司)的分离程序而将单核细胞中的cd34阳性细胞或cd3阳性细胞分离。
(所分离的细胞的培养)
使所分离的5×106个单核细胞悬浮于1ml的t细胞培养基、或血液干/前驱细胞培养基中,播种于12孔板中进行培养。培养条件是co2浓度为5%、氧浓度为19%、及温度为37℃。
(启动因子的脂质转染)
将100μl低血清培养基(opti-mem(注册商标)、gibco)与25μl启动因子混合液加以混合而制成第1混合液。而且,将112.5μl低血清培养基(opti-mem(注册商标)、gibco)与12.5μlsirna导入试剂(lipofectamine(注册商标)rnaimax、赛默飞世尔科技)加以混合而制成第2混合液。其后,将第1混合液与第2混合液加以混合,在室温下静置15分钟而制成脂质转染反应液。
将所获得的脂质转染反应液中的60μl平稳地添加于培养单核细胞的12孔板中,接着于37℃下对单核细胞进行18小时的无饲养层培养。培养条件是co2浓度为5%、氧浓度为19%、及温度为37℃。添加脂质转染反应液时的单核细胞的密度为3×106。在18小时后,将单核细胞回收至15ml的试管中,以300g进行离心,将上清液除去。其后,将1.25mlcd34用血球培养基添加于15ml的试管中,将单核细胞悬浮液倒回至相同的12孔板中,在37度下对单核细胞进行一夜的无饲养层培养。培养条件是co2浓度为5%、及氧浓度为19%。上述步骤每2日进行1次,在7日内反复进行。
(gfp的表达的确认)
在开始脂质转染后的第7日,合计进行4次脂质转染的细胞的密度为3×106。将细胞的一部分自12孔板中取出,用荧光显微镜确认gfp的表达,结果如图55所示那样,确认了gfp的表达。由此确认在单核细胞中转染了mrna,由所转染的mrna合成蛋白质。
(tra-1-60的表达的确认)
在开始脂质转染后的第7日,自12孔板中取出细胞的一部分,用如下抗体对所取出的细胞进行染色,所述抗体是对于在开始初始化的ips细胞中特异性表达的表面抗原tra-1-60的抗体,用别藻蓝蛋白(allophycocyanin,apc)荧光色素进行了标识。其后,利用荧光激活细胞分选仪(facs(注册商标)、bd)确认tra-1-60阳性细胞的比率,由此确定在细胞中开始重新编程,ips细胞基因进行表达,产生ips细胞。
如图56所示那样,制成以自体荧光强度为x轴、荧光标识抗tra-1-60抗体的荧光强度为y轴的点图。在未导入基因的阴性对照中并未检测出tra-1-60阳性细胞。相对于此,在实验1、2及3中检测出tra-1-60阳性细胞。另外,实验1是由并未进行利用标记物的分离的单核细胞全体所诱导的结果,实验2是由利用cd3阳性而进行分离的细胞所诱导的结果,实验3是由利用cd34阳性而进行分离的细胞所诱导的结果。因此表示使用启动因子rna的脂质转染,在源自血液的细胞中导入启动因子,从而可诱导ips细胞。
(实施例2)
将500ml的primateescellmedium(reprocell)、及0.2ml的浓度为10μg/ml的bfgf(gibcophg0266)加以混合而制备含有bfgf的人类ips培养基。
而且,在含有bfgf的人类ips培养基中以浓度成为0.02重量%的方式添加脱酰化结冷胶(日产化学),制备含有bfgf的人类ips凝胶培养基。进一步将5ml的浓度为2.5重量%的胰蛋白酶、5ml的浓度为1mg/ml的胶原酶iv、0.5ml的浓度为0.1mol/l的cacl2、10ml的knockout血清替代(注册商标、invitrogen10828-028)、及30ml的纯化水加以混合,制备一般被称为ctk溶液的剥离液。
在饲养细胞上培养ips细胞的6孔皿(赛默飞世尔科技)12-556-004)中添加300μl的ctk溶液,在co2培养箱中进行3分钟的培养。在3分钟后将皿自培养箱中取出,确认仅仅饲养细胞剥落,使用吸引器而将ctk溶液除去。
将ctk溶液除去后,在6孔皿中添加500μl的pbs(santacruzbiotechsc-362183),对ips细胞进行清洗后,自6孔皿中除去pbs,将0.3ml的剥离液(accutase、注册商标)添加于6孔皿中,放入至co2培养箱中进行5分钟的培养。其后,将0.7ml的含有bfgf的ips培养基添加于6孔皿中,使ips细胞悬浮直至成为单细胞。
在使ips细胞悬浮后,将4ml的含有bfgf的人类ips培养基添加于15ml的离心管中,使用离心机以270g对ips细胞悬浮液进行离心。在离心后,将上清液除去,将1ml的含有bfgf的人类ips培养基添加于15ml的离心管中,使用血球计计算细胞数。在细胞计算后,每次5×105个地将ips细胞播种于15ml的falcontube(注册商标、corning352096)或非附着皿中,以后并不进行搅拌地进行悬浮培养。
在15ml的试管中,使用2ml的含有bfgf的人类ips凝胶培养基。在非附着皿中,使用2ml的并未凝胶化的含有bfgf的人类ips培养基。在各培养基中添加rock抑制剂(sellecks1049),使其浓度为10μmol/l。其后,在15ml的试管及非附着皿中,每日添加500μl的含有bfgf的人类ips凝胶培养基,在非附着皿中,每日添加500μl的含有bfgf的人类ips培养基。而且,在15ml的试管及非附着皿中,每日以最终浓度成为10μmol/l的方式添加rock抑制剂,继续进行7日的悬浮培养。
将其结果表示于图57中。如图57(b)所示那样,在非附着皿中使用并未凝胶化的含有bfgf的人类ips培养基培养ips细胞的情况下,明显发现ips细胞的集落彼此凝聚。相对于此,如图57(a)所示那样,在15ml的试管中使用含有bfgf的人类ips凝胶培养基培养ips细胞的情况下,并未发现明显的凝聚。图58(a)是在15ml的试管中,使用含有bfgf的人类ips凝胶培养基培养ips细胞时的第1日的照片,图58(b)是在15ml的试管中,使用含有bfgf的人类ips凝胶培养基培养ips细胞时的第9日的照片。根据图58(a)及图58(b)的照片而确认不同株的ips细胞彼此并未凝聚地形成集落。
图59(a)是在凝胶培养基中悬浮培养7日的ips细胞的集落即将再播种于饲养细胞上之前的照片。图59(b)是在其3日后确认集落形态时的照片。其结果如图60所示那样,确认95%以上的集落未分化。因此,表示可在凝胶培养基中,维持未分化的状态地培养ips细胞。
(实施例3)
与实施例2同样地制备含有bfgf的人类ips培养基、及含有bfgf的人类ips凝胶培养基。在饲养细胞上培养ips细胞的6孔皿中添加300μl的ctk溶液,在co2培养箱中进行3分钟的培养。3分钟后将皿自培养箱中取出,确认仅仅饲养细胞剥落,使用吸引器而将ctk溶液除去。将ctk溶液除去后,在皿中添加500μl的pbs,对ips细胞进行清洗后,自皿中除去pbs,将0.3ml的accumax添加于皿中,将皿放入至co2培养箱中进行5分钟的培养。其后,将0.7ml的含有bfgf的ips培养基添加于皿中,使ips细胞悬浮直至成为单细胞。
在使ips细胞悬浮后,将4ml的含有bfgf的人类ips培养基添加于15ml的离心管中,使用离心机以270g对ips细胞悬浮液进行离心。在离心后,将上清液除去,将1ml的含有bfgf的人类ips培养基添加于15ml的离心管中,使用血球计计算细胞数。在细胞计算后,每次5×105个地将ips细胞播种于15ml的试管中,以后并不进行搅拌地进行悬浮培养。
在15ml的试管中,使用2ml的含有bfgf的人类ips凝胶培养基。在各培养基中添加rock抑制剂使其浓度为10μmol/l。其后,在15ml的试管中,每日添加500μl的含有bfgf的人类ips凝胶培养基。另外,500μl的凝胶培养基含有0.5μl的rock抑制剂。而且,作为对照,并未添加rock抑制剂,除此以外在相同的条件下对ips细胞进行7日的悬浮培养。
如图61(a)所示那样,在含有bfgf的人类ips培养基中并未添加rock抑制剂的情况下,ips细胞并未形成集落。相对于此,如图61(b)所示那样,在含有bfgf的人类ips培养基中添加rock抑制剂的情况下,ips细胞形成集落。根据该结果,表示在由单细胞而悬浮培养ips细胞的情况下,rock抑制剂有效。
(实施例4)
容纳透析管的容器使用并非二氧化碳透过性的容器falcon离心管50ml(注册商标)与二氧化碳透过性的容器g-rex(注册商标、wilsonwolf),除了容器以外在相同条件下对细胞进行悬浮培养。其结果如图62所示那样,使用二氧化碳透过性的容器而进行培养的细胞的生存率高。
(实施例5)
将含有ips细胞的凝胶培养基分别放入至具备截留分子量为100kda的透析管的2个透析模块(spectrumg235035)中。进一步将透析模块分别放入至50ml的离心管中,在离心管内的透析管的周围放入凝胶培养基。而且,将含有ips细胞的凝胶培养基直接放入至其他的50ml的离心管中。
其后,在数日内,在内部装有透析管的2个离心管中的一个离心管上,如图21中所示那样连接泵,连续地更换离心管内的凝胶培养基。以如下方式设定凝胶培养基:在4℃下保管,在到达离心管时成为37℃。在内部装有透析管的2个离心管中的另一个离心管上并未连接泵,并不更换离心管内的凝胶培养基。而且,在内部并未放入透析管的离心管内的凝胶培养基也不进行更换。
在培养相同的时间后,观察在各个容器内所培养的细胞,结果如图63及图64所示那样,在透析管内培养细胞团,用泵连续地更换透析管周围的凝胶培养基的情况下,形成许多细胞团。而且,分化的细胞极少。然而,在透析管内培养细胞团,并未用泵连续地更换透析管周围的凝胶培养基的情况下,细胞团变少,分化的细胞增加。而且,在并未使用透析管培养细胞团,并未用泵连续地更换凝胶培养基的情况下,基本上未形成细胞团。
符号说明
2…试管、10…分离装置、20…导入前细胞送液通路、21…诱导因子送液机构、30…因子导入装置、31…导入细胞送液通路、40…细胞团制作装置、50…初始化培养装置、51…细胞团送液通路、60…分割机构、61…末端区块、61a…凹部、61b…凸部、61c…大孔径部、62…连结区块、62a…凹部、62b…凸部、62c…大孔径部、62d…小孔径部、62e…大孔径部、63…前端区块、63a…凹部、63b…管嘴部、63c…大孔径部、63d…小孔径部、64…插入管嘴、65a…大孔径部、65b…小孔径部、66a…插入部、66b…插入部、70…扩增培养装置、71…扩增培养送液通路、72…细胞团送液通路、75…透析管、76…容器、77…补给培养基送液泵、78…送液管、79…废液管、80…分割机构、90…细胞魂搬送机构、91…封装前细胞流路、100…封装装置、101…溶液置换器、102…过滤器、103…送液流路、104…送液流路、105…排出流路、106…排出流路、110…冻结保存液送液机构、171…初始化培养摄影装置、172…焦阑透镜、173…细胞观察用照明光源、174…培养基观察用照明光源、201…血液保存部、202…血液送液通路、203…单核细胞分离部、204…泵、205…分离剂保存部、206…送液通路、207…泵、208…单核细胞送液通路、209…泵、210…单核细胞纯化过滤器、211…导入前细胞送液通路、212…泵、213…因子导入部、214…因子保存部、215…因子送液通路、216…泵、217…导入细胞送液通路、218…泵、219…初始化培养器、220…血液细胞培养基保存部、221…培养基送液通路、222…泵、223…干细胞培养基保存部、224…培养基送液通路、225…泵、226…废液送液通路、227…泵、228…废液保管部、229…导入细胞送液通路、230…泵、231…细胞团分割器、232…扩增培养器、233…培养基送液通路、234…泵、235…废液送液通路、236…泵、237…导入细胞送液通路、238…泵、239…细胞团分割器、240…扩增培养器、241…培养基送液通路、242…泵、243…废液送液通路、244…泵、245…导入细胞送液通路、246…泵、247…溶液置换器、248…废液送液通路、249…泵、250…冻结保存液保存部、251…送液通路、252…泵、253…送液通路、254…泵、255…冻结保存容器、256…低温保管库、257…液氮保管库、258…送液通路、259…构件、260…冷藏保存部、271…传感器、272…温度计、301…袋、302…袋、401…输入装置、402…输出装置、403…关系储存装置、501…图像处理部、511…轮廓定义部、512…细胞评价部、513…统计处理部、514…密度算出部、515…培养基评价部、601…壳体、602…吸气净化过滤器、603…排气净化过滤器、605…排气装置、606…排气净化过滤器、608…导入装置、613…气体排出装置、651…送回构件、652…基部、653…开口、654…盖、655…开口、656…盖、701…外侧壳体、702…压力调整孔、703…堵塞构件、800…遮蔽构件、801…壳体侧遮蔽构件、802…排气装置侧遮蔽构件、811…导轨、812…导轨、900…细胞培养器具、1201…血液保存部、1202…血液送液通路、1203…单核细胞分离部、1204…驱动部、1205…分离剂保存部、1206…分离剂送液通路、1207…驱动部、1208…单核细胞送液通路、1210…单核细胞纯化过滤器、1211…导入前细胞送液通路、1212…驱动部、1213…因子导入部、1214…因子保存部、1215…因子送液通路、1216…驱动部、1217…导入细胞送液通路、1218…驱动部、1219…初始化培养器、1220…血液细胞培养基保存部、1221…培养基送液通路、1222…驱动部、1223…干细胞培养基保存部、1224…培养基送液通路、1226…废液送液通路、1228…废液保管部、1229…导入细胞送液通路、1230…驱动部、1231…细胞团分割器、1232…扩增培养器、1235…废液送液通路、1245…导入细胞送液通路、1246…驱动部、1247…溶液置换器、1248…废液送液通路、1250…冻结保存液保存部、1251…冻结保存液送液通路、1252…驱动部、1253…冻结用细胞送液通路、1253…送液通路、1254…驱动部、1255…冻结保存容器、2000…包埋构件、2001…单核细胞流路、2002…单核细胞保存部、2003…其他成分流路、2004…其他成分保存部、2204…从动部、2228…废液保管部、2229…导入细胞送液通路、2231…细胞团分割器、3228…废液保管部、4228…废液保管部、5228…废液保管部
- 还没有人留言评论。精彩留言会获得点赞!