一种海藻酸裂解酶SHA-6基因及应用的制作方法
本发明属于微生物基因工程领域,具体涉及海藻酸裂解酶SHA-6基因及其工程菌株和在制备海藻酸裂解酶中的应用。
背景技术:
海藻酸是由褐藻和有限的革兰氏阴性细菌产生。它们由任意分布的均聚组块poly-β-(1→4)-D-甘露糖醛酸和poly-α-(1→4)-L-古洛糖醛酸以及两种单体随机排列形成的杂聚组块。由于它的粘性和凝胶性能,海藻酸被广泛用于食品和药物产业。最近,海藻酸在生物乙醇生产上的应用受到了持续的关注。
海藻酸是一种天然高分子化合物,可通过一系列方法将其降解。目前降解海藻酸的方法一般有三种:化学降解法、物理降解法和生物学降解法。目前生物降解法是该领域的主要研究方向之一。海藻酸裂解酶通过β-消除反应破坏海藻酸线性化合物上两个糖醛酸之间的1-4糖苷键,降解产物为不饱和寡糖,是一种条件温和、可控性强和特异性高的降解方法,可大大提高低聚糖片段制备的目的性和产率。这些酶促降解产物有许多生物活性功能,比如促进双歧杆菌的的生长活动、单核细胞的细胞因子诱导活性、抗氧化活性、内质网和线粒体介导的凋亡细胞的死亡、氧化应激保护反应和植物根系生长促进活动。海藻酸裂解酶已经在海藻酸低聚糖生产、褐藻原生质体的制备、分析海藻酸结构和囊性纤维化管理上得到应用。
从菌株Marinicatena alginatilytica SH-52中已发现了5种海藻酸裂解酶,这些酶通过异源表达后,菌体破碎离心后的上清液中分离得到,这些酶基因诱导表达后表达量低,且经过分析这类酶基因只有一个结构域,至今还未发现异源表达离心后的沉淀中存在海藻酸裂解酶,也未见相关这类型酶的报道。
技术实现要素:
本发明的目的是提供一种新的海藻酸裂解酶基因,其核苷酸序列如SEQ ID NO:1所示,本海藻酸裂解酶SHA-6基因来源于Marinicatena alginatilytica SH-52(保藏编号为CCTCC NO:M013073,该保藏菌株在本申请日之前已经在其它专利申请中公开过);该基因编码的蛋白包含两个结构域,即AlgLyase Superfamily(海藻酸裂解酶超家族结构域)和Heparinase II/III-like protein(类肝素酶II/III结构域)。
本发明的另一目的是提供一株产海藻酸裂解酶SHA-6的工程菌株,将含有上述的海藻酸裂解酶SHA-6基因的重组质粒pET-32a-SHA-6构建于大肠杆菌中获得的重组菌株,具有产海藻酸裂解酶SHA-6的能力。
本发明的另一个目的是将上述工程菌株应用在制备具有活性的海藻酸裂解酶SHA-6中,该工程菌经IPTG诱导产生海藻酸裂解酶SHA-6包涵体,对该包涵体蛋白进行变性、纯化和复性,使蛋白包涵体产生活性。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
1、Marinicatena alginatilytica SH-52海藻酸裂解酶基因的SHA-6基因的获得和原核表达载体的构建
(1)根据Marinicatena alginatilytica SH-52海藻酸裂解酶SHA-6基因编码框序列和原核表达载体pET-32a多克隆位点,设计一对特异引物如下:
SHA-6-F:5’-GGATCCATGCAGAAAAAGTATGTCTCGCT-3’
SHA-6-R:5’-GCGGCCGCTTAATGAATGATTAATTTGTAG-3’,在上下游引物的5’端分别加入BamH I和Not I酶切位点(下划线为酶切位点);提取Marinicatena alginatilytica SH-52的基因组,使用上述引物进行扩增;
(2)回收并纯化海藻酸裂解酶基因SHA-6全长基因片段,并将其连接到PMD19-T载体上,采用SDS-碱裂解法提取质粒DNA,通过酶切检测获得重组质粒PMD19T-SHA-6;
(3)构建原核表达载体pET-32a-SHA-6,用BamHI和Not I双酶切PMD19T-SHA-6和pET-32a(+),并回收纯化海藻酸裂解酶SHA-6基因片段及pET-32a载体片段,然后连接、转化、抽提质粒进行双酶切验证,获得原核表达载体pET-32a-SHA-6,进行测序后,将测序结果进行生物信息学分析。
2、海藻酸裂解酶SHA-6的原核表达
使用热刺激法将pET-32a-SHA-6转入大肠杆菌BL21(DE3)中,IPTG诱导重组蛋白表达,发现重组产生的酶SHA-6是包涵体。
3、对产生的包涵体蛋白溶解后进行镍柱纯化及体外复性,形成可溶的海藻酸裂解酶SHA-6重组蛋白。
(1)包涵体变性,采用超声破碎菌体后离心弃上清,采用包涵体增溶液溶解沉淀并离心,收集上清,对溶解的包涵体海藻酸裂解酶SHA-6进行下一步的分离纯化;
(2)分离纯化,采用镍柱亲和层析进行纯化,收集纯化后的蛋白用于包涵体SHA-6的复性;
(3)蛋白复性,将包涵体蛋白SHA-6稀释到浓度在0.1µg/µL以下,经复性液进行复性处理后进行离心,收集上清,测定上清中复性后的海藻酸裂解酶SHA-6浓度。
4、对复性后的海藻酸裂解酶SHA-6进行以下特性研究,该酶的最适温度是50℃,最适pH是7.0;本发明采用的测定方法为常规海藻酸裂解酶酶活性测定方法,测定反应底物在A235nm处吸光值的变化。
海藻酸裂解酶基因SHA-6与该菌株中获得的另外五种海藻酸裂解酶基因SHA-1至SHA-5进行基因序列比对,发现基因相似性最高的是SHA-4,为37.27%,最低的是SHA-1,为20.98%;进行氨基酸序列比对结果表明氨基酸相似性最高的是海藻酸裂解酶SHA-4,为11.62%,最低的是海藻酸裂解酶SHA-1,为6.63%。
与另外5种海藻酸裂解酶基因相比,本发明涉及的海藻酸裂解酶基因SHA-6包含两个结构域AlgLyase Superfamily和Heparinase II/III-like protein(见图13);对海藻酸裂解酶SHA-6进行异源表达,与之前成功表达的另外5种可溶性海藻酸裂解酶SHA-1、SHA-2、SHA-3、SHA-4和SHA-5相比,本发明表达的海藻酸裂解酶SHA-6为不可溶的包涵体,但诱导表达量很高,是其他酶最大表达量的2倍。
本发明成功克隆了来自厌氧海藻酸分解菌Marinicatenaalginatilytica SH-52中海藻酸裂解酶基因SHA-6,并进行原核表达得到大量包涵体蛋白,对包涵体蛋白进行变性、纯化和复性制备了具有生物活性的可溶性高纯度SHA-6蛋白。通过保守结构域预测知该酶包含两个结构域,AlgLyase Superfamily和Heparinase II/III-like protein,而之前的海藻酸裂解酶仅含有一个结构域,因此推测可能是一种双功能酶。相对于另外五种海藻酸裂解酶的诱导表达量,本发明的基因工程菌株只需6h即可获得大量的包涵体蛋白,纯化前蛋白含量为7567mg,对该蛋白进行复性后得到活性蛋白,复性后的酶活达到13.5U/mg。本发明获得的重组海藻酸裂解酶具有广泛的底物特异性,除了可以利用海藻酸外还可以利用PolyM和PolyG,为进一步研究海藻酸裂解酶SHA-6的机理及机制奠定基础。
附图说明
图1是本发明Marinicatena alginatilytica SH-52基因组DNA的检测示意图,图中:M是DNA marker;1和2是基因组DNA;
图2是本发明海藻酸裂解酶SHA-6基因的TA克隆策略示意图;
图3是本发明重组质粒PMD19T-SHA-6的双酶切检测示意图,图中:M是DNA marker;1-3是BamH I和Not I双酶切的PMD19T-SHA-6质粒;
图4是本发明海藻酸裂解酶SHA-6基因的原核表达载体构建示意图;
图5是本发明重组质粒pET-32a-SHA-6的双酶切检测示意图,图中:M是DNA marker;1是BamHI和Not I双酶切的pET-32a-SHA-6质粒;
图6是本发明海藻酸裂解酶SHA-6表达的SDS-PAGE检测示意图,图中:M是蛋白marker;1是pET-32a-SHA-6质粒在37℃经0.1 mM IPTG诱导6h的上清;2是pET-32a-SHA-6质粒在37℃经0.1 mM IPTG诱导6h的沉淀;
图7是本发明的包涵体蛋白SHA-6的纯化电泳示意图,图中:M是蛋白marker;1包涵体经变性剂溶解后的沉淀;2是包涵体经变性剂溶解后的上清;3是包涵体经变性剂溶解后的上清过镍柱纯化后的流川液;4是包涵体经变性剂溶解后的上清过镍柱纯化后的洗涤液;5-7分别是用20mM、50mM和100mM咪唑溶液洗脱后的洗脱液;
图8是本发明的海藻酸裂解酶SHA-6的复性电泳示意图,图中:M是蛋白marker;1是复性后的蛋白上清液;
图9是本发明的海藻酸裂解酶SHA-6的最适pH示意图,图中:正方形曲线为SHA-6蛋白在pH6.0-8.0磷酸盐缓冲液中的活性示意图;圆形曲线为SHA-6蛋白在pH8.0-9.0 Tris-HCl缓冲液中的活性示意图;
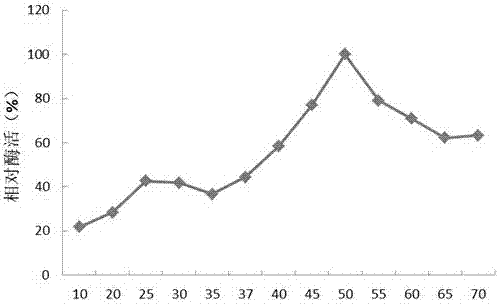
图10是本发明海藻酸裂解酶SHA-6的最适温度示意图;
图11是本发明海藻酸裂解酶SHA-6的金属离子影响示意图;
图12是本发明海藻酸裂解酶SHA-6的底物特异性示意图;
图13是本发明海藻酸裂解酶SHA-6基因及其编码的蛋白结构域示意图。
具体实施方式
下面结合附图和实施例对本发明作进一步详细说明,但本发明保护范围不局限于所述内容,实施例中使用的试剂和方法,如无特殊说明,均采用常规试剂和使用常规方法。
实施例1:Marinicatenaalginatilytica SH-52基因组DNA的制备与检测
本发明所用的Marinicatenaalginatilytica SH-52为本实验室筛选菌株,SH-52基因组DNA的制备采用普通细菌基因组提取方法,具体内容如下:取2mL过夜培养菌液于4℃,4000rpm离心2min,弃尽上清液,收集菌体,加入100µL SolutionⅠ悬液、30 µL 10%SDS和1 µL 20 mg/mL蛋白酶K,混匀,37℃温育1h。加入5M NaCl 100 µL,颠倒混匀,再加入20µL CTAB/NaCl溶液(CTAB 10%,0.7M NaCl),65℃温育10 min。加入等体积氯仿/异戊醇(24:1),颠倒混匀,4℃,12000 rpm离心5 min。取上清液,加入2倍体积无水乙醇,0.1倍体积3M NaAc,-20℃放置30分钟,4℃,12000 rpm离心10 min;沉淀中加入冰冷的70%乙醇(-20℃)洗涤,4℃,12000 rpm离心5 min,弃上清。沉淀干燥后,溶于20µL ddH2O中,-20℃保存。取2µL电泳检测,结果(图1)说明提取到的基因组DNA质量符合要求。
实施例2:海藻酸裂解酶SHA-6基因的扩增与TA克隆
海藻酸裂解酶SHA-6基因的扩增及克隆如图2所示,设计一对特异性引物,序列如下:
SHA-6-F :GGATCCATGCAGAAAAAGTATGTCTCGCT
SHA-6-R: GCGGCCGCTTAATGAATGATTAATTTGTAG
5’端引入GGATCC特征序列,形成BamH I酶切位点;3’端引入GCGGCC特征序列,形成Not I酶切位点。
在PCR反应混合液中加入10ng的Marinicatena alginatilytica SH-52基因组DNA作为模板,同时加入50ng的特异性引物SHA-6-F和SHA-6-R,2.5µLdNTP(10mM),2.5µL的Pfu反应Buffer和0.5µL的Pfu(5U/µL)聚合酶(北京全式金生物技术有限公司),加入双蒸水使终体积为25µL。在PCR仪上于94℃加热3min,然后按照94℃、30s,56℃、30s,72℃、1 min 20 s的程序进行25个循环的反应,最后在72℃延长反应10min的程序进行PCR反应扩增得到SHA-6基因,反应完成后,通过琼脂糖凝胶电泳分离PCR扩增产物。回收并纯化SHA-6全长基因DNA(2040bp),然后用宝生物(TaKaRa)的TA克隆试剂盒亚克隆到pMD19-T(大连宝生物公司)载体上,实验操作按试剂盒的说明书进行,反应过夜后用反应混合液转化大肠杆菌感受态DH5α(昆明硕擎生物科技公司),把转化后的大肠杆菌涂于加有氨苄霉素(终浓度为100 µg/mL)的平板上,37℃过夜培养,筛选Amp抗性重组子菌落,用SHA-6-F和SHA-6-R引物进行菌落PCR验证,连接成功的质粒进行液体培养后采用碱裂解法提取质粒DNA,对大小相符的重组质粒进行酶切实验。用BamHⅠ和NotⅠ(TaKaRa)进行双酶切检测,连接成功的重组质粒pMD19T-SHA-6有一条大小为2040bp左右,另一条为2969bp左右(图3),测序分析证明重组质粒载体中插入的SHA-6全长基因序列正确。
实施例3:原核表达载体pET-32a-SHA-6的构建
如图4所示,使用BamHⅠ和NotⅠ切开纯化后的原核表达载体pET-32a和pMD19-T-SHA-6,通过琼脂糖凝胶电泳分离已切开的载体和插入的目的片段,从凝胶中回收pET-32a被切割后产生的载体片段pET-32a及pMD19-T-SHA-6被切割产生的SHA-6DNA片段,经宝生物的连接酶试剂盒连接pET-32a载体片段和SHA-6 DNA片段产生原核表达载体pET-32a-SHA-6。将连接反应混合物转化大肠杆菌感受态细胞BL21(天根生化科技),把转化后的大肠杆菌涂于加有氨苄霉素(终浓度为100µg/mL)的平板上,37℃过夜培养,筛选Amp抗性重组子菌落,用SHA-6-F和SHA-6-R引物进行菌落PCR验证,连接成功的质粒进行液体培养后采用碱裂解法提取质粒DNA,对大小相符的重组质粒进行酶切实验。用BamHⅠ和NotⅠ(TaKaRa)进行双酶切检测,连接成功的重组质粒pET-32a-SHA-6有5900bp和2040bp左右大小的两条带(图5),测序分析证明重组质粒载体中插入的SHA-6全长基因序列正确。
实施例4:海藻酸裂解酶SHA-6的原核表达与表达条件的优化
挑取测序鉴定正确的单菌落加入5mL(含有Amp 100 µg/mL)中,37℃过夜培养(OD约为1.5)。然后转接到1L(含有Amp 100 µg/mL)中,当OD600达到0.6-0.8时,加入0.1mM IPTG于37℃下诱导6h,4℃离心收集菌体,用PBS缓冲液(4.3mM Na2HPO4,1.4mM KH2PO4,137mM NaCl,2.7mM KCl)悬浮菌体后进行超声破碎,取菌体破碎液于4℃(12000rpm)离心10min分别收集上清和沉淀,加入5×SDS-PAGE上样缓冲液(Sample loading buffer),于100℃加热10min后进行SDS-PAGE检测。根据文献资料和软件分析预测目的融合蛋白大小为94KDa左右,(融合标签为18KDa),采用12%的分离胶。SDS-PAGE电泳参看《分子克隆实验指南(第三版)》。SDS-PAGE电泳结果(图6)表明目的蛋白在沉淀中,为包涵体。
实施例5:包涵体蛋白SHA-6的复性
将在37℃、0.1mM IPTG下诱导表达6h后的1 L菌体,经超声破碎菌体(工作5s,休息5s)30min后,将菌体破碎液于4℃、12000rpm离心15min,弃上清。
(1)包涵体变性:用变性剂50mM Tris-HCl,300mM NaCl,8M urea,pH8.0溶解,放置摇床,220rpm,室温。2h后离心,上清含有SHA-6融合蛋白的包涵体用0.45µm滤器进行过滤,除去杂质,用于下一步的分离纯化。
(2)包涵体纯化:分离纯化采用镍柱亲和层析,层析介质为Ni-NTA,将保存柱子的20%的乙醇放出;加入40mL的蒸馏水洗涤柱子,然后用26mL预冷的变性剂50mM Tris-HCl,300mM NaCl,8M urea,pH8.0平衡柱子后上样;再用10~15mL预冷的变性剂50mM Tris-HCl,300mM NaCl,8M urea,pH8.0清洗柱子;最后分别用10mL含20mM、50mM和100mM咪唑的洗脱液10mL 50mM Tris-HCl,300mM NaCl,8M urea,pH8.0洗脱柱子,收集洗脱液,获得纯化的SHA-6包涵体蛋白,分别取20µL进行SDS-PAGE检测,纯化结果如图7获得了纯度较高的SHA-6变性蛋白。
(3)包涵体复性:将SHA-6包涵体蛋白稀释到浓度在0.1µg/µL以下,取20mL放入透析袋中,用透析袋专用夹子夹好后放入500mL复性缓冲液I 50mM Tris-HCl,300mM NaCl,0.2mM GSSG,2mM GSH,10%甘油,0.5mM EDTA,4M urea,pH8.0,4℃复性6h;接着将透析袋转移至500mL复性液II 50mM Tris-HCl,300mM NaCl,0.2mM GSSG,2mM GSH,10%甘油,0.5mM EDTA,2M urea,pH8.0,4℃复性6h;再将透析袋转移至1L的复性液III 50mM Tris-HCl,300mM NaCl,10%甘油,0.5mM EDTA, pH8.0,4℃,6h;最后再更换一次复性液III,4℃,6h;透析结束后,将蛋白液转移至离心管中,10000rpm,4℃,10min,用考马斯亮蓝法测定上清蛋白浓度,并通过SDS-PAGE检测其纯度,检测结果如图8所示。
通过上述的实验,本发明达到了如下的结果:利用本发明的SHA-6的原核表达载体(pET-32a-SHA-6)转化大肠杆菌(BL21),可实现SHA-6蛋白的大量表达,但是SHA-6均以包涵体的形式存在,因此通过变性、纯化和复性得到纯化的有活性的SHA-6蛋白。
实施例6:海藻酸裂解酶SHA-6蛋白的特性分析,具体内容如下:
1、酶活测定
由于海藻酸裂解酶裂解海藻酸钠产生的不饱和糖醛酸在235nm处具有吸收值,通过测量反应液在该波长下的变化而计算相应的酶活。
在反应体系中加入0.1mL的海藻酸裂解酶蛋白启动反应,10min后测量235nm处吸光值的变化。
酶活定义:在235nm下的吸光值,以每分钟吸光值增加1定义为一个酶活单位(U)。
通过测定,复性后的海藻酸裂解酶SHA-6蛋白的酶活可达13.5U/mg。
2、酶学性质的研究
(1)海藻酸裂解酶SHA-6最适催化pH值测定
在pH缓冲体系(pH6.0-8.0磷酸钠缓冲液或pH8.0-9.0Tris-HCl缓冲液)中用0.3%海藻酸钠为底物测定海藻酸裂解酶最适反应pH,温度为37℃,反应时间为10min,将处于最适pH下的酶活定义为100%,结果如图9所示,海藻酸裂解酶SHA-6的最适酶反应的pH条件为7.0。
(2)海藻酸裂解酶SHA-6最适催化温度测定
在pH7.0的磷酸盐缓冲液中用0.3%海藻酸钠为底物测定酶的最适反应温度,反应时间为10min,将处于最适温度下的酶活定义为100%,结果如图10所示,酶的最适反应温度50℃。
(3)金属离子对海藻酸裂解酶SHA-6蛋白活性的影响
在pH7.0的磷酸盐缓冲液中用海藻酸钠为底物测定不同金属化合物(反应液中金属离子的浓度为0.5mM)对海藻酸裂解酶SHA-6蛋白活性的影响,以添加相同体积水的溶液作为对照组,在最适温度50℃下测定酶活力,将对照组的酶活定义为100%,结果如图11所示,Mg2+、Ca2+、Na+、Mn2+对酶活有促进作用。
(4)海藻酸裂解酶SHA-6蛋白的底物特异性
将0.1mL复性后的海藻酸裂解酶SHA-6分别添加0.9mL含质量分数为0.3%的不同底物(海藻酸钠、PolyM、PolyG)的20mM磷酸盐缓冲液(pH7.0)中,在反应温度为50℃下反应10min,结果如图12所示,SHA-6对PolyM和PolyG均有底物特异性,但对于PolyM的底物特异性相对略强一些。
本发明采用基因工程手段,构建含有厌氧菌的海藻酸裂解酶基因SHA-6的工程菌株,通过诱导表达产生了SHA-6的包涵体,与文献报道的已构建的产可溶性的海藻酸裂解酶重组表达载体相比,该体系得到的海藻酸裂解酶包涵体表达量较大,且复性后得到有活性的蛋白SHA-6。
序列表
<110> 昆明理工大学
<120> 一种海藻酸裂解酶SHA-6基因及应用
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 2040
<212> DNA
<213> 厌氧海藻酸分解菌SH-52(Marinicatena alginatilytica SH-52)
<400> 1
atgcagaaaa agtatgtctc gcttctacgt gaggggattg ataaatatcc gcttcttcat 60
tcatcatttc aggaagtcaa agttaatgcc gaccaagcga tagcaaaccc aattgttgtg 120
cctttcccta aagatccggg tggtggatat acccacgaaa agcataagca aaactataga 180
gagatgtaca atgcagggtt agtttaccag ttaacggggg atgaaaagta tgccactttt 240
gtaaaaaaca tgctgctgga gtatgcgaag atgtatccga cattggggct gcatccggag 300
cgaaagaacc agtctcccgg taaattattc tggcaggggt tgaatgaatc tgtttggttg 360
gtttacacaa ttcaggccta tgattgtatt tacgatttcc tatccgagag cgataggagt 420
gcaatcgaaa ataacttatt ccggaaagtt gttcaattct ttaccgttga ggattcgtat 480
tcctttgatc gggtgcacaa ccacggaacc tgggctgtag ccggagtggg aatgacaggg 540
atggtgttgg gagattcaat tatgattaaa caagctcttt acagtaccaa actagatggt 600
tcggggggat ttttaaaaca aattgatcaa ttgttttcgc cggatggtta ttacgcagaa 660
gggccttatt atcagcgtta cgctatgctt ccgtttatcg tgtttgcaca ggctcttcaa 720
aacaatcggc cggatgttga cattttcagt tacaaaggag gagttctgaa aaaggctgtt 780
cagactttgc tgcaaatgac cagtacagat ggccgttttt atccaataaa cgatgctatt 840
aaagaaaaat cgtggataac ggctgagttg gtttttggag ttgatatcac ctatgcacag 900
acagaagatc cacatctgtt ggatgtggca gaaaaacacg gtgaggttat cctaagtaaa 960
gaaggcttgg aagtcgcaaa aagtattgct gaggggaaag ctgaaaagtt tgttcggcgg 1020
ccaatgctga ttcacgacgg tgaaaatggg gaccaaggcg gactcgcatt gatgcgagat 1080
gctgttggaa acgagcaaac ctcggtgctg ttcaagttta gctcacaggg tatggggcac 1140
ggtcatttcg atcggctcgg atttttgatg tatgatcagg gaaatgagat tattccggat 1200
tacggggctg cccgatatat gaatgttgtt gcaaaacaag gagggcgtta ccttcccgaa 1260
aacgacactt gggcgcatca aacggtggcg cacaatacgt tagtcattaa ccagcaatct 1320
aattttgagg gaaactcaaa acttgccgac caatacagtc cagctctgcg gttctgtgat 1380
ttgtctggcg attcaatcca aatcgtatcg gcaacggatt cttcctgtta caaaggagca 1440
gtattaacac gtaccatggc attgttaccg ctcgacggac gtaaatatct ggttgatctg 1500
ttcagtgcga atagtgataa ggagtgccaa tatgatttac cactttactt caatggtcag 1560
attatagaat ccaattttaa ttatcataag ccagaggatt tagtcccact agggaaggaa 1620
aatggctatc agcacttatg gcttgaggct caagctaagc aacttccatc aacatcttca 1680
attacctgga tggaagggag tacattttgt acaatgtcat ttctaaccag tccaaacact 1740
gagttctata taaccaggct cggtgcaaat gatccggatt tcaatcttag gaaacagcag 1800
gggatgatga ttcgagagcc taatcgaaag gatattcagt ttctctcggt ttacgaaatc 1860
catggtaact acaatccagt gacggaagca gtcatgcaat cagaaggatc tgttcgtgag 1920
ctcaaactgg aaaatgatgg agcgaaaaca acattaaaaa tcggtctgaa aagcggcaag 1980
gtcatcgagc ttgatctaaa caacgccgga cctcggcact acaaattaat cattcattaa 2040
<210> 2
<211> 29
<212> DNA
<213> 人工序列(Artificial)
<400> 2
ggatccatgc agaaaaagta tgtctcgct 29
<210> 3
<211> 30
<212> DNA
<213> 人工序列(Artificial)
<400> 3
gcggccgctt aatgaatgat taatttgtag 30
- 还没有人留言评论。精彩留言会获得点赞!